肿瘤多药耐药(multidrug resistance, MDR)是指肿瘤细胞通过降低摄取、增加胞内药物排出、降低胞内药物浓度、激活DNA修复机制、上调代谢和/或刺激排毒途径等多种防御机制, 使其对一种或多种化疗药物产生耐药性[1-4], 影响化疗药物的临床效果。已有大量研究表明纳米载体在逆转MDR方面具有增强药物靶向性、减少药物外排和降低药物毒副作用等优势。
一氧化氮(nitric oxide, NO)与肿瘤有密切的联系, 对肿瘤生物学有双重作用, 低浓度的NO能扩张肿瘤组织周围血管, 增加肿瘤部位血液供应, 为其提供营养与氧气, 促进其增殖; 然而肿瘤细胞内高浓度的NO能抑制肿瘤的生长、诱导肿瘤细胞凋亡甚至杀伤肿瘤细胞[5-7]。NO及其供体还有良好的化疗增敏作用, 该作用高度依赖于它的浓度和持续时间[8], 因此将NO递送至靶部位并控制其释放是实现NO抗肿瘤活性的重要前提[9]。NO由于其高活性导致体内外稳定性较差, 生物利用度较低, 难以直接用于杀伤肿瘤细胞, 纳米载体有助于提高其稳定性, 拓展其应用[10-12]。较宽浓度范围的NO及其供体(nmol·L-1~mmol·L-1)均显示出化疗增敏效应, 利用负载NO的纳米载体输送抗肿瘤药物则是将NO的活性作用与纳米载体特有性质的有机整合, 显示良好的逆转MDR作用, 有利于改善肿瘤疗效。本文综述了利用负载NO的纳米载体递送抗肿瘤药物的研究进展。
1 NO逆转肿瘤多药耐药的机制NO对肿瘤细胞DNA修复、消耗肿瘤细胞内活性硫醇、组蛋白谷胱甘肽化、低氧诱导因子、核因子κB (nuclear factor-κB, NF-κB)途径和介导药物外排相关蛋白中的作用。
1.1 NO抑制肿瘤细胞DNA修复部分化疗药物是通过引起肿瘤细胞DNA损伤产生细胞毒性而发挥作用[13, 14]。NO在细胞内能与活性氧簇(ROS)作用生成氧化能力更强的活性氮簇(RNS)。RNS能亚硝化修饰参与DNA修复过程中的蛋白质使其变性降低活性[15-19], 从而抑制肿瘤细胞DNA修复能力, 协同增加诱导DNA损伤的抗肿瘤药物的细胞毒性[19]。
1.2 NO消耗肿瘤细胞内还原型谷胱甘肽还原型谷胱甘肽(glutathione, GSH)是细胞内重要的非特异性的解毒物质, 肿瘤细胞内高浓度的GSH是导致MDR的重要因素之一。具有氧化性的抗肿瘤药物与GSH结合后失去氧化能力导致细胞毒性降低, 而NO氧化GSH有助于逆转对GSH敏感的抗肿瘤药物的耐药性。GSH会导致对-SH基团有很高的亲和力的铂类药物(platinum, Pt)失活[20-22], 耐药肿瘤细胞中GSH含量较药物敏感性肿瘤细胞更高, 在这些细胞系中, 通过消耗GSH来抑制Pt-GSH复合物(Pt-GSH adducts)的形成有助于增强Pt类药物的抗癌作用[23]。
1.3 NO诱导组蛋白的谷胱甘肽化NO能促进多柔比星(doxorubicin, DOX)与核酸的结合以增强其抗肿瘤活性[24]。与药物敏感型乳腺癌细胞相比, 耐药型乳腺癌细胞(MCF7/Dx)胞内高表达GSH与谷胱甘肽S-转移酶P1-1。经NO供体S-nitrosoglutathione (GSNO)处理后的MCF7/Dx胞内谷胱甘肽化组蛋白的含量显著增加[24], 由于组蛋白是调节基因转录的重要核蛋白, 组蛋白的谷胱甘肽化可能成为作为克服MDR机制的关键途径。
1.4 抑制缺氧诱导因子的作用缺氧诱导因子(hypoxia-induced factors, HIF)是缺氧应答的全局调控性因子, 参与肿瘤血管形成、肿瘤细胞增殖、转移及浸润的调控。MDR1基因增强子上存在HIF-1α结合区域, HIF-1α/β的二聚化能够诱导MDR相关蛋白(MDR-associated proteins, MRPs)的表达, 因此HIF-1α的降解或失活能够抑制MDR效应。NO供体硝普钠能够阻止HIF-1α在人肝癌Hep3B细胞中的内源性累积, 还可以抑制HIF-1α的C端反式激活结构域的形成, 从而抑制HIF-1α与DNA的结合阻断HIF的转录[25], 此外, NO还能通过降低HIF-1α的稳定性来逆转MDR[26]。
1.5 NO通过NF-κB途径实现化疗增敏作用NF-κB是具有多种调节功能的转录因子, 当其被化疗药物激活时可由细胞质进入细胞核内诱发P-gp的过度表达而导致MDR[27]。NO可以S-亚硝基化NF-κB降低其活性, 从而逆转MDR[28]。
1.6 抑制转运蛋白的活性NO能抑制细胞膜、核膜上存在的转运蛋白P-gp、多药耐药相关蛋白MRPs的活性和表达数量[29, 30]。在过表达MRP3的耐药结肠癌细胞中, NO供体S-亚硝基青霉胺亚硝基化MRP3使其构象改变而失活, 使胞内DOX的浓度增加[29-31]。
2 NO药物输送系统提高抗肿瘤活性NO的抗肿瘤作用高度依赖于浓度与作用部位, 由于NO的不稳定性导致其难以进入抗肿瘤的临床应用, 纳米药物递送系统能提高其在血液循环中的稳定性, 控制其释放行为, 增加其在肿瘤部位的蓄积, 因此NO/NO供体通过物理包载或化学键合作用与纳米药物递送系统结合的策略被提出, 以提高抗肿瘤作用[32]。
据最新研究, Jia等[33]以两亲性嵌段共聚物聚苯乙烯-block-聚丙烯酸胶束为载体, 将NO前药负载于胶束内核, 借助溶胶凝胶法在胶束表面形成含有二硫键的有机硅层, 并通过聚乙二醇在表面修饰增强其胶束稳定性, 制备得到具有氧化还原/酶双重响应释放NO的纳米载体。该系统能有效防止NO提前释放, 提高NO供体在血液循环中的生理稳定性。利用肿瘤细胞中过量表达的谷胱甘肽GSH和谷胱甘肽转移酶GSTπ激活NO供体释放出NO, 实现对肿瘤细胞的特异性杀伤, 从而实现高效低毒的肿瘤治疗。该系统通过共包载一种具有聚集诱导法光效应的新型荧光染料, 实现对该纳米载体在体内分布的有效监控, 荧光成像结果显示, 该纳米药物能有效地富集在肿瘤组织。该纳米载体的杂化硅层在血液循环和正常组织中能有效防止NO供体发生非酶催化分解释放NO, 不仅提高了NO的有效利用率, 还避免了高浓度NO在血液循环中可能引起的静脉舒张压降低等不良反应。抑瘤结果表明, 纳米药物显著提高抑瘤率。然而单一的NO用于肿瘤治疗的抑瘤效率不理想, 并且受限于肿瘤对NO的敏感性等问题。很多研究将其作为传统放疗或化疗增敏的方法, 来逆转MDR改善肿瘤治疗效果。
3 NO联合化疗药物逆转MDR药物输送系统能够通过被动和/或主动靶向的方式来促使药物绕过MDR的外排作用, 因此NO和化疗药物递送系统的联用, 尤其是共递送系统, 被用以克服癌症中的MDR (图 1)。
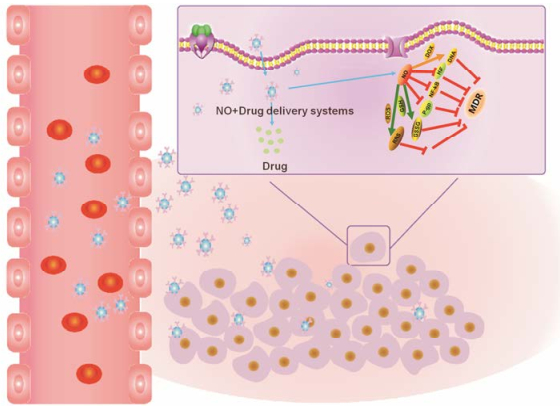
|
Figure 1 Schematic presentation of the potential mechanisms of nitric oxide (NO)-releasing delivery systems combined with chemotherapeutics in overcoming multidrug resistance (MDR) |
NO和药物的时空分离使其难以发挥协同效应, 因此很少有将NO用于提高抗癌药物疗效的临床研究。NO和化疗药物的共输送系统能通过延长药物在血液中的循环而促进药物和NO的积累提高肿瘤治疗效果。有关NO和药物输送系统联用的研究现状见表 1[34-41], 并重点介绍NO和药物输送系统的最新进展。
| Table 1 Combined NO and drug delivery systems for overcoming MDR. DOX: Doxorubicin |
Duong等[42]合成了含有硫醇基团的嵌段共聚物, 并利用S-亚硝基硫醇与聚合物中的硫醇通过二硫键结合, 通过在水溶液中自组装形成负载S-亚硝基硫醇的纳米胶束。该胶束能在还原性条件下响应性释放NO, 将该负载NO的胶束与耐顺铂的神经母细胞瘤细胞作用后, 再加入顺铂, 可将顺铂IC50降低80%, 显著提高耐药肿瘤细胞对顺铂的敏感性。然而该负载NO的纳米胶束不影响正常细胞对顺铂的敏感性。这项研究是首次在体外序贯联用NO输送系统和化学药物, 并评估其疗效, 首次明确联合NO供体有利于增强化疗药物的效果, 对将NO的药物输送系统用于逆转MDR具有重要指示意义。受到Duong等[42]研究成果的鼓舞, 同时为了避免NO供体在体循环过程中过早释放, 提高其稳定性, Lee等[35, 43]利用聚乙二醇PEG和碳酸钙CaCO3组成的生物矿物作为GSNO的纳米载体(GSNO-MNPs)。由于CaCO3的pH敏感性和GSNO的还原响应性, GSNO-MNPs表现在低pH和高还原态环境中快速释放NO的行为, 有利于NO在肿瘤组织酸性、高还原态微环境中的特异性释放。经GSNO-MNPs预处理, DOX对耐药乳腺癌MCF-7细胞的抗肿瘤作用提高了30%。
Song等[37]使用NO的硝酸盐(-ONO2)修饰D-α-生育酚聚乙二醇琥珀酸酯(D-α-tocopheryl polyethylene glycol succinate, TPGS), 得到负载NO的胶束(TNO3)。在体外释放实验中, 硝酸盐基团表面暴露在周围的水环境不会导致NO突释, 但由于硝酸盐的氧化还原响应性, 胶束在GSH和HepG2细胞中会发生NO的突释, 从而引起NO浓度升高诱导细胞毒性, 并在体外实验中增强了细胞对DOX的摄取。通过计算TNO3和DOX联合治疗的药物相互作用指数表明, 胶束释放的NO是通过诱导细胞毒性和增加肿瘤细胞对DOX的敏感性来发挥协同作用。NO诱导可以使实体瘤周围的血管扩张, 从而降低间质的压力并增加肿瘤灌注有助于短时间内DOX在肿瘤中积累, 与TNO3和DOX单独给药相比, TNO3和DOX的联合治疗可以显著抑制肿瘤生长。
由于肿瘤部位的异质性, 化疗药物难以到达肿瘤组织的深部。NO/NO供体也能有效增强肿瘤组织的渗透性和滞留性(enhanced permeability and retention effect, EPR)[44, 45]。Seki等[46]递送大分子抗肿瘤药物时通过在小鼠肿瘤部位皮肤表面涂抹NO供体硝酸甘油乳膏, 增加了大分子抗肿瘤药物在肿瘤部位的蓄积。然而外用硝酸甘油乳膏递送至肿瘤部位的NO效率较低, Kinoshita等[47]研究了大分子NO供体对两种化疗药物活性的影响。该研究利用肿瘤组织的EPR效应, 设计了较大分子量的亚硝化的重组人白蛋白二聚体, 以延长NO的血浆滞留时长, 增加NO在肿瘤部位的蓄积。研究发现, 该大分子NO供体与N-(2-羟丙基)甲基丙烯酰胺-锌原卟啉(HPMA-ZnPP)联用时, 能增加肿瘤内部血管渗透性, 促进HPMA- ZnPP到达肿瘤组织深部, 提高其抑瘤率, 并减少该化疗药物在肝、肾等部位的蓄积, 以减少其不良反应, 同时有效抑制肿瘤在肺部的转移。亚硝化重组人白蛋白二聚体与DOX脂质体联用时, 在C26荷瘤小鼠模型中抑瘤率从0.8%提高至2.0%, 在B16荷瘤小鼠模型中抑瘤率从0.3%提高至1.9%, 证明了该大分子NO供体在多种肿瘤模型中都具有增强EPR效应的作用。
3.3 负载NO药物输送系统递送抗肿瘤药物Wang等[48]将负载NO的聚倍半硅氧烷用于抗肿瘤药物的递送, 并评估了其体外抗肿瘤活性。他们利用一步沉淀法制备了含有S-亚硝基硫醇和DOX的纳米粒(SNO- DOX)。由于NO和DOX的协同作用, SNO-DOX在乳腺癌MDA-MB-231细胞中的细胞毒性高于单独使用DOX或SNO纳米粒时的细胞毒性, 而NO对正常细胞没有显著的细胞毒性作用, 表明NO和抗肿瘤药物联合应用有利于提高对肿瘤细胞的选择性作用。
Chung等[39]用聚合物微囊来递送NO和抗肿瘤药物, 利用微流体装置和双乳液法制备的聚(D, L-乳酸-乙醇酸)共聚物(PLGA)中空微球来递送抗癌药物伊立替康(irinotecan, CPT-11)和NO供体-二亚乙基三胺二醇二氮烯鎓(DETA-NONOate)。肿瘤的酸性环境中的质子渗入PLGA微球壳中可以促使DTEA-NONOate释放NO气泡, 所产生的NO气泡不仅可以亚硝化P-gp, 逆转其介导的MDR, 同时破坏PLGA微球表面以释放CPT-11。此研究首次证明了负载NO的纳米载药系统释放的NO通过抑制P-gp转运蛋白而增强肿瘤细胞对药物的吸收。因此, 合理设计pH响应性的负载NO的纳米载药系统不仅能够选择性地抑制P-gp转运体而且可以提高后续药物的疗效。
上述提及的治疗方法都采用了对体内刺激因素有响应性NO供体, 例如pH响应性二醇二氮烯鎓或氧化还原响应性S-亚硝基硫醇。但这些类型的NO供体在生理条件下通常是不稳定的, 在使用之前难以保存, 也会导致体循环中NO的意外释放。因此, 如何提高NO供体的肿瘤组织靶向性成为学界关注的重点之一。有研究提出将外部刺激响应性NO供体递送系统应用于化疗药物的输送可能有助于提高肿瘤靶向性。
Fan等[40]制备了紫外/可见光响应性胶束, 通过将具有UV响应性NO供体(N, N '-二仲丁基-N, N '-二亚硝基-1, 4-苯二胺, N, N '-di-sec-butyl-N, N '-dinitroso-1, 4- phenylenediamine, BNN6)和DOX共同包封入具有疏水内核的PEG-PLGA中, 以制备mPEG-PLGA-BNN6-DOX纳米粒胶束。在体外释放实验中验证了BNN6胶束能够在紫外线的照射下能迅速将光能转化为热能促进NO的迅速释放, 同时释放的NO能破坏纳米的核-壳结构加速DOX的释放。在耐药卵巢癌细胞中, 该纳米粒显著提高了DOX的细胞摄取率, 对耐药性肿瘤细胞产生明显抑制作用。mPEG- PLGA-BNN6-DOX体系印证了防止NO和抗肿瘤药物过早释放和增强NO与抗肿瘤药物的靶向性有利于逆转MDR这一观念。
Guo等[41]使用Fe3O4、聚多巴胺和介孔二氧化硅制备了具有核-壳-壳结构的纳米载体, 随后用巯基(-SH)基团将外壳介孔二氧化硅壳功能化获得了光热响应性载体, 再将亚硝酸叔丁酯与-SH基团反应得到载-SNO的具有光热响应性的NO纳米载体(PTNGs-DOX)。为提高纳米的肿瘤靶向性, 将转铁蛋白Tf通过二硫键结合到纳米粒表面。该纳米粒不仅能特异性靶向肿瘤细胞, 而且在激光照射下通过S-NO键的断裂能迅速释放出NO。体外给耐药乳腺癌细胞以适当剂量的PTNGs-DOX后进行激光照射, 发现NO能通过下调转运糖蛋白P-gp的表达以增加DOX的摄取率, 促进MDR在肿瘤细胞中富集, 增强其肿瘤细胞杀伤效果。给予耐药乳腺癌小鼠适当PTNGs-DOX治疗, 经过近红外光照射后, 肿瘤生长受到了明显的抑制。因此, NO供体结合其他有利于深度组织穿透的远程药物控制系统如双光子激发激光(two-photon excitation laser)响应性纳米粒[49]或上转换纳米粒(upconversion nanoparticles)[50]等对于逆转MDR改善肿瘤疗效有着重要意义。
4 总结与展望迄今为止, 越来越多的报道表明NO可以通过抑制DNA损伤修复、消耗硫醇、组蛋白修饰、抑制HIF、使NF-κB失活及减少外排相关蛋白的数量来逆转MDR。与单一的药物治疗相比, NO和药物输送系统的联用在克服MDR、改善化疗效果具有很大的潜力, 但在实际应用中存在以下问题。首先, 保证NO和药物输送系统结合需要能够有效地储存和输送NO的技术。NONOates和S-亚硝基硫醇是在研究NO的治疗潜力方面广泛使用的NO供体, 由于其性质不稳定难以在体内外稳定储存[9]。硝基苯和金属-NO配合物在水溶液中虽然具有良好的稳定性, 但是由于这些NO供体中NO释放需要紫外光刺激, 而紫外光的组织穿透能力差, 导致这些NO供体的实际应用(尤其在深部肿瘤的治疗方面)也受到限制[9]。因此, 提高NO供体的稳定性对生物因素刺激相应的NO递送体系有着重要意义[9, 35, 43, 51-53]; 其次, 对于NO和药物输送系统联用克服MDR效应并改善化疗效果的机制研究至关重要。尽管上述研究讨论了抗癌药物和NO供体联合应用的抗肿瘤机制, 但缺乏基于纳米粒的NO和药物输送系统联用也遵循相同机制的直接证据; 第三, 应该给出克服多药耐药适当的NO浓度范围。尽管有不少研究报道了NO影响MDR, 但没有明确有关NO浓度与克服MDR的活性之间的量效关系研究。适当NO浓度范围对于设计NO和药物输送系统并评估其临床潜力是非常重要的指标, 应进一步研究NO浓度对克服MDR的影响; 第四, 用于临床的NO和药物联合应用高度依赖于药物输送系统技术的进步。NO和药物递送系统联用以克服MDR的优势会在其有效累积于目标位点后显现出来, NO和药物输送系统实际应用的关键点是如何实现靶部位有针对性的药物积累。NO所具有的增加肿瘤灌注的潜力可以增强滞留效应, 即允许大分子物质和脂质聚积于肿瘤组织中。这一特性使NO和药物递送系统联用有望成为逆转MDR的有效途径。利用先进的技术解决上述困难有助于逆转MDR, 实现临床化疗中NO和药物输送系统的联用, 对于改善肿瘤治疗效果有重要意义。
| [1] | Markman JL, Rekechenetskiy A, Holler E, et al. Nanomedicine therapeutic approaches to overcome cancer drug resistance[J]. Adv Drug Deliv Rev, 2013, 65: 1866–1879. DOI:10.1016/j.addr.2013.09.019 |
| [2] | Shapira A, Livney YD, Broxterman HJ, et al. Nanomedicine for targeted cancer therapy:towards the overcoming of drug resistance[J]. Drug Resist Updat, 2011, 14: 150–163. DOI:10.1016/j.drup.2011.01.003 |
| [3] | Dawar S, Singh N, Kanwar RK, et al. Multifunctional and multitargeted nanoparticles for drug delivery to overcome barriers of drug resistance in human cancers[J]. Drug Discov Today, 2013, 18: 1292–1300. DOI:10.1016/j.drudis.2013.09.009 |
| [4] | Bu HH, Gao Y, Li YP. Overcoming multidrug resistance (MDR) in cancer by nanotechnology[J]. Sci China Chem, 2010, 53: 2226–2232. DOI:10.1007/s11426-010-4142-5 |
| [5] | Fukumura D, Kashiwagi S, Jain RK. The role of nitric oxide in tumour progression[J]. Nat Rev Cancer, 2006, 6: 521–534. DOI:10.1038/nrc1910 |
| [6] | Chen L, Shang J, Wang ZF, et al. Synthesis and biological evaluation of nitrate-oleanolic acid hybrids as inhibitors of HepG2 cell apoptosis[J]. Acta Pharm Sin (药学学报), 2010, 45: 1516–1522. |
| [7] | Zheng N, Liu L, Liu W, et al. Crosstalk of ROS/RNS and autophagy in silibinin-induced apoptosis of MCF-7 human breast cancer cells in vitro[J]. Acta Pharmacol Sin, 2017, 38: 277–289. DOI:10.1038/aps.2016.117 |
| [8] | Mocellin S, Bronte V, Nitti D, et al. Nitric oxide, a double edged sword in cancer biology:searching for therapeutic opportunities[J]. Med Res Rev, 2007, 27: 317–352. DOI:10.1002/(ISSN)1098-1128 |
| [9] | Kim J, Saravanakumar G, Choi HW, et al. A platform for nitric oxide delivery[J]. J Mater Chem B, 2014, 2: 341–356. DOI:10.1039/C3TB21259A |
| [10] | Wu W, Perrin-Sarrado C, Ming H, et al. Polymer nanocomposites enhance S-nitrosoglutathione intestinal absorption and promote the formation of releasable nitric oxide stores in rat aorta[J]. Nanomedicine, 2016, 12: 1795–1803. DOI:10.1016/j.nano.2016.05.006 |
| [11] | Wu W, Gaucher C, Fries I, et al. Polymer nanocomposite particles of S-nitrosoglutathione:a suitable formulation for protection and sustained oral delivery[J]. Int J Pharm, 2015, 495: 354–361. DOI:10.1016/j.ijpharm.2015.08.074 |
| [12] | Wu W, Gaucher C, Diab R, et al. Time lasting S-nitrosoglutathione polymeric nanoparticles delay cellular protein S-nitrosation[J]. Eur J Pharm Biopharm, 2015, 89: 1–8. DOI:10.1016/j.ejpb.2014.11.005 |
| [13] | Kim MS, Blake M, Baek JH, et al. Inhibition of histone deacetylase increases cytotoxicity to anticancer drugs targeting DNA[J]. Cancer Res, 2003, 63: 7291–7300. |
| [14] | Havelka AM, Berndtsson M, Olofsson MH, et al. Mechanisms of action of DNA-damaging anticancer drugs in treatment of carcinomas:is acute apoptosis an "off-target" effect?[J]. Mini Rev Med Chem, 2007, 7: 1035–1039. DOI:10.2174/138955707782110196 |
| [15] | Hirst DG, Robson T. Nitrosative stress in cancer therapy[J]. Front Biosci, 2007, 12: 3406–3418. DOI:10.2741/2322 |
| [16] | Wink DA, Laval J. The Fpg protein, a DNA repair enzyme, is inhibited by the biomediator nitric oxide in vitro and in vivo[J]. Carcinogenesis, 1994, 15: 2125–2129. DOI:10.1093/carcin/15.10.2125 |
| [17] | Graziewicz M, Wink DA, Laval F. Nitric oxide inhibits DNA ligase activity:potential mechanisms for NO-mediated DNA damage[J]. Carcinogenesis, 1996, 17: 2501–2505. DOI:10.1093/carcin/17.11.2501 |
| [18] | Chien YH, Bau DT, Jan KY, et al. Nitric oxide inhibits DNA-adduct excision in nucleotides excision repair[J]. Free Radic Biol Med, 2004, 36: 1011–1017. DOI:10.1016/j.freeradbiomed.2004.01.011 |
| [19] | Laval F, Wink DA. Inhibition by nitric oxide of the repair protein, O6-methylguanine DNA-methyltransferase[J]. Carcinogenesis, 1994, 15: 443–447. DOI:10.1093/carcin/15.3.443 |
| [20] | Kim J, Pramanick S, Lee D, et al. Polymeric biomaterials for the delivery of platinum-based anticancer drugs[J]. Biomater Sci, 2015, 3: 1002–1017. DOI:10.1039/C5BM00039D |
| [21] | Gibson D. The mechanism of action of platinum anticancer agents-what do we really know about it?[J]. Dalton Trans, 2009, 48: 10681–10689. |
| [22] | Ivanov AI, Christodoulou J, Parkinson JA, et al. Cisplatin binding sites on human albumin[J]. J Biol Chem, 1998, 273: 14721–14730. DOI:10.1074/jbc.273.24.14721 |
| [23] | Turchi JJ. Nitric oxide and cisplatin resistance:NO easy answers[J]. Proc Natl Acad Sci U S A, 2006, 103: 4337–4338. DOI:10.1073/pnas.0601001103 |
| [24] | De Luca A, Moroni N, Serafino A, et al. Treatment of doxorubicin-resistant MCF7/Dx cells with nitricoxide causes histone glutathionylation and reversal of drug resistance[J]. Biochem J, 2011, 440: 175–183. DOI:10.1042/BJ20111333 |
| [25] | Huang LE, Willmore WG, Gu J, et al. Inhibition of hypoxia-inducible factor 1 activation by carbon monoxide and nitric oxide. Implications for oxygen sensing and signaling[J]. J Biol Chem, 1999, 274: 9038–9044. DOI:10.1074/jbc.274.13.9038 |
| [26] | Callapina M, Zhou J, Schmid T, et al. NO restores HIF-1α hydroxylation during hypoxia:role of reactive oxygen species[J]. Free Radic Biol Med, 2005, 39: 925–936. DOI:10.1016/j.freeradbiomed.2005.05.009 |
| [27] | Bonavida B, Baritaki S, Huerta-Yepez S, et al. Novel therapeutic applications of nitric oxide donors in cancer:roles in chemo-and immuno-sensitization to apoptosis and inhibittion of metastases[J]. Nitric Oxide, 2008, 19: 152–157. DOI:10.1016/j.niox.2008.04.018 |
| [28] | Huerta-Yepez S, Baritaki S, Baay-Guzman G, et al. Contribution of either YY1 or BclXL-induced inhibition by the NO-donor DETANONOate in the reversal of drug resistance, both in vitro and in vivo. YY1 and BclXL are overexpressed in prostate cancer[J]. Nitric Oxide, 2013, 29: 17–24. DOI:10.1016/j.niox.2012.12.001 |
| [29] | Riganti C, Miraglia E, Viarisio D, et al. Nitric oxide reverts the resistance to doxorubicin in human colon cancer cells by inhibiting the drug efflux[J]. Cancer Res, 2005, 65: 516–525. |
| [30] | Riganti C, Orecchia S, Pescarmona G, et al. Statins revert doxorubicin resistance via nitric oxide in malignant mesothelioma[J]. Int J Cancer, 2006, 119: 17–27. DOI:10.1002/(ISSN)1097-0215 |
| [31] | Lind DS, Kontaridis MI, Edwards PD, et al. Nitric oxide contributes to adriamycin's antitumor effect[J]. J Surg Res, 1997, 69: 283–287. DOI:10.1006/jsre.1997.5015 |
| [32] | Seabra AB, de Lima R, Calderón M. Nitric oxide releasing nanomaterials for cancer treatment:current status and perspectives[J]. Curr Top Med Chem, 2015, 15: 298–308. DOI:10.2174/1568026615666150108122918 |
| [33] | Jia XB, Zhang YH, Zou Y, et al. Dual intratumoral redox/enzyme-responsive NO-releasing nanomedicine for the specific, high-efficacy, and low-toxic cancer therapy[J]. Adv Mater, 2018: e1704490. |
| [34] | Duong HTT, Kamarudin ZM, Erlich RB, et al. Intracellular nitric oxide delivery from stable NO-polymeric nanoparticle carriers[J]. Chem Commun, 2013, 49: 4190–4192. DOI:10.1039/C2CC37181B |
| [35] | Lee HJ, Kim DE, Park DJ, et al. pH-responsive mineralized nanoparticles as stable nanocarriers for intracellular nitric oxide delivery[J]. Colloids Surf B Biointerfaces, 2016, 146: 1–8. DOI:10.1016/j.colsurfb.2016.05.039 |
| [36] | Kim J, Yung BC, Kim WJ, et al. Combination of nitric oxide and drug delivery systems:tools for overcoming drug resistance in chemotherapy[J]. J Control Release, 2017, 263: 223–230. DOI:10.1016/j.jconrel.2016.12.026 |
| [37] | Song Q, Tan S, Zhuang X, et al. Nitric oxide releasing D-α-tocopheryl polyethylene glycol succinate for enhancing antitumor activity of doxorubicin[J]. Mol Pharm, 2014, 11: 4118–4129. DOI:10.1021/mp5003009 |
| [38] | Lin SY, Wang MR, Chiu SJ, et al. S-Nitrosothiols (SNO) as light-responsive molecular activators for post-synthesis fluorescence augmentation in fluorophore-loaded nanospheres[J]. J Mater Chem B, 2018, 6: 153–164. |
| [39] | Chung MF, Liu HY, Lin KJ, et al. A pH-responsive carrier system that generates NO bubbles to trigger drug release and reverse P-glycoproteinmediated multidrug resistance[J]. Angew Chem Int Ed Engl, 2015, 54: 9890–9893. DOI:10.1002/anie.201504444 |
| [40] | Fan J, He Q, Liu Y, et al. Light-responsive biodegradable nanomedicine overcomes multidrug resistance via NO-enhanced chemosensitization[J]. ACS Appl Mater Interfaces, 2016, 8: 13804–13811. DOI:10.1021/acsami.6b03737 |
| [41] | Guo R, Tian Y, Wang YJ, et al. Near-infrared laser-triggered nitric oxide nanogenerators for the reversal of multidrug resistance in cancer[J]. Adv Funct Mater, 2017, 27: 1606398. DOI:10.1002/adfm.v27.13 |
| [42] | Duong HTT, Kamarudin ZM, Erlich RB, et al. Intracellular nitric oxide delivery from stable NO-polymeric nanoparticle carriers[J]. Chem Commun, 2013, 49: 4190–4192. DOI:10.1039/C2CC37181B |
| [43] | Choi HW, Kim J, Kim Y, et al. Light-induced acid generation on a gatekeeper for smart nitric oxide delivery[J]. ACS Nano, 2016, 10: 4199–4208. DOI:10.1021/acsnano.5b07483 |
| [44] | Maeda H, Noguchi Y, Sato K, et al. Enhanced vascular permeability in solid tumor is mediated by nitric oxide and inhibited by both new nitric oxide scavenger and nitric oxide synthase inhibitor[J]. Jpn J Cancer Res, 1994, 85: 331–334. DOI:10.1111/cas.1994.85.issue-4 |
| [45] | Wu J, Akaike T, Maeda H, et al. Modulation of enhanced vascular permeability in tumors by a bradykinin antagonist, a cyclooxygenase inhibitor, and anitric oxide scavenger[J]. Cancer Res, 1998, 58: 159–165. |
| [46] | Seki T, Fang J, Maeda H. Enhanced delivery of macromolecular antitumor drugs to tumors by nitroglycerin application[J]. Cancer Sci, 2009, 100: 2426–2430. DOI:10.1111/cas.2009.100.issue-12 |
| [47] | Kinoshita R, Ishima Y, Ikeda M, et al. S-Nitrosated human serum albumin dimer as novel nano-EPR enhancer applied to macromolecular anti-tumor drugs such as micelles and liposomes[J]. J Control Release, 2015, 217: 1–9. DOI:10.1016/j.jconrel.2015.08.036 |
| [48] | Wang MR, Chiu SJ, Chou HC, et al. An efficient S-NO-polysilsesquioxane nano-platform for the co-delivery of nitric oxide and an anticancer drug[J]. Chem Commun, 2015, 51: 15649–15652. DOI:10.1039/C5CC06087G |
| [49] | Garcia JV, Zhang F, Ford PC. Multi-photon excitation in uncaging the small molecule bioregulator nitric oxide[J]. Philos Trans A Math Phys Eng Sci, 2013, 371: 20120129. DOI:10.1098/rsta.2012.0129 |
| [50] | Zhang X, Tian G, Yin W, et al. Controllable generation of nitric oxide by near-infrared-sensitized upconversion nanoparticles for tumor therapy[J]. Adv Func Mater, 2015, 25: 3049–3056. |
| [51] | Jo YS, van der Vlies AJ, Gantz J, et al. Micelles for delivery of nitric oxide[J]. J Am Chem Soc, 2009, 131: 14413–14418. DOI:10.1021/ja905123t |
| [52] | Kumar V, Hong SY, Maciag AE, et al. Stabilization of the nitric oxide (NO) prodrugs and anticancer leads, PABA/NO and double JS-K, through incorporation into PEG-protected nanoparticles[J]. Mol Pharm, 2010, 7: 291–298. DOI:10.1021/mp900245h |
| [53] | Barraud N, Kardak BG, Yepuri NR, et al. Cephalosporin-3'-diazeniumdiolates:targeted NO-donor prodrugs for dispersing bacterial biofilms[J]. Angew Chem Int Ed Engl, 2012, 51: 9057–9060. |
 2018, Vol. 53
2018, Vol. 53


