2. 军事医学研究院辐射医学研究所, 北京 100850;
3. 中国医学科学院、北京协和医学院医药生物技术研究所, 北京 100050
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China;
3. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
皂苷是中药中一类重要的活性成分, 广泛存在于人参、三七、甘草、柴胡、黄芪、重楼、知母等多种中药材。该类成分具有共同的结构特征, 即均由疏水性的皂苷元和亲水性的糖基两部分通过糖苷键连接而成, 相对分子质量普遍较大(700~2 000)。根据苷元结构的不同, 又可将其分为三萜皂苷和甾体皂苷两种类型[1, 2]。现代药理学研究表明, 很多天然皂苷具有显著的抗炎、抗病毒、抗衰老、防治心脑血管疾病等药理活性[3], 临床广泛应用的复方甘草酸苷片、地奥心血康胶囊等的有效成分均为皂苷类化合物。
中药主要通过口服给药, 其中的成分经胃肠道吸收入血后, 主要在肝脏中发生氧化、还原等Ⅰ相代谢反应和葡萄糖醛酸化、硫酸酯化等Ⅱ相代谢反应, 最终生成多样的代谢产物。但在口服过程中, 中药成分不可避免地会与胃肠道中的酶或微生物进行接触, 直接突破胃肠道屏障并以原形进入体内发挥药效作用的成分非常有限。尤其分子量较大的皂苷类成分, 通常在肠道中吸收较差, 生物利用度低, 因此其在肠道中滞留的时间也相对较长, 更易受到肠道菌群的影响[4]。部分日本学者早在20世纪80年代起, 便对活性天然皂苷(如甘草皂苷和人参皂苷)的肠道菌群代谢展开了研究[5, 6]。结果表明, 皂苷类成分会在肠道菌群的作用下发生以逐级脱糖为主的一系列结构变化, 生成的转化产物可能比原形成分具有更好的生物利用度或更强的生物活性。因此, 肠道也是天然皂苷代谢的另一重要器官, 天然皂苷的肠道菌群转化受到日益广泛的关注[7]。
有效地对体内代谢产物进行分析和鉴定, 是正确认识包括皂苷类成分在内的天然产物如何在体内发挥药效的重要途径, 也是基于活性天然产物进行新药研发的关键环节。本文分别选择了几类具有显著药理活性且基础研究及临床应用均较为广泛的三萜皂苷(如人参皂苷、甘草皂苷、柴胡皂苷)和甾体皂苷(如薯蓣皂苷、知母皂苷等)类成分, 以此为例分析总结了这类重要的活性天然产物的体内代谢途径, 并对其在肠道菌群和肝脏作用下的转化规律进行了归纳总结, 以明确皂苷类成分的整体代谢特征, 为皂苷体内代谢产物的体外转化和制备、活性化合物的结构改造和成药性评价提供依据。
1 三萜皂苷 1.1 人参皂苷人参是我国传统名贵中药, 其化学成分主要包括三萜皂苷、多糖、黄酮、有机酸等[4]。其中, 三萜皂苷类成分是人参中最主要的活性成分, 又称人参皂苷。现代药理学研究表明, 其具有抑制肿瘤细胞增殖、调节中枢神经系统、增强机体免疫力、保护心脑血管等多种药理作用[8, 9]。人参皂苷按照苷元结构的不同可分为两大类。第一类为达玛烷型四环三萜皂苷, 包括20(S)原人参二醇型人参皂苷(如人参皂苷Rb1、Rb2、Rc、Rd、Rg3、Rh2)和20(S)原人参三醇型人参皂苷(如人参皂苷Re、Rf、Rg1、Rg2、Rh1);第二类为齐墩果烷型五环三萜皂苷(如人参皂苷Ro、Rh3、Ri)。其中, 以二醇型和三醇型人参皂苷在药材中含量最高, 人参皂苷Rb1、Rb2、Rc、Rd、Rg1、Re这6个化合物的含量在人参总皂苷中占90%以上[10]。因此, 早期的人参皂苷体内代谢和作用机制研究大多围绕这些主要成分展开。
一系列研究表明, 口服后的人参皂苷不会在胃中发生水解, 进入小肠后仅有极少一部分直接以原形被吸收, 而其在肠道中发生水解后生成的稀有皂苷和苷元才是人参皂苷吸收入血并发挥药效的主要形式[4]。吸收入血的肠道代谢产物大多直接发挥药理作用, 少部分被肝脏进一步代谢。因此, 肠道菌群介导的逐级脱糖反应对人参皂苷的体内代谢及药代动力学行为起到了极为重要作用。根据苷元结构的不同, 以下分别将二醇型和三醇型人参皂苷的体内代谢途径进行了总结。
1.1.1 原人参二醇型皂苷20(S)原人参二醇型皂苷的体内代谢过程目前已较为清晰。其原形成分口服后吸收较差, 在肠道中会发生阶梯式的脱糖反应, 且最终产物均为Compound K及20(S)原人参二醇(protopanaxadiol, PPD)。以人参和三七中含量均较高的人参皂苷Rb1为例, 该化合物在大鼠口服给药(80 mg·kg-1)时的绝对生物利用度仅有2.01%[11], 但会在肠道中代谢生成一系列次级苷和苷元。如图 1A所示, 其在人和大鼠肠道中的主要代谢途径均为“人参皂苷Rb1→人参皂苷Rd→人参皂苷F2→ Compound K→ PPD”, 即: C-20位糖链的末端糖苷键首先断裂, 脱去一分子葡萄糖后形成人参皂苷Rd; 之后人参皂苷Rd的C-3位末端糖苷键断裂, 脱去一分子葡萄糖后形成人参皂苷F2, 并进一步脱去C-3位的另一分子葡萄糖, 形成Compound K。最终Compound K脱去C-20位的一分子葡萄糖后生成苷元PPD[12-14]。除上述代谢途径外, 人参皂苷Rb1在人的肠道中还可以经“人参皂苷Rb1→绞股蓝皂苷XVII→绞股蓝皂苷LXXV→ Compound K→ PPD”这一途径进行代谢, 为次要代谢途径[13]。类似地, 人参皂苷Rb2在大鼠肠道菌群的作用下会逐级脱糖并生成人参皂苷Rd和Compound K, 人参皂苷Rc在人肠道菌群的作用下最终生成Compound K和PPD[13, 15]。
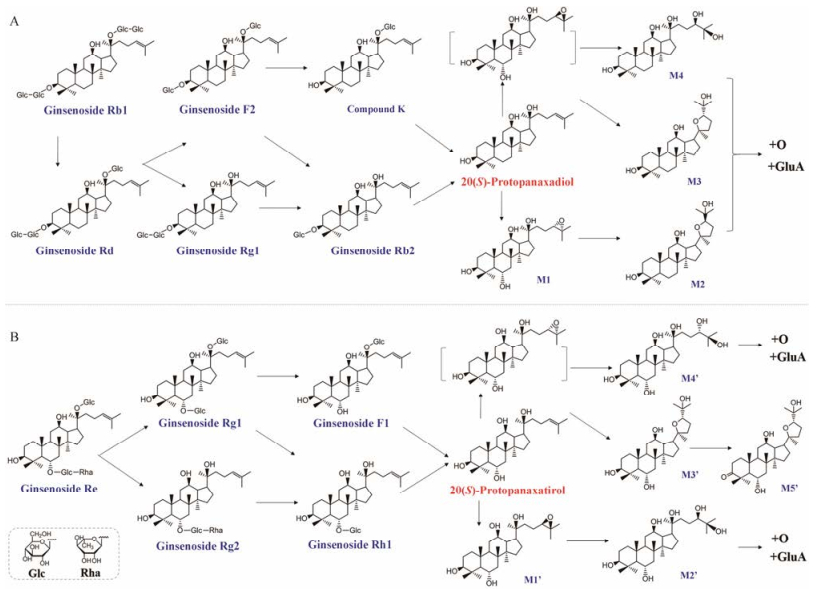
|
Figure 1 Proposed metabolic pathways of 20(S)-protopanaxadiol-type ginsenosides (A) and 20(S)-protopanaxatriol-type ginsenosides (B) in human. The metabolites in brackets are proposed metabolic intermediates, which were not measured in human plasma or human urine |
除阐明肠道代谢途径外, 也有研究对参与上述代谢反应的肠道菌株进行了筛选和鉴定。Akao等[12]通过比较灌胃给予人参皂苷Rb1后的无菌大鼠和定植特定菌株的悉生大鼠的肠道代谢产物, 发现在29株人源肠道细菌中仅有真杆菌属(Eubacterium)的菌株A-44可催化Rb1的脱糖反应, 并形成人参皂苷Rd (16.8%)和Compound K (70.3%)。另有报道, 口腔内普雷沃氏菌(Prevotella oris)也是转化人参皂苷Rb1的肠道活性菌[16]。Bae等[17]研究发现, 人参皂苷Rg3可以在拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、真杆菌属(Eubacterium)的菌株共同作用下, 生成人参皂苷Rh2并进一步脱糖转化为Compound K, 而梭杆菌属(Fusobacterium)的菌株仅能催化人参皂苷Rg3生成人参皂苷Rh2。表 1对人参皂苷单体化合物的肠内菌代谢产物和相应的转化菌株进行了总结[12-18]。
| Table 1 Bacterial strains involved in the intestinal metabolism of ginsenosides. G-: Ginsenoside |
Compound K和PPD作为原人参二醇型皂苷的重要肠道代谢物, 一部分随粪便排出体外, 另一部分则经小肠吸收后进入血液循环[19]。Hasegawa等[16]研究表明, 给C57BL/6小鼠和Wistar大鼠静脉注射Compound K后, Compound K会迅速地从循环系统消失, 同时选择性地在肝脏中蓄积。Hu等[20]对人口服三七提取物(主要含人参皂苷)后的血浆、尿液和胆汁中的代谢产物进行了全面鉴定, 发现Compound K和PPD吸收入血后会进一步发生氧化、侧链水合成环、葡萄糖醛酸化等Ⅰ相和Ⅱ相代谢。在血液中可检测到M1~M4, 而尿液中还可检测到M2和M3的氧化产物和葡萄糖醛酸化产物, 其代谢途径如图 1A所示。
1.1.2 原人参三醇型皂苷三醇型人参皂苷与二醇型人参皂苷的区别在于三醇型人参皂苷的C-6连有羟基, 而二醇型人参皂苷的C-6位无羟基取代。如图 1B所示, 两者在肠道中的代谢途径类似, 均是在肠道细菌的作用下, 从C-3或C-20位的糖链外侧阶梯式地发生糖苷键的开裂。人参皂苷Re作为三醇型人参皂苷的典型代表, 可在肠道菌群的作用下生成人参皂苷Rg1、Rg2、Rh1、F1和20(S)-原人参三醇(protopanaxatriol, PPT)。整个代谢过程由一系列肠道细菌共同完成, 如Prevotella oris、Eubacterium sp. A-44、Bifidobacterium sp. K506、Bacteroides sp. JY6和Fusobacterium sp. K-60等[14, 16, 18, 21]。目前已鉴定的可转化三醇型人参皂苷的单菌株及其代谢产物见表 1。苷元PPT吸收入血后, 其中一部分进一步发生Ⅰ相和Ⅱ相代谢反应。与PPD相似, 在人体内C-24和C-25位为主要的氧化位点, 羟基化反应大多发生于皂苷母核C-20的α位侧链[20]。Hao等[22]研究表明, 该羟基化反应主要由CYP3A4催化。
1.2 甘草皂苷三萜皂苷是甘草中最主要的一类化学成分, 其含量占甘草中全部次生代谢物的70%以上[23]。绝大多数甘草皂苷均具有五环三萜结构母核, 且均在C-3位通过氧苷键连有两分子葡萄糖醛酸。以其中含量最高的甘草酸为例, 其不仅是甘草质量控制的指标性成分, 也具有多种药理活性, 目前已开发为保肝药物并应用于临床[24]。
研究表明, 甘草皂苷口服给药后少部分可以原形吸收入血, 进而在肝脏中发生Ⅰ相及Ⅱ相代谢反应。例如, Xiang等[25]对甘草酸的体内代谢产物进行了系统分析和鉴定。给大鼠灌胃甘草酸(270 mg·kg-1)后, 在血浆中可检测到原形成分和另外5个代谢产物, 其中最主要的是C-3位糖苷键发生水解脱去两分子葡萄糖醛酸后生成的苷元甘草次酸。甘草次酸在体内会进一步发生葡萄糖醛酸化和羟基化反应。大鼠血浆中检测到两个甘草次酸单葡萄糖醛酸化代谢产物, 糖醛酸化位点分别为C-3位羟基和C-30位羧基。其中C-3位的单葡萄糖醛酸苷则可能由甘草酸的水解和甘草次酸的葡萄糖醛酸化两种途径产生。而血浆中发现的甘草次酸羟基化代谢产物, 其羟基化位点分别为苷元的C-22α位和C-24位, 有研究显示该反应分别由肝脏CYP 3A1P2和CYP 2C9P10催化[26]。总结其体内代谢途径如图 2所示。
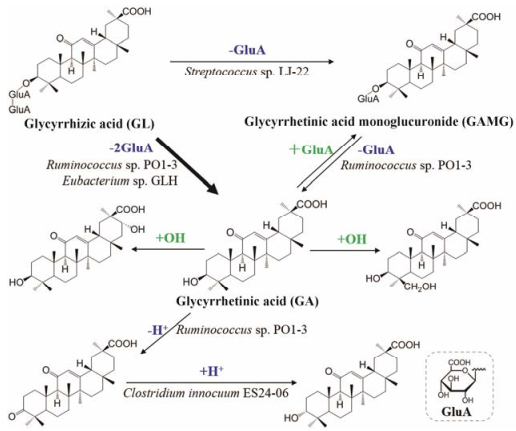
|
Figure 2 Proposed metabolism pathway of glycyrrhizinic acid after oral administration in rats. Blue and green colors denote metabolic reactions in intestinal and liver, respectively. The main metabolic pathway is in bold font |
虽然甘草酸可直接吸收入血, 但其生物利用度仅为4.0%[27, 28]。早在1983年, Hattori等[29]便发现甘草酸可经人的肠道菌群代谢。此后, Akao[30]阐明甘草酸的肠道代谢途径主要有两种:一种是甘草酸水解脱掉整个糖链, 直接生成甘草次酸; 另一种是先水解掉糖链末端的一个葡萄糖醛酸形成中间体, 再进一步水解生成甘草次酸。前一种为甘草酸在人和大鼠肠道中的最主要代谢方式。而甘草次酸的生物利用度高达90%, 是甘草酸在体内吸收入血并发挥药效的主要形式。有研究发现, 无菌大鼠的血液中既未检测到甘草酸也无甘草次酸, 说明肠道菌群的水解作用是其被肠道吸收并入血后发挥药效的必要环节[6]。Akao[30, 31]比较了大鼠消化系统不同部位(胃、十二指肠、小肠上段、小肠下段、盲肠和结肠)对甘草酸的代谢能力, 发现甘草酸在大鼠胃部基本不发生水解, 而肠道中不同部位的菌株均可水解甘草酸。进而该研究组从人的粪便中分离并验证了一系列参与其代谢的菌株, 如Eubacterium sp. GLH、Ruminococcus sp. PO1-3 (瘤胃球菌PO1-3)、Clostridium innocuum ES24-06 (无害梭菌ES24-06)、Streptococcus sp. LJ-22 (链球菌LJ-22)等。其中, Streptococcus sp. LJ-22被证实可特异性地转化甘草酸生成GAMG[32]。此外, 甘草次酸也会在盲肠中氧化还原酶的作用下, 发生3位羟基的脱氢反应生成微量的3-oxo-甘草次酸, 或进一步生成3位差向异构的3α-OH-甘草次酸(图 2)[33]。
除甘草酸外, Wang等[34]对22β-乙酰氧基甘草酸(22β-acetoxyl glycyrrhizin)在大鼠血浆、尿液和粪便中的代谢产物进行了鉴定, 在血浆中仅可检测到其脱糖后形成的苷元, 而在粪便和尿液中则可检测到逐级水解、水解后脱水、水解后脱氢和水解后脱去C-22位乙酰基的代谢产物。另外也在粪便中检测到少量该皂苷的甲基化代谢产物, 并经对照品比对确定其甲基化位点为葡萄糖醛酸C-6位羧基。Huang等[35]通过液质联用技术分析了甘草提取物及其中主要成分在与人肠道菌体外厌氧孵育前后的成分变化情况。结果表明, 甘草皂苷A3、22-β乙酰氧基甘草酸、甘草皂苷G2、甘草皂苷E2等甘草中其他的主要三萜皂苷在人肠道中最主要的代谢方式与甘草酸相同, 均为脱糖后形成相应的五环三萜苷元。脱糖后的苷元极性降低, 脂溶性增强, 更利于肠道的吸收。
1.3 柴胡皂苷柴胡皂苷是中药柴胡中的一类重要活性成分, 为齐墩果烷型五环三萜类衍生物, 具有解热、抗炎、保肝、抗肿瘤、抗病毒、抗溃疡惊厥等多种药理活性。柴胡提取物也已被开发为多种制剂, 如柴胡注射液、柴胡口服液、柴胡颗粒等[36]。柴胡皂苷在体内可经胃肠道和肝脏代谢, 包括为糖链的逐级水解和皂苷元的脱氢、羟基化、羧基化等多种反应类型。
柴胡皂苷在口服给药后, 首先在胃及肠道中发生一系列转化。早在1985年, 日本学者Shimizu等[37]便对柴胡中最主要的两种皂苷, 柴胡皂苷a和柴胡皂苷d在大鼠胃液和肠道中的代谢途径进行了研究。结果表明, 柴胡皂苷a和d在胃液(pH 1.5)中会在苷元部位发生开环和还原反应, 生成柴胡皂苷b1、柴胡皂苷b2等。在肠道中, 柴胡皂苷a、d及其开环还原产物进一步发生水解反应, 首先脱去C-3位糖链外侧的单糖形成次级苷prosaikosaponin F、G、A、D, 并在此后1 h内则完全脱糖转化为皂苷元saikogenin F、G、A、D。Kida等[38]将柴胡皂苷与人粪便悬液共同培养后, 也观察到其能够完全被代谢为相应的次级苷和苷元。Kida等还从31株人肠道菌株中筛选出3个可以将柴胡皂苷转化为前柴胡苷元的菌株Bifido bacterium sp. Saiko-1、Bifidobacterium sp. Saiko-2和Eubacterium sp. A-44。其中, E. sp. A-44可以催化前柴胡皂苷元进一步脱糖形成柴胡皂苷元。从该菌株中分离得到的β-D-葡萄糖苷酶(SHGase)和β-D-岩藻糖苷酶(PHFase)可分步催化柴胡皂苷a和柴胡皂苷b1发生逐级脱糖反应, 最终生成柴胡皂苷元。此外, Yu等[39]则分别采用大鼠和人的肠道菌群进行了体外转化, 证明柴胡皂苷c在肠道中的代谢途径与柴胡皂苷a、d类似, 在体内均是经由前柴胡苷元E1、E2转化为前柴胡苷元E3, 再最终水解为柴胡苷元E。
柴胡皂苷原形成分或肠道代谢产物(次级苷和苷元)在吸收入血后, 在肝脏中进行进一步代谢。Liu等[40]对柴胡皂苷a经静脉和胃肠道两种途径给药后的大鼠体内代谢过程进行了比较, 并从血液、胆汁、尿液、粪便样本中鉴定了17个代谢产物。结果发现, 两种给药途径下的体内代谢产物存在明显差异。静脉注射的柴胡皂苷a在肝脏中主要发生Ⅰ相代谢, 即脱去C-3外侧葡萄糖产生次级苷prosaikogenin f, 并进一步发生水合反应和单加氧反应, 但无法脱去糖链内侧的果糖并生成苷元。而口服给药的柴胡皂苷a可在肠道中水解后以苷元形式吸收入血, 因此还可以检测到苷元的脱氢、羟基化和羧基化代谢产物, 但具体的催化反应位点并未得到确切鉴定。Yu等[41]在体外条件下分别对柴胡皂苷d及其次级苷prosaikogenin G和苷元saikogenin G的肝脏代谢产物进行了鉴定。如图 3所示, 柴胡皂苷d会在大鼠肝微粒体的作用下发生羟基化反应(M1)和脱氢反应(M2)。但与柴胡皂苷a类似, 肝微粒体无法催化次级苷进一步脱去果糖生成苷元, 该水解反应只能由肠道菌群催化完成。若将肝微粒体直接与苷元saikogenin G共同孵育, 体系中可检测到一系列产生羟基化和羧基化代谢产物, 其中羟基化主要发生于苷元的C-1位或E环, 羧基化则主要表现为A环C-24位。
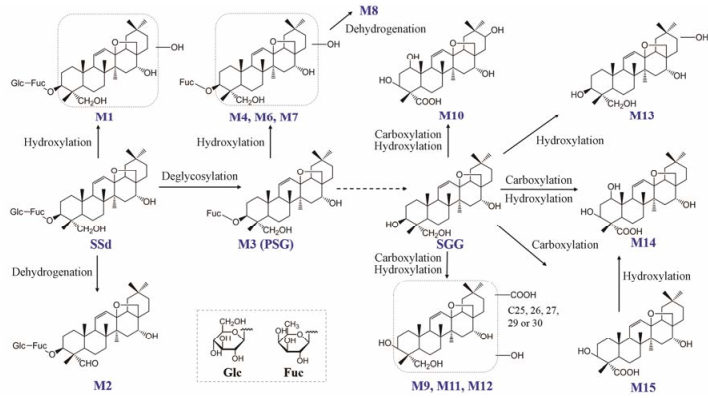
|
Figure 3 Proposed metabolic pathways of saikosaponian d (SSd), prosaikogenin G (PSG) and saikogenin G (SGG) in rat liver. Metabolic reaction that can not be catalyzed by rat liver microsomes is shown in dashed arrow |
薯蓣皂苷(dioscin)为螺甾烷型甾体皂苷, 由薯蓣皂苷元的3位羟基与一个含有两个鼠李糖和1个葡萄糖的糖链连接而成(图 4)。该化合物广泛存在于薯蓣科、石竹科、百合科、蔷薇科的多种药用植物中, 其中以薯蓣科含量最为丰富, 如穿龙薯蓣、盾叶薯蓣和黄山药等。研究表明, 薯蓣皂苷及其结构类似物具有抗肿瘤、抗真菌、免疫调节等多种药理作用。目前临床广泛应用于治疗心血管疾病的地奥心血康胶囊, 其有效成分便是从黄山药中提取得到的甾体总皂苷, 其中含量较高的两种成分为伪原薯蓣皂苷和薯蓣皂苷[42, 43]。

|
Figure 4 Proposed metabolic pathways of dioscin in rats |
以薯预皂苷为例, 其经灌胃给药后生物利用度极低, 仅为0.2%[44]。在大鼠的肠灌流实验中, 薯蓣皂苷总量在小肠循环后几乎不发生变化, 而阳性对照组右旋泮托拉唑钠在小肠循环后药量减少47.4%, 说明该化合物的小肠吸收差, 这也是薯蓣皂苷生物利用度极低的根本原因。但根据董梅[45]的研究结果, 薯蓣皂苷可以被人体内的肠道菌群所代谢。随着原形成分在肠道中停留时间的延长, 其中的糖被逐个水解, 最终形成薯蓣皂苷元(diosgenin)。Zhu等[46]从大鼠灌胃给药薯蓣皂苷后的粪便、尿液和胆汁中共鉴定了8个代谢产物(图 4, M1~M8), 涉及的反应类型包括水解脱糖、羟基化和葡萄糖醛酸化三种。此外, Tang等[47]也对薯蓣总皂苷和两个主要单体(薯预皂苷、薯蓣皂苷元)口服给药后的大鼠体内代谢轮廓进行了表征, 结果表明薯蓣皂苷的逐级脱糖是其最主要的代谢反应, 形成的薯蓣皂素是血浆、粪便和尿液中的最主要代谢产物。此外, 该研究还发现薯蓣皂素在吸收入血后, 会进一步发生Ⅰ相代谢反应, 如苷元5(6)位双键的加氢反应生成tigogenin (M9), 以及异构化后生成sarsasapogenin (M10)。综合以上研究结果, 总结其体内代谢途径如图 4所示。
2.2 知母皂苷知母皂苷为常用中药知母中一类重要的活性成分, 在抗衰老及改善记忆、防治心血管疾病、抗血小板聚集、清除自由基等方面均具有显著的药理作用[48, 49]。知母中的皂苷类成分根据苷元结构的不同, 可分为螺甾皂苷和呋甾皂苷两大类, 其中知母皂苷BII (timosaponin BII)为其中含量最高的成分, 在知母总皂苷中占70%以上, 其苷元为菝葜皂苷元(sarsapogenin)[50]。Jia等[51]从灌胃给药知母皂苷BII (300 mg·kg-1)后的大鼠体内共检测到19个代谢产物(图 5, M1~M19), 反应类型包括逐级脱糖、脱水环合、羟基化、加氧以及E环的开裂5种类型。此外, 该研究也采用人工胃液和肠液对知母皂苷BII进行了体外转化, 原形成分分别产生了9个和7个代谢产物, 其中肠液中的原形成分转化完全, 提示肠道代谢产物是知母皂苷吸收入血的主要形式。

|
Figure 5 Proposed metabolic pathway of timosaponin BII (TB-Ⅱ) in rats. a: Deglycosylation; b: Dehydration; c: Hydroxylation; d: E-ring cleavage; e: Oxidation |
在肝微粒体的作用下, 三萜苷元的母核结构一般不会发生变化, 而甾体皂苷元则可能发生开环、异构化等多种代谢反应, 代谢产物类型相对三萜更为多样。Qin等[52]分别对药食同源植物薤白中的总皂苷和五个代表性甾体皂苷单体的大鼠体内代谢产物进行了系统分析, 并总结了甾体皂苷常见的代谢反应位点和体内代谢的整体途径。甾体皂苷口服给药后, 在肠道中主要发生逐级脱糖, 此外也伴随着C20和C22位、C25位和C27位的脱氢反应。而肝脏对于甾体母核的代谢则主要表现为C12位的氧化, 以及E环C22位及其取代基上的结构变化。
3 总结与展望以上分别以几种代表性的三萜皂苷和甾体皂苷为例, 总结了中药中皂苷类成分的体内代谢研究进展。与其他一些天然产物如生物碱、萜类等不同的是, 皂苷口服后其原形成分的生物利用度低, 胃肠道代谢产物是皂苷吸收入血的主要形式。这也是皂苷类成分体内代谢的重要特点。无论是三萜皂苷还是甾体皂苷, 口服后原形成分均会在胃肠道内发生不同程度的转化, 其中以肠道菌群介导的代谢反应为主。肠道菌群数目庞大、种类多样, 对皂苷的代谢能力十分强大。其中, 逐级水解脱糖是最主要的代谢方式, 即生成一系列次级苷并最终生成苷元。此外, 肠道菌群还能够催化皂苷在苷元部分发生羟基化、脱氢、脱水、去甲基化等代谢反应, 为次要的肠道代谢途径。胃肠道中代谢生成的次级苷和苷元与原形成分相比, 其极性降低、脂溶性增加, 从而更有利于其吸收入血。因此, 肠道菌群的代谢是影响皂苷吸收入血的重要因素, 肠道菌群的水解作用对于改善皂苷类成分的生物利用度、充分发挥其药理活性是必不可少的[53]。参与上述代谢的肠道菌主要属于双歧杆菌属、真杆菌属、肠球菌属(Enterococcus)、埃希菌属(Escherichia)等[54]。这些细菌富含能够水解糖苷键的酶系, 皂苷水解后产生的糖链或单糖也是肠道内细菌的重要碳源。肠道菌群中的糖苷酶主要有葡萄糖苷酶、鼠李糖苷酶、木糖酶等。值得注意的是, 肠道菌群对皂苷类成分的脱糖基等代谢活性与其菌群组成、各菌属的相对数量密切相关。由于人的肠道菌群在物种组成及多样性方面与模型动物存在差异, 因此皂苷的胃肠道代谢也存在一定的种属差异。但无论在人体还是大鼠、小鼠等动物体内, 脱糖降解后生成苷元仍是皂苷最主要的胃肠道代谢途径, 其中部分糖链的水解位点或先后顺序可能因菌群组成结构的差异而有所不同。以人参皂苷Rg1为例, 其在大鼠肠道菌群的作用下可生成人参皂苷Rh1和人参皂苷F1两种次级苷, 并最终生成苷元20(S)-PPT。而在人的肠道菌群作用下其仅产生人参皂苷F1和苷元20(S)-PPT[55]。另一方面, 由于肠道菌群受饮食、年龄、环境等多种因素影响, 皂苷的肠道菌群代谢也会存在个体差异。皂苷类成分在肠道中的脱糖基代谢处置可以由益生菌介导, 亦可由某些致病菌和真菌介导。现有研究多关注健康人或动物的肠道菌群对皂苷类成分的代谢转化, 而在宿主菌群紊乱、应用抗菌药物或患有某些肠道菌群相关疾病的特定状态下, 这些成分的胃肠道代谢规律及差异尚待深入研究。
皂苷类成分体内代谢的另一特点, 是肝脏对皂苷入血成分的代谢以Ⅰ相代谢反应为主。皂苷以原形成分或肠道代谢产物的形式入血后, 肝脏作为最重要的代谢器官, 催化皂苷入血成分进一步发生Ⅰ相代谢反应, 包括脱糖、脱水、羟基化、加氢反应等, 而较少发生如葡萄糖醛酸化、硫酸酯化等Ⅱ相代谢反应。种属差异方面, 以原人参二醇型皂苷的肠道代谢产物Compound K为例, 其在小鼠和大鼠体内几乎不经肝脏代谢, 仅检测到原形和少量酯化产物[16]; 而该化合物在人体内吸收入血后则会进一步发生氧化、侧链水合成环等代谢反应, 代谢类型更为多样[21], 这与不同物种中肝微粒体代谢酶的种类存在差异有关。不过相对于肠道菌群, 肝脏对皂苷入血成分的代谢受环境、饮食等因素影响较少, 其个体差异相对较小。但由于体内代谢产物往往缺乏对照品、在血浆、尿液等样品中的含量有限, 目前代谢产物的结构鉴定大多依赖于高分辨质谱分析, 其确切的代谢位点往往难以进行准确鉴定, 这也是包括皂苷在内的活性天然产物体内代谢研究目前遇到的一个瓶颈。
大多数皂苷类化合物口服给药后原形生物利用度低, 这也给基于活性天然皂苷的新药研究带来了困难。由于体内代谢产物是其到达靶器官或靶部位并发挥药理活性的直接形式, 因此, 有必要采取体外生物转化等技术方法制备体内代谢产物, 然后对皂苷的体内代谢产物的结构、活性、作用机制等进行深入研究。已有部分研究采用生物转化的手段, 高效、特异地获得这些代谢产物。生物转化方法根据转化介质的不同, 主要包括酶催化和微生物发酵两种方法。其中, 酶法产物特异性强, 催化效率高, 但往往成本较高, 大规模应用目前尚不多见; 微生物发酵的方法比较简便快捷, 但大多伴有非特异性转化。以稀有非天然人参皂苷Compound K为例, 它是多种二醇型人参皂苷的共有代谢产物, 目前只能由温和的生物转化方法获得, 而无法通过剧烈的化学水解法获得。有研究表明, 从食用微生物Bifidobacterium sp. Int57和Bifidobacterium sp. SJ32中提取得到的粗酶液, 可以转化人参皂苷Rb1、Rb2和Rc生成Compound K[56]。此外, 多种肠道厌氧菌如Prevotella Oris、Eubaceteria sp. A-44等也被证明可以用来转化人参皂苷并生成次级苷[12, 57], 但厌氧菌的培养成本较高且发酵培养条件相对苛刻。Zhao等[58]采用真菌Colletotrichum gloeosporioides对知母皂苷BII进行了体外生物转化, 结果表明, 该菌株可特异性地水解知母皂苷BII C-26位葡萄糖基和C-3位糖链外侧的葡萄糖基, 生成一系列知母皂苷BII的体内代谢产物, 且产物类型与培养体系中葡萄糖浓度密切相关:葡萄糖浓度较低时(0~5 g·L-1), 知母皂苷BII仅脱去C-26位的葡萄糖基; 而当体系中葡萄糖浓度升高后(10 g·L-1、20 g·L-1), 该菌株进一步催化底物脱去C-3位葡萄糖基, 且在20 g·L-1下转化率可达100%。由此可见, 从真菌等微生物中筛选合适的菌株或酶进行体外生物转化, 是制备获得皂苷类成分体内代谢产物的有效途径。能够高效、特异地生成目标代谢产物的工程菌仍有待进一步开发, 以实现皂苷类成分体内代谢产物的大规模制备, 满足后续成药性研究和新药开发的需求。
| [1] | Singh D, Chaudhuri PK. Structural characteristics, bioavailability and cardioprotective potential of saponins[J]. Int Med Res, 2018, 7: 33–43. DOI:10.1016/j.imr.2018.01.003 |
| [2] | Vincken JP, Heng L, De GA, et al. Saponins, classification and occurrence in the plant kingdom[J]. Phytochemistry, 2007, 38: 275–297. |
| [3] | Rao AV, Gurfinkel DM. The bioactivity of saponins:triterpenoid and steroidal glycosides[J]. Drug Metab Drug Interact, 2000, 17: 211–235. |
| [4] | Liu H, Yang J, Du F, et al. Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats[J]. Drug Metab Dispos, 2009, 37: 2290–2298. DOI:10.1124/dmd.109.029819 |
| [5] | Akao T, Akao T, Kobashi K. Glycyrrhizin beta-D-glucuronidase of Eubacterium sp. from human intestinal flora[J]. Chem Pharm Bull, 1987, 35: 705–710. DOI:10.1248/cpb.35.705 |
| [6] | Akao T, Hayashi T, Kobashi K, et al. Intestinal bacterial hydrolysis is indispensable to absorption of 18β-glycyrrhetic acid after oral administration of glycyrrhizin in rats[J]. J Pharm Pharmacol, 1994, 46: 135–137. |
| [7] | Hierro JND, Herrera T, Fornari T, et al. The gastrointestinal behavior of saponins and its significance for their bioavailability and bioactivities[J]. J Funct Foods, 2018, 40: 484–497. DOI:10.1016/j.jff.2017.11.032 |
| [8] | Kang S, Min H. Ginseng, the 'immunity boost':the effects of Panax ginseng on immune system[J]. J Ginseng Res, 2012, 36: 354–368. |
| [9] | Cheng Y, Shen LH, Zhang JT. Anti-amnestic and anti-aging effects of ginsenoside Rg1 and Rb1 and its mechanism of action[J]. Acta Pharmacol Sin, 2005, 26: 143–149. |
| [10] | Wang Y, Pan JY, Xiao XY, et al. Simultaneous determination of ginsenosides in Panax ginseng with different growth ages using high-performance liquid chromatography-mass spectrometry[J]. Phytochem Anal, 2006, 17: 424–430. |
| [11] | Li X, Wang G, Sun J, et al. Pharmacokinetic and absolute bioavailability study of total panax notoginsenoside, a typical multiple constituent traditional Chinese medicine (TCM) in rats[J]. Biol Pharm Bull, 2007, 30: 847–851. |
| [12] | Akao T, Kida H, Kanaoka M, et al. Intestinal bacterial hydrolysis is required for the appearance of compound K in rat plasma after oral administration of ginsenoside Rb1 from Panax ginseng[J]. J Pharm Pharmacol, 1998, 50: 1155–1160. DOI:10.1111/jphp.1998.50.issue-10 |
| [13] | Bae EA, Park SY, Kim DH. Constitutive beta-glucosidases hydrolyzing ginsenoside Rb1 and Rb2 from human intestinal bacteria[J]. Biol Pharm Bull, 2000, 23: 1481–1485. DOI:10.1248/bpb.23.1481 |
| [14] | Chi H, Ji GE. Transformation of ginsenosides Rb1 and Re from Panax ginseng, by food microorganisms[J]. Biotechnol Lett, 2005, 27: 765–771. |
| [15] | Bae EA, Choo MK, Park EK, et al. Metabolism of ginsenoside Rc by human intestinal bacteria and its related antiallergic activity[J]. Biol Pharm Bull, 2002, 25: 743–747. DOI:10.1248/bpb.25.743 |
| [16] | Hasegawa H, Sung JH, Benno Y. Role of human intestinal Prevotella oris in hydrolyzing ginseng saponins[J]. Planta Med, 1997, 63: 436–440. DOI:10.1055/s-2006-957729 |
| [17] | Bae EA, Han MJ, Kim EJ, et al. Transformation of ginseng saponins to ginsenoside Rh2 by acids and human intestinal bacteria and biological activities of their transformants[J]. Arch Pharm Res, 2004, 27: 61–67. DOI:10.1007/BF02980048 |
| [18] | Bae EA, Shin JE, Kim DH. Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect[J]. Biol Pharm Bull, 2005, 28: 1903–1908. |
| [19] | Zhu H, Shen H, Xu J, et al. Comparative study on intestinal metabolism and absorption in vivo of ginsenosides in sulphur-fumigated and non-fumigated ginseng by ultra performance liquid chromatography quadruple time-of-flight mass spectrometry based chemical profiling approach[J]. Drug Testing Anal, 2015, 7: 320–330. DOI:10.1002/dta.v7.4 |
| [20] | Hu Z, Yang J, Cheng C, et al. Combinatorial metabolism notably affects human systemic exposure to ginsenosides from orally administered extract of Panax notoginseng roots (Sanqi)[J]. Drug Metab Dispos, 2013, 41: 1457–1469. |
| [21] | Yang L, Xu S, Liu C, et al. In vivo metabolism study of ginsenoside Re in rat using high-performance liquid chromatography coupled with tandem mass spectrometry[J]. Anal Bioanal Chem, 2009, 395: 1441–1451. DOI:10.1007/s00216-009-3121-1 |
| [22] | Hao H, Lai LC, Wang Q, et al. Microsomal cytochrome P450-mediated metabolism of protopanaxatriol ginsenosides:metabolite profile, reaction phenotyping, and structure-metabolism relationship[J]. Drug Metab Dispos, 2010, 38: 1731–1739. |
| [23] | Song W, Qiao X, Chen K, et al. Biosynthesis-based quantitative analysis of 151 secondary metabolites of licorice to differentiate medicinal Glycyrrhiza species and their hybrids[J]. Anal Chem, 2017, 89: 3146–3153. DOI:10.1021/acs.analchem.6b04919 |
| [24] | Zhang QY, Ye M. Chemical analysis of the Chinese herbal medicine Gan-Cao (licorice)[J]. J Chromatogr A, 2009, 1216: 1954–1969. DOI:10.1016/j.chroma.2008.07.072 |
| [25] | Xiang C, Qiao X, Wang Q, et al. From single compounds to herbal extract:a strategy to systematically characterize the metabolites of licorice in rats[J]. Drug Metab Dispos, 2011, 39: 1597–1608. DOI:10.1124/dmd.111.038695 |
| [26] | Gao K, Yu W, Yang J, et al. CYP3A1/2 and 2C9/10 in rat liver microsomes mediate 22α-and 24-hydroxylation of 18α-glycyrrhetic acid[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2007, 12: 1255–1260. |
| [27] | Ishida S, Sakiya Y, Ichikawa T, et al. Dose-dependent pharmacokinetics of glycyrrhizin in rats[J]. Chem Pharm Bull, 1992, 40: 1917–1920. DOI:10.1248/cpb.40.1917 |
| [28] | Qiao X, Ye M, Xiang C, et al. Analytical strategy to reveal the in vivo process of multi-component herbal medicine:a pharmacokinetic study of licorice using liquid chromatography coupled with triple quadrupole mass spectrometry[J]. J Chromatogr A, 2012, 1258: 84–93. DOI:10.1016/j.chroma.2012.08.041 |
| [29] | Hattori M, Sakamoto T, Kobashi K, et al. Metabolism of glycyrrhizin by human intestinal flora[J]. Planta Med, 1983, 48: 38–42. DOI:10.1055/s-2007-969875 |
| [30] | Akao T. Localization of enzymes involved in metabolism of glycyrrhizin in contents of rat gastrointestinal tract[J]. Biol Pharm Bull, 1997, 20: 122–126. DOI:10.1248/bpb.20.122 |
| [31] | Akao T. Influence of various bile acids on the metabolism of glycyrrhizin and glycyrrhetic acid by Ruminococcus sp. PO1-3 of human intestinal bacteria[J]. Biol Pharm Bull, 1999, 22: 787–793. |
| [32] | Kim DH, Lee SW, Han MJ. Biotransformation of glycyrrhizin to 18 beta-glycyrrhetinic acid-3-O-beta-D-glucuronide by Streptococcus LJ-22, a human intestinal bacterium[J]. Biol Pharm Bull, 1999, 22: 320–322. DOI:10.1248/bpb.22.320 |
| [33] | Akao T. Effects of glycyrrhizin and glycyrrhetic acid on the growth, glycyrrhizin beta-D-glucuronidase and 3 beta-hydroxysteroid dehydrogenase of human intestinal bacteria[J]. Biol Pharm Bull, 2000, 23: 104–107. DOI:10.1248/bpb.23.104 |
| [34] | Wang Q, Qian Y, Wang Q, et al. Metabolites identification of bioactive licorice compounds in rats[J]. J Pharmaceut Biomed Anal, 2015, 115: 515–522. DOI:10.1016/j.jpba.2015.08.013 |
| [35] | Huang WW, Wang MY, Shi HM, et al. Comparative study of bioactive constituents in crude and processed Glycyrrhizae radix, and their respective metabolic profiles in gastrointestinal tract in vitro, by HPLC-DAD and HPLC-ESI/MS analyses[J]. Arch Pharm Res, 2012, 35: 1945–1952. |
| [36] | Tao Y, Su D, Li W, et al. Pharmacokinetic comparisons of six components from raw and vinegar-processed Daphne genkwa aqueous extracts following oral administration in rats by employing UHPLC-MS/MS approaches[J]. J Chromatogr B, 2018, 1079: 34–40. DOI:10.1016/j.jchromb.2018.02.005 |
| [37] | Shimizu K, Amagaya S, Ogihara Y. Structural transformation of saikosaponins by gastric juice and intestinal flora[J]. J pharmacobio-dynamics, 1985, 8: 718–725. DOI:10.1248/bpb1978.8.718 |
| [38] | Kida H, Akao T, Meselhy R, et al. Metabolism and pharmacokinetics of orally administered saikosaponin b1 in conventional, germfree and Eubacterium sp. A-44-infected gnotobiote rats[J]. Biol Pharm Bull, 1998, 21: 588–593. DOI:10.1248/bpb.21.588 |
| [39] | Yu KU, Jang IS, Kang KH, et al. Metabolism of saikosaponin c and naringin by human intestinal bacteria[J]. Arch Pharm Res, 1997, 20: 420–424. DOI:10.1007/BF02973933 |
| [40] | Liu GQ, Tian Y, Li G, et al. Metabolism of saikosaponin a in rats:diverse oxidations on the aglycone moiety in liver and intestine in addition to hydrolysis of glycosidic bonds[J]. Drug Metab Dispos, 2013, 41: 622–633. DOI:10.1124/dmd.112.048975 |
| [41] | Yu P, Qiu H, Wang M, et al. In vitro metabolism study of saikosaponin d and its derivatives in rat liver microsomes[J]. Xenobiotica, 2016, 47: 11–19. |
| [42] | Qin J, Kang Y, Xu Z, et al. Dioscin prevents the mitochondrial apoptosis and attenuates oxidative stress in cardiac H9c2 cells[J]. Drug Res, 2014, 64: 47–52. |
| [43] | Wang Z, Yue C, Wang N, et al. Dioscin induces cancer cell apoptosis through elevated oxidative stress mediated by downregulation of peroxiredoxins[J]. Cancer Biol Ther, 2012, 13: 138–147. DOI:10.4161/cbt.13.3.18693 |
| [44] | Ke L, Tang Y, Fawcett JP, et al. Characterization of the pharmacokinetics of dioscin in rat[J]. Steroids, 2005, 70: 525–530. |
| [45] | Dong M. Studies on the Metabolism of and the Signal Transduction Pathways of Apoptosis Induced by the Constituents of Dioscorea Pahthaica Prain (黄山药化学成分代谢及其诱导细胞凋亡的分子机制的研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2001. |
| [46] | Zhu H, Xu J, Mao Q, et al. Metabolic profiles of dioscin in rats revealed by ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry[J]. Biomed Chromatogr, 2015, 29: 1415–1421. DOI:10.1002/bmc.v29.9 |
| [47] | Tang YN, Pang YX, Cheng X, et al. UPLC-QTOF-MS identification of metabolites in rat biosamples after oral administration of Dioscorea saponins:a comparative study[J]. J Ethnopharmacol, 2015, 165: 127–140. DOI:10.1016/j.jep.2015.02.017 |
| [48] | Guo CR, Li L, Yang XL, et al. Protective effects of timosaponin B-Ⅱ on high glucose-induced apoptosis in human umbilical vein endothelial cells, Environ[J]. Toxicol Pharmacol, 2014, 37: 37–44. DOI:10.1016/j.etap.2013.11.009 |
| [49] | Kang YJ, Chung HJ, Nam JW, et al. Cytotoxic and antineoplastic activity of timosaponin A-Ⅲ for human colon cancer cells[J]. J Nat Prod, 2011, 74: 701–706. |
| [50] | Yu S, Liu L, Ying P, et al. Metabolites characterization of timosaponin AⅢ in vivo, and in vitro, by using liquid chromatography-mass spectrometry[J]. J Chromatogr B, 2015, 997: 236–243. |
| [51] | Jia Y, Fu Z, Li Z, et al. In vivo and in vitro metabolism study of timosaponin B-Ⅱ using HPLC-ESI-MSn[J]. Chromatographia, 2015, 78: 1175–1184. |
| [52] | Qin ZF, Dai Y, Yao ZH, et al. Study on chemical profiles and metabolites of Allii Macrostemonis Bulbus, as well as its representative steroidal saponins in rats by ultra-performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry[J]. Food Chem, 2016, 192: 499–515. |
| [53] | Yu K, Chen F, Li C. Absorption, disposition, and pharmacokinetics of saponins from Chinese medicinal herbs:what do we know and what do we need to know more?[J]. Curr Drug Metab, 2012, 13: 577–598. |
| [54] | Xu J, Chen HB, Li SL. Understanding the molecular mechnisms of the interplay between herbal medicine and gut microbiota[J]. Med Res Rev, 2017, 37: 1140–1185. |
| [55] | Wang Y, Liu T, Wang W, et al. Studies on the metabolism of ginsenoside Rg1 by intestinal bacteria and its absorbed metabolites in rat and human sera[J]. Acta Pharm Sin (药学学报), 2000, 35: 284–288. |
| [56] | Chi H, Kim DH, Ji GE. Transformation of ginsenosides Rb2 and Rc from Panax ginseng by food microorganisms[J]. Biol Pharm Bull, 2005, 28: 2102–2105. DOI:10.1248/bpb.28.2102 |
| [57] | Sung JH, Huh JD, Hasegawa H, et al. Process for the preparation of ginseng saponins: US, 5925537[P]. 1999-7-20. |
| [58] | Zhao Y, Jiang T, Han B, et al. Preparation of some metabolites of timosaponin BⅡ by biotransformation in vitro[J]. Proc Biochem, 2015, 50: 2182–2187. |
 2018, Vol. 53
2018, Vol. 53


