自身免疫病是指机体对自身抗原发生免疫反应而导致自体组织损伤所引起的一系列疾病, 包括类风湿关节炎(rheumatoid arthritis, RA)、系统性红斑狼疮(systemic lupus erythematosus, SLE)、炎症性肠病(inflammatory bowel disease, IBD)和银屑病(psoriasis)等。近现代医学研究发现, 自身免疫病的产生与机体内炎性细胞因子(cytokines)合成和释放的失衡密切相关, 该发现也推动越来越多自身免疫病相关细胞因子及信号通路的研究[1]。JAKs (Janus kinases)是许多下游炎性细胞因子必需的信号转导介质, 因此靶向JAKs的小分子抑制剂能够通过影响下游炎性因子的信号转导而发挥抗炎和免疫调节的药理作用[2]。研究表明, JAKs为一类非受体型酪氨酸激酶, 包括JAK1、JAK2、TYK2 (tyrosine kinase 2)和JAK3。本文以JAK1、JAK2、TYK2和JAK3为切入点, 就治疗自身免疫病靶向小分子药物的最新研究进展进行综述。
1 JAKs的生物学特性和JAK/STAT信号通路JAKs通过催化与之相连的信号转导与转录激活因子(signal transducers and activators of transcription, STATs)使其酪氨酸磷酸化而激活, 从而介导细胞的增殖、分化、凋亡及免疫调节等一系列生物学过程。
1.1 JAKs的结构与功能JAKs是一类非受体型酪氨酸蛋白激酶家族, 包括JAK1、JAK2、TYK2和JAK3。JAK1、JAK2和TYK2广泛存在于各种组织和细胞中, 能被多种细胞因子激活; 而JAK3仅仅存在于骨髓和淋巴系统中, 只在白细胞中表达。JAKs具有7个同源区(JH1~JH7), JH1区为激酶区, 是C末端的酪氨酸激酶结构域, 具有催化活性; JH2区为伪激酶区, 不具有催化活性; JH3~JH7的结构和功能尚不清楚, 或许与细胞因子受体的结合作用有关。与其他酪氨酸蛋白激酶不同, JAK没有Src同源区2 (SH2)结构和Src同源区3 (SH3)结构。JAKs既能催化与之相连的细胞因子受体发生酪氨酸磷酸化使其激活, 又能通过磷酸化含特定SH2区的信号分子而产生信号转导作用[3]。
1.2 STATs的结构和功能JAKs的底物为STATs。STATs是一类存在于胞浆、激活后转入细胞核内结合DNA的蛋白家族, 具SH2和SH3两类结构域。SH2介导STATs与活化受体的酪氨酸残基结合, 诱导STATs二聚化, 并促使其与DNA结合; SH3结构域能与富含Pro的基序(motif)结合, 它能够识别富含脯氨酸和疏水残基的蛋白质并与之结合, 从而介导蛋白与蛋白的相互作用。STATs通过偶联上游信号分子磷酸化后的酪氨酸, 进入核内与DNA结合, 把胞外信号和胞内基因的表达调控直接联系起来[4]。
1.3 JAK/STAT信号通路转导方式细胞因子与相应的受体结合后引起膜通道开放, 使与受体偶联的JAK激酶相互接近并活化。JAKs被激活后, 会催化受体上的酪氨酸残基发生磷酸化修饰, 继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位点”(docking site), 同时含有SH2结构域的STATs蛋白被招募到这个“停泊位点”。接着, JAKs催化结合在受体上的STATs发生磷酸化修饰, 活化的STATs以二聚体的形式进入细胞核内与DNA结合, 调控基因的转录及表达, 这条信号转导途径被称为JAK/STAT信号通路[5] (图 1)。
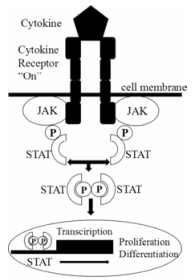
|
Figure 1 JAK/STAT signaling pathway |
JAK/STAT信号通路是一条与炎性细胞因子密切相关的细胞内信号转导通路, 参与机体细胞的增殖、分化、凋亡及免疫调节等许多重要的生物学过程, 尤其是其与自身免疫病的关系近年来受到越来越多的关注。例如, 白介素(interleukin, IL)-6是一种在许多自身免疫性和炎症性疾病中过度表达的促炎因子, 其信号转导通过JAK/STAT通路介导, 靶向IL-6单克隆抗体在临床治疗类风湿关节炎中取得较好的效果[6], 证实了JAK依赖性细胞因子在免疫发病机制中的重要性, 因此, 推测靶向JAK可以开发应用于多种自身免疫病的治疗药物。
2 靶向JAKs的小分子药物现已研究开发出多种应用于自身免疫病的JAKs小分子抑制剂, 基于它们的选择性和作用靶点不同, 可以将其分为非选择性JAK抑制剂、选择性JAK抑制剂以及JAK和其他激酶抑制剂。
2.1 非选择性JAK抑制剂非选择性JAK抑制剂指的是一类同时作用于多个JAKs的小分子化合物, 这类化合物能阻断多条JAK相关信号通路, 对多种自身免疫病有效, 是目前临床上应用最为广泛的一类JAKs小分子抑制剂。
2.1.1 TofacitinibTofacitinib是一种有效的非选择性JAK抑制剂, 优先抑制与JAK3或JAK1相关细胞因子受体的信号转导, 对JAK2有轻微抑制作用, 但对TYK2无效。临床前实验研究显示, tofacitinib可抑制JAK1/JAK3介导的IL-2、IL-4、IL-6、IL-7、IL-15和IL-21以及干扰素(interferon, IFN)-α和IFN-γ的信号转导, 并调节相关免疫和炎症反应过程, 从而抑制异常的信号通路转导, 有效控制自身免疫病病程, 同时其对JAK2和TYK2抑制作用微弱, 可缩小不良反应的发生范围[7]。
Tofacitinib是一种可口服的有机小分子物质, 进入机体内后被迅速吸收, 半衰期较短, 生物利用度较高。相比于生物制剂或抗体药的皮下或静脉给药方式而言, tofacitinib每日口服2次的给药方式更为便捷, 且tofacitinib在临床研究中一般耐受良好, 最严重的不良反应是感染, 以上呼吸道感染(URTI)和鼻咽炎较为常见[8]。
Tofacitinib枸橼酸盐为Pfizer公司开发的一种用于治疗中度至重度活动性类风湿关节炎的JAK小分子抑制剂, 于2012年首次在美国上市, 2013年在日本获得批准[9]。Tofacitinib在美国申请批准用于治疗中重度慢性斑块型银屑病, 但在2016年终止了申请。2017年3月, tofacitinib被批准在中国上市, 它可与甲氨蝶呤或其他非生物改善病情抗风湿药(DMARDs)联用治疗对甲氨蝶呤反应不足或对其无法耐受的中度至重度活动性类风湿性关节炎成年患者。此外, tofacitinib正在日本申请用于治疗关节炎和溃疡性结肠炎(ulcerative colitis, UC)的Ⅱ期临床试验[10]。
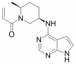
2.1.2 BaricitinibBaricitinib是Incyte和Lilly公司共同开发的第一个进入临床试验的JAK1/JAK2抑制剂, 强效抑制JAK1和JAK2 (半数抑制浓度IC50分别为5.9和5.7 nmol·L−1), 但其对TYK2和JAK3的抑制效力较低。Baricitinib能够有效地抑制STATs的磷酸化, 并且抑制随后产生的单核细胞趋化蛋白-1 (monocyte chemotactic protein 1, MCP-1)、IL-17和IL-22等致炎细胞因子的合成和释放[11], 从而控制炎症及免疫性疾病的发展。
Baricitinib口服生物利用度约为79%, 半衰期为12.5 h, 在体内主要以原型药形式经由肾脏和粪便排泄, 对肝药酶无较大影响。在应用baricitinib治疗活动性类风湿关节炎时, 会出现轻微的感染、中性粒细胞减少、肌酐水平升高和低密度脂蛋白水平升高[12]。
Baricitinib首先被FDA批准用于治疗中风险和高风险的骨髓纤维化(myelofibrosis, MF), 2017年在日本被批准用于治疗中度至重度活动性类风湿关节炎。Incyte公司也正在进行baricitinib治疗中度至重度银屑病、糖尿病肾病(diabetic nephropathy, DN)、中重度特应性皮炎(atopic dermatitis, AD)和系统性红斑狼疮的Ⅱ期临床试验[13]。此外, 2017年, baricitinib被美国指定为用于治疗小儿系统性红斑狼疮的孤儿药。
2.1.3 PeficitinibPeficitinib是Astellas公司开发的JAK1和JAK3抑制剂, 在体外能够浓度依赖性抑制JAK介导的IL-2和STAT5的表达, 抑制IL-2诱导的T细胞的增殖作用及一些致炎细胞因子如IL-6和IL-12的转导作用[14]。
Peficitinib在单次给药后迅速被吸收, 耐受性良好, 总淋巴细胞和外周淋巴细胞数目均未显示剂量依赖性变化, 但自然杀伤细胞(natural killer cell, NK)数目出现剂量依赖性下降。在重复给药2周后, 最常见的与治疗有关的不良反应为嗜中性白血球减少症、头痛和腹痛, 这些不良反应的发生可能与嗜中性粒细胞减少存在相关性[15]。
Peficitinib主要用于治疗活动性类风湿关节炎, 并在临床上取得了较好的疗效, 对peficitinib治疗中度及重度斑块状银屑病和中度至重度活动性溃疡性结肠炎的Ⅱ期临床试验也已经完成[16]。此外, Janssen Research & Development公司正在对peficitinib治疗中度至重度活动性溃疡性结肠炎进行进一步的Ⅱ期临床试验。
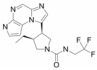
2.1.4 PF-06700841PF-06700841是Pfizer开发的JAK1、JAK2和TYK2抑制剂, 能阻断细胞因子IL-6、IL-12和IL-23的下游信号转导, 控制多种自身免疫病的发生与发展[17]。临床上, PF-06700841主要用于治疗中度至重度慢性斑块型银屑病患者和中度至重度斑秃(alopecia areata, AA)患者, 此外, PF-06700841与选择性JAK3抑制剂PF-06651600联用也可作为中度至重度溃疡性结肠炎患者的慢性治疗方案。
2.2 选择性JAK小分子抑制剂选择性JAK小分子抑制剂是指作用于某一个JAK靶点的小分子化合物, 在临床上应用于治疗RA、银屑病及其他自身免疫病。相比于非选择性JAK小分子抑制剂, 这类药物在控制疾病发展的同时, 能显著降低不良反应事件的发生, 改善患者的临床症状, 提高生活质量。因此, 对选择性JAK抑制剂的筛选、相关信号通路的研究和最佳适应症的选择具有重要的学术意义和应用价值。目前对选择性JAK抑制剂的研发仍处于初步阶段, 但此类小分子抑制剂的研究可能是今后的研发热点之一。
2.2.1 选择性JAK1抑制剂JAK1可以被存在于多发性骨髓瘤患者骨髓细胞中的细胞因子激活, 并且与多发性骨髓瘤和其他多种癌症细胞的增殖和侵袭有关。同时, 大量促炎细胞因子的信号转导也依赖于JAK1, 选择性抑制JAK1在治疗自身免疫病的同时也降低了因抑制其他JAKs而引发的不良反应[18]。
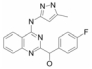
2.2.1.1 SolcitinibSolcitinib是通过高通量筛选得到的选择性JAK1抑制剂, 其在2位具有三唑并吡啶骨架和环丙基酰胺结构, 这个结构被报道具有抑制JAK1活性的作用。Solcitinib对JAK1具有良好的选择性, 临床前实验数据表明, 其对银屑病和系统性红斑狼疮具有较好的治疗效果, 对炎症性肠病也有一定的疗效[19]。
Solcitinib首先被开发应用于治疗斑块型银屑病患者, 并取得了较好的临床疗效, 而后对其用于治疗成人系统性红斑狼疮也进行了Ⅱ期临床试验研究, 但是在这项研究中发生了10例严重不良反应事件, 因此这项临床试验被提前终止[20]。此外, 对solcitinib应用于治疗溃疡性结肠炎和克罗恩病(crohndisease, CD)也进行了临床前研究, 这为solcitinib申请治疗IBD的临床试验建立了相关理论基础。
2.2.1.2 UpadacitinibUpadacitinib是一种通过结构预测开发的选择性JAK1抑制剂, 此前研究发现, JAK1和JAK2与细胞因子的ATP结合方式各不相同, 这种现象为JAK1选择性抑制剂的结构预测建立了理论基础。
Upadacitinib口服生物利用度高, 每日2次给药无累积且耐受性良好。Upadacitinib是细胞色素酶P450 (CYP)的非敏感底物, 与广泛CYP抑制剂利福平相互作用无太大影响。其对类风湿关节炎的治疗效果与非选择性JAK小分子抑制剂的治疗效果类似, 但也一定程度上存在轻度不良反应, 包括感染、血清转氨酶水平的短暂升高和血清脂质剂量依赖性升高, 可能与该药作用于其他激酶有关[21]。
Upadacitinib主要用于治疗炎性疾病患者。目前正在对克罗恩病和特应性皮炎进行Ⅱ期临床试验[22], 对类风湿关节炎和银屑病关节炎(psoriasis arthritsi, PsA)进行Ⅲ期临床试验, 并且对溃疡性结肠炎进行Ⅱ/Ⅲ期临床试验联合研究。
2.2.2 选择性JAK2抑制剂JAK2能与多种细胞因子的受体相偶联, 如生长激素、促红细胞生成素、γ干扰素、神经营养因子、粒细胞集落刺激因子和白介素家族等。细胞因子受体的活化促使JAK2的自磷酸化并对其下游信号分子(如STATs)的转导产生进一步的调控, 因而JAK2适宜作为治疗自身免疫病的重要靶点。如AC-430是Ambit Biosciences公司开发的新型选择性JAK2抑制剂, 正在进行Ⅰ期临床试验, 然而对这个产品没有最新的临床研究报道。
2.2.3 选择性JAK3抑制剂JAK3是一种较大的细胞质蛋白, 其在NK细胞和胸腺细胞中高表达, 并且在T细胞、B细胞和髓样细胞中可被诱导表达。选择性靶向JAK3作为治疗多种自身免疫病的关键优势在于JAK3的表达主要限于淋巴细胞, 其生理效应仅源于常见的γ细胞因子受体家族的信号转导过程。因此, 选择性靶向JAK3可以用于预防移植排斥和治疗各种自身免疫病如类风湿性关节、强直性脊柱炎(ankylosing spondylitis, AS)、银屑病、关节炎和克罗恩病等, 并且可以降低由于抑制JAK1和JAK2而引发的机体不良反应[23]。
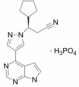
2.2.3.1 DecernotinibDecernotinib是通过筛选针对免疫细胞中关键信号激酶JAK3的化合物文库, 根据结合亲和力以及基于细胞效力, 选择特定的活性支架7-氮杂吲哚进行进一步优化得到的一种新型的选择性JAK3抑制剂[24]。
Decernotinib在临床上主要用于联合甲氨蝶呤治疗对甲氨蝶呤单独给药反应不足的类风湿关节炎患者, 但Ⅱ期临床试验研究表明服用decernotinib后存在高脂血症、肌酐升高、转氨酶升高、嗜中性白细胞减少症和淋巴细胞减少症[25]等不良反应的发生。
2.2.3.2 PF-06651600PF-06651600是Pfizer公司开发的选择性JAK3抑制剂, 体外能够剂量依赖性地抑制由IL-2、IL-4、IL-7和IL-15引发的STAT5的磷酸化和IL-21引发的STAT3磷酸化, 并能够抑制Th1和Th17细胞的分化和功能[26]。Pfizer公司对PF-06651600正在进行克罗恩病、类风湿关节炎和溃疡性结肠炎的Ⅱ期临床试验研究。
2.3 JAK和其他激酶抑制剂研究发现, 部分小分子药物在抑制JAKs的同时, 对细胞内存在的其他激酶如脾酪氨酸激酶(spleen tyrosine kinase, SYK)等也有着较为明显的抑制作用, 这类药物可以通过扩大抑制信号转导途径来提高活性并增加适应症范围, 然而, 这种广泛的抑制作用也可能导致一定的不良反应。
2.3.1 CerdulatinibCerdulatinib是一种JAK和SYK共同抑制剂。SYK是许多免疫相关受体能够识别的关键激酶。临床前研究表明, cerdulatinib对免疫细胞模型有着较好的疗效[27], Portola Pharmaceuticals公司正在评估该药物治疗类风湿关节炎的潜力, 然而对该化合物没有最新的临床研究报道。
2.3.2 SB-1578SB-1578是一种多激酶抑制剂, 作用于JAK2、集落刺激因子1受体(colony stimulating factor, CSF1R)和FMS样的酪氨酸激酶3 (Fms-like tyrosine kinase, FLT3)[28]。CSF1R和FLT3分别是促进骨髓生成和造血作用的受体酪氨酸激酶, 并且这两种激酶也涉及类风湿关节炎的发病机制。类似于其他多酶抑制剂, SB-1578通过阻断3个不关联的信号转导途径能明显提高其生物学活性并能增加适应症范围, 但与此同时也可能会引起药物不良反应的发生。
临床前实验表明, SB-1578在胶原诱导的关节炎大鼠和小鼠模型中均表现出较好的疗效, 其对骨吸收和软骨损伤的组织病理学修复有着很好的促进作用。此外, 该药物还可以消除炎症反应, 并防止巨噬细胞和嗜中性粒细胞渗入受累关节[29]。SB-1578具有独特的激酶谱, 其药理学特征为正在进行的自身免疫病的临床研究提供了强有力的理论基础。SB-1578对人类的类风湿关节炎治疗的Ⅰ期试验已于2012年完成, 但是未见进一步的进度报告。
3 结语与展望近现代医学研究发现, 自身免疫病的产生与机体内多种炎性细胞因子稳态失衡密切相关, 这种发现也推动了越来越多的靶向细胞因子及信号通路的药物在自身免疫病治疗中的研究。许多在研及临床治疗中的基于JAK的小分子药物已显示出明确疗效, 为自身免疫病的治疗提供了极大的可能性和空间(表 1)。例如:新近一系列FDA批准的JAK小分子抑制剂正在被研发并投入于市场, 其中一部分药物是通过与JAK共价结合而发挥药效的特异性靶向JAK抑制剂[30, 31]。但是现有的小分子药物在临床上的选择性尚未得到充分表征, 适用患者人群及最佳剂量方案仍待进一步的证实, 且对血液系统、免疫系统等存在或多或少的不良反应, 所以推测该类小分子抑制剂与其他治疗自身免疫病药物的联合使用可能在临床研究中具有提高疗效和降低毒副作用的优势。
| Table 1 Small-molecule inhibitors of JAKs relating to inhibiting autoimmune diseases. RA: Rheumatoid arthritis; SLE: Systemic lupus erythematosus; UC: Ulcerative colitis; CD: Crohn's disease; AA: Alopecia areata |
综上所述, 基于多靶点的联合用药可能是今后对自身免疫病药物研发的一个重要方向。如何进一步定向筛选、综合评价和选择低毒高效的治疗药物, 可能是今后该领域的研发热点之一, 以上研究工作的展开和深入也将为自身免疫病的治疗提供新思路、新方法和新探索。
| [1] | Wahren-Herlenius M, D rner T. Immunopathogenic mechanisms of systemic autoimmune disease[J]. Lancet, 2013, 382: 819–831. DOI:10.1016/S0140-6736(13)60954-X |
| [2] | Clark JD, Flanagan M, Telliez JB. Discovery and development of Janus kinase (JAK) inhibitors for inflammatory diseases[J]. J Med Chem, 2014, 57: 5023–5038. DOI:10.1021/jm401490p |
| [3] | Saharinen P, Takaluoma K, Silvennoinen O, et al. Regulation of the Jak2 tyrosine kinase by its pseudokinase domain[J]. Mol Cell Biol, 2000, 20: 3387–3395. DOI:10.1128/MCB.20.10.3387-3395.2000 |
| [4] | Chaturvedi P, Sharma S, Reddy EP, et al. Abrogation of interleukin-3 dependence of myeloid cells by the v-src oncogene requires SH2 and SH3 domains which specify activation of STATs[J]. Mol Cell Biol, 1997, 17: 3295–3304. DOI:10.1128/MCB.17.6.3295 |
| [5] | Coskun M, Salem M, Pedersen J, et al. Involvement of JAK/STAT signaling in the pathogenesis of inflammatory bowel disease[J]. Pharmacol Res, 2013, 76: 1–8. DOI:10.1016/j.phrs.2013.06.007 |
| [6] | Calabrese LH, Rose-John S. IL-6 biology:implications for clinical targeting in rheumatic disease[J]. Nat Rev Rheumatol, 2014, 10: 720–727. DOI:10.1038/nrrheum.2014.127 |
| [7] | Gao W, McGarry T, Orr C, et al. Tofacitinib regulates synovial inflammation in psoriatic arthritis, inhibiting STAT activation and induction of negative feedback inhibitors[J]. Ann Rheum Dis, 2016, 75: 311–315. |
| [8] | Dhillon S. Tofacitinib:a review in rheumatoid arthritis[J]. Drugs, 2017, 77: 1987–2001. DOI:10.1007/s40265-017-0835-9 |
| [9] | Lee EB1, Fleischmann R, Hall S, et al. Tofacitinib versus methotrexate in rheumatoid arthritis[J]. N Engl J Med, 2014, 370: 2377–2386. DOI:10.1056/NEJMoa1310476 |
| [10] | Naganuma M, Mizuno S, Nanki K, et al. Recent trends and future directions for the medical treatment of ulcerative colitis[J]. Clin J Gastroenterol, 2016, 9: 329–336. DOI:10.1007/s12328-016-0686-z |
| [11] | Markham A. Baricitinib:first global approval[J]. Drugs, 2017, 77: 697–704. DOI:10.1007/s40265-017-0723-3 |
| [12] | Genovese MC, Kremer J, Zamani O, et al. Baricitinib in patients with refractory rheumatoid arthritis[J]. N Engl J Med, 2016, 374: 1243–1252. DOI:10.1056/NEJMoa1507247 |
| [13] | Taylor PC, Keystone EC, van der Heijde D, et al. Baricitinib versus placebo or adalimumab in rheumatoid arthritis[J]. N Engl J Med, 2017, 376: 652–662. DOI:10.1056/NEJMoa1608345 |
| [14] | Cao YJ, Sawamoto T, Valluri U, et al. Pharmacokinetics, pharmacodynamics, and safety of ASP015K (peficitinib), a New Janus kinase inhibitor, in healthy subjects[J]. Clin Pharmacol Drug Dev, 2016, 5: 435–449. DOI:10.1002/cpdd.v5.6 |
| [15] | Ito M, Yamazaki S, Yamagami K, et al. A novel JAK inhibitor, peficitinib, demonstrates potent efficacy in a rat adjuvant-induced arthritis model[J]. J Pharmacol Sci, 2017, 133: 25–33. DOI:10.1016/j.jphs.2016.12.001 |
| [16] | Nielsen OH, Seidelin JB, Ainsworth M, et al. Will novel oral formulations change the management of inflammatory bowel disease?[J]. Expert Opin Investig Drugs, 2016, 25: 709–718. DOI:10.1517/13543784.2016.1165204 |
| [17] | Banfield C, Scaramozza M, Zhang W, et al. The safety, tolerability, pharmacokinetics, and pharmacodynamics of a TYK2/JAK1 inhibitor (PF-06700841) in healthy subjects and patients with plaque psoriasis[J]. J Clin Pharmacol, 2018, 54: 434–447. |
| [18] | Dymock BW, Yang EG, Chu-Farseeva Y, et al. Selective JAK inhibitors[J]. Future Med Chem, 2014, 6: 1439–1471. DOI:10.4155/fmc.14.92 |
| [19] | Ludbrook VJ, Hicks KJ, Hanrott KE, et al. Investigation of selective JAK1 inhibitor GSK2586184 for the treatment of psoriasis in a randomized placebo-controlled phase Ⅱa study[J]. Br J Dermatol, 2016, 174: 985–995. DOI:10.1111/bjd.14399 |
| [20] | Kahl L, Patel J, Layton M, et al. Safety, tolerability, efficacy and pharmacodynamics of the selective JAK1 inhibitor GSK2586184 in patients with systemic lupus erythematosus[J]. Lupus, 2016, 25: 1420–1430. DOI:10.1177/0961203316640910 |
| [21] | Mohamed MF, Camp HS, Jiang P, et al. Pharmacokinetics, safety and tolerability of ABT-494, a novel selective JAK 1 inhibitor, in healthy volunteers and subjects with rheumatoid arthritis[J]. Clin Pharmacokinet, 2016, 55: 1547–1558. DOI:10.1007/s40262-016-0419-y |
| [22] | Kremer JM, Emery P, Camp HS, et al. A phase Ⅱb study of ABT-494, a selective JAK-1 inhibitor, in patients with rheumatoid arthritis and an inadequate response to anti-tumor necrosis factor therapy[J]. Arthritis Rheumatol, 2016, 68: 2867–2877. DOI:10.1002/art.39801 |
| [23] | Yin Y, Zhang TT, Zhang DY. Research progress of JAK-3 kinase and its inhibitors[J]. Acta Pharm Sin (药学学报), 2016, 51: 1520–1529. |
| [24] | Farmer LJ, Ledeboer MW, Hoock T, et al. Discovery of VX-509(decernotinib):a potent and selective Janus kinase 3 inhibitor for the treatment of autoimmune diseases[J]. J Med Chem, 2015, 58: 7195–7216. DOI:10.1021/acs.jmedchem.5b00301 |
| [25] | Gadina M, Schwartz DM, O'Shea JJ. Decernotinib:a next-generation jakinibs[J]. Arthritis Rheumatol, 2016, 68: 31–34. DOI:10.1002/art.39463 |
| [26] | Thorarensen A, Dowty ME, Banker ME, et al. Design of a Janus kinase 3(JAK3) specific inhibitor 1-((2S, 5R)-5-((7H-pyrrolo[J]. J Med Chem, 2017, 60: 1971–1993. DOI:10.1021/acs.jmedchem.6b01694 |
| [27] | Coffey G, Betz A, DeGuzman F, et al. The novel kinase inhibitor PRT062070(cerdulatinib) demonstrates efficacy in models of autoimmunity and B-cell cancer[J]. J Pharmacol Exp Ther, 2014, 351: 538–548. DOI:10.1124/jpet.114.218164 |
| [28] | Poulsen A, William A, Blanchard S, et al. Structure-based design of oxygen-linked macrocyclic kinase inhibitors:discovery of SB1518 and SB1578, potent inhibitors of Janus kinase 2(JAK2) and Fms-like tyrosine kinase-3(FLT3)[J]. J Comput Aided Mol Des, 2012, 26: 437–450. DOI:10.1007/s10822-012-9572-z |
| [29] | Madan B, Goh KC, Hart S, et al. SB1578, a novel inhibitor of JAK2, FLT3, and c-Fms for the treatment of rheumatoid arthritis[J]. J Immunol, 2012, 189: 4123–4134. DOI:10.4049/jimmunol.1200675 |
| [30] | Kettle JG, Åstrand A, Catley M, et al. Inhibitors of JAK-family kinases:an update on the patent literature 2013-2015, part 1[J]. Expert Opin Ther Pat, 2017, 27: 127–143. DOI:10.1080/13543776.2017.1252753 |
| [31] | Kettle JG, Åstrand A, Catley M, et al. Inhibitors of JAK-family kinases:an update on the patent literature 2013-2015, part 2[J]. Expert Opin Ther Pat, 2017, 27: 145–161. DOI:10.1080/13543776.2017.1252754 |
 2018, Vol. 53
2018, Vol. 53