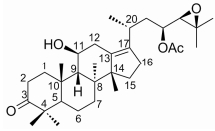
泽泻(Alismatis Rhizoma)为泽泻科植物东方泽泻[Alisma orientale (Sam.) Juzep.]的干燥块茎, 是我国常用大宗药材, 具有利水渗湿、泄热、化浊降脂等功效, 以福建为道地产区[1, 2]。原萜烷型(protostane)四环三萜类成分是泽泻的主要药效成分[3], 这是一类包括23-乙酰泽泻醇B及其衍生物在内的天然植物化合物, 其结构独特, C10位和C14位各有一个β-CH3, C8位和C20位有α-CH3 (图 1)。国内外的研究发现, 泽泻中原萜烷型三萜类成分具有明显的调血脂[4]、保肝[5]、抗炎及抗氧化[6]等作用, 近年研究表明, 泽泻还具有较强的抗恶性肿瘤转移作用[7], 23-乙酰泽泻醇B可诱导结肠癌细胞、前列腺癌PC-3细胞及肺癌细胞的凋亡, 可用于新型抗肿瘤药物的研制, 应用前景广阔, 但其含量低, 自然分布窄, 迄今除泽泻属外, 仅在几种植物中偶见报道[8, 9]。
|
Figure 1 Chemical structure of alisol B 23-acetate |
植物体内主要以甲羟戊酸(mevalonic aid, MVA)途径合成活性成分三萜[10], 法呢基焦磷酸合酶通过5个碳链长度的类异戊二烯以缩合的方式催化异戊烯基焦磷酸(isopentyl pyrophosphate, IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate, DMAPP)形成10个碳的牻牛儿基焦磷酸(geranyl pyrophosphate, GPP), 然后与另一个异戊烯基焦磷酸缩合形成15个碳的法呢基焦磷酸(farnesyl pyrophosphate, FPP)[11]。法呢基焦磷酸是MVA途径中由法呢基焦磷酸合酶(farnesyl pyrophosphate synthase, FPPS)催化产生的一个多分支点的底物, 是倍半萜及多萜等多种次生代谢产物的重要前体物质。目前已从卷叶贝母[12]、杜仲[13]、三七[14]等多种药用植物中克隆了FPPS的cDNA序列。近期研究亦表明, 通过过表达法呢基焦磷酸合酶可以调控植物三萜的生物合成, 最终促进三萜的积累[15]。
本课题组前期已克隆获得泽泻法呢基焦磷酸合酶基因AoFPPS全长(accession No. HQ724508)[1], 但其功能及在原植物体内的表达仍未见报道。本文将泽泻AoFPPS基因克隆到原核表达载体中, 利用大肠杆菌系统表达并纯化获得AoFPPS重组蛋白; 将该重组蛋白免疫新西兰兔, 从而制备AoFPPS多克隆抗体, 并对其效价和特异性进行分析和功能验证, 同时采用蛋白质免疫印迹(Western blot)分析泽泻AoFPPS基因在不同器官中蛋白水平的表达情况, 分析其在泽泻品质形成过程中的表达规律。研究结果将有助于阐明FPPS在泽泻体内的作用机制, 为泽泻资源性成分原萜烷型三萜的合成生物学应用提供科学依据。
材料与方法材料 所用实验材料均取自福建建瓯, 经南京中医药大学谷巍教授鉴定为泽泻科植物东方泽泻[Alisma orientale (Sam.) Juzep.]。取其根和块茎, 分装于冻存管, 并立刻置于液氮中保存备用。原核表达载体pCzn1、大肠杆菌(E. coli) DH5α菌株、原核表达宿主菌BL21 (Roseta)购自南京钟鼎生物技术有限公司。含AoFPPS全长序列的体外克隆pCzn1-AoFPPS由本实验室保存。
T4 DNA连接酶、限制性内切酶NdeⅠ和Hind Ⅲ、羊抗兔lgG (HRP标记)购自南京钟鼎生物技术有限公司; 异丙基硫代β-D-半乳糖苷(IPTG)、丙烯酰胺(Acr)、氨苄青霉素(Amp)、三羟甲基氨基甲烷(Tris)购自Sigma公司; 十二烷基硫酸钠(SDS)购自Amresco公司; N, N, N", N"-四甲基乙二胺(TEMED)购自BIO-RAD公司; 0.22 μm无菌滤器和透析袋购自Millipore公司; Ni2+ IDA亲和色谱胶购自Novagen公司; DNA胶纯化试剂盒、质粒小提试剂盒购自Axygen公司; GPP、IPP购自Cayman公司; 其他试剂均为国产分析纯; 引物由上海捷瑞生物有限公司合成, 测序工作由上海生工生物工程公司完成。
仪器 Allegra 21R台式高速冷冻离心机(美国BECKMAN公司产品); Biologic LP色谱系统、Mini Proteam Ⅱ垂直平板电泳系统、Gel Doc2000凝胶成像系统、水平电泳系统(美国BIO-RAD公司产品); PTC-200基因扩增仪(美国MJ Research公司产品); Nano-Drop 2000核酸/蛋白定量仪(Thermo公司产品); JY92-2D超声波细胞粉碎机(中国新芝科器研究所产品); 高效液相色谱仪(Waters公司产品); C18色谱柱(250 mm × 4.6 mm, YMC公司产品)。
原核表达载体pCzn1-AoFPPS的构建及鉴定 根据前期获得并提交到NCBI上的AoFPPS基因序列结果(accession No. HQ724508), 将其克隆进pGHn载体, 在获得克隆载体pGHn-AoFPPS的基础上, 重新设计引物, 上游引入NdeⅠ酶切位点, 下游引入Hind Ⅲ酶切位点(下划线部分)。上游引物: 5'-CCCATATGGCGGCGTCTCC-3', 下游引物: 5'-GAAGCTTCTACTTCTGCCTCTTG-3'。进行PCR扩增, 50 μL反应体系含: 10×PCR缓冲液5.0 μL, 25 mmol·L-1 MgCl2 4.0 μL, 10 mmol·L-1 dNTP 4.0 μL, 10 nmol·L-1上下游引物各1.0 μL, cDNA模板5.0μL, 5 U rTaq DNA聚合酶0.5 μL, ddH2O 29.5 μL。PCR反应条件为: 94 ℃预变性5 min; 94 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸1 min, 30个循环; 72 ℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳检测后, 割胶纯化回收PCR目的片段进行克隆测序。经测序无突变的重组质粒分别用NdeⅠ和Hind Ⅲ双酶切, 定向连入经相同双酶切的载体pCzn1, 然后转入大肠杆菌DH5α, 酶切、测序鉴定阳性克隆。
重组质粒pCzn1-Ao FPPS的诱导表达 将经测序无突变的重组质粒pCzn1-AoFPPS转化至大肠杆菌BL21 (Roseta)受体菌, 筛选阳性重组克隆, 置于含有50 μg·mL-1 Amp的3 mL LB培养液中, 37 ℃ 220 r·min-1振摇培养过夜, 次日稀释100倍, 继续培养至OD600值为0.6, 取1 mL作为诱导前对照, 向剩余的培养物中加入IPTG至终浓度为0.2 mmol·L-1, 20 ℃ 220 r·min-1振摇4 h, 诱导融合蛋白表达, 12 000 ×g室温离心2 min, 收集菌体沉淀。分别取诱导前重悬菌液、诱导后菌液、诱导后菌液的上清及沉淀作为样品, 进行10% SDS-PAGE电泳分析。
重组蛋白的纯化 将诱导表达的培养菌体溶液用20 mL Ni-IDA Binding-Buffer重悬后, 超声破碎(功率400 W, 工作4 s, 间歇8 s, 共20 min), 4 ℃ 10 000 ×g离心20 min, 取上清; 利用低压色谱系统, 上清液以0.5 mL·min-1流速上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和色谱柱; 用Ni-IDA Binding-Buffer以0.5 mL·min-1流速冲洗, 至流出液OD280值到达基线; 用Ni-IDA Washing-Buffer (20 mmol·L-1 Tris-HCl, 20 mmol·L-1咪唑, 0.15 mol·L-1 NaCl, pH 8.0)以1 mL·min-1流速冲洗, 至流出液OD280值到达基线; 用Ni-IDA Elution-Buffer (20 mmol·L-1 Tris-HCl, 250 mmol·L-1咪唑, 0.15 mol·L-1 NaCl, pH 8.0)以1 mL·min-1流速洗脱目的蛋白, 收集流出液; 将上述收集的蛋白溶液加入透析袋中, 使用PBS (pH 7.4)进行透析过夜; 进行10% SDS-PAGE分析。
原核表达蛋白的体外酶促反应 200μL酶促反应体系: 5 mmol·L-1 DTT, 5 mmol·L-1 MgCl2, 25 μmol·L-1 IPP, 25 μmol·L-1 GPP, 6.70μL 0.8 mg·mL-1 AoFPPS蛋白, pH 7.4 Tris-HCl缓冲液补足, 上覆400μL正己烷, 在30 ℃反应2 h, 充分涡悬振荡后10 000 r·min-1离心, 取上层正己烷溶液, 并以携带空载体菌液提取的蛋白代替AoFPPS蛋白, 其他组分不变, 作为对照组, HPLC检测催化反应产物。HPLC分析条件: 0 min, 乙腈-水(5:95, v/v); 95 min, 乙腈(100%)。柱温30 ℃, 流速1.0 mL·min-1, 进样量10 μL。紫外检测器, 检测波长: 275 nm。
多克隆抗体的制备与纯化 用纯化蛋白免疫2只新西兰兔(2~2.5 kg), 每次皮下免疫400 μg, 每2~3周免疫1次, 共免疫4次。重复3次实验。采血检测, 通过间接酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)确定抗血清针对蛋白的效价, 待效价大于1:50 000, 进行最终采血制备抗血清, 并准备纯化。
将蛋白与琼脂糖介质偶联制备成抗原亲和纯化色谱柱, 然后将所得抗血清与PBS等量混合后缓慢上样, 待抗原抗体结合后用甘氨酸洗脱缓冲液洗脱, 即得所需纯化抗体, 并立即在PBS中4 ℃进行透析过夜。隔日进行纯度、浓度和效价测定。
多克隆抗体浓度、纯度及效价测定 通过BCA蛋白浓度测定试剂盒对所得抗体的浓度进行测定; 通过SDS-PAGE电泳, 考马斯亮蓝染色考察纯化抗体的纯度; 通过间接ELISA检测抗体效价: 0.05 mol·L-1碳酸盐缓冲液(pH 9.6)将纯化的抗体稀释为20 μg·mL-1, 酶标板每孔加入100 μL, 4 ℃恒温包被过夜; 次日每孔加入5%脱脂奶粉100 μL, 37 ℃恒温孵育1 h, 用PBST (pH 7.4)洗涤3次; 洗涤后分别加入500~512 000倍稀释的兔抗血清100 μL, 同时以1:50倍稀释的免疫前血清作为阴性对照, 以兔抗血清稀释液(PBS)为空白对照, 37 ℃孵育恒温1 h, 同上洗涤3次; 然后每孔加入HRP标记的羊抗兔lgG 100 μL, 37 ℃恒温孵育1 h, 同上洗涤3次; 每孔再加TMB 100 μL, 37 ℃避光显色20 min; 最后加入2 mol·L-1硫酸50μL终止液。终止反应后, 用酶标仪测定并读取450 nm处的OD值。
Western blot测定抗体特异性 分别取根和块茎组织样品200 mg, 剪碎加入适量裂解液(使用前加PMSF), 匀浆器匀浆, 充分裂解。取上清10 μL, 以AoFPPS为阳性对照, 未诱导前菌液为阴性对照, 进行SDS-PAGE电泳后, 恒压100 V转膜。以纯化的多克隆抗体作为一抗, 用封闭液稀释一抗, 膜在一抗稀释液中37 ℃反应1 h, 洗膜4次, 每次5 min; 以HRP标记的羊抗兔lgG作为二抗, 用含5%脱脂奶粉的封闭液稀释二抗, 膜在二抗中37 ℃反应1 h。洗膜增强化学发光法(enhanced chemiluminescence, ECL)显影。
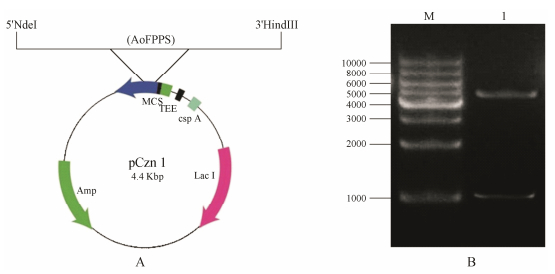
结果与分析 1 原核表达载体pCzn1-AoFPPS的构建及鉴定利用PCR引入酶切位点的方法, 将泽泻法呢基焦磷酸合酶cDNA插入到原核表达载体pCzn1的Nde I和Hind Ⅲ酶切位点之间, 获得了N端携带有6×His表达标签的重组表达载体pCzn1-AoFPPS (图 2A), 提取质粒, 进行酶切验证, 获得1条约1 000 bp的DNA片段和1条约5 000 bp的载体片段(图 2B), 与预期大小一致; 测序结果显示, 重组表达载体pCzn1-AoFPPS插入的序列与本课题组克隆的泽泻AoFPPS基因序列完全一致, 为预期的AoFPPS编码序列, 此结果表明, 本实验获得了正确的重组原核表达载体pCzn1-AoFPPS。
|
Figure 2 Construction of AoFPPS prokaryotic expression vector (A) and enzyme digestion reaction of recombinant plasmid pCzn1-AoFPPS (B). M: DNA Marker; 1: Double enzyme digestion products |
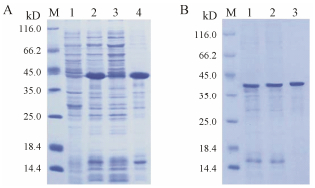
将经过0.5 mmol·L-1 IPTG诱导后的菌体超声破碎, 离心, 再分别取上清和沉淀进行SDS-PAGE蛋白电泳分析。AoFPPS蛋白的理论分子质量为40.60 kD, 加上N端的His标签, 该蛋白的理论分子质量为42.03 kD。在图 3A中的2、4泳道42 kD处出现一条特异性条带, 该特异性条带与预测的蛋白分子质量大小相一致, 表明已表达出融合蛋白AoFPPS, 目标蛋白存在于沉淀中。
|
Figure 3 SDS-PAGE analysis of the expression of AoFPPS (A) and purification (B). M: Protein Marker; A-1: Un-induced; A-2: Induced; A-3: Supernatant of 20 ℃ induction with 0.2 mmol·L-1 IPTG; A-4: Precipitate of 20 ℃ induction with 0.2 mmol·L-1 IPTG; B-1: Supernatant of 20 ℃ induction with 0.2 mmol·L-1 IPTG; B-2: Flow through; B-3: Elution |
将诱导表达的培养菌体溶液用20 mL Ni-IDA Binding-Buffer重悬后, 超声破碎, 利用低压色谱系统, 通过Ni-IDA-Sepharose CL-6B亲和色谱柱分离, 获得较纯的目的蛋白。10% SDS-PAGE检测获得单一目的条带(图 3B), 结果表明获得纯度较高的法呢基焦磷酸合酶重组蛋白。
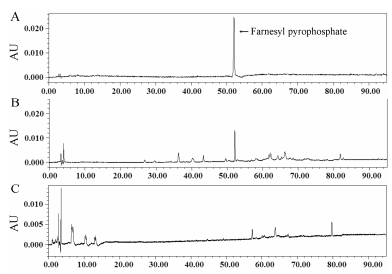
4 蛋白酶促反应产物分析取诱导表达的AoFPPS可溶性总蛋白, 加入到体外酶促反应体系(其中包含AoFPPS的催化底物GPP和IPP)中, 催化产物经正己烷萃取后, HPLC分析产物的成分。结果显示, 色谱图上在保留时间为52.26 min处, 样品组出现与FPP对照品相同的色谱峰, 而阴性对照组中未检测到该色谱峰(图 4)。该结果表明AoFPPS能够催化GPP和IPP合成FPP。FPP处在许多萜类合成的分支点上, 该酶促反应被认为是在萜类合成中的一个限速步骤。
|
Figure 4 HPLC analysis of AoFPPS enzymatic reaction in vitro. A: Standard FPP; B: The reaction products; C: The control group |
利用BCA蛋白浓度测定试剂盒对所得抗体进行浓度测定, 测得纯化抗体的浓度为1.0 mg·mL-1。通过SDS-PAGE电泳, 考马斯亮蓝染色观察纯化抗体的纯度, 可见抗体纯化后纯度在95%以上(图 5A)。以纯化后的融合蛋白为包被抗原, 抗血清以500~512 000倍数稀释, 间接ELISA法测定免疫后获得的多克隆抗血清的效价。测定结果显示(图 5B), 当血清稀释到512 000倍数时, 酶标仪测定A450值为1.339, 阴性对照为0.142, 两者比值为9.429 > 2.1。实验结果表明纯化制备的AoFPPS兔抗血清效价大于512 000。

|
Figure 5 SDS-PAGE of purified antibody (A) and ELISA result (B) |
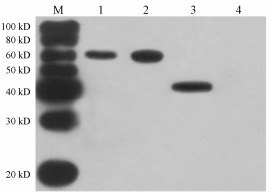
为检测多克隆抗体的特异性, 以制备的兔抗血清作为一抗, 进行Western blot分析。若克隆血清与AP标记的羊抗兔lgG杂交显色后在膜上出现清晰的条带, 说明所制备的抗血清anti-AoFPPS可以识别AoFPPS蛋白。结果显示, 泽泻根、块茎免疫印迹条带清晰, 检测到了约60 kD大小的蛋白条带, 且无非特异条带存在(图 6)。这表明制备的AoFPPS多克隆抗体的特异性好, 且AoFPPS蛋白在泽泻的根和块茎中均有表达。
|
Figure 6 Western blot analysis of AoFPPS from different tissues of A. orientale (Sam.) Juzep. M: Protein Marker; 1: Root; 2: Tuber; 3: Positive control; 4: Negative control |
原萜烷型四环三萜是泽泻属植物的资源性活性成分[16], 通过植物基因工程调控其生物合成途径上相关位点可有效改善药材品质[17]。关键酶基因的克隆、表达和调控是目前重要的研究方向之一[18-20], FPPS是MVA途径中一个关键的调控位点, 其产物FPP为MVA途径中萜类、甾体、皂苷等多种代谢产物的前体物质[21]。本研究在课题组前期克隆获得AoFPPS基因的基础上构建AoFPPS原核表达载体, 并对其功能进行验证研究, 对后期通过基因工程提升中药材品质具有重要意义。
大肠杆菌外源蛋白表达系统具有遗传背景清楚、表达水平高等特点, 通过构建原核表达载体, 将目的蛋白在大肠杆菌内高效表达获得大量、高纯度且具有生物活性的目的蛋白是目前科学研究活动中酶活性体外研究的重要方法, 已经成功应用于中药学、生命科学等领域[22, 23]。Li等[22]利用大肠杆菌成功构建桑树MMLO基因的原核表达载体, 揭示桑树应激反应过程中信号转导机制的分子基础; Guan等[23]利用大肠杆菌构建红花转录因子CtMYB1基因的原核表达载体, 为红花黄色素合成及代谢调控等方面的进一步研究奠定了基础。但是, 外源基因在原核细胞中表达时易形成包涵体[24], 其形成与温度、pH等有一定关系, 本研究将诱导表达条件优化至20 ℃下, 通过变复性的方式, 重溶获得目标蛋白。AoFPPS目的蛋白的获得为鉴定其功能提供了物质材料, 同时也为多克隆抗体的制备奠定了物质基础。
体外蛋白催化分析是研究基因功能的一个重要方法[25, 26], 本研究采用体外酶促反应检验所得蛋白的功能, 通过HPLC发现在pH 7.4、30 ℃时, AoFPPS能够催化GPP和IPP合成FPP。研究结果验证了泽泻法呢基焦磷酸合酶在MVA生物合成途径中的功能, 为后期通过合理提高AoFPPS基因表达以提高泽泻中原萜烷型四环三萜含量, 从而改善泽泻质量提供科学依据。
免疫学技术具有特异性高、快速简便、不依赖酶活性且易于标记等特点, 是从蛋白质水平探讨AoFPPS表达与泽泻原萜烷型三萜类化合物关系的有效手段。本研究利用纯化的AoFPPS蛋白免疫新西兰兔制备多克隆抗体, ELISA及Western blot结果显示其抗体具有较高的效价及良好的特异性, Western blot结果发现条带出现在60 kD处, 与大肠杆菌中表达的分子质量存在差异, 可能是由于该蛋白在植物体内存在修饰。AoFPPS蛋白在泽泻根和块茎中均有表达, 且块茎中表达量高于根, 可能与泽泻原萜烷型三萜生物合成部位有关, 推测泽泻不同部位均会合成原萜烷型三萜, 但不同部位生物合成的量可能存在一定差异, 这与课题组前期发现块茎中23-乙酰泽泻醇B含量高于根相一致[1], 从分子层面合理解释了泽泻以块茎为传统入药部位的原因。
总之, 本研究通过构建泽泻法呢基焦磷酸合酶基因的原核表达载体, 诱导并纯化目的蛋白后免疫新西兰白兔, 获得了效价较高的多克隆抗体; 通过Western blot检测抗体特异性, 建立了AoFPPS的快速免疫检测方法, 并通过体外酶促反应验证AoFPPS的功能, 为揭示AoFPPS在泽泻体内的作用机制及其基因的调控与表达奠定基础, 为利用植物基因工程提高泽泻资源性活性成分含量、改善中药材品质提供科学依据。
| [1] | Gu W, Wu QN, Chao JG, et al. Molecular cloning of farnesyl pyrophosphate synthase from Alisma orientale (Sam.) Juzep. and its distribution pattern and bioinformatics analysis[J]. Acta Pharm Sin (药学学报), 2011, 46: 605–612. |
| [2] | Wu J, Yang W, Pan H, et al. Geographic impact evaluation of the quality of Alismatis Rhizoma by untargeted metabolomics and quantitative assay[J]. J Sep Sci, 2017, 41: 839–846. |
| [3] | Zhang LL, Xu W, Xu YL, et al. Therapeutic potential of Rhizoma Alismatis: a review on ethnomedicinal application, phytochemistry, pharmacology, and toxicology[J]. Ann N Y Acad Sci, 2017, 1401: 90–101. DOI:10.1111/nyas.2017.1401.issue-1 |
| [4] | Wang YL, Zhao JC, Liang JH, et al. A bioactive new protostane-type triterpenoid from Alisma plantago-aquatica subsp. orientale (Sam.) Sam[J]. Nat Prod Res, 2017(95): 1–6. |
| [5] | Meng Q, Chen X, Wang C, et al. Protective effects of alisol B 23-acetate from edible botanical Rhizoma alismatis against carbon tetrachloride-induced hepatotoxicity in mice[J]. Food Funct, 2015, 6: 1241–1250. DOI:10.1039/C5FO00082C |
| [6] | Zhao XY, Wang G, Wang Y, et al. Chemical constituents from Alisma plantago-aquatica subsp. orientale (Sam.) Sam and their anti-inflammatory and antioxidant activities[J]. Nat Prod Res, 2017. DOI:10.1080/14786419.2017.1380024 |
| [7] | Zhao Y, Li E, Wang M. Alisol B 23-acetate induces autophagicdependent apoptosis in human colon cancer cells via ROS generation and JNK activation[J]. Oncotarget, 2017, 8: 70239–70249. |
| [8] | Zhao M, Goedecke T, Gunn J, et al. Protostane and fusidane triterpenes: a mini-review[J]. Molecules, 2013, 18: 4054–4080. DOI:10.3390/molecules18044054 |
| [9] | Yodsaoue O, Sonprasit J, Karalai C, et al. Diterpenoids and triterpenoids with potential anti-inflammatory activity from the leaves of Aglaia odorata[J]. Phytochemistry, 2012, 76: 83–91. DOI:10.1016/j.phytochem.2012.01.015 |
| [10] | Gu W, Geng C, Xue W, et al. Characterization and function of the 3-hydroxy-3-methylglutaryl-CoA reductase gene in Alisma orientale (Sam.) Juz. and its relationship with protostane triterpene production[J]. Plant Physiol Biochem, 2015, 97: 378–389. DOI:10.1016/j.plaphy.2015.10.031 |
| [11] | Peng B, Nielsen LK, Kampranis SC, et al. Engineered protein degradation of farnesyl pyrophosphate synthase is an effective regulatory mechanism to increase monoterpene production in Saccharomyces cerevisiae[J]. Metab Eng, 2018, 47: 83–93. DOI:10.1016/j.ymben.2018.02.005 |
| [12] | Li R, Chen XY, Zhang Y, et al. Cloning and expression analysis of farnesyl diphosphate synthase gene in Fritillaria cirrhosa[J]. Guihaia (广西植物), 2018. http://kns.cnki.net/kcms/detail/45.1134.Q.20180313.1133.014.html. |
| [13] | Du C, Li J, Peng QZ, et al. Gene cloning and sequence analysis of farnesyl pyrophosphate synthase genes from Eucommia ulmoides[J]. Life Sci Res (生命科学研究), 2015, 19: 100–105. |
| [14] | Xiang L, Guo X, Niu YY, et al. Full-length cDNA cloning and bioinformatics analysis of PnUGT1 gene in Panax notoginseng[J]. Acta Pharm Sin (药学学报), 2012, 47: 1085–1091. |
| [15] | Yang Y, Ge F, Sun Y, et al. Strengthening triterpene saponins biosynthesis by over-expression of farnesyl pyrophosphate synthase gene and RNA interference of cycloartenol synthase gene in Panax notoginseng Cells[J]. Molecules, 2017, 22: e581. DOI:10.3390/molecules22040581 |
| [16] | Mai ZP, Zhou K, Ge GB, et al. Protostane triterpenoids from the Rhizome of Alisma orientale exhibit inhibitory effects on human carboxylesterase 2[J]. J Nat Prod, 2015, 78: 2372–2380. DOI:10.1021/acs.jnatprod.5b00321 |
| [17] | Kim YK, Kim YB, Uddin MR, et al. Enhanced triterpene accumulation in Panax ginseng hairy roots overexpressing mevalonate-5-pyrophosphate decarboxylase and farnesyl pyrophosphate synthase[J]. ACS Synth Biol, 2014, 3: 773–779. DOI:10.1021/sb400194g |
| [18] | Cao F, Xia J, Chen YP, et al. Molecular cloning and functional characterization of the gene encoding hydroxy-2- methyl-2-(E)-butenyl 4-diphosphate reductase gene from Artemisia annua L[J]. Acta Pharm Sin (药学学报), 2016, 51: 1791–1798. |
| [19] | Feng YY, Zhang ZX, Dong XJ, et al. Expression analysis of allene oxide synthase gene from Aquilaria sinensis[J]. Acta Pharm Sin (药学学报), 2017, 52: 1962–1969. |
| [20] | Zhao GH, Zhang NN, Gao SS, et al. Cloning, expression characteristics and prokaryotic expression analysis of CYP83A1 gene from Isatis indigotica Fort[J]. Genom Appl Biol (基因组学与应用生物学), 2018, 37: 302–312. |
| [21] | Jiang L, Gu W, Chao JG, et al. Gene cloning of farnesyl pyrophosphate synthase in Atractylodes lancea and its expression pattern analysis[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 760–766. |
| [22] | Li R, Li R, Chen D, et al. Mildew resistance locus O gene cloning, characterization, and expression pattern in mulberry (Morus multicaulis) and its prokaryotic expression in E. coli[J]. Russ J Bioorg Chem, 2018, 44: 104–111. DOI:10.1134/S1068162018010119 |
| [23] | Guan LL, Zhang X, Han YL, et al. Cloning and prokaryotic expression of transcription factor CtMYB1 gene in Carthamus tinctorius[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 2603–2609. |
| [24] | Qin M, Wang W, Thirumalai D. Protein folding guides disulfide bond formation[J]. Proc Natl Acad Sci U S A, 2015, 112: 11241–11246. DOI:10.1073/pnas.1503909112 |
| [25] | Xiong S. Molecular Cloning and Functional Analysis of AaF3H and AaFLS Genes in Flavonoids Biosynthetic Pathway from Artemisia annua L. (黄花蒿中黄酮类化合物生物合成AaF3H和AaFLS基因克隆与功能鉴定)[D]. Changsha: Hunan Agricultural University, 2015. |
| [26] | Su SS, Zhang HM, Liu XY, et al. Cloning and characterization of a farnesyl pyrophosphate synthase from Matricaria recutita L. and its upregulation by methyl jasmonate[J]. Gen Mol Res, 2015, 14: 349–361. DOI:10.4238/2015.January.23.8 |
 2018, Vol. 53
2018, Vol. 53


