人参(Panax ginseng C. A. Meyer)是一种传统的名贵中药材, 其主要活性成分是人参皂苷[1]。药理学研究表明, 人参皂苷具有广泛的药理活性, 如抗肿瘤、抗炎、降低血糖、抗氧化及延缓衰老等[2-6]。人参皂苷可分为两种类型:一类是达玛烷型四环三萜类皂苷; 一类是齐墩果烷型五环三萜类皂苷。达玛烷型皂苷在人参皂苷中占大多数, 是其中的主要活性成分。达玛烷型皂苷又包括二醇皂苷和三醇皂苷。大多数人参皂苷是在糖基转移酶的作用下, 由四环三萜类皂苷苷元原人参二醇(protopanaxadiol, PPD)和原人参三醇(protopanaxatriol, PPT) (图 1)糖基化而生成的。在糖基转移酶的作用下, PPD的C-3和/或C-20位羟基引入一个或几个糖基生成人参二醇皂苷; PPT的C-6和/或C-20位羟基引入一个或几个糖基生成人参三醇皂苷。糖基化修饰是人参皂苷生物合成的最后一步, 在人参皂苷的生物合成过程中起着至关重要的作用。糖基的数目、位置以及供体种类的不同造成了人参皂苷结构的多样性, 从而使人参皂苷具有多种生物活性[7-9]。

|
Figure 1 The chemical structures of ginsenoside aglycones |
近年来, 人参皂苷生物合成相关糖基转移酶的研究取得了较大进展。人参糖基转移酶UGTPg1能够催化PPD和PPT的C-20位羟基糖基化, 分别生成人参皂苷Compound K和F1[10, 11]。糖基转移酶UGTPg45能够催化PPD的C-3位羟基发生糖基化, 生成人参皂苷Rh2;而在UGTPg29的催化作用下, Rh2的C-3位糖基的2'位羟基发生糖基化, 从而生成人参皂苷Rg3[12]。UGTPg100能够催化PPT和人参皂苷F1的C-6位羟基发生糖基化, 分别生成人参皂苷Rh1和Rg1; UGTPg101能够催化PPT的C-20位羟基发生糖基化, 生成人参皂苷F1, 在此基础上, 能够继续催化人参皂苷F1的C-6位羟基发生糖基化, 生成人参皂苷Rg1[11]。Jung等[13]对糖基转移酶PgUGT74AE2进行了研究, 发现PgUGT74AE2可以催化PPD和Compound K的C-3位羟基发生糖基化, 分别生成人参皂苷Rh2和F2, 但不能催化PPT的C-3位羟基发生糖基化。
本研究构建PgUGT74AE2重组表达质粒, 将其转入大肠杆菌获得重组菌株, 经过诱导表达, 获得重组PgUGT74AE2;以PPT为底物, 建立体外酶促反应体系, 确证了重组PgUGT74AE2能够催化PPT的C-3位羟基发生糖基化, 生成一种新型三醇皂苷。
材料与方法菌株与质粒 大肠杆菌(Escherichia coli) Trans1-T1和Transetta (DE3)感受态细胞购自Transgene公司; 质粒pET-32a购自Novagen公司; 质粒pUC57-PgUGT74AE2由本实验室保存, 其中PgUGT74AE2基因序列与文献[13]一致。
试剂与仪器 T4 DNA连接酶和限制性内切酶购自New England Biolabs公司; DNA Marker和琼脂糖凝胶DNA回收试剂盒购自Transgene公司; 质粒提取试剂盒购自天根生化科技有限公司; 异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)和氨苄青霉素购自INALCO公司; PPT购自南京春秋生物工程有限公司; UDP-glucose (UDPG)购自Sigma公司; 其他试剂均为国产分析纯。
3K18型低温高速离心机(Sigma公司); HZQ-Q型振荡器(哈尔滨东联电子技术开发有限公司); PCR仪(德国Eppendorf公司); 高效液相色谱仪(Agilent 1200, 安捷伦公司); DNA电泳仪(Bio-Rad公司); 凝胶成像仪(UVP公司); 恒温培养箱(上海新苗医疗器械制造有限公司); 旋转蒸发仪(Re-2000, 上海亚荣生化仪器厂); 超声破碎仪(Sonic VCX130, 美国Sonics公司); 高压细胞破碎仪(APV-2000型, 德国SPX公司); HPLC-LTQ/FTICRMS (Thermo公司); INOVA-500核磁共振波谱仪(Varian公司)。
PgUGT74AE2原核表达载体的构建及异源表达 质粒pUC57-PgUGT74AE2含有目的基因PgUGT74AE2, 且两端分别含有BamH I和Sal I酶切位点, 利用BamH I和Sal I对质粒pUC57-PgUGT74AE2和载体pET-32a进行双酶切, 电泳检测, 并用凝胶回收试剂盒对目的基因PgUGT74AE2和载体pET-32a进行回收。利用T4 DNA连接酶将PgUGT74AE2连接到质粒pET-32a上, 转化大肠杆菌Trans1-T1感受态细胞。随机挑取转化子, 以引物T7-F和T7-R进行菌落PCR筛选, 测序确证, 将重组质粒命名为pET-32a-PgUGT74AE2。将pET-32a-PgUGT74AE2和pET-32a分别转化大肠杆菌Transetta (DE3)感受态细胞, 获得重组菌株Transetta-PgUGT74AE2和对照菌株Transetta-32a。菌株在含100 μg·mL-1氨苄青霉素的LB平板上进行培养, 37 ℃过夜。从抗性平板上挑取单菌落, 接种于10 mL LB培养基(含氨苄青霉素100 μg·mL-1), 在37 ℃、220 r·min-1的摇床中培养过夜, 然后按照1%接种量转接于150 mL LB培养基(含氨苄青霉素100 μg·mL-1)培养, 在37 ℃、220 r·min-1条件下培养至OD600为0.6~1.0, 加入IPTG至终浓度为1 mmol·L-1, 在16 ℃、180 r·min-1的条件下, 诱导表达18 h。菌液以8 000 r·min-1离心2 min, 收集菌体。用适量缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0)将菌体重悬浮, 利用超声破碎仪(超声5 s, 间隔5 s, 共40 min)将菌体进行破碎。超声后的菌液在10 000 r·min-1、4 ℃条件下离心40 min, 收集上清液, 取20 μL进行SDS-PAGE电泳检测。
重组PgUGT74AE2的纯化 利用Ni-NTA亲和色谱对重组PgUGT74AE2进行纯化。先用10倍体积含20 mmol·L-1咪唑的缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0)对镍柱进行平衡。将含重组蛋白的上清液用0.22 μm的滤膜过滤, 缓慢加入到镍柱中, 流速控制在0.5~1.0 mL·min-1。依次用含20、30、40、50及200 mmol·L-1咪唑的缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0)进行洗脱, 并对不同浓度咪唑洗脱下来的样品进行SDS-PAGE电泳检测。将重组蛋白用30 kDa超滤管进行浓缩。采用Bradford法(美国Bio-Rad公司)测定蛋白浓度。
重组PgUGT74AE2的活性检测 以UDPG为糖基供体, PPT作为糖基受体, 加入纯化的重组PgUGT74AE2, 建立酶促反应体系。100 μL反应体系如下: 0.05 mg·mL-1 PgUGT74AE2, 10 μL; 50 mmol·L-1底物PPT, 2 μL; 50 mmol·L-1 UDPG, 10 μL; 缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0), 补加至体系为100 μL。将反应体系混匀, 在37 ℃条件下, 静置反应12 h, 加入200 μL甲醇终止反应。12 000 r·min-1离心10 min, 上清液经0.22 μm滤膜过滤。利用C18反相柱(4.6 mm × 150 mm, 5 μm, 日本CAPCELL PAK公司)检测反应产物。紫外检测波长为203 nm, 以水(A)和乙腈(B)为流动相。HPLC检测条件如下: 0 min, 10% B; 20 min, 55% B; 30 min, 70% B; 31 min, 100% B; 40 min, 100% B; 41 min, 10% B; 50 min, 10% B。
PgUGT74AE2催化产物的制备及结构鉴定 将通过发酵培养收集的Transetta-PgUGT74AE2菌体用适量缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0)重悬浮, 利用高压破碎仪将菌体进行破碎。破碎后的菌液在10 000 r·min-1、4 ℃条件下离心40 min, 收集上清液作为PgUGT74AE2粗酶液。酶促反应体系如下: PgUGT74AE2粗酶液, 22 mL; 50 mmol·L-1底物PPT, 0.5 mL; 50 mmol·L-1 UDPG, 2.5 mL; 缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0), 25 mL。将催化体系混匀后, 在37 ℃、180 r·min-1条件下, 震荡反应24 h, 加入100 mL甲醇终止反应。10 000 r·min-1离心30 min, 取出上清液, 将离心沉淀用适量甲醇洗涤3次, 然后将上清液与甲醇洗涤液合并, 利用旋转蒸发仪蒸干, 用适量甲醇将化合物溶解后, 经0.22 μm滤膜过滤。利用C18反相柱(10 mm × 250 mm, 5 μm, 日本CAPCELL PAK公司)对产物进行制备。紫外检测波长为203 nm, 流动相为42%乙腈。将制备的产物进行ESI-MS、1H NMR、13C NMR和HMBC测定, 确定其结构。
2 结果与分析 1 重组表达质粒的构建及重组蛋白的表达与纯化将质粒pUC57-PgUGT74AE2利用BamH I和Sal I进行双酶切, 并用凝胶回收试剂盒回收长度为1 356 bp的PgUGT74AE2基因片段。利用T4 DNA连接酶将PgUGT74AE2基因连接到用BamH I和Sal I双酶切过的载体pET-32a上, 转化大肠杆菌Trans1-T1感受态细胞。通过菌落PCR筛选阳性转化子并测序, 确证PgUGT74AE2基因正确插入。重组质粒命名为pET-32a-PgUGT74AE2。
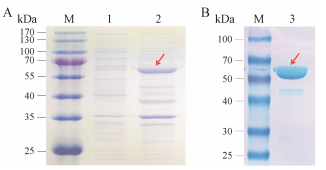
将重组表达质粒pET-32a-PgUGT74AE2转入大肠杆菌Transetta (DE3)获得重组菌株Transetta-PgUGT74AE2。通过1 mmol·L-1 IPTG诱导重组蛋白表达。SDS-PAGE电泳检测, 发现重组菌超声破碎后的上清液在55~70 kDa之间出现一条预期大小的蛋白条带, 而转入空载体pET-32a的对照菌株Transetta-32a在相应位置没有出现蛋白条带, 表明经IPTG诱导后PgUGT74AE2获得了可溶性表达(图 2A)。
|
Figure 2 SDS-PAGE analysis of the expression (A) and purification (B) of the recombinant PgUGT74AE2. M: Marker; 1: Soluble protein fraction of Transetta-32a; 2: Soluble protein fraction of Transetta-PgUGT74AE2; 3: The recombinant PgUGT74AE2 purified by Ni-NTA affinity chromatography |
通过Ni-NTA亲和色谱对重组蛋白进行纯化时, 依次用含20、30、40、50及200 mmol·L-1咪唑的缓冲液(25 mmol·L-1 Tris-HCl, pH 8.0)洗脱, 结果显示, 大部分PgUGT74AE2被40 mmol·L-1咪唑洗脱下来。因此, 最终采用20 mmol·L-1咪唑洗脱除去杂蛋白、40 mmol·L-1咪唑洗脱目的蛋白的方法对重组PgUGT74AE2进行纯化(图 2B)。
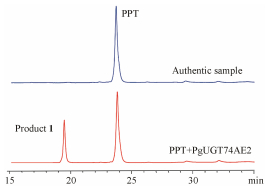
2 重组PgUGT74AE2催化活性的检测以PPT为底物, UDPG为糖基供体, 利用重组PgUGT74AE2进行催化反应, HPLC检测反应产物。在不含重组PgUGT74AE2的对照反应体系中, 仅检测到保留时间为23.72 min的PPT底物峰, 而在含重组PgUGT74AE2的反应体系中, 在19.48 min有明显的产物峰出现, 即化合物1, 其紫外吸收与底物PPT一致(图 3)。PPT转化率约为28%。
|
Figure 3 HPLC analysis of the glycosylated product of PPT catalyzed by PgUGT74AE2 |
通过HPLC对PgUGT74AE2催化PPT得到的化合物1进行制备, 并利用ESI-MS、1H NMR、13C NMR和HMBC进行检测。
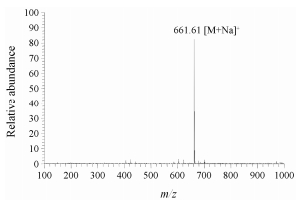
ESI-MS检测结果显示, 化合物1的分子离子峰为661 [M+Na]+, 可以确定化合物1的相对分子质量为638, 比底物PPT的分子量476增加了162, 推测化合物1是在重组PgUGT74AE2催化作用下, 由PPT与一分子葡萄糖发生糖基化反应生成的产物(图 4)。
|
Figure 4 ESI-MS analysis of the glycosylated product of PPT catalyzed by the recombinant PgUGT74AE2 |
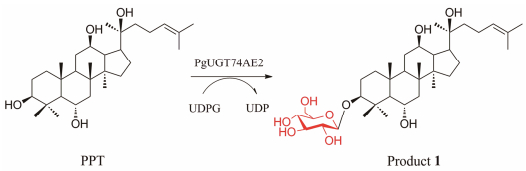
化合物1的1H NMR和13C NMR数据与底物PPT非常相似, 差异在于多出一组葡萄糖基信号。1H NMR (500 MHz, methanol-d4) δ: 4.28 (1H, d, J = 8.0 Hz, H-1'), 3.30 (1H, m, H-2'), 3.35 (1H, m, H-3'), 3.24 (1H, m, H-4'), 3.17 (1H, m, H-5'), 4.00 (1H, td, J = 10.5, 3.5 Hz, H-6'), 3.52 (1H, m, H-6'); 13C NMR (100 MHz, methanol-d4) δ: 107.0 (C-1'), 75.7 (C-2'), 78.3 (C-3'), 72.0 (C-4'), 77.7 (C-5'), 62.8 (C-6')。同时, 在13C NMR (100 MHz, methanol-d4)谱中, C-3的化学位移向低场位移12.3 ppm, 说明化合物1的C-3位羟基发生了糖基化。通过对HMBC谱的分析: δH 3.10 (1H, dd, J = 12.0, 4.5 Hz, H-3)与δC 107.0 (C-1')相关, δH 4.28 (1H, d, J = 8.0 Hz, H-1')与δC 90.7 (C-3)相关, 进一步证明了推测的正确性。葡萄糖基的端基质子具有较大的偶合常数J = 8.0 Hz, 说明该分子葡萄糖基的构型为β型。通过以上综合分析并与文献报道数据比对[14], 确定化合物1的结构为3-O-β-D-glucopyranosyl-dammar-24-ene-3β, 6α, 12β, 20S-tetraol (图 5)。1H NMR (500 MHz, methanol-d4)和13C NMR (100 MHz, methanol-d4)具体数据见表 1。
|
Figure 5 Glycosylation pattern of PgUGT74AE2 towards PPT |
| Table 1 1H NMR (500 MHz) and 13C NMR (100 MHz) spectral data for product 1 in methanol-d4 |
糖基化是一种在植物中广泛存在的由糖基转移酶催化的修饰反应, 通常是天然产物合成的最后一步[15]。人参中存在多种糖基转移酶, 人参皂苷苷元的糖基化作为人参皂苷合成的最后一步, 就是由这些糖基转移酶催化完成。糖基化修饰不仅使人参皂苷的种类更加丰富, 而且糖基的种类、数目以及连接的位置等都会对人参皂苷的生物活性产生影响。例如, 在结构方面, 人参皂苷Rh2在C-3位羟基上连有一个葡萄糖基, Rb1在C-3和C-20位羟基上均连有由两个葡萄糖基组成的二糖链; 在药理活性方面, Rh2主要表现为抗肿瘤活性, 而Rb1主要对神经细胞的增长起到促进作用[16]。Rb1和Rg1都能作用于中枢神经系统, 但是由于糖基化修饰的不同, 两者在药理活性以及作用机制上也略有不同。Rb1通过激活cAMP依赖的蛋白激酶通路刺激神经递质释放[17], Rg1则通过蛋白激酶-Ⅱ依赖的信号通路来刺激神经递质释放[18], 而且Rb1的作用比Rg1弱, 甚至在一些情况下会对中枢神经系统起到抑制作用[19]。因此, 许多人参皂苷仅仅是糖基化修饰的微小差异, 就产生了不同的药理作用。
在达玛烷型皂苷中, 二醇皂苷主要在C-3和/或C-20位羟基发生糖基化, 而三醇皂苷主要在C-6和/或C-20位羟基发生糖基化。通过大肠杆菌表达的重组PgUGT74AE2能够催化PPT的C-3位羟基发生糖基化反应, 获得一种新型三醇皂苷3-O-β-D-glucopyranosyl-dammar-24-ene-3β, 6α, 12β, 20S-tetraol。Jung等[13]研究发现PgUGT74AE2可以催化PPD和Compound K的C-3位羟基发生糖基化, 但不能催化PPT的C-3位羟基发生糖基化。上述研究结果不一致可能是反应体系的不同造成的。本研究通过重组PgUGT74AE2催化的酶促反应获得新型人参三醇皂苷, 下一步将对该皂苷进行药理活性研究, 为新药研究奠定基础。
| [1] | Choi J, Kim TH, Choi TY, et al. Ginseng for health care: a systematic review of randomized controlled trials in Korean literature[J]. PLoS One, 2013, 8: e59978. DOI:10.1371/journal.pone.0059978 |
| [2] | Shibata S. Chemistry and tumor preventing activities of ginseng saponins and some related triterpenoid compounds[J]. J Korean Med Sci, 2001, 16: S28–S37. DOI:10.3346/jkms.2001.16.S.S28 |
| [3] | Yun TK. Panax ginseng—a non-organ-specific cancer preventive?[J]. Lancet Oncol, 2001, 2: 49–55. DOI:10.1016/S1470-2045(00)00196-0 |
| [4] | Ahn S, Siddiqi MH, Noh HY, et al. Anti-inflammatory activity of ginsenosides in LPS-stimulated RAW 264.7 cells[J]. Sci Bull, 2015, 60: 773–784. DOI:10.1007/s11434-015-0773-4 |
| [5] | Mathiyalagan R, Subramaniyam S, Kim YJ, et al. Ginsenoside compound K-bearing glycol chitosan conjugates: synthesis, physicochemical characterization, and in vitro biological studies[J]. Carbohydr Polym, 2014, 112: 359–366. DOI:10.1016/j.carbpol.2014.05.098 |
| [6] | Ni HX, Yu NJ, Yang XH. The study of ginsenoside on PPAR-gamma expression of mononuclear macrophage in type 2 diabetes[J]. Mol Biol Rep, 2010, 37: 2975–2979. DOI:10.1007/s11033-009-9864-0 |
| [7] | Park MT, Cha HJ, Jeong JW, et al. Anti-invasive activity of ginsenoside Rh1 and Rh2 in the HT1080 cells[J]. J Ginseng Res, 1998, 22: 216–221. |
| [8] | Lee Y, Jin Y, Lim W, et al. A ginsenoside-Rh1, a component of ginseng saponin, activates estrogen receptor in human breast carcinoma MCF-7 cells[J]. J Steroid Biochem Mol Biol, 2003, 84: 463–468. DOI:10.1016/S0960-0760(03)00067-0 |
| [9] | Jung JS, Shin JA, Park EM, et al. Anti-inflammatory mechanism of ginsenoside Rh1 in lipopolysaccharide-stimulated microglia: critical role of the protein kinase A pathway and hemeoxygenase-1 expression[J]. J Neurochem, 2010, 115: 1668–1680. DOI:10.1111/jnc.2010.115.issue-6 |
| [10] | Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside Compound K in metabolically engineered yeast[J]. Cell Res, 2014, 24: 770–773. DOI:10.1038/cr.2014.28 |
| [11] | Wei W, Wang P, Wei Y, et al. Characterizations of Panax ginseng UDP-glycosyltransferases catalyzing protopanaxatriol and biosyntheses of bioactive ginsenosides F1 and Rh1 in metabolically engineered yeasts[J]. Mol Plant, 2015, 8: 1412–1424. DOI:10.1016/j.molp.2015.05.010 |
| [12] | Wang P, Wei Y, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts[J]. Metab Eng, 2015, 29: 97–105. DOI:10.1016/j.ymben.2015.03.003 |
| [13] | Jung SC, Kim W, Park SC, et al. Two ginseng UDP-glycosyltransferases synthesize ginsenoside Rg3 and Rd[J]. Plant Cell Physiol, 2014, 55: 2177–2188. DOI:10.1093/pcp/pcu147 |
| [14] | Li KK, Yang XB, Yang XW, et al. New triterpenoids from the stems and leaves of Panax ginseng[J]. Fitoterapia, 2012, 83: 1030–1035. DOI:10.1016/j.fitote.2012.05.013 |
| [15] | Harborne JB. The Flavonoids: Advances in Research Since 1986 (Harborne, J. B.)[J]. Boca Raton: CRC Press, 1988, 72: A73. |
| [16] | Song XZ, Gao WB, Zheng YN, et al. New advances in the study of biotransformation of ginsenosides[J]. Ginseng Res (人参研究), 2012, 24: 34–39. |
| [17] | Xue JF, Liu ZJ, Hu JF, et al. Ginsenoside Rb1 promotes neurotransmitter release by modulating phosphorylation of synapsins through a cAMP-dependent protein kinase pathway[J]. Brain Res, 2006, 1106: 91–98. DOI:10.1016/j.brainres.2006.05.106 |
| [18] | Liu ZJ, Ming Z, Yun Z, et al. Ginsenoside Rg1 promotes glutamate release via a calcium/calmodulin-dependent protein kinase Ⅱ-dependent signaling pathway[J]. Brain Res, 2010, 1333: 1–8. DOI:10.1016/j.brainres.2010.03.096 |
| [19] | Chen C, Chiou W, Zhang J. Comparison of the pharmacological effects of Panax ginseng and Panax quinquefolium[J]. Acta Pharmacol Sin, 2008, 29: 1103–1108. DOI:10.1111/aphs.2008.29.issue-9 |
 2018, Vol. 53
2018, Vol. 53


