2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 潍坊医学院药学院, 山东 潍坊 261021;
4. 安徽医科大学, 安徽 合肥 230032
2. Department of Pharmaceutical Sciences, Beijing Institute of Radiation Medicine, Beijing 100850, China;
3. Department of Pharmacy, Weifang Medical University, Weifang 261021, China;
4. Anhui Medical University, Hefei 230032, China
哮喘是一种常见支气管慢性炎症性疾病。据统计, 世界约3亿人罹患哮喘, 发病率与死亡率还在不断上升[1, 2]。哮喘的一线治疗药物是吸入性糖皮质激素类药物, 但长期用药可能产生言语障碍、骨质疏松症等不良反应[3]。同时, 约半数哮喘患者的激素疗法不佳甚至无效[4]。因此, 研究新型哮喘治疗方法, 对这一重大疾病的治疗有重要意义。
传统中医中没有“哮喘”病症, 但古人在长期临床实践中, 制备出白芥子涂方可“冷哮灸肺俞、膏肓、天突, 应有不应。夏月三伏中, 白芥子涂法, 往获效”。而内病外治, 也体现出中医在辨证论治和治疗方法的先进性。但由于传统中药制剂中辅料和制剂技术较落后, 传统白芥子涂方采用白芥子、延胡索、甘遂和细辛生药, 以新鲜生姜汁调成糊状或膏状使用, 制备工艺复杂, 患者主观感受差, 不易接受。同时, 传统制剂中辅料的不可控和不规范, 导致透皮效果不佳、波动性大, 也影响药效发挥。
巴布剂(cataplasm)起源于20世纪80年代, 最早源于日本“Pappu”, 意为泥蓭。现代巴布剂是药材提取物、药材或化学药物与亲水性基质混合涂布于背衬材料上制成的贴膏剂[5]。巴布剂和其他外用制剂的区别是载药量大、保湿性强和透皮吸收性能优越, 具有黏度高、无刺激性、易贴敷在皮肤表面和揭贴舒适等优点[6]。已上市的巴布剂有吲哚美辛巴布剂、蟾乌巴布膏等。
皮肤是人体天然屏障, 最外层角质层能阻碍外来异物进入人体内, 但同时也对药物透皮吸收提出了挑战, 药物能否克服皮肤屏障提高透皮吸收能力成为药剂学研究的热点[7, 8]。近年来, 以离子导入、超声导入、微针和激光等为代表的物理技术促进药物透皮吸收成为研究热点, 但横向比较研究较少。离子导入法(iontophoresis)是将低电压正负电极施加在皮肤表面, 在低电流强度(< 0.5 mA·cm-2)作用下, 增强药物尤其是离子型药物的透皮速率和效率[9]。其促渗透机制是电场在皮肤角质层两侧形成电压差产生驱动力, 膜两侧液体发生定向移动, 推动带电或中性粒子透过皮肤, 同时角质层在电流作用下发生短暂、可逆的结构紊乱, 由此产生孔道促进药物的转运。超声导入法(sonophoresis)是将超声作用于皮肤表面, 通过空化效应、热效应、对流转运及机械效应促进药物穿透皮肤。超声波使皮肤细胞间、细胞内大量气泡产生振动或破裂, 释放能量, 导致周围组织产生空隙或空囊, 促进药物渗透[10]。
本文以传统白芥子涂法为基础, 制备了白芥子涂方巴布剂, 并以芥子碱硫氰酸盐为检测指标, 考察离子导入和超声导入对其透皮吸收的影响。建立豚鼠哮喘模型, 以白介素4 (interleukin 4, IL-4)、免疫球蛋白(immunoglobulin E, IgE)和干扰素γ (interferon γ, IFN-γ)为评价指标, 比较离子导入、超声导入对该中药巴布剂治疗哮喘效果的影响[5, 9]。该研究旨在为现代物理促透技术促进传统外用中药复方透皮吸收提供依据。
材料与方法药品与试剂 白芥子、延胡索、甘遂和细辛均购自安徽省亳州市中药材市场并经鉴定; 甘油(西陇化工股份有限公司, 批号: 124152);聚乙二醇400 (PEG-400, 南京威尔化工有限公司, 批号: 20120524);甘羟铝(陕西太白山制药有限责任公司, 批号: 20130302);柠檬酸(批号: T20100913), 冰醋酸(分析纯), 无水乙醇(批号: 20131114) (国药集团化学试剂有限公司); 羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na, 中国医药上海化学试剂有限公司, 批号: F20030626);聚丙烯酸钠(国际特品, 批号: 231770A); 生姜油由本所天然药物化学课题组提供; 氮酮(北京化学试剂公司, 批号: 010619);芥子碱硫氰酸盐(化学纯, 纯度 > 98%, 成都普瑞法科技开发有限公司); 乙腈(色谱纯, 赛默飞世尔科技有限公司); 氯化钠注射液(石家庄四药有限公司); 无纺布(浙江弘扬无纺新材料有限公司); 塑料隔离膜(佛山兰迪胶粘材料厂); 自制蒸馏水。
主要仪器 小型实验用涂布机(上海锴凯科技贸易有限公司, 型号: TB-0612B); 电动测试仪(上海锴凯科技贸易有限公司, 型号: DG-2000A); 电热鼓风干燥箱(上海一恒科学仪器有限公司, 型号: DZF-150);冷冻干燥机(北京博医康实验仪器有限公司, 型号: FD-1-55);智能双频超声治疗仪(UT1021, 深圳市东迪欣科技有限公司); 小型离子导入装置(HHK-806II型, 北京博尔通科技发展有限公司); 智能透皮吸收仪(YB-P6, 天津市鑫洲科技有限公司); 高效液相色谱仪(Agilent1260, 美国安捷伦科技公司); 倒置荧光显微镜(BDS200-FL, 重庆奥普医疗器械有限公司); 空气压缩式雾化器(江苏省鱼跃医疗器械股份有限公司, 403M型)。
实验动物 Sprague Dawley (SD)大鼠, 雌雄各半, 体重(120 ± 20) g, 军事医学科学院实验动物中心, 动物合格证号: SCXK-(军) 2012-0004。雄性豚鼠购自北京维通利华实验动物技术有限公司, 体重230~270 g, 动物合格证号: SCXK (京) 2015-0005。动物饲养于Specific Pathogen Free (SPF)级屏障动物房, 室温20~25 ℃, 相对湿度55%~70%, 通风良好、环境安静, 自由摄食饮水, 室内保持自然节律光照, 并定期消毒。
中药有效成分的提取 将处方量白芥子、延胡索和甘遂(2:2:1, w/w/w)粉碎成粗粉, 装入圆底烧瓶内置于电热套内, 加入8倍量60%乙醇-水溶液, 连接回流装置, 保持微沸1 h后, 倒出提取液, 再向圆底烧瓶中加入8倍量60%乙醇水溶液, 加热回流1 h, 合并两次提取液。将提取液转入茄型瓶中, 70 ℃减压浓缩, 将浓缩液分装在烧杯中, 于-20 ℃冷冻。冷冻干燥24 h后得到中药复方提取物干粉[11]。
细辛挥发油根据2010版《中国药典》一部附录XD“挥发油测定法”中的甲法提取。取细辛适量置于圆底烧瓶中, 加水适量与玻璃珠数粒, 振摇混合后, 连接挥发油提取器和回流冷凝管。自冷凝管上端加水使充满挥发油提取器的刻度部分, 并溢入烧瓶为止。用电热套缓慢加热, 保持微沸5 h, 直至测定器中油量不再增加, 停止加热。放置片刻, 打开测定器下端活塞, 将水缓缓放出, 至油层上端到达0线上面5 mL处止。放置1 h, 开启活塞使油层下降至其上端恰好与0线齐平, 读取挥发油量, 收集挥发油备用。
白芥子涂方巴布剂的制备 参考文献[11]并略作改进制备白芥子涂方巴布剂。称取甘油40 g、无水乙醇16 g、聚乙二醇400 (8 g)于300 mL烧杯中, 称取聚丙烯酸钠10 g、CMC-Na 2 g、细辛挥发油0.225 mL、氮酮2.5 g[为基质总质量的1% (w/w)]和生姜油适量加入上述烧杯中, 搅拌均匀作为A相; 称取甘羟铝1.4 g、柠檬酸3.0 g、有效成分干粉50 g, 于200 mL烧杯中, 加入蒸馏水160 mL, 搅拌均匀作为B相; 将B相缓慢加入A相, 沿同一方向缓慢搅拌均匀得到含药巴布剂。将上述巴布剂基质倒入涂布机储料槽中, 涂布于无纺布上, 并被覆隔离膜。放置熟化成型, 得巴布剂成品。
芥子碱硫氰酸盐的体外释放药物测定方法 采用高效液相色谱法(high performance liquid chromatograph, HPLC)测定芥子碱硫氰酸盐的含量[12]。HPLC色谱条件:色谱柱: Agilent Eclipse XDB-C18柱(250 mm × 4.6 mm, 5 μm); 流动相:乙腈-3%冰醋酸溶液(10:90, v/v); 流速: 1.0 mL·min-1; 检测波长: 326 nm; 柱温: 30 ℃; 进样量: 10 μL。
称取芥子碱硫氰酸盐2.5 mg于25 mL量瓶中, 加入pH 7.4磷酸盐缓冲液(phosphate buffered solution, PBS)定容至刻度, 配制成质量浓度为100 μg·mL-1母液。分别量取0.03、0.12、0.50、2.00、4.00和8.00 mL母液加入至10 mL量瓶中, 加PBS定容至刻度, 配制成0.3、1.2、5.0、20、40和80μg·mL-1对照品溶液, 采用HPLC测定各样品峰面积, 以峰面积对浓度作图, 绘制标准曲线。
体外透皮实验 取SD大鼠, 颈椎脱臼致死, 剪去腹部毛, 避免损伤皮肤, 剥离腹部皮肤, 用蒸馏水和生理盐水反复冲洗干净, 置于保鲜膜内, 4 ℃冷藏备用。Franz扩散池接收室体积为16.5 mL, 供给室体积为3 mL, 渗透面积为1.77 cm2。本实验分为空白对照组(不施加促透技术组)、超声导入组和离子导入组。超声导入组皮肤在0、4和8 h分别超声处理10 min (2 W·cm-2, 1 MHz, 占空比20%); 离子导入组是将离子导入仪正、负电极浸入供给室液面下, 正负电极间不接触, 也不与皮肤接触。将上述处理好的SD大鼠腹部皮肤分别固定在供给室和接收室之间, 皮肤角质层面向供给室, 真皮层一侧与接收液接触。量取3 mL芥子碱硫氰酸盐水溶液(2 mg·mL-1)置于供给室中, 接收池中加入pH 7.4 PBS (液面与皮肤真皮层接触) 16.5 mL, 放入磁力搅拌子, 于智能透皮吸收仪中保持恒速搅拌(200 r·min-1)和恒温(32 ± 1 ℃), 平衡15 min后开始计时。于1、2、4、6、8、10和12 h分别从接收室取样3 mL, 同时补加等体积预温至32 ℃的pH 7.4 PBS。各时间点样品采用HPLC测定药物含量[13]。
皮肤累积透过量计算
按下式计算累积透过量:
| $ {Q_n} = \frac{{\left[{{C_n} \cdot V + {V_0}\sum\limits_{i = 1}^{n-1} {{C_i}} } \right]}}{A} $ |
其中, Qn为累积透过量(μg·cm-2); V为接收室中接受液体积(mL); Cn为第n个取样点测得的浓度(μg·mL-1); Ci为第i个取样点测得的浓度(μg·mL-1); V0为取样体积(mL); A为有效透皮面积(cm2)。以t时刻药物通过皮肤的累积透过量Qn对时间t作图, 可得Qn-t释放曲线, 该直线斜率即为稳态透皮吸收速度(Jss, 即药物稳态流量, μg·cm-2·h-1)。Jss值越大, 表示药物越容易透过皮肤。
释药机制拟合对体外透皮实验结果分别采用零级、一级、Higuchi、Ritger-Peppas方程拟合, 阐明其释放机制。
零级方程: Qn = kr0t + b, 式中, kr0为零级释放速率常数, b为常数。
一级方程: ln(100-Qn) = -kr1t + lnM, 式中, kr1为一级释放速率常数, M为常数。
Higuchi方程: Qn = kHt1/2, 式中, kH为Higuchi释放速率常数。
Ritger-Peppas方程: lnQn = nlnt + lnk, 式中n为扩散系数, k为常数。
动物药效学考察豚鼠哮喘模型的建立 15只雄性豚鼠适应性饲养1周后, 随机分为正常组、哮喘模型组、巴布剂治疗组、巴布剂/超声导入联合治疗组和巴布剂/离子导入联合治疗组, 建立豚鼠哮喘模型[14]。造模第1、7天, 正常组动物腹腔注射生理盐水1 mL; 其余组动物腹腔注射含10% (w/v)卵清白蛋白、5%氢氧化铝的生理盐水1 mL, 造模第13~16天, 每天采用压缩空气式雾化器使豚鼠雾化吸入5%卵清白蛋白和2.5%氢氧化铝的生理盐水, 持续5 min, 同时正常组豚鼠雾化吸入等体积生理盐水, 持续5 min。记录豚鼠从雾化结束到开始出现腹式呼吸的间隔时间作为哮喘潜伏期。
给药方案及样品采集造模第17天开始给药。正常组、哮喘模型组:不治疗; 巴布剂组:在3 cm × 3 cm背部剃毛区域贴敷巴布剂, 并用橡皮膏固定; 巴布剂/超声导入组:在3 cm × 3 cm背部剃毛区域贴敷巴布剂, 用橡皮膏固定。每天换药时, 揭下巴布剂, 将超声耦合剂均匀涂于超声探头上, 于豚鼠背部原巴布剂贴敷区实施超声导入10 min (2 W·cm-2, 1 MHz, 占空比20%); 巴布剂/离子导入组:在3 cm × 3 cm背部剃毛区域贴敷巴布剂, 用橡皮膏固定。每天换药时, 揭下巴布剂, 将正负电极固定于豚鼠背部原巴布剂贴敷区实施离子导入10 min。给药组连续给药4天, 每日换药。末次给药后第2天, 所有动物麻醉后取左肺肺泡灌洗液及右肺肺组织。
肺泡灌洗液的处理 采用水合氯醛麻醉豚鼠, 开胸, 使主、支气管清楚暴露, 主气管处剪一个T型小开口。用止血钳结扎右侧支气管。将自制导管前端嵌入直至主气管下端分叉处。抽取生理盐水(4 ℃) 2 mL, 沿导管缓缓注入左肺, 至观察到左肺充盈, 在肺中停留30 s后, 轻轻抽回灌注液体, 再将该液体注入到肺中, 反复抽注3次, 将注入的液体全部抽回, 转移至5 mL离心管中。按上述步骤重复灌洗1次。合并2次灌洗液, 以1 600 ×g离心10 min, 吸取上清液, 于-80 ℃保存[15]。取右肺组织分两份, 一份肺组织用10%甲醛固定、脱水、包埋后, 进行常规切片, 苏木精-伊红(Hematoxylin-eosin, HE)染色后光镜观察; 另一份肺组织按肺组织/生理盐水为5%的比例, 用组织匀浆器制成肺组织匀浆。按ELISA试剂盒说明书检测豚鼠肺组织匀浆中IFN-γ、IL-4水平及肺泡灌洗液中IgE含量。
统计学处理 采用SPSS16.0软件进行单因素方差分析, P < 0.05被认为具有显著性差异。实验数据以x±s表示。
结果 1 离子导入和超声导入方法的体外促渗透效果本研究中最终制备得到巴布剂成品为每100 g巴布剂中含白芥子涂方提取物的量为17 g (17%, w/w)。芥子碱硫氰酸盐是白芥子中的主要有效成分, 是一种水溶性药物, 不易透皮吸收。以芥子碱硫氰酸盐作为模型药物, 考察离子导入、超声导入对其体外透皮吸收的促进作用。
芥子碱硫氰酸盐 HPLC标准曲线方程为A = 14.521 C - 4.670 (r = 0.999 8), 线性范围为0.3~100.0 μg·mL-1。体外透皮实验中, 芥子碱硫氰酸盐透皮吸收量随时间延长而增加, 呈正相关。超声导入、离子导入、空白对照组的Jss分别为4.75、1.26和1.21 μg·cm-2·h-1。超声导入促芥子碱硫氰酸盐吸收效果显著, 离子导入有一定促进作用, 但效果不明显(图 1), 说明二者促吸收机制不同。通过零级、一级、Higuchi和Ritger-Peppas方程拟合, 发现芥子碱硫氰酸盐的体外透皮释放最符合Ritger-Peppas方程, 空白对照组、离子导入组、超声导入组的相关系数r分别为0.999 0、0.996 4和0.975 7 (表 1)。通过分析参数n值, 说明空白对照组、超声导入组药物透皮释放机制主要为骨架溶蚀机制, 离子导入组药物释放机制为药物扩散与聚合物材料降解溶蚀协同作用。
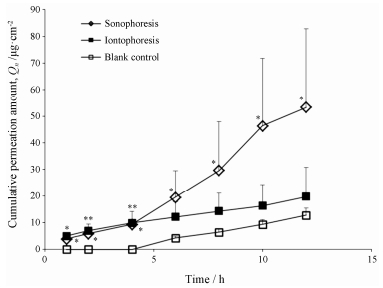
|
Figure 1 Effect of iontophoresis and sonophoresis on transdermal absorption of sinapinethiocyanate. n = 3, x±s. *P < 0.05, **P < 0.01 vs blank control group |
| Table 1 Matching equation of release profiles in vitro |
用卵清蛋白和氢氧化铝雾化诱导哮喘发生后, 豚鼠出现不安、少动、挠鼻和大小便失禁等症状。诱导2天后出现哮喘症状潜伏期明显缩短, 潜伏期缩短至120 s左右; 诱导4天后潜伏期缩短至(89.7 ± 36.9) s (图 2A)。诱导4天雾化结束后10 min内腹式呼吸次数增加至(614.7 ± 52.4)次(图 2B)。诱导引发豚鼠出现哮喘症状的潜伏期在2 min内提示造模成功。
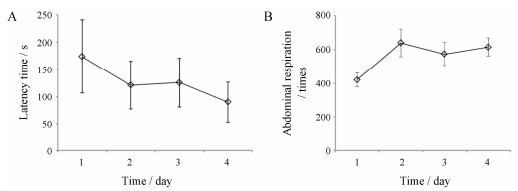
|
Figure 2 Evaluation index of guinea pig asthma models. A: Latent period of asthma; B: Abdominal breathing frequency in 10 min |
豚鼠肺部组织经病理切片并HE染色后, 可观察到较详细的病理特征。由图 3可见, 正常组豚鼠肺泡壁清晰, 结构完整。细支气管管壁完整, 管壁与平滑肌厚度正常, 偶见个别炎症细胞; 模型组细支气管上皮增厚, 有出血现象并伴有大量炎细胞浸润, 终末支气管管壁皱缩; 巴布剂组较模型组炎症明显减轻, 但仍有部分炎细胞浸润, 平滑肌增生, 细支气管腔内可见蛋白渗出; 巴布剂/超声导入组、巴布剂/离子导入组肺泡完整清晰, 细支气管管壁增生不明显, 终末支气管结构完整, 炎症情况显著减轻。哮喘是一种常见支气管慢性炎症性疾病, 其肺部主要病理特征包括支气管黏膜上皮组织中大量的嗜酸细胞、淋巴细胞等炎症细胞浸润, 内膜纤毛细胞受损或坏死, 黏膜水肿和充血及大量分泌物和黏液存留, 支气管管壁增生等[16]。由上述病理结果可见, 巴布剂/超声导入组、巴布剂/离子导入组炎症情况比模型组明显减轻。说明超声导入、离子导入手段能明显促进白芥子涂方巴布剂中有效成分的透皮吸收, 更好地发挥哮喘治疗效果。

|
Figure 3 Lung pathological section images of guinea pigs in different groups (20×) |
IL-4是重要的炎性因子, IgE为过敏反应的介导因素, IgE升高是过敏性疾病最有力的提示, 也是评价哮喘疗效的重要指标[17]。与正常组相比, 哮喘模型组豚鼠肺泡灌洗液中的IL-4、IgE水平明显升高(P < 0.01), 证明建模成功。与模型组相比, 巴布剂组、巴布剂/离子导入组、巴布剂/超声导入组的IL-4和IgE水平明显降低(P < 0.01), 其中巴布剂/超声导入组的水平最低, 甚至与正常组相当(图 4)。因此离子导入和超声导入能促进巴布剂有效成分的透皮吸收, 其中超声导入效果更明显。
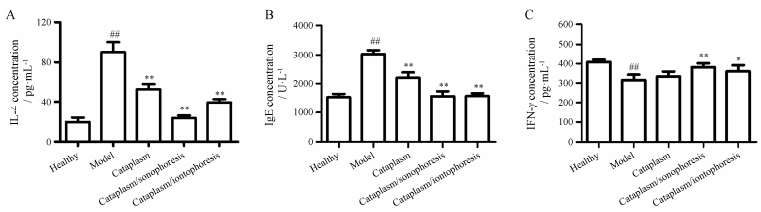
|
Figure 4 IL-4 (A), IgE (B) and IFN-γ (C) level in bronchoalveolar lavage fluid of guinea pigs in different groups. ##P < 0.01 vs healthy group; *P < 0.05, **P < 0.01 vs model group |
IFN-γ属于Th2细胞分泌的平喘因子, 可拮抗IL-4[18]。与正常组相比, 模型组IFN-γ水平明显降低(P < 0.01);与模型组相比, 巴布剂/超声导入组IFN-γ水平明显升高(P < 0.01), 而单纯巴布剂组无明显差异(P > 0.05)。因此, 不施加任何物理促渗技术时, 巴布剂透皮效果有限; 超声导入比离子导入手段的促透皮效果更明显。
讨论巴布剂中基质选择十分重要, 本研究以聚丙烯酸钠、羧甲基纤维素钠、聚维酮K30为黏合剂, 甘油和PEG400为保湿剂, 甘羟铝为交联剂, 柠檬酸为pH调节剂, 氮酮为吸收促进剂, 得到了黏附力良好、易成型的巴布剂。
本研究证明了离子导入和超声导入均能促进白芥子涂方中有效成分芥子碱硫氰酸盐的透皮吸收, 其中超声导入效果更明显。离子导入法主要促透皮吸收机制为通过电流作用促进离子型药物富集, 引发电位差、浓度差, 从而促进药物进入皮肤[19], 适用于离子化药物或带电胶体微粒, 对皮肤结构影响较小。超声导入法主要影响皮肤结构, 皮肤经超声处理后角质层、表皮层结构变松散, 流动性增加, 细胞和组织结构暂时改变, 皮肤组织形成孔道、空泡和凹陷等通道, 有利于药物透皮吸收[20]。芥子碱硫氰酸盐是水溶性药物, 其透皮吸收的限速步骤是通过皮肤细胞间隙的速率, 因此皮肤结构是影响其透皮吸收的重要因素, 超声导入法促渗效果优于离子导入法。超声导入主要是对皮肤结构产生暂时影响, 而离子导入主要对药物产生影响, 后者受药物性质影响大[12]。因此, 超声导入手段促吸收效果更具有普适性, 对大多数药物的促透皮效果更显著, 同时对皮肤结构可逆性影响也证明其安全性。
Ritger-Peppas方程中k是表示释药速率大小的重要参数, n是表示药物释放机制的特征参数。当n < 0.45时, 药物释放符合扩散机制; n > 0.89时, 药物释放主要为骨架溶蚀机制; 0.45 < n < 0.89时, 药物释放机制为混合型, 即药物扩散与聚合物材料降解溶蚀协同作用机制[21]。本研究中, 空白对照组、离子导入组和超声导入组的n值分别为1.59、0.53和1.10, 表明空白对照组、超声导入组药物透皮释放机制主要为骨架溶蚀机制, 离子导入组药物释放机制为药物扩散与聚合物材料降解溶蚀协同作用。
豚鼠对乙酰胆碱、组胺等引喘物质的敏感性非常高, 被用于研究哮喘发病机制与治疗机制中[22]。本实验用卵清白蛋白和氢氧化铝雾化诱导后, 豚鼠出现不安、少动、挠鼻和大小便失禁等症状。肺部相关细胞因子是诊断哮喘、评估病情进展及预后的重要指标, 与正常组相比, 哮喘模型组炎性因子IL-4、IgE水平明显升高, 平喘因子IFN-γ明显降低, 证明造模成功。巴布剂组、巴布剂/离子导入组和巴布剂/超声导入组均能升高IFN-γ水平, 降低IL-4、IgE水平, 证明了其治疗效果。
“内病外治”是中医理论中一个重要的理念。但由于中药复方成分复杂, 理化性质各不相同, 透皮吸收效率有限, 限制了其临床应用。本研究比较了离子导入、超声导入两种不同物理促渗技术对白芥子涂方有效成分芥子碱硫氰酸盐透皮吸收、白芥子涂方巴布剂治疗豚鼠哮喘的疗效, 为现代物理促透技术与传统中医外用制剂的紧密结合提供了范例, 为内病外治的广泛应用提供了有效手段。
| [1] | Sagar S, Akbarshahi H, Uller L. Translational value of animal models of asthma: challenges and promises[J]. Eur J Pharmacol, 2015, 759: 272–277. DOI:10.1016/j.ejphar.2015.03.037 |
| [2] | Bahadori K, Doylewaters MM, Marra C, et al. Economic burden of asthma: a systematic review[J]. BMC Pulm Med, 2009, 9: 24–39. DOI:10.1186/1471-2466-9-24 |
| [3] | Xu F, Xiao H, Zhou S, et al. Effect of Chaipu decoction on airway inflammation and ERK/p38 MAPK signal pathway in rats with asthma[J]. Chin J Exp Tradit Med Formu (中国实验方剂学杂志), 2018, 24: 104–109. |
| [4] | Williamson P, Short P, Vaidyanathan S, et al. Inhaled and systemic corticosteroid response in severe asthma assessed by alveolar nitric oxide: a randomized crossover pilot study of add-on therapy[J]. Br J Clin Pharmacol, 2013, 75: 93–102. DOI:10.1111/bcp.2013.75.issue-1 |
| [5] | Bai Y, Du L, Feng X, et al. Progress of transdermal drug delivery systems for natural drugs[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1377–1381. |
| [6] | Liu S, Yang S. Research and clinic application of cataplasm[J]. Mod Prev Med (现代预防医学), 2010, 37: 3188–3189. |
| [7] | Gorcea M, Hadgraft J, Moore DJ, et al. Fourier transform infrared spectroscopy studies of lipid domain formation in normal and ceramide deficient stratum corneum lipid models[J]. Int J Pharm, 2012, 435: 63–68. DOI:10.1016/j.ijpharm.2011.11.004 |
| [8] | Sintov AC, Hofmann MA. A novel thermo-mechanical system enhanced transdermal delivery of hydrophilic active agents by fractional ablation[J]. Int J Pharm, 2016, 511: 821–830. DOI:10.1016/j.ijpharm.2016.07.070 |
| [9] | Zuo J, Du L, Li M, et al. Transdermal enhancement effect and mechanism of iontophoresis for non-steroidal anti-inflammatory drugs[J]. Int J Pharm, 2014, 466: 76–82. DOI:10.1016/j.ijpharm.2014.03.013 |
| [10] | Yang M, Chan HK. Monitoring the inhalation flow rate of nebulized aerosols using an ultrasonic flow meter: in vitro assessment[J]. Mary Ann Liebert, 2017, 30: 173–181. |
| [11] | Du L, Zhu W, Liu X, et al. Preparation, in vitro and in vivo evaluation of cataplasm of white mustard seed varnish to prevent asthma[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 4596–4602. |
| [12] | Ma P, Chen X, Chen W, et al. Effect of physical techniques on in vitro transdermal permeability of sinapine thiocyanate[J]. J Int Pharm Res (国际药学研究杂志), 2017, 44: 432–436, 465. |
| [13] | Du L, Liu X, Jia J, et al. Improvement effect of iontophoresis on transdermal permeation of ferulic acid[J]. J Int Pharm Res (国际药学研究杂志), 2014, 41: 595–598. |
| [14] | Evans R, Nials A, Knowles R, et al. A comparison of antiasthma drugs between acute and chronic ovalbumin-challenged guinea-pig models of asthma[J]. Pulm Pharmacol Ther, 2012, 25: 453–464. DOI:10.1016/j.pupt.2012.08.004 |
| [15] | Hu Y, Li M, Zhang T, et al. Preparation of liposomal artesunate dry powder inhalers and the effect on the acute lung injury of rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1906–1912. |
| [16] | Pera T, Zuidhof A, Smit M, et al. Arginase inhibition prevents inflammation and remodeling in a guinea pig model of chronic obstructive pulmonary disease[J]. J Pharmacol Exp Ther, 2014, 349: 229–238. DOI:10.1124/jpet.113.210138 |
| [17] | Scala E, Pirrotta L, Uasuf C, et al. Aedes communis reactivity is associated with bee venom hypersensitivity: an in vitro and in vivo study[J]. Int Arch Allergy Immunol, 2018, 176: 101–105. DOI:10.1159/000488866 |
| [18] | Naradikian M, Myles A, Beiting D, et al. Cutting edge: IL-4, IL-21, and IFN-γ interact to govern T-bet and CD11c expression in TLR-activated B cells[J]. J Immunol, 2016, 197: 1023–1028. DOI:10.4049/jimmunol.1600522 |
| [19] | Zhang H, Xu Q, Wang Y, et al. Passive transmembrane permeation mechanisms of monovalent ions explored by molecular dynamics simulations[J]. J Chem Theory Comput, 2016, 12: 4959–4969. DOI:10.1021/acs.jctc.6b00695 |
| [20] | Tardoski S, Gineyts E, Ngo J, et al. Low-intensity ultrasound promotes clathrin-dependent endocytosis for drug penetration into tumor cells[J]. Ultrasound Med Biol, 2015, 41: 2740–2754. DOI:10.1016/j.ultrasmedbio.2015.06.006 |
| [21] | Li X, Li L, Wang X, et al. Application of model-based methods to characterize exenatide-loaded double-walled microspheres: in vivo release, pharmacokinetic/pharmacodynamic model, and in vitro and in vivo correlation[J]. J Pharm Sci, 2012, 101: 3946–3961. DOI:10.1002/jps.23236 |
| [22] | Meurs H, Santing R, Remie R, et al. A guinea pig model of acute and chronic asthma using permanently instrumented and unrestrained animals[J]. Nat Protoc, 2006, 1: 840–847. DOI:10.1038/nprot.2006.144 |
 2018, Vol. 53
2018, Vol. 53


