生物大分子药物作为21世纪药物研发中最有前景的领域之一, 目前主要用于治疗肿瘤、艾滋病、心血管病和糖尿病等重大疾病。相对于小分子药物, 生物大分子药物主要优点是对反应物的高选择性、作用位点的高活性及较小的毒副作用[1]。但是, 相比较于小分子药物, 生物大分子药物在制剂研究中具有相当大的难度。其一, 生物大分子药物同时具有化学结构和空间结构, 发挥其药效作用需要维持其具有生物活性的构象。其二, 生物大分子药物容易被酶降解, 具有酶不稳定性[2]。其三, 生物大分子药物一般具有较高的水溶性和分子质量, 药物的细胞膜渗透性较差。鼻腔给药作为非侵入性的给药途径在生物大分子药物递送中被广泛研究。鼻黏膜细胞上有很多微细绒毛, 大大提高了药物吸收的有效面积, 并且, 鼻黏膜细胞下有丰富的血管和淋巴管, 可以使吸收的生物大分子药物迅速通过血管壁进入体循环, 提高药物的起效速度。相对于口服给药, 鼻腔中的酶含量较少, 药物经鼻腔吸收后直接进入体循环, 可以避免肝首过效应, 有效提高生物药物的生物利用度。同时, 鼻腔给药使用方便, 提高患者的顺应性。而且, 鼻腔给药相对于其他给药途径更具有其独特的优势, 体现在经鼻腔吸收的药物可以绕过血脑屏障, 通过嗅神经通路和三叉神经通路直接进入脑部, 提高一些治疗神经性疾病的生物药物的脑内分布, 增强药物的治疗效果[3]。
胰岛素作为生物大分子的代表性药物被广泛应用于糖尿病的治疗, 1型糖尿病患者由于自身丧失分泌胰岛素的能力, 必须用胰岛素治疗才能获得满意的疗效, 2型糖尿病患者虽然体内产生胰岛素的能力并非完全丧失, 可以通过某些口服药物刺激体内胰岛素的分泌, 但到后期仍有一些患者需要使用胰岛素治疗。除此之外, 胰岛素通过鼻腔给药后可以直接进入脑组织和脑脊液, 提高药物在脑内的分布[4], 对于改善阿尔茨海默症患者的记忆功能具有良好的应用前景。临床试验结果也证明, 大部分的中度认知障碍和阿尔茨海默症早期的患者经胰岛素鼻腔给药后记忆可以得到改善[5, 6]。然而, 根据鼻腔自身生理结构特点, 多重屏障阻碍胰岛素的鼻腔吸收[7]。首先, 阻碍胰岛素鼻腔吸收的是在鼻腔上皮细胞上覆盖着黏液层, 黏液中的糖蛋白链对药物分子的屏障作用和黏液纤毛对药物的清除作用阻碍药物的吸收。其中, 由于胰岛素具有亲水性和跨膜渗透速率慢的特点, 使可溶解在黏液层的胰岛素对黏液清除作用更加敏感。其次, 胰岛素作为亲水性的生物大分子, 药物不容易跨过鼻腔上皮细胞被吸收。最后, 胰岛素在鼻腔中可能会被酶降解失活, 降低其生物利用度。
安全有效的吸收促进剂的使用是最常用的改善胰岛素鼻腔吸收的方法。胰岛素作为具有生物活性的大分子药物, 一般采用体内药效学和体内药动学的方法考察不同吸收促进剂对于胰岛素鼻腔吸收的影响。但是该类体内研究方法一般需要处理复杂的生物样品和使用昂贵的试剂盒进行药物浓度或药效指标的检测。相对而言, 对于众多的吸收促进剂的初步筛选, 合适的在体和体外研究方法更能提高实验效率和节省实验成本。在体循环法作为鼻黏膜吸收研究的一种在体研究方法, 最早是由Shinichiro等[8]建立, 主要是通过循环药液中药物的含量随循环时间的变化来反映药物在鼻腔黏膜的吸收情况。该方法按照灌流的方式可以分为单向灌流法和循环灌流法, 可以用于药物的吸收机制和影响因素的考察及吸收促进剂的体外筛选。但是, 采用在体循环方法对药物进行体外研究的前提是药物在管路循环和鼻腔洗出液中具有良好的稳定性。而生物大分子药物如胰岛素一般容易吸附于疏水性界面如硅胶管和玻璃容器, 同时, 鼻腔洗出液中的酶可能会对药物产生降解作用, 因此, 在体循环法应用于大分子药物的研究面临着挑战。根据文献[9]报道, 应用0.001%表面活性剂可以改善生物大分子药物的界面吸附问题, 因此, 推测应用0.001%表面活性剂可能会减少生物大分子如胰岛素在在体循环装置的硅胶管内的吸附, 从而, 可以建立一种适用于胰岛素研究的在体鼻循环实验方法, 为生物大分子药物的体外鼻腔吸收促进剂的筛选和吸收行为的研究提供更加快捷简单的在体研究方法, 解决长期以来大分子鼻腔吸收研究只能依赖于体内药效和药动的问题。
本研究选择胰岛素作为鼻腔给药的适用药物, 首先考察了在体循环实验对于胰岛素研究的适用性, 包括药物在管路循环过程中的稳定性及在鼻腔洗出液中的稳定性, 建立了一种适用于胰岛素鼻腔吸收研究的在体循环方法。然后, 通过建立的在体循环实验方法考察了pH和药物浓度对于胰岛素鼻腔吸收的影响, 并对其鼻腔的吸收机制进行了研究。
材料与方法材料 猪胰岛素(徐州万邦金桥制药有限公司, 批号: 1510A16, 实测效价: 26.8 U·mg-1); 三羟甲基氨基甲烷(Tris, 北京博奥拓科技有限公司); 乌拉坦(国药集团化学试剂有限公司); 辛酸癸酸聚乙二醇甘油酯(Labrasol, 嘉法狮贸易有限公司); 乙腈为色谱纯, 其他试剂为分析纯。
仪器 1100高效液相色谱仪(安捷伦科技有限公司); 蠕动泵(保定兰格蠕动泵有限公司); RYJ-6B型药物透皮扩散试验仪(上海黄海药检仪器有限公司); 雷磁pHSJ-3F pH计(上海精密科学仪器有限公司); HC-2062高速离心机(安徽中科中佳科学仪器有限公司)。
动物 健康Sprague-Dawley (SD)雄性大鼠, 体重(200 ± 20) g, 由沈阳药科大学实验动物中心提供, 动物合格证号: SCXK (辽) 2015-0001。
药物含量测定方法 参考2015版中国药典的含量测定方法进行胰岛素含量的测定, 即采用高效液相色谱法对药物的含量进行测定。色谱条件如下:色谱柱: Gemini C18色谱柱(250 mm × 4.6 mm, 5 μm, 110 Ǻ); 保护柱:通用型保护柱(广州菲罗门公司); 流动相: 0.2 mol·L-1 Na2SO4溶液(28.4 g·L-1, 加2.7 mL·L-1稀磷酸)-乙腈(500:205, v/v); 流速: 1.0 mL·min-1; 进样量: 20 μL; 检测波长: 214 nm; 柱温: 40 ℃。
循环液的配制 精密称取一定量的胰岛素溶解于一定体积的0.01 mol·L-1盐酸生理盐水溶液中, 继续加入一定体积的0.1 mol·L-1 Tris生理盐水溶液, 盐酸生理盐水溶液与Tris生理盐水溶液的体积比为87:13, 得到质量浓度为1.0 mg·mL-1的胰岛素母液。
将上述药物母液用一定量的生理盐水(含或不含0.001% Labrasol)稀释至一定浓度, 并用1 mol·L-1 HCl和1 mol·L-1 NaOH调节pH, 得到所需的循环液。
循环液中药物在大鼠鼻腔洗出液中稳定性的考察 将大鼠腹腔注射乌拉坦(1.0 g·kg-1)麻醉, 仰位固定在鼠板上, 颈部做一切口暴露气管与食管, 气管内插入聚乙烯管。另一聚乙烯管通过食管插至鼻腔后部, 用胶黏剂将鼻颚通道封闭, 以防药液从鼻腔流入口腔。该聚乙烯管另一端同蠕动泵上的硅胶管相连, 硅胶管插入到5.0 mL生理盐水溶液中。生理盐水置于带有刻度的扩散池内, 控制循环液的流速为2.0 mL·min-1, 循环温度为37 ℃[10]。启动电子蠕动泵使生理盐水在大鼠鼻腔内循环30 min, 得到体积约为5.0 mL鼻腔洗出液。
精密移取1.0 mg·mL-1胰岛素母液0.5 mL至5.0 mL量瓶中, 用鼻腔洗出液定容至刻度。将5.0 mL含药物的鼻腔洗出液转移至带有刻度的扩散池中, 并将扩散池置于透皮扩散仪装置, 设置扩散仪的温度为37 ℃, 搅拌速度为500 r·min-1。待溶液在扩散仪中平衡10 min后, 分别于0、10、20、30、45、60、90、120、180和240 min读取池内剩余药液体积(Vn), 并从池中吸取药液100 μL, 同时补加同体积的不含药物的生理盐水。将取出的药物溶液经高速离心机10 000 r·min-1离心16 min后, 采用高效液相色谱法测定上清液中药物的含量。
不同时间扩散池中剩余药量Qn的计算方法(体积校正法):
根据
循环液中药物在管路循环中稳定性的考察 分别精密移取5.0 mL含和不含0.001% Labrasol的循环液至带有体积刻度的扩散池中, 并将扩散池放在透皮扩散仪中, 设置仪器温度为37 ℃, 搅拌速度为500 r·min-1。药物循环液在蠕动泵的作用下以2.0 mL·min-1的流速在管路内循环, 待循环液在管路内循环平衡10 min后, 分别于0、10、20、30、45、60、90、120、180和240 min读取池内Vn , 并从池中吸取药液100 μL, 同时补加同体积的、不含药物的生理盐水。将取出的药物溶液经高速离心机10 000 r·min-1离心16 min后, 采用高效液相色谱法测定不同时间上清液中药物的含量。
采用“循环液中药物在大鼠鼻腔洗出液中稳定性的考察”中所述的体积较正法计算不同时间扩散池中的累计药量Qn及累计药量损失的百分比, 通过累计药量损失百分比对时间作图来判断循环液中药物在鼻腔洗出液中的稳定性, 其累计药量损失的百分比越小, 药物的稳定性越强。
大鼠在体鼻腔循环实验 对大鼠进行麻醉及食管插入聚乙烯管的手术操作同“循环液中药物在大鼠鼻腔洗出液中稳定性的考察”所述。聚乙烯管另一端同电子蠕动泵上的硅胶管相连, 硅胶管插入到扩散池中。设置扩散池温度为37 ℃, 搅拌速度为500 r·min-1, 蠕动泵流速2 mL·min-1。精密移取含0.001% Labrasol的循环液5 mL于扩散池中, 硅胶管先不连接聚乙烯管使药物溶液在管路内循环平衡10 min后, 再将其连接到聚乙烯管上, 使循环液在蠕动泵的作用下从扩散池进入大鼠鼻腔, 再流回至扩散池, 实现药液在大鼠鼻腔和扩散池之间的循环灌流。同时, 分别于0、10、20、30、45、60、90和120 min读取池内Vn , 并从池中吸取药液100 μL, 同时补加同体积的不含药物的生理盐水。将取出的药物溶液经高速离心机10 000 r·min-1离心16 min后, 采用高效液相色谱法测定上清液中药物的含量。
采用“循环液中药物在大鼠鼻腔洗出液中稳定性的考察”中所述的体积校正法计算不同时间扩散池中的剩余药量Qn, 用Qn/Q0计算不同时间点的剩余药物的百分比, 以剩余药物的百分比的对数为纵坐标, 时间为横坐标, 进行线性回归分析。回归直线的斜率即为对应条件下的吸收速率常数(K), 其大小反映药物的鼻黏膜吸收速度[12]。
统计学分析 实验所得数据采用x±s表示, 用t-检验进行组间统计学分析, P < 0.05被认为有显著性差异。
结果与讨论 1 胰岛素体外分析方法的建立胰岛素含量测定的检测限为2 μg·mL-1, 胰岛素的质量浓度在10~1 000 μg·mL-1内线性良好, 以峰面积(A)对质量浓度(C, μg·mL-1)进行线性回归, 得回归方程为A = 19.482 C - 116.39 (r = 0.999 9, n = 7)。低、中和高(10、100和1 000 μg·mL-1) 3种质量浓度的胰岛素溶液的日内精密度RSD均小于2.0%, 方法回收率在98%~102%之间。结果表明, 该方法符合体外分析方法学要求。
2 胰岛素在体循环实验的适用性考察在体循环实验中, 若想用体外药液中药物含量的变化来反映药物在鼻黏膜的吸收及复杂的体内药物含量变化, 需要首先对循环装置中药物的吸附情况和药物在鼻腔洗出液中的稳定性进行考察。排除这两个因素对药物体外含量变化的干扰, 该方法才具备进行鼻腔在体循环实验研究的适用性。
2.1 胰岛素在生理盐水中孵育的稳定性在37 ℃条件下, 循环液中药物在生理盐水中孵育4 h后含量变化的结果如图 1所示, 药物在2 h内含量损失百分比在-2.3%~1.1%之间, 该药物含量的变化可能是由于实验的系统误差所致, 该系统误差包括实验操作中取样和读取体积的误差及药物体外分析方法的仪器误差等。因此, 可以认为药物溶液在37 ℃下搅拌2 h内稳定性良好。
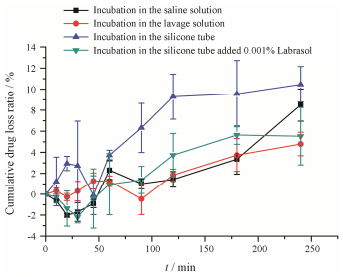
|
Figure 1 The stability of 0.1 mg·mL-1 insulin incubated in the saline solution and nasal lavage solution and the stability of 0.1 mg·mL-1 insulin circulated in the silicone tube with and without the addition of 0.001% Labrasol in the perfusate. n = 3, x±s |
鼻腔中存在多种酶如单加氧酶、还原酶、转移酶、酯酶和蛋白水解酶等, 其中包含肽链端解酶和内肽酶的氨肽酶是最重要的蛋白水解酶[13]。胰岛素是生物大分子, 可能会被鼻腔洗出液中的酶降解, 因此, 对其在鼻腔洗出液中的稳定性进行研究。胰岛素在大鼠鼻腔洗出液中稳定性的实验结果如图 1所示, 药物在2 h内的含量损失百分比为0%~1.8%, 与胰岛素在生理盐水中孵育的实验结果接近。因此, 胰岛素在鼻腔洗出液中的稳定性良好, 同时, 也说明鼻腔黏液中的酶含量较少, 其对药物降解的影响在鼻腔在体循环实验中可忽略不计。
2.3 胰岛素在管路循环中的稳定性根据文献[9]报道, 胰岛素容易吸附在硅烷化玻璃等疏水性的容器表面, 而在体循环装置中用到的硅胶管表面也具有一定的疏水性, 对于胰岛素可能存在一定的吸附作用, 因此, 考察了药物的管路循环的稳定性, 其结果如图 1所示, 药物的生理盐水溶液在经过管路循环后, 2 h内药物含量损失百分比高达9.3%, 与未经过管路循环的孵育实验结果相比, 药物含量经过管路循环2 h后明显减少。药物的减少可能是由于蛋白类药物溶液在硅胶管的液固界面间发生了吸附作用[14]。当药物溶液在管路循环2~4 h时, 药物含量变化达平台期, 可能是药物达到了吸附和解析的平衡, 含量变化不明显。有文献[14]报道, 蛋白类药物在吸附和解析作用下会导致药物变性, 2~4 h的平台期也不适用于鼻腔在体循环实验的研究。因此, 在保证药物稳定性的前提下, 避免药物在管路的吸附是建立在体循环实验方法的关键。
2.4 0.001% Labrasol对胰岛素管路吸附的影响根据文献的报道, 表面活性剂Genapol PF-10在0.001%浓度下具有减少溶解的蛋白质在界面的吸附及其导致的聚集体形成的作用[14]。同时, Tween-80、HCO-60、Pluronic F-68、Span-20、卵磷脂、HPC和MC等具有表面活性的化合物在配制成0.001%溶液时可以防止胰岛素在硅烷化玻璃和输液管路的吸附作用[9]。因此, 推断少量的表面活性剂可能可以解决药物的管路吸附问题, 进而, 随机选择被认为安全的0.001% Labrasol来减少药物在管路界面的吸附作用。其结果如图 1所示, 在0.001% Labrasol作用下, 药物在2 h内含量损失百分比在-1.0%~3.7%内, 明显改善了药物溶液在管路的吸附作用, 与药物溶液未经过管路循环的孵育实验结果接近。因此, 0.001% Labrasol可以使药物溶液在管路里稳定循环2 h, 提高药物溶液在管路循环的稳定性, 可满足实验要求。这可能是Labrasol作为表面活性剂, 可以减少界面的表面张力, 减少药物的疏水性区域与硅胶管壁的吸附作用, 同时, Labrasol自身是两亲性物质, 其疏水区域可以与药物竞争性地吸附到硅胶管壁, 减少药物的吸附[9, 14]。从实验结果可以看出, 0.001%表面活性剂的使用不仅可以减少胰岛素在容器表面的吸附, 同时可以减少胰岛素在管路的吸附, 因此, 可将其运用到胰岛素在体循环实验的方法学的建立中。由于Labrasol的用量只有0.001%, 对鼻黏膜的吸收影响较小。此外, 在体循环实验一般用来研究药物的鼻腔吸收影响因素的考察和吸收促进剂的体外筛选。在实验中, Labrasol浓度固定为0.001%, 进行其他因素的考察, 其实验结果具有一定的指导意义。对于吸收促进剂的体外筛选, 吸收促进剂的浓度一般远远大于Labrasol的浓度, Labrasol对于鼻黏膜吸收的影响更是微乎其微。
3 胰岛素鼻黏膜吸收的影响因素考察上述研究表明, 应用0.001% Labrasol可有效解决鼻腔在体循环实验方法中存在的胰岛素管路吸附问题。因此, 应用该改进的实验方法, 考察了pH和循环液中药物浓度对胰岛素鼻腔吸收的影响, 并阐明了其鼻腔吸收机制。
3.1 循环液pH对鼻腔吸收的影响根据鼻腔制剂适合的pH范围为4.5~7.4, 本研究考察了pH 4.5、6.0和7.4对0.1 mg·mL-1胰岛素鼻腔吸收行为的影响, 不同pH的药物溶液在鼻腔的吸收量和剩余药物百分比的对数随时间的变化曲线如图 2所示, 不同pH条件下的药物K与相关系数(r)列于表 1。结果表明, 胰岛素在鼻腔内的吸收符合一级动力学, 模型拟合度良好。当循环液pH为6.0时药物K最小, 其可能的原因是该pH条件下药物易于形成聚集体, 使药物溶液的鼻腔黏膜的渗透性明显降低, 导致药物在pH 6.0的条件下吸收最差[15]。相对于pH 6.0, 当循环液的pH变为7.4时, 胰岛素K明显增加。该结果与文献报道的体内药效学实验结果有相同的趋势, Wang等[15]研究发现, 相较于pH 6.0, pH 7.4的胰岛素等渗溶液使大鼠的血糖降低水平从(1.5 ± 0.1) %提高到(6.2 ± 0.8) %。
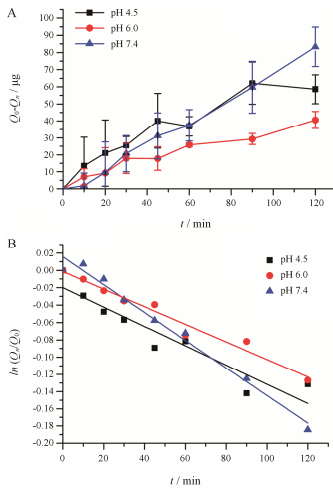
|
Figure 2 Effect of perfusate pH on the absorbed amount (A) and absorption rate (B) of 0.1 mg·mL-1 insulin on the nasal mucosa. n = 4, x±s |
| Table 1 Nasal absorption of 0.1 mg·mL-1 insulin at different pH. K: Absorption rate constant; r: Coefficient. n = 4, x±s. *P < 0.05 vs pH 6.0 |
考虑到鼻腔生理环境的pH是5.5~6.5, 因此, 固定循环液pH为6.0, 选择3个药物质量浓度(0.1、0.3和0.5 mg·mL-1), 考察胰岛素浓度对于药物鼻腔吸收的影响, 不同浓度药物的鼻腔吸收量和剩余药物百分比的对数随时间变化曲线如图 3所示, 不同浓度的药物K与r列于表 2。由结果可知, 胰岛素的鼻腔吸收量随循环液中药物浓度的增加而增加, 可能是由于循环液与体内药物的浓度梯度增加造成的。不同浓度的胰岛素在大鼠鼻腔的吸收行为符合一级动力学, 并且不同浓度的胰岛素K无显著性差异, 平均K值为2.4×10-3 min-1。因此, 推测在考察的浓度范围内胰岛素的鼻腔吸收机制是基于浓度梯度的被动扩散, 即药物从高浓度区(吸收部位)向低浓度区域(血液)顺浓度梯度转运。
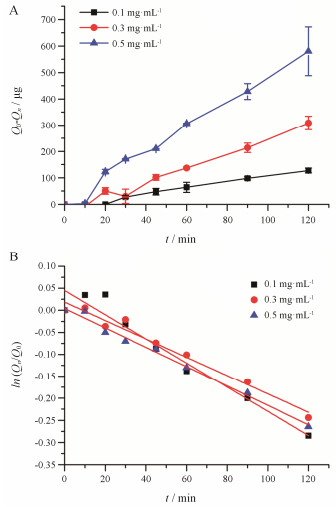
|
Figure 3 Effect of perfusate concentration on the absorbed amount (A) and absorption rate (B) of insulin (pH 6.0) on the nasal mucosa. n = 3, x±s |
| Table 2 Nasal absorption of insulin (pH 6.0) at different concentrations. n = 3, x±s |
以胰岛素为模型药物考察了生物大分子进行在体鼻循环实验的适用性, 发现药物在鼻腔洗出液中具有较好的稳定性, 但药物存在管路吸附。在循环液中加入0.001%表面活性剂Labrasol可有效解决胰岛素的管路吸附问题。采用改良的实验方法考察了循环液pH和药物浓度对于胰岛素鼻腔吸收的影响。结果表明, 与pH 4.5和pH 7.4相比, 药物在pH 6.0条件下吸收速率常数最小。同时, 胰岛素的鼻腔吸收机制可能是基于浓度梯度的被动扩散。相对于体内研究方法, 该方法可为生物大分子的鼻腔吸收行为研究及吸收促进剂的筛选提供更加简单便捷的在体研究方法。
| [1] | Yu M, Wu J, Shi J, et al. Nanotechnology for protein delivery: overview and perspectives[J]. J Control Release, 2016, 240: 24–37. DOI:10.1016/j.jconrel.2015.10.012 |
| [2] | Yamamoto A, Hayakawa E, Lee VH. Insulin and proinsulin proteolysis in mucosal homogenates of the albino rabbit: implications in peptide delivery from nonoral routes[J]. Life Sci, 1990, 47: 2465–2474. DOI:10.1016/0024-3205(90)90492-A |
| [3] | Kamei N, Tanaka M, Choi H, et al. Effect of an enhanced nose-to-brain delivery of insulin on mild and progressive memory loss in the senescence-accelerated mouse[J]. Mol Pharmaceut, 2017, 14: 916–927. DOI:10.1021/acs.molpharmaceut.6b01134 |
| [4] | Salameh TS, Bullock KM, Hujoel IA, et al. Central nervous system delivery of intranasal insulin: mechanisms of uptake and effects on cognition[J]. J Alzheimers Dis, 2015, 47: 715–728. DOI:10.3233/JAD-150307 |
| [5] | Freiherr J, Hallschmid M, Frey WH, et al. Intranasal insulin as a treatment for Alzheimer's disease: a review of basic research and clinical evidence[J]. CNS Drugs, 2013, 27: 505–514. DOI:10.1007/s40263-013-0076-8 |
| [6] | Claxton A, Baker LD, Hanson A, et al. Long-acting intranasal insulin detemir improves cognition for adults with mild cognitive impairment or early-stage alzheimer's disease dementia[J]. J Alzheimers Dis, 2015, 44: 897–906. DOI:10.3233/JAD-141791 |
| [7] | Davis SS, Illum L. Absorption enhancers for nasal drug delivery[J]. Clin Pharmacokinet, 2003, 42: 1107–1128. DOI:10.2165/00003088-200342130-00003 |
| [8] | Shinichiro H, Takatsuka Y, Tai M, et al. Absorption of drugs from the nasal mucosa of rat[J]. Int J Pharm, 1981, 7: 317–325. DOI:10.1016/0378-5173(81)90058-2 |
| [9] | Ran M. Prevention of the absorption of insulin in the containers[J]. World Clin Drugs (世界临床药物), 1996, 1: 64–65. |
| [10] | Na L, Wang J, Wang L, et al. A novel permeation enhancer: n-succinyl chitosan on the intranasal absorption of isosorbide dinitrate in rats[J]. Eur J Pharm Sci, 2013, 48: 301–306. DOI:10.1016/j.ejps.2012.10.030 |
| [11] | Song X, Du S, Lu Y, et al. Study on rat nasal absorption in situ of borneol based on single pass perfusion method[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 2489–2492. |
| [12] | Wang H, Wei G, Gao M, et al. Intranasal absorption of rivastigmine hydrogen tartrate and brain targeting evaluation[J]. Acta Pharm Sin (药学学报), 2016, 51: 1616–1621. |
| [13] | Lee VHL, Yamamoto A. Penetration and enzymatic barriers to peptide and protein absorption[J]. Adv Drug Deliv Rev, 1989, 4: 171–207. DOI:10.1016/0169-409X(89)90018-5 |
| [14] | Thurow H, Geisen K. Stabilisation of dissolved proteins against denaturation at hydrophobic interfaces[J]. Diabetologia, 1984, 27: 212–218. |
| [15] | Wang J, Sakai S, Deguchi Y, et al. Aminated gelatin as a nasal absorption enhancer for peptide drugs: evaluation of absorption enhancing effect and nasal mucosa perturbation in rats[J]. J Pharm Pharmacol, 2002, 54: 181–188. DOI:10.1211/0022357021778367 |
 2018, Vol. 53
2018, Vol. 53


