2. 中国科学院上海药物研究所, 上海 201203;
3. 迪沙药业集团有限公司, 山东 威海 264200
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Disha Pharmaceutical Co., Ltd., Weihai 264200, China
固体制剂由药物活性成分(active pharmaceutical ingredient, API)与辅料共同组成, 原辅料的粒径及其分布是影响药物制剂质量的关键因素[1]。药用辅料直接参与到药物制剂的成型、填充、崩解与溶出、缓释和控释等过程。因此, 确定原料药与辅料的微粒性质对保证制剂质量有重要意义[2]。聚焦制剂内部药物及其关键性辅料的微粒形态及粒径, 不仅有助于精确控制药物制剂的质量, 还对创制新剂型具有指导价值。在片剂等剂型中, 由于原辅料高度混合, 同种微粒之间、不同微粒之间的空间关系复杂, 难以测定单一微粒的粒径, 制剂内部药物及其关键性辅料的物质形态及粒径的测定是药物制剂剖析与一致性评价研究的难点。成像是研究固体制剂内部物质形态及分布最直接的方法, 然而, 当前能用于固体制剂内部微粒形态及粒径的研究手段非常有限, 多数操作复杂、数据分析难度大。例如, 核磁共振成像技术灵敏度高且能实时在线成像[3], 太赫兹波成像利用光子能量低的太赫兹辐射作为信号源可以实现高信噪比、高灵敏度的无损伤检测[4], 但因技术本身的限制, 核磁共振和太赫兹波成像的分辨率尚不足以提供药物制剂内微粒的精细结构, 并不适合广泛的制剂结构三维(3D)成像研究。激光共聚焦成像通过对同一样品不同层面实时扫描, 然后叠加图像得到样品的3D结构, 可以对较厚的荧光标本进行精细的光学切片分析, 且图像的对比度和分辨率较好[5]; 光学相干断层成像技术可以对不同深度组织所产生的反向散射强度和延搁时间进行测量, 进而得到结构图像, 具有非接触性、非破坏性等特点[6]; X-射线成像具有较高的分辨率, 是目前较理想的三维成像技术[7]; 同步辐射X-射线断层扫描显微成像具有可定量、非损伤、高灵敏度和高分辨率性质, 已用于氯吡格雷、扑热息痛等药物在制剂内的原位粒径分析, 但设备资源极其紧张限制了其应用[7, 8]。上述方法由于成像技术复杂、测试费用高、数据分析难度大和多数不能普及, 难以在药厂实施, 制约了其实际应用。
利用原辅料的热力学性质, 研究固体相变的方法在药物制剂领域存在广泛的应用, 如药品检验、药物生产过程中的质量控制等[9]。受热时, 有的药品在熔融的同时分解, 有的药品则有明确的熔点[10]。测定熔点可以对药物进行鉴别, 也可反映药物的纯度, 是衡量药物质量的重要指标。热台显微镜[11]是在偏光显微镜的基础上加装了恒温工作台, 同时具有热分析和光学分析两种功能, 可直接观察物料的相变、熔融、分解和重结晶等热力学动态过程, 具有测量周期短、测试步骤简单、能直接观察目标成分相变的动态过程等优点。本研究以硬脂酸(stearic acid, SA)为模型辅料, 利用其热熔特征检出混合粉体中SA微粒, 并对比不同混合微粒对SA微粒粒径检测的影响, 建立基于热熔特征识别混合粉体中目标辅料成分的方法。同时, 以非诺贝特为模型药物, 利用其热熔特征研究原研片与仿制片内药物微粒粒径及其分布特征差异。通过热台显微镜采集目标成分熔化前后图像, 使用Image-Pro Analyzer (IPA)软件对比识别目标成分, 分析计算目标成分的平均粒径、定向长短接线径(Feret diameter)、面积相当径(Heywood diameter)和周长相当径(equivalent perimeter diameter)等粒径参数, 对混合粉体中SA与片剂中非诺贝特微粒的各粒径参数分别进行统计学分析, 为仿制药与原研药的一致性评价提供新思路和新方法。
材料与方法材料 硬脂酸(纯度≥99.5%, 湖州展望药业有限公司); 微晶纤维素(PH-101, 美国FMC公司); 乳糖(Flowlac 100, 德国美剂乐集团); Tween 80 (分析纯, 南京威尔化工有限公司); 十二烷基硫酸钠(分析纯, 国药集团化学试剂有限公司); 非诺贝特原研片(美国益邦制药公司); 非诺贝特仿制片(国产某公司); 图像处理软件Image-Pro Analyzer (7.0版, 美国Media Cybernetics公司)。
主要仪器 透光反射偏光显微镜(DYP-990)、精密恒温工作台(DY400) (上海点应光学仪器有限公司); 涡旋混匀器(MS3数显型)、加热磁力搅拌器(ETS-D5) (德国IKA公司)。
粉末混合 将球形的硬脂酸(spheric stearic acid, SAs)微粒分别与微晶纤维素(cellulose microcrys talline, MCC)、乳糖(lactose, LAC)、微晶纤维素-乳糖混合物(1:1, w/w)按照1:2、1:2.5和1:5 (w/w)比例置于EP管中, 1 500 r·min-1涡旋5 min, 使充分混合。
样品制备及显微图像采集样品制备 用200 μL枪头蘸取少量Tween 80平铺于载玻片上, 形成无色透明的薄层; 再将样品填充于洁净的200 μL枪头内, 用洗耳球尖头插入枪头大口端, 枪头尖头以45°度放置于载玻片的无色透明薄层上方2 cm处, 轻轻挤压洗耳球让粉末缓缓喷出并附着于Tween 80处理后的载玻片上, 使样品均匀分散。
硬脂酸显微图像采集 采集载玻片上SA熔化前的微粒显微图后, 保持镜头、样品位置不变, 参照SA的熔点(67~69 ℃)将加热台从室温(20 ℃)开始缓慢加热至70 ℃ (接近目标成分熔点), 设置升温速率为1 ℃·s-1, 观察微粒形态变化, 采集SA熔化后的微粒显微图。
非诺贝特片的分散及微粒图像采集 掰开非诺贝特原研片、仿制片, 各称取20 mg于离心管中, 加入十二烷基硫酸钠(0.2%, w/w)水溶液4 mL, 超声5 min使分散(25 Hz, 25 ℃)。将得到的原研片、仿制片微粒混悬液稀释4倍后, 各移取30 μL均匀涂布于载玻片上, 真空干燥2 h (20 ℃)。采集载玻片上的微粒显微图后, 保持镜头、样品位置不变, 参照非诺贝特的熔点(80~82 ℃), 加热台由室温(20 ℃)开始缓慢加热至82 ℃ (接近目标成分熔点), 设置升温速率为1 ℃·s-1, 采集非诺贝特微粒熔化后的显微图。
图像处理 在IPA中首先建立图像标尺; 将采集的显微图像转变为灰度图像, 调整亮度、对比度和伽马值等参数, 增加目标微粒的对比度; 根据微粒分布及成像分辨率设置面积、圆形度、半径比阈值提取微粒, 在一种微粒样品的分析中使不同图片阈值的设置保持一致; 对比熔化前后图片, 依据熔化后图片, 在熔化前图片中去除未熔的微粒, 并使用软件中Count Size工具, 计算得到熔化前图片中剩余微粒(目标成分)的平均粒径、Feret径、Heywood径和周长相当径等二维定量表征参数。平均粒径指通过目标微粒圆心一点每隔2°划线, 所有线段的均值; Feret径指在投影面定方向外接平行线之间的距离[12], Feret径为在投影面定方向外接平行线的最长径和最短径的均值; Heywood径(DH)是将粒子的投影面积(A)当作圆面积计算求得的直径[13]; 周长相当径(DL)是将投影面的周长(L)当作圆周长计算求得的直径。相关计算公式如下:
| $ {D_{\rm{H}}} = {\rm{ }}{(4A/\pi )^{1/2}} $ | (1) |
| $ {D_{\rm{L}}} = {\rm{L}}/{\pi ^2} $ | (2) |
统计学分析 微粒的粒径采用“均值±标准差” (x±s)表示。应用SPSS 19.0软件进行统计学分析, 不同粉体的数据采用Kruskal-Wallis检验分析, P < 0.05为差异有统计学意义。
结果 1 混合辅料中目标成分检出的方法学建立药用辅料SA的熔点为67~69 ℃, 在片剂中主要作为润滑剂[14], 其润滑作用与其粒径和比表面积有关[15]。
1.1 不同类型的SA微粒形态未经处理的、不规则形态硬脂酸(irregular shape stearic acid, SAi)微粒粒径不均一, 呈扁平或针状(图 1a); 而处理后的SAs的粒径相对均一, 粒径约为10~50 μm, 呈规则的球形(图 1b)。使用热台对SAi、SAs微粒加热至70 ℃后, 显微图片中的微粒全部熔化(图 1c, d), 证明利用热熔特征可以有效识别SAi与SAs微粒。

|
Figure 1 Microscopic images of SAi particles (a, c) and SAs particles (b, d) before heating (a, b) and after heating (c, d) at 70 ℃. SAi: Irregular shape stearic acid; SAs: Spheric stearic acid |
SAs微粒形态与MCC微粒可直观地区分, 而球形LAC微粒的形态则与SAs微粒相近, 需要进行热熔后, 利用熔化前后微粒形态变化才能区分。采用Tween 80薄层法, 分别将混合粉体平铺于经Tween 80薄层处理的载玻片上, MCC (长条形或细微的点状微粒)与SAs (球形)分散均匀, 采集显微图像(图 2a), 缓慢升温至70 ℃后, 可见SAs微粒熔融、呈液滴状, 未熔化的均为MCC (图 2b)。SAs微粒与球形LAC微粒按1:2.5 (w/w)混合(图 2c), 加热至70 ℃后, 可见部分球形微粒熔化呈液滴状, 而未熔化球形微粒可断定为LAC (图 2d)。同理, 将SAs微粒与LAC-MCC混合物按1:5 (w/w)混合, 采集显微图像(图 2e), 加热至70 ℃后, SAs熔化, 而LAC和MCC微粒均不发生熔化(图 2f)。总之, 将SAs微粒与不同形态、不同混合比例的辅料LAC和MCC混合后, 在显微视野下观察, 各微粒均可有效分散、微粒间干扰小, 利用各辅料的熔融特征, 可有效地识别混合粉体中的SAs微粒。

|
Figure 2 Microscopic images of mixed powders of SAs-MCC (a, b), SAs-LAC (c, d), and SAs-MCC-LAC (e, f) before heating (a, c, e) and after heating (b, d, f) at 70 ℃. SAs-MCC: Mixed powder of spheric steric acid and cellulose microcrystalline; SAs-LAC: Mixed powder of spheric steric acid and lactose; SAs-MCC-LAC: Mixed powder of spheric steric acid, cellulose microcrystalline and lactose |
热熔法显微观察后, 采集足够数量的SAs微粒(每组 > 500个), 结合微粒数目与粒径分布范围, 对SAs的平均粒径、Heywood径、周长相当径和Feret径作粒径频数分布图。4种粒径的频数分布图中(图 3), 粒径累积分布曲线趋势基本一致, SAs微粒与不同辅料混合后, 测定结果表明其微粒累积频数曲线高度重合, 微粒粒径分布与未混合的SAs微粒的粒径分布基本一致; 不同混合粉体中, 各组间粒径的粒径均值差异较小, 均在36~38 μm内波动(表 1), 表明各混合粉体中SAs微粒粒径无显著差异, 说明本方法可以从混合粉体中有效检出SAs微粒。

|
Figure 3 Pareto diagrams of 2D morphological parameters of SAs particles in mixtures of SAs-MCC, SAs-LAC, and SAs-MCC-LAC, in which the histogram and fold line represent the number and the cumulative frequency of SAs particles, respectively |
| Table 1 Diameters of SAs detected from mixtures of SAs and other excipients |
对以上不同混合比例和不同混合种类的粉体中SAs微粒的平均粒径、Feret均径、Heywood径、周长相当径等参数进行统计学比较分析。使用Kruskal- Wallis检验, P值均大于0.05, 即未经混合的SAs微粒和混合粉末中的SAs微粒粒径分布相似, 证明球形SAs微粒与不同辅料混合后, 利用热熔特征检出混合粉体中SAs微粒粒径的方法准确可靠。
2 片剂中药物成分的检出以非诺贝特为模型药物, 其熔点为80~82 ℃, 是临床常用的调血脂药物, 难溶于水, 微粉化非诺贝特极大增加了药物和胃肠道的接触面积, 提高了生物利用度, 其疗效与药物粒径有显著的相关性[16]。
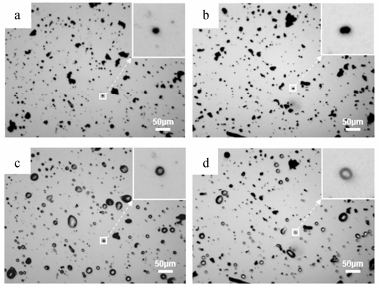
2.1 片剂中非诺贝特的粒径测定片剂粉碎后的粉体并不能直接在显微镜下观察, 需要适当处理, 以使药物微粒与其他辅料分离, 而这样的分离不得对目标成分的粒径造成影响。经预实验发现, 使用十二烷基硫酸钠溶液和超声波处理后的非诺贝特原研片、仿制片粉体能分散均匀, 但辅料微粒的形态与非诺贝特微粒近似, 难以仅通过形态来进行分类; 通过前期考察, 确定了十二烷基硫酸钠溶液浓度、超声波处理强度与时间, 以保证药物微粒能充分地分散开, 而其粒径及其分布不受影响; 利用热熔前后的微粒形态变化的差异, 检出药物微粒。将处置后的待测样品置于显微镜下, 采集图片(图 4a, b), 加热台由室温(20 ℃)缓慢逐步加热至82 ℃ (图 4c, d), 可见非诺贝特微粒熔化呈液滴状。参照原研药品说明书, 非诺贝特片中的辅料有羟丙甲纤维素、交联羧甲基纤维素钠、MCC和硬脂酸镁等, 各辅料微粒在片剂中占比小, 且熔点均高于180 ℃, 显著区别于非诺贝特原料药, 即在82 ℃时不熔化的微粒为辅料微粒。使用IPA对比熔化前后的图片, 依据熔化后图片, 在熔化前图片中去除未熔的微粒(辅料微粒), 得到剩余微粒(非诺贝特微粒)的图像, 并计算剩余微粒的粒径等参数。
|
Figure 4 Microscopic images of the dispersed particles of fenofibrate brand (a, c) and generic products (b, d) before heating (a, b) and after heating (c, d) at 82 ℃ |
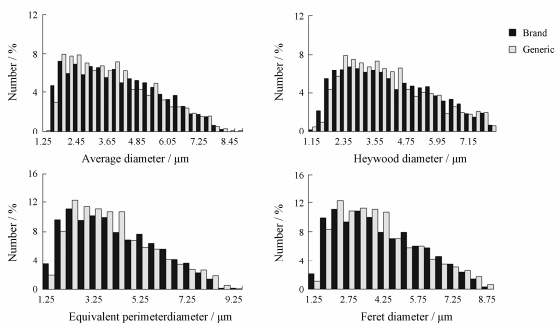
采集足够数量的原研、仿制片中非诺贝特微粒(每组 > 1 000个); 结合微粒数量与粒径分布范围, 对非诺贝特微粒的平均粒径、Heywood径、周长相当径和Feret径作粒径频数分布图。4种粒径频数分布图中(图 5), 原研片与仿制片中非诺贝特微粒的粒径分布存在一定差别。非诺贝特原研片中药物单微粒粒径 < 2 μm的微粒数多于仿制片中非诺贝特微粒数, 2~5 μm内微粒数少于仿制片中的非诺贝特微粒数, 5~7μm内的微粒数多于仿制片中非诺贝特微粒数; 非诺贝特原研片中原料药粒径频数分布相较于仿制片中的粒径分布更趋于平缓, 说明原研片中非诺贝特微粒粒径较仿制片中非诺贝特微粒粒径分布更加均匀。
|
Figure 5 Particle size distributions of fenofibrate particles in brand and generic products |
使用Kruskal-Wallis检验对比分析非诺贝特原研片、仿制片中非诺贝特微粒的各组粒径。经检验, 原研片和仿制片中非诺贝特微粒的平均粒径、Feret均径、Heywood径和周长相当径的P值均 < 0.05, 证明原研、仿制片中的非诺贝特的微粒粒径分布存在显著性差异。
讨论原辅料的粒径是影响固体制剂药物质量的重要因素, 利用热熔特征检出混合粉体中目标成分的微粒粒径, 适用于具有明显熔点特征的辅料与API, 结合统计学方法对目标成分各粒径参数与原研制剂进行对比分析, 为原研制剂的剖析和仿制药的一致性评价提供了一个实用的基础方法。该方法的基本流程是: ①取样; ②制样:适当的反溶剂下分散, 载玻片上涂布, 除去溶剂; ③常温成像:热台显微镜采集同一视野下的微粒影像; ④受热成像:可控加热使目标成分微粒熔化, 记录影像; ⑤目标微粒的识别与检出; ⑥数据分析与统计。
药物制剂内原料微粒、多种辅料微粒之间存在复杂的空间关系, 显微图像并不能直接给出特定原料药粉体或辅料粉体的粒径特征, 利用热熔特征检出混合粉体中目标成分, 再进行定量分析, 具有一定的局限性, 仅适用于熔点范围显著区别于混合粉体中其他原辅料的情形, 而多个成分熔点近似、低熔点成分存在时如何测定高熔点微粒粒径的方法学仍有待深入研究; 利用热熔特征检测的微粒粒径均为二维等效粒径, 其准确性可能低于高精度、高灵敏度的制剂结构3D成像研究得到的三维参数; 统计足够数量的目标成分微粒, 以提高实验结果的准确性。此外, 该法受光学显微镜放大倍数及显微图像分辨率的限制, 热台显微镜不适用于粉体粒径小于1 μm的微粒检出及粒径分析, 故利用热熔特征识别混合粉体中目标成分需充分考虑原辅料目标成分熔点及其粒径范围。
综上, 本研究以具有规则形态的SAs为研究对象, 结合热熔特征与显微成像技术, 建立了混合粉体中目标成分微粒粒径及其分布的新方法; 并成功将其应用于分析非诺贝特片剂内的药物微粒粒径及其分布, 为原研制剂的剖析和仿制药的一致性评价提供示例和思路。
| [1] | Zhang JW, Meng FY, Xiao TQ. Structure-based strategy for consistency evaluation of dosage forms[J]. Acta Pharm Sin (药学学报), 2017, 52: 659–666. |
| [2] | Yang S, Yin XZ, Li HY, et al. Research progress on architecture of dosage forms using synchrotron radiation X-ray microtomography[J]. Chin Bull Life Sci (生命科学), 2013, 25: 794–802. |
| [3] | Kuroiwa Y, Higashi K, Ueda K, et al. Nano-scale and molecularlevel understanding of wet-milled indomethacin/poloxamer 407 nanosuspension with TEM, suspended-state NMR, and Raman measurements[J]. Int J Pharm, 2018, 537: 30–39. DOI:10.1016/j.ijpharm.2017.12.028 |
| [4] | Novikova A, Markl D, Zeitler JA, et al. A non-destructive method for quality control of the pellet distribution within a MUPS tablet by terahertz pulsed imaging[J]. Eur J Pharm Sci, 2018, 111: 549–555. DOI:10.1016/j.ejps.2017.10.029 |
| [5] | Kahn E, Tissot N, Frere P, et al. Fluorescence excitation analysis by two-photon confocal laser scanning microscopy: a new method to identify fluorescent nanoparticles on histological tissue sections[J]. Int J Nanomed, 2012, 7: 5545–5554. |
| [6] | Zeitler JA, Gladden LF. In-vitro tomography and nondestructive imaging at depth of pharmaceutical solid dosage forms[J]. Eur J Pharm Biopharm, 2009, 71: 2–22. DOI:10.1016/j.ejpb.2008.08.012 |
| [7] | Yin XZ, Wu L, Li Y, et al. Visualization and quantification of deformation behavior of clopidogrel bisulfate polymorphs during tableting[J]. Sci Rep, 2016. DOI:10.1038/srep21770 |
| [8] | Guo Z, Yin XZ, Liu C, et al. Microstructural investigation using synchrotron radiation X-ray microtomography reveals taste-masking mechanism of acetaminophen microspheres[J]. Int J Pharm, 2016, 499: 47–57. DOI:10.1016/j.ijpharm.2015.12.045 |
| [9] | Liu XQ, Zhang LH, Li B. Application progress of thermal analysis technology in drug analysis[J]. West China J Pharm Sci (华西药学杂志), 1999, 14: 177–179. |
| [10] | Wang F. Studies on the effect of DSC parameters on melting point of medication[J]. J Nanjing Norm Univ (Eng Technol) [南京师范大学学报(工程技术版)], 2004, 4: 58–60. |
| [11] | Tick PA, Lu KE, Mitachi S, et al. Hot stage optical microscopy studies of crystallization in fluoride glass melts[J]. J NonCryst Solids, 1992, 140: 275–280. DOI:10.1016/S0022-3093(05)80781-1 |
| [12] | Verheyen P, Steffens KJ, Kleinebudde P. Use of crospovidone as pelletization aid as alternative to microcrystalline cellulose: effects on pellet properties[J]. Drug Dev Ind Pharm, 2009, 35: 1325–1332. DOI:10.3109/03639040902902401 |
| [13] | Takami K, Machimura H, Takado K, et al. Novel preparation of free flowing spherically granulated dibasic calcium phosphate anhydrous for direct tabletting[J]. Chem Pharm Bull, 1996, 44: 868–870. DOI:10.1248/cpb.44.868 |
| [14] | National Pharmacopoeia Committee. Pharmacopoeia of People's Republic of China[S]. Beijing: China Medical Science Press, 2015: 584. |
| [15] | Wang M, Wu WC, Wang CM. Determination of specific surface area of magnesium stearate by static volumetric method based on BET adsorption theory[J]. Chin J Pharm (中国医药工业杂志), 2016, 47: 1546–1548, 1567. |
| [16] | Keating GM, Ormrod D. Micronised fenofibrate - an updated review of its clinical efficacy in the management of dyslipidaemia[J]. Drugs, 2002, 62: 1909–1944. DOI:10.2165/00003495-200262130-00013 |
 2018, Vol. 53
2018, Vol. 53


