2. 吉首大学 植物资源保护与利用湖南省高校重点实验室, 湖南 吉首 416000
2. Key Laboratory of Plant Resources Conservation and Utilization, College of Hunan Province, Jishou University, Jishou 416000, China
雪胆为雪胆属多种植物如长果雪胆(H. doli chocarpa)、峨眉雪胆(H. omeiensis)、巨花雪胆(H. gigantha)、蛇莲(H. sphaerocarpa)和雪胆(H. chinensis)等的干燥块茎, 具有清热解毒、消炎杀菌、健胃止痛等功效, 常用于胃痛、溃疡病、上呼吸道感染、支气管炎、肺炎、肠炎、泌尿系感染等常见感染性疾病的治疗, 为我国西南地区各民族常用的中草药[1-3]。现代研究表明, 雪胆的主要活性成分为葫芦烷型四环三萜及其皂苷和齐墩果烷型五环三萜及其皂苷, 其中尤以葫芦烷三萜的含量最高, 药理实验表也明该类成分具有显著的药理活性, 包括抗肿瘤、抗菌、抗炎、抗HIV等[4-6]。
长果雪胆(H. dolichocarpa)为葫芦科(Cucur bitaceae)雪胆属(Hemsleya)植物, 生于海拔2 000米左右的山谷灌丛中, 主要分布于四川中部, 其块茎为雪胆来源之一。因此, 为了筛选活性显著的葫芦烷三萜类化合物, 课题组以研究较少的长果雪胆块茎为研究对象, 对其进行了化学成分的研究, 从其乙醇提取物中分离得到7个葫芦烷三萜类化合物, 包括一个新化合物和6个已知化合物, 分别鉴定为3β, 11α, 26, 27-tetrahydroxycucurbita-5, 24(E)-diene-3, 26-glucosides (1)、scandenogenin D (2)、jinfushanencin F (3)、scandenoside R3 (4)、scandenoside R1 (5)、scandenogenin A (6)和scandenoside R2 (7)。其中化合物1为一新化合物, 结构见图 1。
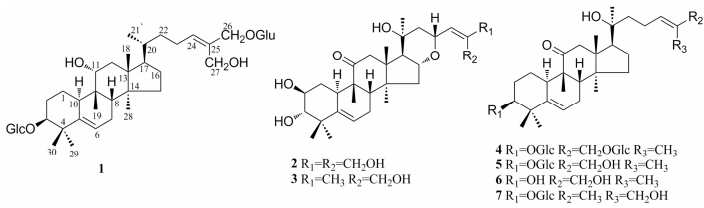
|
Figure 1 Structures of compounds 1-7 |
化合物1白色粉末(甲醇)。[α]D20 +2.8 (c 0.06, MeOH); HR-ESI-MS m/z: 821.467 3 [M+Na]+ (计算值: 821.466 3), 确定分子式为C42H70O14, 不饱和度为8。UV末端吸收峰λmax (log ε): 204 (3.78) nm。红外光谱显示结构中存在羟基(3 458~3 347 cm-1)、甲基(2 948、2 867 cm-1)、双键(1 625 cm-1)等特征信号峰。
1H NMR谱(表 1)显示结构中存在6个甲基信号δH 0.87 (s)、0.88 (s)、0.91 (d, J = 6.6 Hz)、1.15 (s)、1.30 (s)、1.56 (s); 两个烯氢质子信号δH 5.48 (t, J = 6.0 Hz)和δH 5.80 (t, J = 7.2 Hz)。两个端基质子信号δH 4.90 (1H, d, J = 7.80 Hz)、δH 4.92 (1H, d, J = 7.80 Hz), 提示结构中存在两分子的糖结构单元。除去两分子的六碳糖信号, 13C NMR APT谱(表 1)共给出30个碳信号, 包括6个甲基碳、10个亚甲基碳(2个羟甲基碳δC 73.3、58.6)、8个次甲基碳(2个连氧碳δC 88.3、78.2; 2个烯碳δC 118.9、132.1)和6个季碳(2个烯碳δC 144.7、137.4), 说明化合物1为典型的三萜结构类型, 结合关键碳信号包括6个甲基碳信号δC 17.4、19.2、19.7、26.7、26.8、28.1和4个烯碳信号δC 118.9、132.1、144.7、137.4, 推断该三萜的基本骨架为葫芦烷型三萜皂苷[7-9]。该结论进一步被1H-1H COSY (图 2)和HMBC谱证实。
| Table 1 NMR data (600 MHz, in pyridine-d5) for compound 1 |
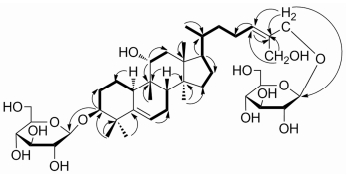
|
Figure 2 Key 1H-1H COSY (bold bonds) and HMBC (arrows) correlations of compound 1 |
化合物1的官能团和取代基位置由HSQC和HMBC谱确定(图 2)。在HMBC谱中, δH 5.80 (1H, t, J = 7.2 Hz)与C-22 (δC 37.1)和C-23 (δC 25.1)存在相关, 提示C-24/25位被氧化形成双键; 另外, H3-29 (δH 1.15, s)与C-5 (δC 144.7), H-6 (δH 5.48, t, J = 6.0 Hz)与C-4 (δC 42.8)均存在相关, 显示C-5/6位存在双键。在HSQC谱中, δH 4.89 (2H, d, J = 6.6 Hz)与δC 73.3, δH 4.65 (2H, s)与δC 58.6存在直接相关, 提示结构中存在两个羟甲基官能团, 进一步分析HMBC谱发现, 4个质子信号均与C-24 (δC: 132.1)和C-25 (δC: 137.4)存在相关, 提示葫芦烷三萜C-26和C-27位甲基在化合物1中均被氧化形成羟甲基; 连氧质子δH 4.16 (1H, m)在HSQC谱中与δC 78.2存在直接相关, 在HMBC谱中与C-9 (δC: 40.5)和C-12 (δC: 41.5)存在相关, 结合分子式提示C-11位存在羟基取代。另外, 在HMBC谱中, δH 3.67 (1H, m, H-3)与δC 107.8 (Glu-1)存在相关, 提示一分子的糖单元与C-3位相连; δH 4.89 (2H, d, J = 6.6 Hz)与δC 103.9 (Glu-1)存在相关, 说明另一分子的糖单元与C-26位相连。化合物1水解后水层部位经薄层色谱检识, 在相同薄层色谱条件下, 水解液与D-葡萄糖对照品在相同位置显示相同颜色的斑点, 进一步采用蒸发光检测器对水解液分析发现其与D-葡萄糖对照品的保留时间基本一致(tR = 12.3 min), 因此, 将结构中的糖单元鉴定为D-葡萄糖, 端基质子偶合常数(J = 7.8 Hz)提示两分子的葡萄糖单元均为β型。化合物1的相对构型是由NOESY谱和偶合常数来确定。在NOE谱中, H-3 (δH 3.67)与H-10 (δH 2.78)存在相关, H-11 (δH 4.16)与H-8 (δH 1.62)存在相关, 提示C-3位的葡萄糖单元处于β位, C-11位的羟基处于α位。目前所得的葫芦烷三萜中A/B、C/D环均处于反式, B/C环处于顺式[8-10], 基于同源生物合成途径的考虑, 化合物1应具有同样的母核立体构型, 因此, 化合物1取代基的立体构型如图所示。综上所述, 将化合物1的结构确定为3β, 11α, 26, 27-tetrahydroxycucurbita-5, 24(E)-diene-3, 26-glucosides, 该化合物为一新葫芦烷三萜类化合物。
2 活性评价活性评价结果表明, 该类化合物对人宫颈癌细胞HeLa的抑制作用较强, 其中化合物2的IC50达到了6.78 μmol·L-1, 对人结肠癌细胞HCT-8的抑制作用较弱, 仅有化合物2和3有一定的抑制作用, IC50分别为46.1和44.3 μmol·L-1。(表 2)
| Table 2 In vitro antiproliferative activity of compounds 1-7 |
Bruker Avance Ⅲ 600型核磁共振波谱仪, 赛默飞世LTQ-Obitrap XL液质联用仪, BYLABUV-Ⅲ紫外灯(北京炳洋科技有限公司), Waters公司高效液相色谱仪(Waters TM600 Delta四元泵; Waters TM 600 Controller系统控制器; Waters 2996检测器), Lumtech高效液相色谱仪(K501四元低压半制备)流速2 mL·min-1, 检测波长210 nm, 薄层色谱用硅胶G、H、GF-254和柱色谱用硅胶(青岛海洋化工有限公司), Sephadex LH-20凝胶为Pharmacia公司产品, MCI为日本三菱化学公司产品, 常规试剂均为分析纯。
长果雪胆块茎采于重庆金佛山地区, 经吉首大学生物资源与环境科学学院张代贵教授鉴定为长果雪胆H. dolichocarpa的干燥块茎, 标本现保存于湖南吉首大学, 标本号为No.JIU.WH 20161183。
1 提取与分离长果雪胆干燥块茎(1.6 kg)粉碎后过80目筛, 加8倍量95%乙醇加热回流提取3次, 每次2 h, 合并提取液, 减压回收溶剂, 浓缩后得总浸膏114.0 g。总浸膏经水分散后, 依次用石油醚、氯仿、乙酸乙酯萃取, 萃取液减压浓缩至干。最终得到石油醚部位浸膏17.8 g, 氯仿部位浸膏34.9 g, 乙酸乙酯部位浸膏11.3 g。
取乙酸乙酯层浸膏11.3 g, 经硅胶柱色谱(100~200目)分离, 氯仿-甲醇(1:0~0:1)梯度洗脱, 得到7个馏分Fr A-G。其中馏分Fr D (氯仿-甲醇60:1)经Sephadex LH-20柱色谱洗脱, 除去色素类物质, 进一步经ODS中压色谱柱依次用30%、50%、60%、70%、80%、90%甲醇洗脱。60%洗脱液经高效液相色谱分离纯化, 得到化合物1 (6.5 mg, CH3OH-H2O:55-45, tR = 17.8 min); 70%洗脱液经高效液相色谱分离纯化, 得到化合物2 (3.6 mg, CH3OH-H2O:60-40, tR = 21.4 min)、3 (6.1 mg, CH3OH-H2O:60-40, tR = 23.5 min); 80%洗脱液经高效液相色谱分离纯化, 得到化合物6 (5.5 mg, CH3OH-H2O:68-32, tR = 34.1 min); Fr F (氯仿-甲醇40:1)经ODS中压色谱柱依次用50%、70%、90%甲醇洗脱, 其中50%洗脱液经高效液相色谱分离纯化, 得到化合物4 (6.4 mg, CH3OH-H2O:44-56, tR = 23.6 min); 70%洗脱液经高效液相色谱分离纯化5 (7.7 mg, CH3OH-H2O:55-45, tR = 33.5 min)、7 (5.8 mg, CH3OH-H2O:55-45, tR = 37.2 min)。
2 结构鉴定化合物1 白色粉末(甲醇)。[α]D20 +2.8 (c 0.06, MeOH); HR-ESI-MS m/z: 821.467 3 [M+Na]+ (计算值: 821.466 3), 确定分子式为C42H70O14, 不饱和度为8。UV末端吸收峰λmax (log ε): 204 (3.78) nm。红外光谱显示结构中存在羟基(3 458~3 347 cm-1)、甲基(2 948、2 867 cm-1)、双键(1 625 cm-1)等特征信号峰。NMR数据见表 1。
化合物2 白色无定形粉末, 易溶于甲醇。ESI-MS m/z: 541 [M+Na]+。1H NMR (600 MHz, pyridine-d5) δH 1.22 (3H, s, H-19), 1.28 (3H, s, H-18), 1.29 (3H, s, H-29), 1.36 (3H, s, H-28), 1.43 (3H, s, H-30), 1.46 (3H, s, H-21), 3.42 (1H, d, J = 9.0 Hz, H-3), 4.11 (1H, m, H-2), 4.72 (2H, s, H-27), 4.73 (2H, s, H-26), 5.11 (1H, m, H-16), 5.15 (1H, m, H-23), 5.69 (1H, d, J = 5.4 Hz, H-6), 6.71 (1H, d, J = 8.4 Hz, H-24); 13C NMR (150 MHz, pyridine-d5) δC 34.4 (C-1), 70.7 (C-2), 81.2 (C-3), 42.6 (C-4), 142.2 (C-5), 118.5 (C-6), 24.0 (C-7), 42.6 (C-8), 49.0 (C-9), 34.0 (C-10), 212.9 (C-11), 48.6 (C-12), 48.5 (C-13), 48.5 (C-14), 41.5 (C-15), 70.3 (C-16), 55.8 (C-17), 19.9 (C-18), 20.3 (C-19), 72.2 (C-20), 30.0 (C-21), 46.4 (C-22), 70.6 (C-23), 128.3 (C-24), 142.1 (C-25), 65.3 (C-26), 58.2 (C-27), 21.6 (C-28), 22.1 (C-29), 25.2 (C-30)。以上数据与文献报道scandenogenin D一致[7], 故将化合物2鉴定为scandenogenin D。
化合物3 白色无定形粉末, 易溶于甲醇。525 [M+Na]+, 1H NMR (600 MHz, pyridine-d5) δH 1.22 (3H, s, H-19), 1.26 (3H, s, H-18), 1.28 (3H, s, H-29), 1.36 (3H, s, H-28), 1.42 (3H, s, H-21), 1.47 (3H, s, H-30), 1.97 (3H, s, H-26), 3.40 (1H, d, J = 9.0 Hz, H-3), 4.10 (1H, m, H-2), 4.52 (1H, d, J = 12.0 Hz, H-27a), 4.58 (1H, d, J = 12.0 Hz, H-27b), 5.09 (1H, m, H-23), 5.14 (1H, m, H-16), 5.71 (1H, d, J = 6.0 Hz, H-6), 6.68 (1H, d, J = 6.0 Hz, H-24); 13C NMR (150 MHz, pyridine-d5) δC 35.2 (C-1), 71.3 (C-2), 81.7 (C-3), 43.2 (C-4), 142.8 (C-5), 119.0 (C-6), 24.6 (C-7), 43.3 (C-8), 49.8 (C-9), 34.6 (C-10), 213.4 (C-11), 49.2 (C-12), 49.0 (C-13), 49.1 (C-14), 42.2 (C-15), 70.8 (C-16), 56.5 (C-17), 20.4 (C-18), 21.2 (C-19), 72.7 (C-20), 30.5 (C-21), 47.2 (C-22), 71.4 (C-23), 129.4 (C-24), 139.1 (C-25), 21.4 (C-26), 61.3 (C-27), 22.3 (C-28), 22.7 (C-29), 25.8 (C-30)。以上数据与文献报道jinfushanencin F一致[11], 故将化合物3鉴定为jinfushanencin F。
化合物4 白色无定形粉末, 易溶于甲醇。ESI-MS m/z: 819 [M+Na]+。1H NMR (600 MHz, pyridine-d5) δH 1.23 (3H, s, H-19), 1.21 (3H, s, H-18), 1.29 (3H, s, H-28), 1.31 (3H, s, H-29), 1.52 (3H, s, H-30), 1.68 (3H, s, H-21), 1.89 (3H, s, H-27), 3.66 (1H, m, H-3), 4.90 (2H, d, J = 7.8 Hz, H-26), 5.46 (1H, d, J = 6.0 Hz, H-6), 5.48 (1H, t, J = 6.6 Hz, H-24); 13C NMR (150 MHz, pyridine-d5) δC 22.3 (C-1), 28.6 (C-2), 87.2 (C-3), 42.1 (C-4), 141.6 (C-5), 118.9 (C-6), 25.0 (C-7), 43.8 (C-8), 49.0 (C-9), 36.1 (C-10), 214.2 (C-11), 49.2 (C-12), 49.8 (C-13), 50.1 (C-14), 34.9 (C-15), 22.4 (C-16), 51.1 (C-17), 19.1 (C-18), 20.4 (C-19), 74.2 (C-20), 26.1 (C-21), 44.7 (C-22), 23.1 (C-23), 130.3 (C-24), 132.3 (C-25), 75.2 (C-26), 14.2 (C-27), 19.1 (C-28), 28.1 (C-29), 26.7 (C-30), 3-Glc: 107.9 (C-1'), 75.9 (C-2'), 79.1 (C-3'), 72.1 (C-4'), 78.6 (C-5'), 63.4 (C-6'), 26-Glc: 103.4 (C-1''), 75.6 (C-2''), 79.1 (C-3''), 72.1 (C-4''), 78.2 (C-5''), 63.2 (C-6''), 以上数据与文献报道scandenoside R3一致[12], 故将化合物4鉴定为scandenoside R3。
化合物5 白色无定形粉末, 易溶于甲醇。ESI-MS m/z: 657 [M+Na]+。1H NMR (600 MHz, pyridine-d5) δH 1.12 (3H, s, H-18), 1.15 (3H, s, H-28), 1.19 (3H, s, H-19), 1.25 (3H, s, H-29), 1.47 (3H, s, H-30), 1.57 (3H, s, H-21), 1.78 (1H, s, H-27), 3.68 (1H, m, H-3), 4.31 (2H, s, H-26), 5.50 (1H, d, J = 5.4 Hz, H-6), 5.78 (1H, t, J = 7.2 Hz, H-24); 13C NMR (150 MHz, pyridine-d5) δC 22.1 (C-1), 28.5 (C-2), 87.5 (C-3), 42.2 (C-4), 141.3 (C-5), 118.8 (C-6), 24.5 (C-7), 43.4 (C-8), 49.0 (C-9), 36.3 (C-10), 214.5 (C-11), 49.5 (C-12), 50.5 (C-13), 49.6 (C-14), 34.7 (C-15), 22.4 (C-16), 51.4 (C-17), 19.6 (C-18), 20.3 (C-19), 74.0 (C-20), 26.1 (C-21), 45.2 (C-22), 23.7 (C-23), 125.0 (C-24), 136.7 (C-25), 68.3 (C-26), 14.1 (C-27), 18.5 (C-28), 28.6 (C-29), 26.5 (C-30), 3-Glc: 107.2 (C-1'), 75.6 (C-2'), 79.1 (C-3'), 72.5 (C-4'), 78.4 (C-5'), 63.1 (C-6'), 以上数据与文献报道scandenoside R1一致[13], 故将化合物5鉴定为scandenoside R1。
化合物6 白色无定形粉末, 易溶于甲醇。ESI-MS m/z: 495 [M+Na]+。1H NMR (600 MHz, pyridine-d5) δH 1.14 (3H, s, H-18), 1.15 (3H, s, H-28), 1.24 (3H, s, H-19), 1.27 (3H, s, H-29), 1.44 (3H, s, H-30), 1.65 (3H, s, H-21), 1.83 (1H, s, H-27), 3.71 (1H, m, H-3), 4.32 (2H, s, H-26), 5.72 (1H, t, J = 5.4 Hz, H-6), 6.12 (1H, t, J = 6.6 Hz, H-24); 13C NMR (150 MHz, pyridine-d5) δC 21.8 (C-1), 30.3 (C-2), 76.0 (C-3), 42.3 (C-4), 141.8 (C-5), 119.5 (C-6), 24.5 (C-7), 43.7 (C-8), 49.4 (C-9), 36.4 (C-10), 214.7 (C-11), 49.8 (C-12), 50.9 (C-13), 49.9 (C-14), 34.7 (C-15), 23.0 (C-16), 54.0 (C-17), 18.8 (C-18), 20.6 (C-19), 75.5 (C-20), 26.7 (C-21), 48.8 (C-22), 23.0 (C-23), 129.2 (C-24), 136.9 (C-25), 67.7 (C-26), 14.5 (C-27), 19.5 (C-28), 28.3 (C-29), 27.0 (C-30), 以上数据与文献报道scandenogenin A一致[13], 故将化合物6鉴定为scandenogenin A。
化合物7 白色粉末, 易溶于甲醇。ESI-MS m/z: 657 [M+Na]+。1H NMR (600 MHz, pyridine-d5) δH 1.07 (3H, s, H-18), 1.13 (3H, s, H-28), 1.26 (3H, s, H-19), 1.34 (3H, s, H-29), 1.46 (3H, s, H-30), 1.53 (3H, s, H-21), 1.85 (1H, s, H-26), 3.62 (1H, m, H-3), 4.23 (2H, s, H-27), 5.47 (1H, d, J = 5.4 Hz, H-6), 5.85 (1H, t, J = 7.2 Hz, H-24); 13C NMR (150 MHz, pyridine-d5) δC 22.5 (C-1), 29.0 (C-2), 87.7 (C-3), 42.2 (C-4), 141.7 (C-5), 118.9 (C-6), 24.6 (C-7), 42.5 (C-8), 49.2 (C-9), 36.1 (C-10), 213.6 (C-11), 49.2 (C-12), 49.3 (C-13), 50.0 (C-14), 34.6 (C-15), 22.5 (C-16), 51.8 (C-17), 18.2 (C-18), 20.5 (C-19), 72.9 (C-20), 26.3 (C-21), 45.3 (C-22), 23.6 (C-23), 128.1 (C-24), 136.5 (C-25), 21.0 (C-26), 61.3 (C-27), 18.4 (C-28), 28.6 (C-29), 26.3 (C-30), 3-Glc: 107.9 (C-1'), 75.9 (C-2'), 79.2 (C-3'), 72.9 (C-4'), 78.7 (C-5'), 63.4 (C-6'), 以上数据与文献报道scandenoside R2一致[13], 故将化合物7鉴定为scandenoside R2。
3 活性筛选采用MTT比色法, 对所得化合物1~7进行抗肿瘤活性筛选:选取人宫颈癌细胞HeLa、人结肠癌细胞HCT-8, DMEM培养基稀释后, 以每毫升6×104个的密度接种于96孔板, 每孔100 μL, 培养箱中正常培养24 h后, 加药, 使待测药物的最终浓度分别为3.125、6.25、12.5、25、50 μmol·L-1, 阳性药为阿霉素, 每个浓度3个复孔, 并设空白组。培养48 h后, 于每孔加MTT 10 μL染色。继续培养4 h后, 吸弃原培养液, 每孔加入DMSO 200 μL, 置摇床上低速振荡10 min, 使结晶物充分溶解, 并于酶联免疫检测仪570 nm波长处检测光密度值。
| [1] | Shi YQ, Yang PQ, Chen L, et al. Studies on the chemical constituents of Emeixuedan (Hemsleya errriensis)[J]. Chin Tradit Herb Drugs (中草药), 1995, 26: 619–621. |
| [2] | Li Y, Xu XT, Zheng CF, et al. Research progress on chemical constituents and biological activities of plants from Hemsleya Cogn[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 2800–2808. |
| [3] | Meng XJ, Chen YZ, Nie RL, et al. A new cucurbitacin from Hemsleya graciliflora[J]. Acta Pharm Sin (药学学报), 1985, 20: 455–458. |
| [4] | Rui HK, Yuan MY, Yu QM, et al. The structure of cucurbittacin Ⅱ glycoside[J]. Acta Pharm Sin (药学学报), 1981, 16: 445–447. |
| [5] | Xu XT, Bai H, Zhou L, et al. Three new cucurbitane triterpenoids from Hemsleya penxianensis and their cytotoxic activities[J]. Biol Med Chem Lett, 2014, 24: 2159–2162. DOI:10.1016/j.bmcl.2014.03.027 |
| [6] | Xu JZ, Wang XQ, Huang KX, et al. Studies on the chemical constituents of triterpenoid saponins in Hemsleya chinensis Cogn[J]. Chin Pharm J (中国药学杂志), 2009, 43: 1770–1773. |
| [7] | Morita T, Rui LN, Hiroko F. Solubilization of saikosaponin-a with hemslosides Ma2 and Ma3 and structure of hemsloside H1 from Hemsleya chinensis[J]. Chem Pharm Bull, 1986, 34: 401–405. DOI:10.1248/cpb.34.401 |
| [8] | Kasai R, Nie RL. Saponins from Chinese medicinal plant, Hemsleya graciliflora[J]. Chem Pharm Bull, 1990, 38: 1320–1322. DOI:10.1248/cpb.38.1320 |
| [9] | Hano Y, Shi YQ. Two acetogenins from Hemsleya ellipsoidea[J]. Phytochemistry, 1997, 46: 1447–1449. DOI:10.1016/S0031-9422(97)00519-0 |
| [10] | Song N, Li L, Zhen J, et al. Two new penterpenoid saponins and a new diterpenoid glycoside from Hemsleya chinensis[J]. Phytochem Lett, 2015, 13: 103–107. DOI:10.1016/j.phytol.2015.05.021 |
| [11] | Kubo H, Ohtani K, Kasai R, et al. Cucurbitane glycosides from Hemsleya panacis-scandens Rhizomes[J]. Phytochenistry, 1996, 41: 1169–1174. DOI:10.1016/0031-9422(95)00722-9 |
| [12] | Li YD, Yi SR, Sun XB, et al. Bioactive cucurbitane triterpenoids from the tubers of Hemsleya penxianensis[J]. Phytochem Lett, 2016, 18: 5–9. DOI:10.1016/j.phytol.2016.08.011 |
| [13] | Kasai R, Matsumoto K, Nie RL, et al. Glycosides from Chinese medicinal plant, Hemsleya panacis-scandens, and structure-taste relationship of cucurbitane glycosides[J]. Chem Pharm Bull, 1988, 36: 234–243. DOI:10.1248/cpb.36.234 |
 2018, Vol. 53
2018, Vol. 53


