2. 南阳理工学院 河南省张仲景方药与免疫调节重点实验室, 河南 南阳 473004;
3. 苏州大学药学院, 江苏 苏州 215123
2. Henan Key Laboratory of Zhang Zhongjing Formulae and Herbs for Immunoregulation, Nanyang Institute of Technology, Nanyang 473004, China;
3. College of Pharmaceutical Science, Soochow University, Suzhou 215123, China
卵巢癌是妇科肿瘤中死亡率最高的恶性肿瘤, 其中90%为上皮性卵巢癌。全球癌症生存分析工作组(CONCORD)的《2000年~2014年全球癌症生存趋势监测报告》显示, 包括中国在内的绝大多数国家的卵巢癌5年生存率在30%~50%[1]。由于卵巢癌发病隐匿, 约70%患者确诊时已为中晚期(FIGO分期: Ⅲ期和Ⅳ期)。美国国家综合癌症网络推荐的晚期卵巢癌的标准治疗方案为:外科手术之后进行铂类为基础的化疗或者手术风险高的患者直接进行铂类基础化疗[2]。然而, 化疗导致的肿瘤多药耐药(multidrug resistance, MDR)始终是临床肿瘤治疗难以逾越的障碍, 目前也无可用于临床的MDR逆转剂。因此, 探究MDR产生机制并找到应对措施是当前极其迫切而重要的研究课题。
异黏蛋白(metadherin, MTDH)基因[又名星形胶质细胞升高基因-1 (astrocyte elevated gene 1, AEG-1)或LYRIC (lysine-rich CEACAM1 coisolated)]在包括卵巢癌和子宫内膜等众多肿瘤中均有表达, 并且能够激活NF-κB、MAPK、P13K/AKT、Wnt/β-catenin等信号通路, 参与肿瘤的发生发展、侵袭、转移和耐药, 是一个潜在的多通路调控靶点[3, 4]。MTDH可通过激活PI3K/AKT通路而增加编码P糖蛋白(P-glycoprotein, P-gp)的MDR1基因表达, 引起肿瘤MDR[5]。磷酸酶和张力蛋白类似物(phosphatase and tensin homolog, PTEN)是参与MTDH调控PI3K/AKT通路的一个重要蛋白。MTDH高表达可以抑制PTEN的表达, 进而促进恶性肿瘤的生长[6]。在卵巢癌中, PTEN的表达与患者的无进展生存期也具有相关性[7], 且其低表达与卵巢癌的化疗耐药密切相关[8]。因此, 以MTDH和PTEN为靶点, 研究开发逆转卵巢癌化疗耐药的药物是值得尝试的新研究思路。
丹皮酚(paeonol, PL)是牡丹皮和芍药等中药的主要活性成分。近年研究发现, PL具有抑制肿瘤增殖、迁移和侵袭等作用, 其机制与抑制核因子κB (nuclear factor-kappa B, NF-κB)、信号传导与转录激活因子3 (signal transducers and activators of transcription 3, STAT3)和Wnt/β-catenin信号通路有关[9, 10], 而Wnt/β-catenin信号通路激活与MDR1/P-gp异常表达直接相关[11]。在乳腺癌耐药细胞中, PL可通过抑制P-gp等转运蛋白表达逆转MDR[12]。因此, 本研究旨在检测PL对卵巢癌耐药性肿瘤细胞的耐药逆转作用, 探讨其对PTEN和MTDH的影响, 为进一步研究PL逆转MDR提供实验依据。
材料与方法仪器与试剂 LSM800激光共聚焦显微镜, 蔡司公司。ABI ViiA7实时荧光定量PCR仪, 赛默飞世尔公司。BD FACSCelesta流式细胞仪, BD公司。xCELLigence RTCA S16实时无标记细胞分析系统, 艾森生物有限公司。RevertAid First Strand cDNA Synthesis Kit试剂盒、Maxima SYBR Green/ROX qPCR Master Mix, 赛默飞世尔公司; PCR引物、UNlQ-10柱式Trizol总RNA抽提试剂盒, 由上海生工生物公司提供; 优级胎牛血清, Biological Industries公司; Hyclone RPMI-1640培养基和胰酶, GE Healthycare Life Sciences公司; PL (纯度99.98%)、LY294002 (纯度99.95%), MedChemExpress公司; 罗丹明123, Sigma公司; 人PTEN、MTDH、P-gp一抗及Alexa Fluor® 488标记羊抗鼠二抗、Alexa Fluor® 647标记羊抗兔二抗, PROTEINTECH公司。顺铂(cisplatin, DDP, 批号307024CF), 齐鲁制药有限公司。
细胞培养 人卵巢癌耐顺铂SKOV3/DDP细胞(上海信裕生物科技有限公司)和人卵巢癌顺铂敏感SKOV3细胞(南京恩晶生物有限公司)培养在含链霉素和青霉素各100 u·mL-1、10%胎牛血清的RPMI 1640培养基中, 37 ℃、5% CO2条件下培养, 每3~4天胰蛋白酶消化传代1次。
丹皮酚对SKOV3/DDP 细胞的耐药逆转作用取对数生长期的SKOV3/DDP和SKOV3细胞, 分别接种于xCELLigence RTCA S16实时无标记细胞分析系统专用E-Plate 16板, 每孔200 μL, 含7 000个细胞。加入不同浓度顺铂, 或丹皮酚联用不同浓度顺铂, 并设空白对照。加药后, RTCA S16分析系统置于37 ℃、5% CO2培养箱中, 通过iPad上的RTCA S16客户端实时监测细胞存活情况, 以细胞指数(cell index)表示, 计算半数抑制浓度(median inhibitory concentration, IC50), SKOV3/DDP对顺铂的IC50除以SKOV3对顺铂的IC50得到耐药倍数(resistance fold)。
P-gp功能检测 取对数生长期的SKOV3/DDP细胞, 分为15、30、60 μmol·L-1丹皮酚组, 并设空白对照和阳性对照LY294002组。48 h后, 弃去培养基, PBS冲洗3遍, 胰酶消化制备细胞悬液0.5 mL, 加入终质量浓度为0.5 mg·L-1罗丹明123。继续在37 ℃孵育60 min, 离心弃上清, 冰PBS洗涤3次后, 重悬于0.5 mL冰PBS中, 立即采用流式细胞仪检测, BD FACS Diva软件分析罗丹明123的平均荧光强度(mean fluorescence intensity, MFI)。
荧光定量PCR检测MDR1、PTEN、MTDH mRNA表达 取对数生长期的SKOV3/DDP细胞, 接种于12孔板, 药物分组同上。37 ℃、5% CO2培养箱中孵育48 h后, 采用UNlQ-10柱式Trizol总RNA抽提试剂盒说明书提取总RNA, 采用cDNA合成试剂盒逆转录合成cDNA, 采用荧光定量PCR扩增各目的基因。扩增引物序列如表 1所示。逆转录条件为: 42 ℃逆转录60 min, 70 ℃灭活10 min。扩增条件为: 95 ℃预变性5 min; 95 ℃变性30 s, 60 ℃退火60 s, 72 ℃延伸1 min, 35个循环。以GAPDH为内参基因, 采用2-ΔΔCt法计算各药物处理组PTEN、MTDH和MDR1 mRNA相对于对照组表达量的变化, 其中ΔΔCt = (Ct目标基因-Ct内参基因)处理组-(Ct目标基因-Ct内参基因)对照组。
| Table 1 Primers for MDR1, PTEN, MTDH and GAPDH |
细胞免疫荧光检测P-gp、MTDH和PTEN蛋白表达 取对数生长期的SKOV3和SKOV3/DDP细胞, 接种于激光共聚焦专用20 mm培养皿, 每皿含1×105个细胞, 药物分组同上。37 ℃、5% CO2培养箱中孵育48 h后, 弃去培养基。PBS冲洗后, 4%多聚甲醛固定5 min, PBS洗3次。0.5% Triton X-100/PBS通透10 min, PBS洗3次。5%羊血清/PBS室温封闭1 h。按照说明书推荐比例加入P-gp、MTDH、PTEN蛋白一抗, 室温孵育1 h, 0.01% Triton X 100/PBS洗3次。加入与一抗对应的AF488或AF647荧光标记二抗, 室温孵育1 h, 0.01% Triton X 100/PBS洗3次。DAPI染核5 min, PBS洗涤后滴加适量抗荧光淬灭封片剂。在激光共聚焦显微镜下观察拍照, 并用蔡司Zen软件分析各组蛋白表达的MFI。
统计学分析 所有数据以x±s表示, 用GraphPad Prism 7软件对数据进行分析和作图, 两样本均数比较采用t检验, 多个样本均数比较采用单因素方差分析, 以P < 0.05为具有统计学显著性差异。
结果 1 丹皮酚逆转SKOV3/DDP细胞耐药的作用RTCA S16系统监测细胞存活情况显示, 丹皮酚作用于SKOV3/DDP和SKOV3细胞24 h, 未见明显细胞毒性; 作用48 h, 对SKOV3和SKOV3/DDP细胞的抑制率均小于10% (图 1A、B)。LY294002作用第48 h, 对SKOV3和SKOV3/DDP细胞的IC50分别为(13.50 ± 0.45)和(19.50 ± 0.31) μmol·L-1, LY294002对两种细胞的杀伤作用均强于丹皮酚。15 μmol·L-1丹皮酚和10 μmol·L-1 LY294002联合顺铂后, SKOV3/ DDP细胞对顺铂的耐药倍数分别下降至1.15和1.22倍, 如表 2和图 1C、D所示。
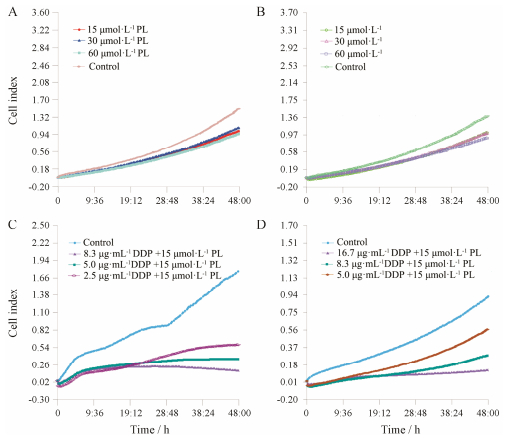
|
Figure 1 Cell viabilities were measured and monitored by xCELLigence RTCA SF16 after treatment with different concentrations of PL alone or combined with different concentrations of DDP. A: SKOV3 cells treated with different concentrations of PL; B: SKOV3/DDP cells treated with different concentrations of PL; C: SKOV3 cells treated with 15 μmol·L-1 PL plus different concentrations of DDP; D: SKOV3/DDP cells treated with 15 μmol·L-1 PL plus different concentrations of DDP |
| Table 2 Cytotoxicity of cisplatin (DDP) alone and in combination with paeonol (PL) or LY294002 in SKOV3 and SKOV3/ DDP cells. n = 3, x±s. *P < 0.05 vs the indicated group in SKOV3 cells; △P < 0.05 vs SKOV3/DDP treated with DDP |
流式细胞术检测发现, 丹皮酚作用SKOV3/DDP细胞48 h后, 细胞内罗丹明123的荧光强度随着丹皮酚的浓度增高而增强, 表明P-gp功能受到抑制。PI3K通路抑制剂LY294002抑制P-gp功能作用强于15 μmol·L-1丹皮酚组, 弱于30和60 μmol·L-1丹皮酚组。经统计学分析, 各组之间差异具有显著性(P < 0.01、P < 0.05) (图 2)。
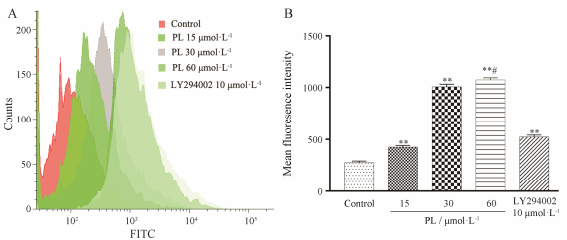
|
Figure 2 P-gp function changes after SKOV3/DDP cells-treated with different concentrations of PL. A: Flow cytometry analysis results; B: Statistical analysis results for the changes of MFI. **P < 0.01 vs control group; #P < 0.05 vs 30μmol·L-1 PL group |
丹皮酚作用细胞48 h后, 细胞内PTEN mRNA表达随着丹皮酚浓度增高而增高, LY294002诱导PTEN mRNA表达的作用强于丹皮酚, 各组之间差异具有显著性(P < 0.01)。细胞内MTDH和MDR1 mRNA表达随着丹皮酚浓度增高而明显受到抑制, 其他各组与15 μmol·L-1 PL相比均具有显著性差异(P < 0.01)。LY294002和60μmol·L-1丹皮酚均几乎完全抑制了MTDH mRNA表达, 但两组之间无显著性差异(P > 0.05), 表明二者对MTDH mRNA的抑制作用相当(图 3)。
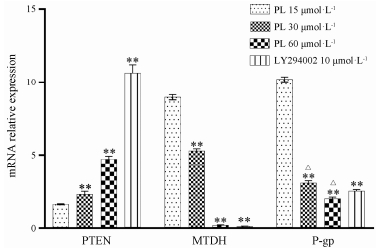
|
Figure 3 The relative expression changes of PTEN, MTDH and MDR1 mRNA in SKOV3/DDP cells after treatment with different concentrations of PL. **P < 0.01 vs 15 μmol·L-1 PL group; △P < 0.05 vs 10 μmol·L-1 LY294002 group |
激光共聚焦显微镜检测发现, 随着丹皮酚浓度增加, P-gp和MTDH蛋白MFI值逐渐下降, PTEN蛋白MFI值逐渐增加。表明丹皮酚可抑制P-gp和MTDH蛋白表达, 诱导PTEN蛋白表达, 与对照组相比, 差异具有显著性(P < 0.01, P < 0.05)。LY294002对MTDH的抑制作用和对PTEN的诱导作用与15 μmol·L-1丹皮酚组相当, LY294002对P-gp的抑制作用与60 μmol·L-1丹皮酚组相当, 组间无显著性差异(P > 0.05)。如图 4所示。
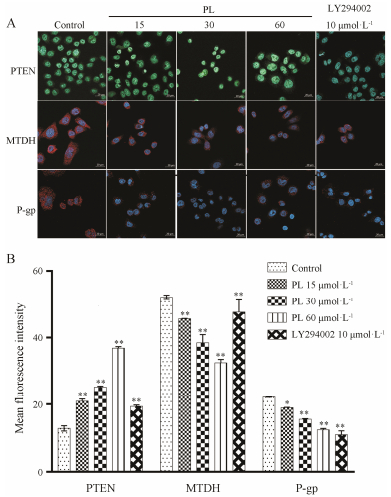
|
Figure 4 The protein expression changes of PTEN, MTDH and P-gp in SKOV3/DDP cells after treatment with different concentrations of PL (400 × magnification). A: Confocal laser scanning microscopy analysis results; B: Statistical analysis results for the changes of MFI. *P < 0.05, **P < 0.01 vs control group |
MDR的分子机制十分复杂, 包括靶基因突变与扩增、DNA损伤修复能力改变、抗凋亡因子(如NF-κB等)表达增强、外排转运蛋白(如P-gp)过度表达等。Xu等[13]通过检索已发表的有关卵巢癌耐药的文献并进行meta分析后发现, P-gp高表达是卵巢癌对铂类为基础的化疗方案耐药的重要原因。研究表明, MTDH在卵巢癌铂类化疗耐药患者肿瘤组织中的表达往往高于卵巢癌化疗敏感患者, 是一个预测化疗耐药的生物标志物[14], 而抑制MTDH可以增加肿瘤细胞对顺铂的敏感性[15]。另外, MTDH可通过激活PI3K/AKT通路而增加MDR1的表达, 引起肿瘤MDR[5]。PTEN表达下调同样可激活P13K/AKT, 进而诱导其下游基因MDR1等的表达, 引起化疗耐药[16]。因此, MTDH和PTEN的异常表达可能是卵巢癌化疗过程中P-gp高表达, 进而导致MDR的重要原因。
自从MDR现象发现以来, 开发逆转MDR的药物一直是研究人员的目标。早期的化学合成MDR逆转剂多因其潜在的毒性或在临床试验中并不具有明显MDR逆转作用而终止了研究, 而作用靶点单一可能是其疗效不明显的原因之一。因此, 研究人员开始从包括中药在内的天然产物中寻找MDR逆转剂, 天然来源的MDR逆转剂通常具有毒性较低、多靶点、人体耐受性良好等特点[17]。丹皮酚作为牡丹皮和芍药等中药的主要活性成分, 具有抗肿瘤、保护血管和保护神经元等多种药理活性[18, 19], 对NF-κB、STAT3和Wnt/β-catenin等信号通路均有抑制作用[9, 10], 是一种潜在的具有多靶点作用的天然成分。本课题组前期研究发现, 以牡丹皮和芍药组方的桂枝茯苓丸可通过抑制PI3K/AKT通路逆转卵巢癌MDR[20], 本课题对丹皮酚逆转卵巢癌MDR的作用和机制进行研究, 可在一定程度上为桂枝茯苓丸逆转MDR进一步提供实验基础。
本研究采用RTCA S16实时无标记细胞分析系统检测细胞毒性, 除了研究药物, 无需加入其他试剂, 避免了其他试剂对细胞的影响。因此, 与CCK-8等细胞毒性分析方法相比具有一定优势[21]。RTCA S16实时无标记细胞分析系统的检测原理是利用贴壁细胞贴壁后, 专用培养板上的电阻会发生改变, 从而可以灵敏地实时监测细胞生长情况。因此, 该方法并不适用于悬浮细胞。另外, 该方法需专用仪器和培养板, 前期投入高, 导致检测成本增加。通过RTCA S16系统分析发现, 丹皮酚在极低细胞毒性剂量下联用顺铂, SKOV3/DDP对顺铂的耐药倍数从4.57倍, 降为1.34倍, 表明丹皮酚具有逆转卵巢癌化疗耐药的作用。LY294002是PI3K通路抑制剂, 已知具有抑制MTDH和P-gp表达及P-gp功能的作用[22, 23], 并可诱导PTEN表达[24], 在本研究中作为阳性对照。RTCA S16系统检测显示, LY294002逆转耐药作用稍强于15 μmol·L-1丹皮酚。LY294002对多种肿瘤均有较强的杀伤作用, 但因可引起毒性和成药性差, 导致其未能进入临床试验阶段[25]。
罗丹明123具有细胞毒性低、可特异性结合P-gp的特点, 广泛用于对P-gp功能进行检测[20, 23, 26]。P-gp功能检测发现, 丹皮酚可浓度依赖性地抑制P-gp功能。荧光定量PCR和细胞免疫荧光检测证实, 随着丹皮酚浓度增加, 其在基因和蛋白水平, 对MDR1/ P-gp和MTDH的抑制作用以及对PTEN的诱导作用均逐渐增强。LY294002对PTEN mRNA的诱导作用强于60 μmol·L-1丹皮酚组, 而其对PTEN蛋白的诱导作用仅与15 μmol·L-1丹皮酚组相当。与此相似, LY294002与60 μmol·L-1丹皮酚均几乎完全抑制了MTDH mRNA的表达, 但LY294002对MTDH蛋白的抑制作用仅与15 μmol·L-1丹皮酚相当, 说明可能还有其他机制参与丹皮酚对MTDH和PTEN蛋白的调控。有研究表明, microRNA 214表达增高可抑制PTEN表达, 进而活化磷酸化蛋白激酶B[27], 导致卵巢癌转移和耐药。
综上, 丹皮酚对SKOV3/DDP细胞具有逆转耐药作用, 其机制可能与抑制P-gp蛋白功能及MDR1/ P-gp和MTDH表达, 诱导PTEN表达有关。本研究为丹皮酚作为MDR逆转剂应用于卵巢癌MDR治疗提供了理论基础。然而, 丹皮酚逆转MDR的其他潜在调控机制仍有待深入研究。
| [1] | Allemani C, Matsuda T, di Carlo V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391: 1023–1075. DOI:10.1016/S0140-6736(17)33326-3 |
| [2] | NCCN Guidelines Version 5. 2017: Epithelial ovarian cancer/ fallopian tube cancer/primary peritoneal cancer & less common histopathologies[EB/OL]. Washington: National Comprehensive Cancer Network, 2018[2018-02-02]. https: //www.nccn.org/professionals/physician_gls/pdf/ovarian.pdf. |
| [3] | Sarkar D, Fisher PB. AEG-1/MTDH/LYRIC: Clinical Significance[M]. Oxford: Academic Press, 2013: 39-74. |
| [4] | Zhu GC, Yu CY, She L, et al. Metadherin regulation of vascular endothelial growth factor expression is dependent upon the PI3K/AKT pathway in squamous cell carcinoma of the head and neck[J]. Medicine (Baltimore), 2015, 94: e502. DOI:10.1097/MD.0000000000000502 |
| [5] | Burris HA. Overcoming acquired resistance to anticancer therapy: focus on the PI3K/AKT/mTOR pathway[J]. Cancer Chemother Pharmacol, 2013, 71: 829–842. DOI:10.1007/s00280-012-2043-3 |
| [6] | Du C, Yi X, Liu W, et al. MTDH mediates trastuzumab resistance in HER2 positive breast cancer by decreasing PTEN expression through an NFκB-dependent pathway[J]. BMC Cancer, 2014, 14: 869. DOI:10.1186/1471-2407-14-869 |
| [7] | Weberpals JI, Amin MS, Chen BE, et al. First application of the automated quantitative analysis (AQUA) technique to quantify PTEN protein expression in ovarian cancer: a correlative study of NCIC CTG OV.16[J]. Gynecol Oncol, 2016, 140: 486–493. DOI:10.1016/j.ygyno.2016.01.015 |
| [8] | Wang L, Wang C, Jin S, et al. Expression of NF-κB and PTEN in primary epithelial ovarian carcinoma and the correlation with chemoresistance[J]. Int J Clin Exp Pathol, 2015, 8: 10953–10963. |
| [9] | Zhang L, Tao L, Shi T, et al. Paeonol inhibits B16F10 melanoma metastasis in vitro and in vivo via disrupting proinflammatory cytokines-mediated NF-κB and STAT3 pathways[J]. IUBMB Life, 2015, 67: 778–788. DOI:10.1002/iub.1435 |
| [10] | Li QN, Wang LL, Tang JM, et al. Anticancer activity of paeonol on human ovarian cancer A2780 cells by inhibiting Wnt/β-catenin signal pathway[J]. J Chin Pract Diagn Ther, 2017, 31: 1062–1066. |
| [11] | Wang YH, Imai Y, Shiseki M, et al. Knockdown of the Wnt receptor Frizzled-1 (FZD1) reduces MDR1/P-glycoprotein expression in multidrug resistant leukemic cells and inhibits leukemic cell proliferation[J]. Leuk Res, 2018, 67: 99–108. DOI:10.1016/j.leukres.2018.01.020 |
| [12] | Cai J, Chen S, Zhang W, et al. Paeonol reverses paclitaxel resistance in human breast cancer cells by regulating the expression of transgelin 2[J]. Phytomedicine, 2014, 21: 984–991. DOI:10.1016/j.phymed.2014.02.012 |
| [13] | Xu L, Cai J, Yang Q, et al. Prognostic significance of several biomarkers in epithelial ovarian cancer: a meta-analysis of published studies[J]. J Cancer Res Clin Oncol, 2013, 139: 1257–1277. DOI:10.1007/s00432-013-1435-z |
| [14] | Li C, Li Y, Wang X, et al. Elevated expression of astrocyte elevated gene-1 (AEG-1) is correlated with cisplatin-based chemoresistance and shortened outcome in patients with stages Ⅲ-Ⅳ serous ovarian carcinoma[J]. Histopathology, 2012, 60: 953–963. DOI:10.1111/his.2012.60.issue-6 |
| [15] | Wei YB, Guo Q, Gao YL, et al. Repression of metadherin inhibits biological behavior of prostate cancer cells and enhances their sensitivity to cisplatin[J]. Mol Med Rep, 2015, 12: 226–232. DOI:10.3892/mmr.2015.3357 |
| [16] | Bartholomeusz C, Gonzalez-Angulo AM. Targeting the PI3K signaling pathway in cancer therapy[J]. Expert Opin Ther Targets, 2012, 16: 121–130. DOI:10.1517/14728222.2011.644788 |
| [17] | Karthikeyan S, Hoti SL. Development of fourth generation ABC inhibitors from natural products: a novel approach to overcome cancer multidrug resistance[J]. Anticancer Agents Med Chem, 2015, 15: 605–615. DOI:10.2174/1871520615666150113103439 |
| [18] | Liu YR, Chen JJ, Dai M. Paeonol protects rat vascular endothelial cells from ox-LDL-induced injury in vitro via downregulating microRNA-21 expression and TNF-α release[J]. Acta Pharmacol Sin, 2014, 35: 483–488. DOI:10.1038/aps.2013.190 |
| [19] | Chen YH, Lin PL, Hsu HY, et al. Action potential bursts in central snail neurons elicited by paeonol: roles of ionic currents[J]. Acta Pharmacol Sin, 2010, 31: 1553–1563. DOI:10.1038/aps.2010.156 |
| [20] | Han L, Guo X, Bian H, et al. Guizhi Fuling Wan, a traditional Chinese herbal formula, sensitizes cisplatin-resistant human ovarian cancer cells through inactivation of the PI3K/AKT/ mTOR pathway[J]. Evid Based Complement Alternat Med, 2016, 2016: 4651949. |
| [21] | Nemade H, Chaudhari U, Acharya A, et al. Cell death mechanisms of the anti-cancer drug etoposide on human cardiomyocytes isolated from pluripotent stem cells[J]. Arch Toxicol, 2018, 92: 1507–1524. DOI:10.1007/s00204-018-2170-7 |
| [22] | Ma J, Xie SL, Geng YJ, et al. In vitro regulation of hepatocellular carcinoma cell viability, apoptosis, invasion, and AEG-1 expression by LY294002[J]. Clin Res Hepatol Gastroenterol, 2014, 38: 73–80. DOI:10.1016/j.clinre.2013.06.012 |
| [23] | Satonaka H, Ishida K, Takai M, et al. (-)-Epigallocatechin-3- gallate down-regulates doxorubicin-induced overexpression of P-glycoprotein through the coordinate inhibition of PI3K/AKT and MEK/ERK signaling pathways[J]. Anticancer Res, 2017, 37: 6071–6077. |
| [24] | Dinesh P, Rasool M. Berberine inhibits IL-21/IL-21R mediated inflammatory proliferation of fibroblast-like synoviocytes through the attenuation of PI3K/AKT signaling pathway and ameliorates IL-21 mediated osteoclastogenesis[J]. Cytokine, 2018, 106: 54–66. DOI:10.1016/j.cyto.2018.03.005 |
| [25] | Zhao W, Qiu Y, Kong D. Class I phosphatidylinositol 3-kinase inhibitors for cancer therapy[J]. Acta Pharm Sin B, 2017, 7: 27–37. DOI:10.1016/j.apsb.2016.07.006 |
| [26] | Dei S, Coronnello M, Bartolucci G, et al. Design and synthesis of new potent N, N-bis(arylalkyl)piperazine derivatives as multidrug resistance (MDR) reversing agents[J]. Eur J Med Chem, 2018, 147: 7–20. DOI:10.1016/j.ejmech.2018.01.092 |
| [27] | Yin G, Chen R, Alvero AB, et al. TWISTing stemness, inflammation and proliferation of epithelial ovarian cancer cells through MIR199A2/214[J]. Oncogene, 2010, 29: 3545–3553. DOI:10.1038/onc.2010.111 |
 2018, Vol. 53
2018, Vol. 53


