2. 厦门医学院药学系, 福建 厦门 361023;
3. 厦门大学医学院, 福建 厦门 361105
2. Department of Pharmacy, Xiamen Medical College, Xiamen 361023, China;
3. Medical College, Xiamen University, Xiamen 361105, China
2型糖尿病(type 2 diabetes, T2DM)是一种由高糖长期、慢性作用引发的以胰岛素抵抗症状为主要特征并伴有多种并发症的代谢性疾病。随着社会老龄化的加剧和糖尿病人群的扩大, 糖尿病患者相关认知功能下降(diabetes-associated cognitive decline, DACD), 又称为糖尿病认知功能障碍或糖尿病脑病(diabetic encephalopathy, DE), 其病理改变主要包括认知功能障碍、脑信号传导异常、神经传递及突触可塑性减弱以及底层结构大脑的异常等[1]。糖尿病并发中枢系统病理损伤时释放大量炎症因子促使神经元细胞的损伤和凋亡, 加重了由脑信号传导异常而引发的认知功能障碍及缺血性脑卒中的风险[2]。糖尿病诱发的微血管病变所致的脑供血不足和脑萎缩症状等都是引起认知功能障碍的危险因素。近几年很多研究提出糖尿病状态下的高血糖及胰岛素抵抗是阿尔茨海默病发病的独立危险因素, 也有很多研究提出阿尔茨海默病可作为3型糖尿病进行研究[3], 但是对于糖尿病认知功能障碍的病理生理机制尚未阐明, 临床特效治疗手段和靶点药物仍然缺乏, 所以深入研究其病理机制, 寻找治疗糖尿病认知功能障碍的药物具有重要的临床和社会意义。
Z-十八碳-9-烯-丙磺酰胺(Z-9-octadecenyl-2- propanesulfonamide, N15), 为油酰乙醇胺(oleoylethanolamide, OEA)结构类似物(化学结构如图 1所示), 经过化学改造后其抗水解能力要强于OEA, 即增强了口服吸收效果。本课题组前期的研究显示, N15通过激活PPARα/γ双靶点改善2型糖尿病的胰岛素抵抗和糖异生[4]。研究表明, 在兴奋性脑损伤如脑外伤后, 脑内的神经元释放OEA, 且发挥明显的神经保护作用, 其机制可能部分与其抑制谷氨酸能神经递质的释放有关[5], 这提示OEA具有应激性神经保护功能, 先前的研究结果表明OEA对急慢性脑缺血损伤均具有保护作用[6]。本课题组的研究结果发现, N15可显著改善小鼠脑卒中后的神经功能、减小脑梗死体积、减轻脑水肿和血脑屏障破坏程度[7]; 显著降低脑卒中后的海马小胶质细胞以及体外单核细胞内TNF-α、IL-1β和IL-6等炎症因子mRNA和蛋白的表达[7, 8]。而T2DM后神经元及胶质细胞内TNF-α、IL-1β和IL-6表达量的增加与DE的发生发展具有重要的关联作用[9]。综上研究结果表明, N15具有明显的抗炎作用和抗糖尿病作用, 但N15对DE是否具有改善作用以及改善机制尚不明确, 因此本文旨在对新化合物N15对T2DM诱发DE后认知障碍的影响及作用机制进行探索。

|
Figure 1 The structure of oleoylethanolamid (OEA) and N-(Z)-9-octadecenyl-2-propanesulfonamide (N15) |
药品与试剂 N15由本实验室自行合成; 链脲佐菌素(streptozotocin, STZ)、柠檬酸和柠檬酸钠购自美国Sigma公司; 高脂高糖饲料购自北京维通利华有限公司; 荧光定量PCR试剂盒(美国Promega生物技术有限公司); 葡萄糖、乳酸试剂盒购自南京建成公司。
动物实验 40只SPF级雄性KM小鼠[25 g, 合格证号为SCXK (京) 2016-0027]和40只SPF级雄性C57BL/6小鼠[25 g, 合格证号为SCXK (京) 2016-0041]购自北京维通利华实验动物技术有限公司。啮齿类动物常规饲料, 自由饮水, 室温20~24 ℃, 12 h明暗循环环境下适应性喂养1周后禁食不禁水12 h。KM小鼠随机选取10只设为对照组, 其余30只腹腔注射60 mg·kg-1 STZ (临用前溶解于0.1 mol·L-1、pH 4.2的柠檬酸-柠檬酸钠缓冲溶液, 现配现用, 置于冰上), 连续注射3天。C57BL/6小鼠随机选取10只设为对照组, 其余30只给予高脂高糖(30%脂肪、20%糖、15%蛋白质、2.5%胆固醇、1%胆酸钠和31.5%碳水化合物)饲料喂养6周后禁食不禁水12 h腹腔注射40 mg·kg-1 STZ (配置方法同上)。两种小鼠经过以上处理后, 禁食12 h尾尖取血检测小鼠空腹血糖, 血糖浓度≥11.1 mmol·L-1即为2型糖尿病模型造模成功, 选取血糖浓度11.1~20.0 mmol·L-1为实验组, 对照组给予pH 4.2的柠檬酸-柠檬酸钠缓冲溶液腹腔注射。将所选实验组小鼠随机分成3组, 即模型组、N15低、高剂量组。对照组和模型组给予生理盐水0.2 mL·kg-1灌胃处理, N15低、高剂量组分别给予N15 50和100 mg·kg-1灌胃处理, 每日1次。于给药第6周, KM小鼠进行跳台和避暗实验, C57BL/6小鼠进行Morris水迷宫实验。
跳台实验 实验前先将小鼠放入跳台中适应10 min, 通电36 V, 小鼠受电击会跳上平台躲避电击, 间隔一段时间再次跳下, 训练时间5 min。24 h后重测, 在通电情况下先将小鼠放在平台上, 记录潜伏期和跳下次数。
避暗实验 实验前先将小鼠放入避暗仪反应箱中适应10 min, 通电36 V, 小鼠受电击会逃到明室躲避电击, 间隔一段时间再次钻进暗室, 训练时间5 min。24 h后重测, 在通电情况下先将小鼠放在明室内, 记录潜伏期和跳下次数。
Morris水迷宫实验定位航行实验 迷宫水温(23 ± 2) ℃, 水深淹没平台, 水中加入牛奶遮掩住气味和老鼠的视野, 小鼠适应环境1天后, 训练第1天将小鼠面朝水池壁放入水迷宫中, 记录小鼠找到平台的时间(潜伏期), 如1 min内仍未游出潜伏期则以60 s计算, 小鼠在平台上停留需≥10 s, 如此反复训练小鼠4次(每象限1次), 取平均潜伏期进行统计, 如此连续测试5天, 考察各组小鼠的学习记忆能力。
空间探索实验 第5天撤去平台, 将小鼠从平台象限对侧入水点放入, 对每只小鼠60 s内穿越原平台的次数(crossing times)、原平台区域游泳时间(time in target)和距离(distance in target)、原平台象限游泳时间(time in target quadrant)和距离(distance in target quadrant)进行记录分析。
海马葡萄糖、乳酸含量测试 水迷宫实验后, 各组小鼠断头取脑, 冰上剥离双侧海马组织, 用预冷PBS冲洗后, 按照说明书操作, 检测海马组织内葡萄糖和乳酸含量。
Real time PCR法检测 水迷宫实验后, 各组小鼠断头取脑, 冰水剥离双侧海马组织加入Trizol匀浆, 完全裂解组织后加入氯仿200 μL振荡, 离心10 min弃去上清, 预冷的75%乙醇清洗沉淀, 离心5 min弃上清。沉淀晾干后RNase free water溶解RNA沉淀。逆转录体系, PCR反应体系扩增条件: 94 ℃变性45 s, 退火45 s, 周期为40个循环, 最后72 ℃延伸45 s。内参为GAPDH, 引物序列见表 1。Real time PCR定量分析基因表达水平:按照荧光定量PCR检测试剂盒(Taq Man® 2×Universal PCR Master Mix, No Amp Erase® UNGb)的说明进行实验, 整个操作在冰上进行, 注意避光。PCR结束后得到扩增曲线和Ct值, ΔΔCt = (Ct目的基因 - Ct管家基因)实验组 - (Ct目的基因 - Ct管家基因)对照组, 基因差异表达水平用2-ΔΔCt方法计算。
| Table 1 Primer sequences used for qPCR. GAP-43: Growth associated protein-43; SYN: Synaptophysin; BDNF: Brain derived neurotrophic factor; NT-3: Neurotrophins-3 |
统计学方法 采用Graphpad Prism 5软件进行分析, 实验结果以(mean ± SEM)表示, 多组间比较采用one way-ANOVA, 以P < 0.05为差异具有统计学意义。
3 结果 1 N15可明显改善2型糖尿病认知功能障碍小鼠学习记忆能力 1.1 跳台实验由图 2A、B可知, 与对照组相比, 模型组小鼠在跳台上的潜伏期明显减少(P < 0.01), 且错误次数明显增多(P < 0.05);与模型组相比, 在给予50和100 mg·kg-1 N15后, 小鼠在跳台上的潜伏期明显增加(P < 0.05, P < 0.01), 错误次数明显减少(P < 0.05, P < 0.01)。
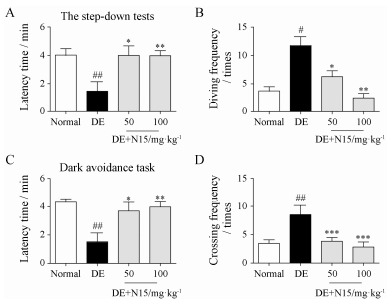
|
Figure 2 Effect of N15 on escaping reaction acquisition in step-down test and dark avoidance task of the streptozotocin (STZ)-induced diabetic encephalopathy (DE) model mice. DE mice were treated with saline or N15 at doses of 50 or 100 mg·kg-1 once a day for 6 weeks. The step-down test and dark avoidance task was measured at the 6th week. A: The latency time of step-down tests; B: The diving times of step-down tests; C: The latency time of dark avoidance task; D: The diving times of dark avoidance task. Mean ± SEM, n = 10. #P < 0.05, ##P < 0.01 vs normal group; *P < 0.05, **P < 0.01, ***P < 0.001 vs DE group |
由图 2C、D可知, 与正常组相比, 模型组小鼠的潜伏期明显减少(P < 0.01), 且错误次数明显增多(P < 0.01);与模型组相比, 在给予50和100 mg·kg-1 N15后, 小鼠在明室内的潜伏期明显增加(P < 0.05, P < 0.01), 错误次数明显减少(P < 0.001)。
1.3 水迷宫实验由图 3所示, 随着测试天数的增加, 各组小鼠的潜伏期均有缩短, 相比对照组, 模型组小鼠于训练第4和第5天出现显著差异(P < 0.01);与模型组相比, 在给予50和100 mg·kg-1 N15后, 小鼠寻找平台的潜伏期明显缩短(P < 0.05, P < 0.01), 说明N15可明显提高2型糖尿病的学习能力。空间探索实验结果显示, 与对照组相比, 模型组小鼠穿越平台的次数明显减少(P < 0.05), 在目标象限以及目标区域所停留时间及游泳距离也明显减少(P < 0.05, P < 0.01);与模型组相比, 在给予50和100 mg·kg-1 N15后, 小鼠穿越平台的次数明显增加(P < 0.05, P < 0.01), 在目标所在象限以及目标区域停留的时间及游泳距离也明显增加(P < 0.05, P < 0.01), 说明N15可明显提高2型糖尿病的记忆能力。
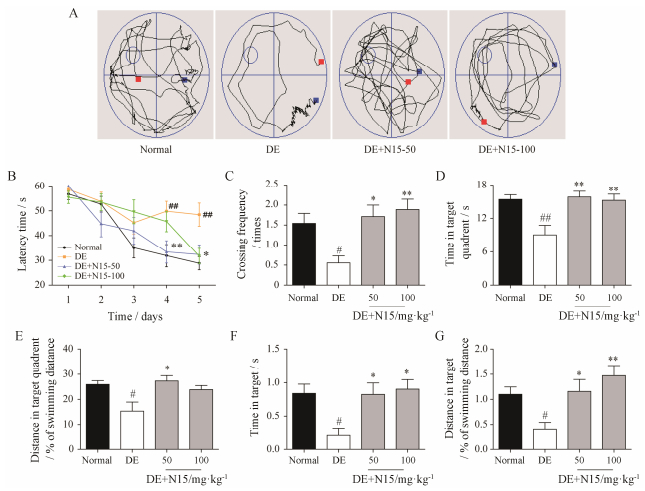
|
Figure 3 Beneficial effects of N15 on learning and memory in HFD+STZ-induced DE model mice. DE mice were treated with saline or N15 at doses of 50 or 100 mg·kg-1 once a day for 6 weeks. The Morris water maze was measured at the 6th week. A: Representative path traces in each quadrant during the probe trail; B: The escape latency during acquisition training; C: The crossing times in the hidden platform trails; D: The time spent in the target quadrant; E: The distance spent in the target quadrant; F: The time spent in the target; G: the distance spent in the target. Mean ± SEM, n = 10. #P < 0.05, ##P < 0.01 vs normal group; *P < 0.05, **P < 0.01 vs DE group |
由图 4可知, 与对照组相比, 模型组小鼠海马内葡萄糖和乳酸含量明显增加(P < 0.001), 给予100 mg·kg-1 N15治疗后, 小鼠海马内葡萄糖和乳酸含量明显降低(P < 0.05, P < 0.01), 即N15改善高糖和高乳酸对海马区域神经元的损伤。
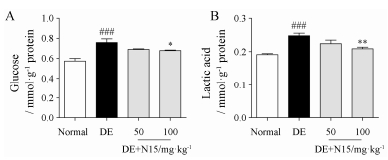
|
Figure 4 Effect of N15 on the level of glucose and lactic acid in hippocampus of HFD+STZ-induced DE model mice. DE mice were treated with saline or N15 at doses of 50 or 100 mg·kg-1 once a day for 6 weeks. The level of glucose (A) and lactic acid (B) were measured at the 6th week. Mean ± SEM, n = 10. ###P < 0.001 vs normal group; *P < 0.05, **P < 0.01 vs DE group |
通过real time-PCR对小鼠海马内突触成长相关蛋白-43 (GAP-43)、突触素(SYN)、脑源性生长因子(BDNF)和神经营养因子-3 (NT-3) mRNA表达量进行测定。如图 5所示, 与对照组相比, 模型组小鼠海马内GAP-43、SYN、BDNF、NT-3 mRNA表达量均明显降低(P < 0.01, P < 0.001), 给予50 mg·kg-1 N15治疗后, 小鼠海马内GAP-43、SYN、BDNF和NT-3 mRNA明显增加(P < 0.05, P < 0.01, P < 0.001);在给予100 mg·kg-1 N15治疗后, 小鼠海马内GAP-43、SYN、NT-3 mRNA明显增加(P < 0.01, P < 0.001), 说明N15可提高2型糖尿病海马内神经营养因子GAP-43、SYN、BDNF、NT-3的表达。
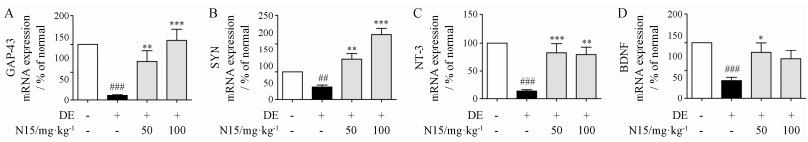
|
Figure 5 Effect of N15 on the mRNA expression of GAP-43, SYN, BDNF and NT-3 in hippocampus of HFD+STZ-induced DE model mice. DE mice were treated with saline or N15 at doses of 50 or 100 mg·kg-1 once a day for 6 weeks. The values are expressed as percentages compared with the normal group (set to 100%). Mean ± SEM, n = 10. ##P < 0.01, ###P < 0.001 vs normal group; *P < 0.05, **P < 0.01, ***P < 0.001 vs DE group |
糖尿病认知功能障碍是一种以认知功能障碍为主要特点的神经退行性疾病, 大量流行病学研究显示, 慢性高血糖是认知功能障碍和痴呆发病的重要独立危险因素[10], 糖尿病患者发生认知功能障碍的风险是同龄非糖尿病患者的3倍[11]。海马对血糖浓度的变化非常敏感, 高血糖时神经元会选择性坏死[12], 而反复低血糖也会导致海马萎缩[13]。目前对于糖尿病认知功能障碍发病机制主要集中于中枢神经细胞损伤和脑内受体胰岛素抵抗作用, 主要包括:高糖状态下线粒体功能障碍而导致细胞色素C释放激活了凋亡相关蛋白[14]; 醛糖还原酶活性增强使葡萄糖转化为山梨醇而引发高渗损伤[15]; 晚期糖基化终末产物堆积且与受体结合激发氧化应激反应后促发炎症反应[16]; β-淀粉样蛋白堆积构成老年斑核心成分[17]; Tau蛋白的过度磷酸化[18]。所以, 降低血糖含量和改善胰岛素抵抗等2型糖尿病的基础治疗同样可作为糖尿病认知功能障碍治疗的基础步骤, 在此基础上寻找具有提高学习记忆能力且发挥神经保护性靶点药物, 是糖尿病认知功能障碍药物研究的重要方向之一。
N15为内源性化合物OEA结构类似物, 为脂溶性化合物, 可通过血脑屏障。前期的研究结果已证实N15灌胃给药可降低小鼠急性期脑卒中损伤, 改善脑卒中慢性期认知功能障碍, 其机制可能与PPARα/γ双靶点相关[7], 间接说明N15能够在脑内发挥生物学效应。在本研究中, 主要利用小鼠跳台、避暗以及水迷宫实验对小鼠的联想记忆能力以及空间学习记忆能力进行测定。其中跳台和避暗实验是根据小鼠不喜欢平台但喜欢暗室的环境, 故逃离电栅受电击后被动回避性返回平台或明室, 这种被动回避可表现在小鼠受电击后不敢再跳下或逃离电栅或下一次错误跳下平台或返回明室的特点, 即应激刺激的学习性和遗忘性, 主要发生部位为大脑皮层[19]。实验结果显示, N15给药后T2DM小鼠的潜伏期明显增加, 错误次数明显减少, 说明N15治疗可以显著提高糖尿病脑病的联想学习记忆功能。Morris水迷宫实验的原理是利用小鼠厌恶停留在水中而想要及时找到平台停留, 主要考察的是空间学习记忆能力[20]。在本课题研究中, 定位航行训练期间, N15给药后小鼠寻找平台的潜伏期明显缩短; 空间探索实验中N15给药后, 小鼠穿越平台的次数明显增加, 在目标所在象限以及目标区域停留的时间及游泳距离也明显增加, 提示N15可以改善糖尿病脑病的空间学习记忆能力。上述结果显示N15对糖尿病动物两种不同学习记忆损伤类型均具有改善作用, 提示N15对糖尿病认知功能损伤具有改善作用。
海马是脑内学习记忆功能重要区域, 2型糖尿病脑内尤其是海马区域内高糖以及所致高乳酸状态可诱发神经毒性, 诱导神经元凋亡, 抑制其神经保护功能, 最终导致认知功能障碍以及学习记忆能力下降[21]。在本研究中, 对海马内葡萄糖和乳酸测试结果显示, DE小鼠海马内葡萄糖和乳酸浓度明显增加。N15治疗后可明显降低海马内葡萄糖含量和乳酸浓度, 减少海马内神经元活动, 提示N15可通过降低海马内葡萄糖及乳酸水平发挥神经保护功能。GAP-43是一种神经特异性轴突膜蛋白, 在神经元发育和再生过程中以高水平表达[21]。SYN作为另一种突触相关蛋白, 参与突触形成和神经细胞发育, 发挥神经保护功能[22]。GAP-43和SYN是突触可塑性的两个标志物, 且均与海马学习记忆功能正相关[23]。本研究显示N15可明显提高2型糖尿病海马内GAP-43和SYN表达水平, 与以往研究结果相似[24], 提示N15改善DE学习记忆功能可能与促进海马突触可塑性有关。神经营养因子是一类对神经元的发育、存活和凋亡起重要作用的蛋白质, 其成员包括神经生长因子、BDNF、NT-3和神经营养因子4 (NT-4)等[3], 本实验对BDFN和NT-3进行了检测, 结果显示N15可明显提高DE海马内神经营养因子BDNF和NT-3的表达。以往的研究表明, 2型糖尿病鼠皮层及海马内突触可塑性相关蛋白和神经营养因子表达均明显减少[25], 这与本研究的结果相似, 进一步说明DE学习记忆能力衰退与突触可塑性和神经营养因子密不可分。此外, 前期研究结果显示, N15为一种新型PPARα/γ激动剂, 并分别通过PPARα和PPARγ靶点发挥脂代谢和糖代谢的调节作用, 具有治疗2型糖尿病胰岛素抵抗的功效[4], 而其是否可通过PPARα和PPARγ靶点发挥糖尿病认知功能障碍保护作用还需要进一步探讨。
综上所述, 新型化合物N15是一种具有治疗糖尿病认知功能障碍, 提高学习记忆功能的新型化合物, 在发挥改善糖脂代谢和胰岛素抵抗的同时对糖尿病认知功能障碍也具有治疗作用, 具有临床应用的潜在价值。
| [1] | Bogush M, Heldt NA, Persidsky Y. Blood brain barrier injury in diabetes: unrecognized effects on brain and cognition[J]. J Neuroimmune Pharmacol, 2017, 12: 593–601. DOI:10.1007/s11481-017-9752-7 |
| [2] | Duarte AI, Santos MS, Oliveira CR, et al. Brain insulin signalling, glucose metabolism and females' reproductive aging: a dangerous triad in Alzheimer's disease[J]. Neuro pharmacology, 2018. DOI:10.1016/j.neuropharm.2018.01.044 |
| [3] | Bennett AC, Van Camp A, Lopez V, et al. Sceletium tortuosum may delay chronic disease progression via alkaloid-dependent antioxidant or anti-inflammatory action[J]. J Physiol Biochem, 2018. DOI:10.1007/s13105-018-0620-6 |
| [4] | Ren T, Yang WS, Lin Y, et al. A novel PPARα/γ agonist, propane-2-sulfonic acid octadec-9-enyl-amide, ameliorates insulin resistance and gluconeogenesis in vivo and vitro[J]. Eur J Pharmacol, 2018, 826: 1–8. DOI:10.1016/j.ejphar.2018.02.029 |
| [5] | Sihag J, Jones PJH. Oleoylethanolamide: the role of a bioac tive lipid amide in modulating eating behaviour[J]. Obes Rev, 2018, 19: 178–197. DOI:10.1111/obr.v19.2 |
| [6] | Yang LC, Guo H, Zhou H, et al. Chronic oleoylethanolamide treatment improves spatial cognitive deficits through enhancing hippocampal neurogenesis after transient focal cerebral ischemia[J]. Biochem Pharmacol, 2015, 94: 270–281. DOI:10.1016/j.bcp.2015.02.012 |
| [7] | Li Y, Xu L, Zeng K, et al. Propane-2-sulfonic acid octadec-9-enyl-amide, a novel PPARalpha/gamma dual agonist, protects against ischemia-induced brain damage in mice by inhibiting inflammatory responses[J]. Brain Behav Immun, 2017, 66: 289–301. DOI:10.1016/j.bbi.2017.07.015 |
| [8] | Zhao Y, Yan L, Luo XM, et al. A novel PPARalpha agonist propane-2-sulfonic acid octadec-9-enyl-amide inhibits inflame mation in THP-1 cells[J]. Eur J Pharmacol, 2016, 788: 104–112. DOI:10.1016/j.ejphar.2016.06.026 |
| [9] | Zhou X, Zhang F, Hu X, et al. Inhibition of inflammation by astaxanthin alleviates cognition deficits in diabetic mice[J]. Physiol Behav, 2015, 151: 412–420. DOI:10.1016/j.physbeh.2015.08.015 |
| [10] | Bartsch T, Dohring J, Reuter S, et al. Selective neuronal vulnerability of human hippocampal CA1 neurons: lesion evolution, temporal course, and pattern of hippocampal damage in diffusion-weighted MR imaging[J]. J Cereb Blood Flow Metab, 2015, 35: 1836–1845. DOI:10.1038/jcbfm.2015.137 |
| [11] | Paul KC, Jerrett M, Ritz B. Type 2 diabetes mellitus and Alzheimer's disease: overlapping biologic mechanisms and environmental risk factors[J]. Curr Environ Health Rep, 2018, 5: 44–58. |
| [12] | Gonzalez-Reyes RE, Aliev G, Avila-Rodrigues M, et al. Alterations in glucose metabolism on cognition: a possible link between diabetes and dementia[J]. Curr Pharm Des, 2016, 22: 812–818. DOI:10.2174/1381612822666151209152013 |
| [13] | Prasad S, Sajja RK, Naik P, et al. Diabetes mellitus and blood-brain barrier dysfunction: an overview[J]. J Pharma covigil, 2014, 2: 125. |
| [14] | Rogers NH, Walsh H, Alvarez-Garcia O, et al. Metabolic benefit of chronic caloric restriction and activation of hypo thalamic AGRP/NPY neurons in male mice is independent of ghrelin[J]. Endocrinology, 2016, 157: 1430–1442. DOI:10.1210/en.2015-1745 |
| [15] | Bahmani F, Bathaie SZ, Aldavood SJ, et al. Glycine therapy inhibits the progression of cataract in streptozotocin-induced diabetic rats[J]. Mol Vis, 2012, 18: 439–448. |
| [16] | Endo M. Effects of vanadate on glucose metabolism of the streptozotocin-diabetic rat lens[J]. Nippon Ganka Gakkai Zasshi, 1993, 97: 333–339. |
| [17] | Pintana H, Apaijai N, Kerdphoo S, et al. Hyperglycemia induced the Alzheimer's proteins and promoted loss of synaptic proteins in advanced-age female Goto-Kakizaki (GK) rats[J]. Neurosci Lett, 2017, 655: 41–45. DOI:10.1016/j.neulet.2017.06.041 |
| [18] | Sciacca MFM, Tempra C, Scollo F, et al. Amyloid growth and membrane damage: current themes and emerging perspec tives from theory and experiments on Abeta and hIAPP[J]. Biochim Biophys Acta, 2018. DOI:10.1016/j.bbamem.2018.02.022 |
| [19] | Tucker LB, Velosky AG, McCabe JT. Applications of the Morris water maze in translational traumatic brain injury research[J]. Neurosci Biobehav Rev, 2018, 88: 187–200. DOI:10.1016/j.neubiorev.2018.03.010 |
| [20] | Brandewiede J, Schachner M, Morellini F. Ethological analysis of the senescence-accelerated P/8 mouse[J]. Behav Brain Res, 2005, 158: 109–121. DOI:10.1016/j.bbr.2004.08.012 |
| [21] | Kandimalla R, Manczak M, Fry D, et al. Reduced dynaminrelated protein 1 protects against phosphorylated Tau-induced mitochondrial dysfunction and synaptic damage in Alzheimer's disease[J]. Human Mol Genet, 2016, 25: 4881–4897. |
| [22] | Long ZM, Zhao L, Jiang R, et al. Valproic acid modifies synaptic structure and accelerates neurite outgrowth via the glycogen synthase kinase-3beta signaling pathway in an Alzheimer's disease model[J]. CNS Neurosci Ther, 2015, 21: 887–897. DOI:10.1111/cns.2015.21.issue-11 |
| [23] | Levesque L, Annaert W, Craessaerts K, et al. Developmental expression of wild-type and mutant presenilin-1 in hippocampal neurons from transgenic mice: evidence for novel species-specific properties of human presenilin-1[J]. Mol Med, 1999, 5: 542–554. DOI:10.1007/BF03401981 |
| [24] | Abdelwahed OM, Tork OM, Gamal El Din MM, et al. Effect of glucagon-like peptide-1 analogue; exendin-4, on cognitive functions in type 2 diabetes mellitus; possible modulation of brain derived neurotrophic factor and brain visfatin[J]. Brain Res Bull, 2018, 139: 67–80. DOI:10.1016/j.brainresbull.2018.02.002 |
| [25] | Tian X, Liu Y, Ren G, et al. Resveratrol limits diabetes-associated cognitive decline in rats by preventing oxidative stress and inflammation and modulating hippocampal structural synaptic plasticity[J]. Brain Res, 2016, 1650: 1–9. DOI:10.1016/j.brainres.2016.08.032 |
 2018, Vol. 53
2018, Vol. 53


