金纳米簇(gold nanoclusters, AuNCs)是尺寸与电子费米波长相当, 粒径一般小于2 nm (不包含外壳保护层)或组成金原子数小于150的金纳米结构[1, 2]。当尺寸小于2 nm时, 金纳米簇将表现出既不同于大块金属又不同于其他大粒径金纳米粒(> 2 nm)的独特性质[3], 如具有离散的、类似分子的电子结构[4]、尺寸依赖的荧光性质[5]和高效的催化能力[6]等。基于上述独特的性质, 近年来金纳米簇在纳米科学和技术领域引起广泛的关注, 在纳米电子学、数据存储、分子成像、生物传感器、催化转化、纳米医学和光学器件制备等方面表现出广泛的运用前景[7, 8]。
在过去的几十年里, 各种合成技术已成功地应用于金纳米簇的制备。如光还原合成法、辐照法和惰性气体蒸发法等物理方法[9], 化学还原法、反相微乳法、模板合成法和配体蚀刻法等化学方法[10, 11], 以及超声波化学合成法、微波溶剂热合成法等综合方法[12]。与金纳米粒类似, 金纳米簇的制备方法主要包括“自下而上”和“自上而下”的两类, 如Brust-Schiffrin金种生长法[13]和金纳米粒配体诱导刻蚀法[14, 15]。然而, 制备具有均一和精确原子数的金纳米簇仍具有较大的难度, 已成为其研究和应用的瓶颈[16, 17]。众多研究结果表明, 由于强烈的量子限制效应, 每增加或减少1个金原子都会显著改变金纳米簇的结构, 结构的改变对金纳米簇光学、电学和催化性能具有重要影响[18]。例如, 具有不同原子数的AuNCs, 也即Au5、Au8、Au13、Au23和Au31, 在385、455、510、760和866 nm不同波长处发射出荧光[19]。因此, 开发简便和可控性强的合成方法, 在金纳米簇理化和生物学性质的精准调节和控制方面具有重要意义。此外, 由于小尺寸效应, “裸”的金纳米簇化学性质非常活跃, 需要使用化学合成分子或生物分子稳定和保护其表面, 避免纳米簇的聚集和表面活性的丧失[20]。对配体结构和性质的合理设计和调控, 可提升金纳米簇合成方法的精确度和可控性, 促进此类纳米簇结构在多学科研究和应用的发展。本文重点讨论基于不同配体保护的金纳米簇合成方法、配体结构对金纳米簇性质的调控作用, 以及具有精确原子数的金纳米簇在检测、催化、生物成像和药物递送方面的相关应用。
1 金纳米簇的制备方法在合适的保护分子(或称配体)存在下, 可合成具有精确原子数的金纳米簇[21]。这些纳米簇可以用明确的公式AunLm来表示(其中L表示配体, n为金原子数, m为配体数), 类似于有明确结构的有机金化合物[22, 23]。目前使用的金纳米簇合成配体主要包括两类, 生物分子和合成分子, 它们各自具有其优势和缺点。采用生物分子作为配体合成的金纳米簇具有良好的生物相容性, 反应条件温和, 可精确控制几类金纳米簇的原子数组成。然而, 生物分子的结构相对复杂, 可调控性差。如何对生物分子的结构进行改造, 用以连续地调控金纳米簇的原子个数仍是此类配体目前面临的一个主要问题。有机合成分子的生物相容性较生物分子差, 纳米簇合成的均一性需要进一步提升, 但其结构易于调控和改变, 为金纳米簇原子数调控的连续性提供了可能。本部分主要讨论这些常用配体保护的金纳米簇的制备方法, 以及配体分子在制备过程中发挥的相应作用。
1.1 蛋白质和DNA稳定的金纳米簇蛋白质和DNA等生物分子具有不同的亲、疏水区域和空腔, 可以用作理想的合成模板, 调控金纳米簇的合成[24, 25]。生物分子保护的金纳米簇具有良好的生物相容性, 以生物分子为模板合成纳米簇绿色环保, 在生物医药领域具有广泛应用潜力。
1.1.1 蛋白质蛋白质是组成生物体的重要成分。白蛋白是血浆中含量最丰富的蛋白质, 采用牛血清白蛋白(bovine serum albumin, BSA)作为合成模板, 在生理温度(37 ℃)和碱性条件下剧烈搅拌, 还原氯金酸(chlorchloric acid, HAuCl4)获得由25个金原子组成的金纳米簇BSA-Au25[26]。这一合成过程类似于自然界的生物矿化行为, 首先BSA吸附并捕获溶液中的金离子, 然后蛋白结构中的半胱氨酸和酪氨酸残基将金离子还原为金原子, 蛋白框架为纳米簇的形成提供了稳定的支架结构(图 1)[24]。也有研究发现采用载脂蛋白-α-乳白蛋白(apo-α-lactalbumin, Apo-α-LA)同样可以合成具有精确原子数的金纳米簇, 即含有10个金原子的纳米簇Apo-α-LA-Au10[27, 28]。此外, 还有多种蛋白被用作模板合成原子数精确的金纳米簇, 如以溶菌酶为模板制备的Au10[29]和以乳铁蛋白为模板制备的Au25[30]。在纳米簇生成过程中, 蛋白质中某些还原性氨基酸残基将氯金酸还原成金原子, 因此富含半胱氨酸和酪氨酸残基的蛋白质结构更有利于金原子的生成[31]。与此同时, 蛋白结构也会发生相应的改变。有研究发现采用BSA合成金纳米簇后, 蛋白分子中的酪氨酸残基会发生交联形成二酪氨酸结构, 从而在410 nm处呈现出强烈的蓝色荧光[32]。此外, 以蛋白质为模板合成的金纳米簇, 其组成原子数主要由蛋白质的结构决定, 与氨基酸种类和数目以及蛋白质内部空腔大小有关。然而, 目前还未有蛋白质空间结构与原子数之间直接定量关系的相关报道, 研究仍停留在选用不同蛋白质进行尝试的阶段。因此, 开展蛋白质空间结构对金纳米簇中原子数的调控研究将为该类材料的人为可控合成开辟一个新的增长点。
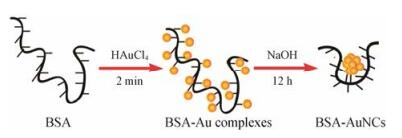
|
Figure 1 Schematic of the formation of gold nanoclusters (AuNCs) in bovine serum albumin (BSA) solution |
DNA与金属阳离子具有很强的亲和力[33], 可以作为纳米簇的合成模板, 通过控制DNA碱基的序列可实现纳米簇尺寸的调控。采用单链的DNA序列作为模板, 在pH为7的磷酸盐缓冲液中将DNA与氯金酸混合, 金离子络合于模板的碱基上。室温下平衡24 h后加入二甲胺硼烷溶液作为还原剂, 在室温下反应16 h, 过膜后得到金原子数为7个的金纳米簇DNA-Au7[34]。此外, 利用DNA上的碱基腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)、胞嘧啶(C)及DNA碱基对(如A-T、C-G)作为保护基, 可获得DNA-Au3的金纳米簇。此处, DNA碱基和Au3+的结合能力是金纳米簇合成的关键, 其中各碱基与Au3+结合力大小依次为A > C≥G > T, 换言之, DNA链中含有腺嘌呤越多越容易合成金纳米簇[35]。然而, 蛋白质和DNA的组成与金纳米簇含有的精确金原子个数之间的量化关系目前尚不清楚, 有待进行深入研究。与蛋白质相比, DNA碱基的序列和长度具有更高的可调控性, 为合成原子数均一、可控的金纳米簇提供可能, 但DNA作为具有特定功能的遗传物质, 其序列和结构的设计, 及其在生物学应用中可能引发的生物安全性问题, 还有待大样本数据的考察和检验。
1.2 巯基配体稳定的金纳米簇含巯基的配体与金原子具有结合强度接近于共价键的相互作用, 常用于金纳米粒的制备。采用巯基配体为稳定剂的金纳米簇可表示为Aun(SR)m[36]。在19世纪90年代中期, 有研究人员历时数十年合成了多种不同原子个数的金纳米簇混合物, 但颗粒很难分离成原子数精确的金纳米簇[37, 38]。之后随着电泳分离和电喷雾质谱的发展, 研究者从混合物中测定出一系列的巯基金纳米簇[39], 包括Au15(SR)13、Au18(SR)14、Au22(SR)16、Au22(SR)17、Au25(SR)18和Au29(SR)20等, 但是分离纯化过程仍繁琐复杂, 且分离产率低。近年来, 经过不断探索, 目前已合成出Au25(SR)18[40, 41]、Au38(SR)24[42, 43]、Au144(SR)60[44, 45]和Au28(SR)20[46, 47]等金纳米簇[48]。
在上述多种金纳米簇中, Au25(SR)18由于独特的结构、高度的稳定性和广泛的运用前景, 受到广泛的关注[49]。通过X射线晶体学分析和理论研究发现, Au25(SR)18可以作为以13个金原子组成的二十面体结构为核、由6个-SR-Au-SR-Au-SR-片段包裹作为外壳的立体结构[50, 51]。在利用谷胱甘肽(glutathione, GSH)和N-γ谷氨酰半胱氨酰甘氨酸作为封端剂的研究基础上[38], 通过配体交换反应, 在剧烈搅拌下, 将合成的Au11(PPh3)8加入GSH, 通过聚集解离可获得Au25(SR)18[52]。也有研究者发展了一种温和的、能动力学控制的合成方法[53]。这是一种两步合成法, Au3+首先被巯基还原为Au+, 随后加入的硼氢化钠(sodium borohydride, NaBH4)将Au+还原为Au25(SR)18, 大大提高了纳米簇的合成效率。此外, 采用“保护-脱保护”策略[21], 溴化十六烷基三甲基铵(cetyltrimethylammonium bromide, CTAB)与配体形成(CTA)+(COO)-离子对, 进而通过静电作用吸附在Au+-SR的表面, 形成类似于反相胶束的表层结构(图 2)。CTAB的空间位阻和(CTA)+(COO)-离子对的静电作用共同维持反胶束结构, 从而提高它们被还原的能力, 使得Au25(SR)18的合成时间从24 h缩短至10 min。当加入反离子后, CTAB保护壳很容易离去, 获得不含表面活性剂的巯基配体保护的金纳米簇。
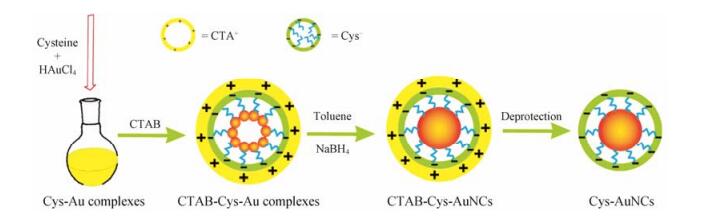
|
Figure 2 Schematic illustration of the fast (< 10 min) synthesis of Cys-Au25NCs by the protection-deprotection method. CTAB: Cetyltrimethylammonium bromide |
除了Au25(SR)18以外, 含有38个金原子数的巯基金纳米簇Au38(SR)24也吸引了广泛关注。Green等[54]在惰性环境下, 采用十二烷基硫醇同时作为稳定剂和腐蚀剂, 通过调控硫醇的加入量和加热温度控制大粒径金颗粒刻蚀的过程, 合成Au38(SC12H25)24。随后, 有研究者报道了一种简便且可大规模合成Au38(SC12H25)24的方法[55]。这种方法是以谷胱甘肽保护的金纳米簇为原料, 与十二烷基硫醇进行两相配体交换, 随后采用蚀刻和二次生长的方法, 合成出Au38(SR)24。为了进一步提高产率, 研究者还发展了一种“尺寸聚焦”的方法, 通过在丙酮中还原Au+-SR合成巯基保护的多分散性金纳米簇, 再与过量的苯乙基硫醇反应, 让大粒径纳米簇经历上述类似的巯基蚀刻诱导生长过程, 获得尺寸均一和原子数统一的Au38(SC2H4Ph)24[44]。除了上述描述的Au25(SR)18和Au38(SR)24外, 还有多种不同金原子数的纳米簇也被成功合成, 例如Au18(SR)14、Au20(SR)16、Au36(SR)23和Au144(SR)60等。这些具有不同原子数的金纳米簇的成功合成, 为系统研究金原子数目与纳米簇的光学和催化性质之间的内在关系, 以及对金纳米簇实际应用的性能调控提供了可能和依据。
1.3 膦基配体和其他配体早在1960年, 膦基配体保护的金纳米簇合成就被初步研究, 但直到近10年原子数才得以精确调控。采用两相系统, 将三苯基膦(triphenylphosphine, TPP)-氯金酸的复合物和四辛基溴化铵溶解于甲苯-水的混合溶液中, 逐滴加入NaBH4溶液, 制得Au20(PPh3)8[56]。如果将NaBH4和三苯基-膦氯金酸的比例设定为5:1, 在四氢呋喃-乙醇溶液中则可得到含有11个金原子的Au11(PPh3)7Cl3[57]。将反应溶剂更换为二氯甲烷, 还原四苯基膦氯化金复合物, 则得到含20个金原子的Au20(PP3)4Cl4[58]。
除了上述含巯基和膦基的配体以外, 还有其他配体如树枝状大分子、聚合物、聚电解质、羰基和胺基等也被用于金纳米簇的合成[59], 如将氯金酸与4代羟基封端的树枝状聚酰胺-胺型大分子(polyamidoamine, PAMAM)共同溶解于甲醇中, NaBH4作为还原剂, 得到含4个金原子的Au4G4-OH PAMAM[60];采用聚乙烯亚胺(polyethylenimine, PEI)作为配体, 利用配体诱导蚀刻法合成含8个金原子的Au8-PEI[61];还有采用咪唑类组氨酸(histidine, His)同时作为还原剂和保护剂合成生物相容性良好的金纳米簇Au10-His[62]等。
2 金纳米簇制备的影响因素原子数目精确的金纳米簇的制备是一个定量精确的过程, 需要严格控制反应条件。除了上述配体的结构和性质以外, 反应的pH值、温度、时间及金前体和配体的摩尔比等[63]均对材料的合成结果具有重要影响。金纳米簇的制备体系一般是由金前体、还原剂和保护配体组成的, 当反应体系中任一条件改变时, 金纳米簇的组成、结构和尺寸就有可能发生改变。
2.1 pH值的影响在金纳米簇的反应体系中, pH值的变化不仅改变了还原剂和金前体的反应环境, 还影响到合成反应的还原动力学, 从而影响纳米簇的尺寸或结构。采用一氧化碳作为还原剂还原GSH-氯金酸复合物时(图 3), 当pH值从7调节至11时, 所合成的纳米簇尺寸逐渐增大, 金原子数递增。当pH为7时, 得到的金纳米簇原子个数相对不稳定; 当pH增加到11时, 合成了稳定的十二面体Au25(SR)18[64]。采用BSA矿化法合成金纳米簇时, NaOH的加入造成组成金纳米簇原子数目的改变[65], 当pH为7.4时合成的纳米簇为BSA-Au13, 而当pH上升至11时制备得到稳定的BSA-Au25, 这可能是不同pH条件下BSA的空间构象发生改变的结果。

|
Figure 3 Schematic illustration of producing Au10-12, Au15, Au18, and Au25 NCs by adjusting the pH of the reaction solution in the CO-reduction method |
金纳米簇的合成是“快速还原生长和缓慢粒径聚焦”的一对可逆反应, 这一过程中温度对维持这对反应的平衡状态至关重要。考察金纳米簇在不同温度下尺寸和结构的变化, 证明纳米簇Au25(SR)18的合成是一个吸热反应, 即在加热条件下, 快速还原生长反应和缓慢粒径聚焦反应速率均有所增加, 最终金纳米簇的合成时间缩短, 合成产率增加[66]。有趣的是, 当温度设定不高于40 ℃时, Au25(SR)18的合成符合吸热反应规律。然而, 当温度高于40 ℃时(如50、60和70 ℃), Au25(SR)18的产率不增反降, 并形成不同金原子数的混合纳米簇。因此, 上述研究选用40 ℃作为Au25(SR)18合成反应的最佳温度。
2.3 配体性质和配体与金前体摩尔比的影响配体保护的金纳米簇的合成与配体的结构和性质密切相关, 不同配体具有不同的性质, 对金前体的氧化还原、电化学和热力学稳定性具有重要作用[67]。采用不同巯基配体合成Au25(SR)18时, 脂肪族巯基配体相对于芳香族巯基配体来说具有较高的电化学和热力学稳定性[68]。在配体相同的情况下, 其与金前体的摩尔比不同, 也会影响金纳米簇合成的精确性。有研究采用两性分子作为配体, 设置金前体与配体摩尔比从1:1变化至1:40。结果显示摩尔比为1:1时所合成的金纳米簇为多聚大粒径纳米簇; 当摩尔比在1:1~1:5时, 大多数纳米簇会发生刻蚀形成单层配体保护的金纳米簇; 而当摩尔比大于1:5时, 第二层配体保护层开始形成[69]。在研究BSA模板制备的金纳米簇时, 当金前体与BSA的摩尔比为5:1、8:1和12:1时, 分别合成含有不同金原子的纳米簇BSA-Au4、BSA-Au8和BSA-Au10[65]。因此, 通过选择合适的配体, 优化配体与金前体的摩尔比, 可以提升所合成的金纳米簇的质量和性能。
3 金纳米簇的应用金纳米簇由于具有量子尺寸效应、等离子共振效应和量子隧道效应等特性, 展现出特异的光学、电学、化学及催化性能。加之合成方法简单, 荧光量子效率高, 生物相容性好, 使得金纳米簇在分析物检测、催化、生物成像和药物递送等多个领域具有广阔的应用前景。
3.1 分析物检测由于突出的光学特性, 金纳米簇常被用于构建新型化学和生物传感器。有研究采用L-脯氨酸为稳定剂合成荧光金纳米簇, 该纳米簇与Fe3+选择性结合后聚集, 发生荧光淬灭, 可作为传感探针选择性测定溶液和血清样品中Fe3+的含量[70]。利用荧光“开-关”效应, 11-巯基十一烷酸(11-mercapto undecylic acid, 11-MUA)保护的金纳米簇(AuNCs@11-MUA)可实现对焦磷酸酶(pyrophosphatase, PPase)活性的检测(图 4)。体系中11-MUA的羧基与Cu2+络合发生荧光淬灭, 而焦磷酸(pyrophosphatic acid, PPi)由于与Cu2+具有更强的亲和力, 将Cu2+从AuNCs@11-MUA释放出来, 纳米簇荧光发生复燃。当PPase水解PPi后, 释放出Cu2+会再次与纳米簇结合发生荧光淬灭。研究证明, 纳米簇的荧光响应与PPase活性之间具有良好的线性关系, 可用于样品中PPase活性的定量测定[71]。癌症侵袭性与癌细胞中的葡萄糖代谢密切相关, 由于肿瘤环境中葡萄糖的代谢异常, 某些癌细胞中葡萄糖转运蛋白(glucose transporters, Gluts)过表达。有研究者合成了与葡萄糖结合的荧光金纳米簇(葡萄糖-AuNCs), 利用葡萄糖-AuNCs的荧光变化可以定量分析癌细胞中Gluts的水平变化, 及时检测致癌突变的过程[72]。
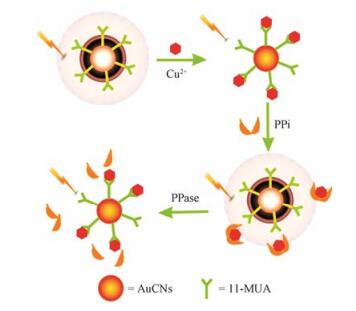
|
Figure 4 Schematic diagram of detection of phosphatase activity by AuNCs@11-MUA fluorescence "Open-Off". 11-MUA: 11- Mercapto undecylic acid |
除了光学特性外, 某些金纳米簇还具有特殊的催化功能, 可模拟生物酶催化某些反应。有研究将硫醇保护金纳米簇Au25(SR)18 (其中R=CH2CH2Ph)负载于各种氧化物载体上, 用于催化CO的氧化。研究结果表明, Au25(SR)18/CeO2系统的催化活性最强, 其催化活性中心位于Au25(SR)18/CeO2界面的周边位置, 且Au25(SR)18的结构完整对催化O2氧化CO具有关键意义。对金纳米簇的催化性能与原子结构之间相关性的研究, 可能揭示新的催化机制[73]。此外, 还有研究发现负载在功能化碳纳米管上孤立的金原子不具有催化活性, 但在特定反应条件下聚集成5~10个原子的金纳米簇显示出与巯基氧化酶相当的催化活性, 能够催化苯硫酚的氧化反应。相比于金纳米粒对反应分子的强吸附, 金纳米簇则表现出反应物易活化和产物易解吸附的特性, 能够同时活化苯硫酚和O2, 可能成为一种良好催化剂[74]。另外, 由于金纳米簇尺寸小、稳定性和生物相容性好, 作为过氧化物酶模拟物用于生物催化的优势更为突出, 如溶菌酶稳定的金纳米簇表现出过氧化物酶样活性, 有望在生物分析领域成为过氧化物酶的新型替代品[75]。
3.3 生物成像在众多生物成像技术中, 荧光成像技术由于其灵敏度高、干扰小等特点, 应用尤为广泛, 其成像的质量在很大程度上依赖于荧光探针的性质。以荧光材料作为探针标记生物体内重要的生物分子, 观察其在生命过程中起到的重要作用是近年来生物医学领域探究的热点。金纳米簇作为一种新型的荧光探针材料, 被广泛应用于生物标记和成像领域的突出优势在于: ①具有远小于大部分生物分子的超微小尺寸, 对生物分子正常生理功能干扰较小; ②对细胞及各种组织器官的毒性较小, 具有良好的生物相容性; ③光学性质稳定, 发射波长在红光至近红外光范围内可调节[76]。壳聚糖-N-乙酰-L-半胱氨酸(AuNCs@NAC-CS)稳定的金纳米簇, 在360 nm激发波长下发射出680 nm强荧光, 既可用于体外细胞成像, 也可用于小动物体内成像研究。静脉注射AuNCs@NAC-CS 6 h后, 正常小鼠的肝脏和肾脏中出现明显的荧光信号[77]。金纳米簇这种优良的荧光成像信号可用于药物递送载体的标记和观察。在BSA稳定的金纳米簇表面修饰具有肿瘤靶向性的环肽精氨酸-甘氨酸-天冬氨酸, 得到RGD-BSA@AuNCs, 并在其上负载了抗肿瘤药物[78];以肿瘤化疗药姜黄素为模板合成了姜黄素-金纳米簇, 研究显示其对正常细胞毒性低, 对癌细胞有较高的选择性, 在可见光(550 nm)照射下发出红色荧光(650 nm), 且荧光高度稳定, 可实现药物靶向递送的体内监测[79]。
3.4 药物递送金纳米簇具有纳米尺寸的药物递送系统, 由于其小尺寸效应, 能利用肿瘤增强的高通透和滞留效应(enhanced permeability and retention effect, EPR)进入并在肿瘤部位蓄积, 提高瘤内药物浓度。与游离药物相比, 纳米药物由于EPR具有治疗优势。较大尺寸的金纳米粒作为药物递送系统在体内的分布和代谢问题一直是人们讨论的话题[80], 金纳米簇构建的药物递送系统不易在肝、脾聚集, 能通过肾脏清除有效排出体外[81]。与尺寸更大的纳米粒相比, 金纳米簇除了赋予递送系统灵敏的荧光监测信号以外, 其易降解和代谢的性质具有独特优势。以BSA保护的金纳米簇(BSA-AuNCs)为外壳, 疏水性姜黄素为核心构建的“纳米胶囊”, 能高效地进入细胞并在细胞内表现出强烈的荧光。研究结果表明, 纳米胶囊的外壳在细胞中降解, 释放姜黄素, 实现了姜黄素的递送[82]。在阳离子聚合物介导下, 金纳米簇可自组装成直径约120 nm的纳米粒。这种带正电荷的纳米粒具有pH依赖性溶胀的性质, 在各种介质中稳定性良好, 且细胞毒性低。将小肽或抗体负载于纳米粒中, 明显增强了它们的细胞摄取, 可以作为一种新型的药物载体[83]。此外, 还有研究合成了一种极其稳定的金纳米簇并将其用于抗肿瘤药物的递送。该合成方法所用的配体HS-C11-EG6-X由巯基(-SH)、烷基链(C11)、聚乙二醇短链(EG6)和末端官能团(X、X=OH、COOH、NH2和GRGD等)组成。将抗癌药物多柔比星与金纳米簇相连后, 显著改善了多柔比星的水溶性, 延长其在体循环时间, 避免了游离多柔比星的毒性, 大大提升了其抗癌效果和安全性[84]。
4 总结与展望近十几年, 基于配体保护的具有精确原子数的金纳米簇的合成迅速发展, 采用各种生物和有机合成配体, 多种含有精确金原子数的金纳米簇被成功制备。本文主要探讨了金纳米簇制备过程中使用配体的结构、性质和影响制备的相关因素, 以及合成的金纳米簇在检测、催化、成像和药物递送方面的应用。金纳米簇的制备方法已取得长足进步, 但提高其合成效率仍然是一个需要解决的问题。由于配体的存在, 金纳米簇表面的活性位点在一定程度上会被遮盖, 其理化和生物学性质也会发生改变。因此, 开发既不影响颗粒各项性能, 又不导致金纳米簇的聚集的新制备方法, 具有重要意义。此外, 配体保护的金纳米簇是一个动态的结构, 它的结构演变和平衡过程、配体结构和性质与纳米簇组成原子数之间的定量关系, 以及纳米簇合成和应用过程中的相关机制还有待深入研究。对金纳米簇制备、调控和表面修饰方法和技术的深入探究对控制金纳米簇的组成、形态和性质, 以及开发其检测、催化、成像和生物医学的实际应用具有重要意义。
| [1] | Zhu Y, Qian H, Zhu M, et al. Thiolate-protected Aun nanoclusters as catalysts for selective oxidation and hydrogenation processes[J]. Adv Mater, 2010, 22: 1915–1920. DOI:10.1002/adma.200903934 |
| [2] | Lu Y, Chen W. Subnanometer sized metal clusters: from synthetic challenges to the unique property discoveries[J]. Chem Soc Rev, 2012, 43: 3594–3623. |
| [3] | Lu Y, Chen W. Progress in the synthesis and characterization of gold nanoclusters[M] // Mingos DMP. Gold Clusters, Colloids and Nanoparticles I. Cham: Springer Int Publish, 2013: 779-783. |
| [4] | Lopezacevedo O, Tsunoyama H, Tsukuda T, et al. Chirality and electronic structure of the thiolate-protected Au38 nanocluster[J]. J Am Chem Soc, 2010, 132: 8210–8218. DOI:10.1021/ja102934q |
| [5] | Zhang L, Han F. Protein coated gold nanoparticles as template for the directed synthesis of highly fluorescent gold nanoclusters[J]. Nanotechnology, 2018, 29: 165702. DOI:10.1088/1361-6528/aaae47 |
| [6] | Li G, Jin R. Gold nanocluster-catalyzed semihydrogenation: a unique activation pathway for terminal alkynes[J]. J Am Chem Soc, 2014, 136: 11347–11354. DOI:10.1021/ja503724j |
| [7] | Wang CS, Li JY, Amatore C, et al. Gold nanoclusters and graphene nanocomposites for drug delivery and imaging of cancer cells[J]. Angew Chem, 2011, 123: 11848–11852. DOI:10.1002/ange.v123.49 |
| [8] | Sun J, Jin Y. Fluorescent Au nanoclusters: recent progress and sensing applications[J]. J Mater Chem C, 2014, 2: 8000–8011. DOI:10.1039/C4TC01489H |
| [9] | Zhang H, Huang X, Li L, et al. Photoreductive synthesis of water-soluble fluorescent metal nanoclusters[J]. Chem Commun, 2012, 48: 567–569. DOI:10.1039/C1CC16088E |
| [10] | Zhang SS, Feng L, Senanayake RD, et al. Diphosphine- protected ultrasmall gold nanoclusters: opened icosahedral Au13 and heart-shaped Au8 clusters[J]. Chem Sci, 2018, 9: 1251–1258. DOI:10.1039/C7SC03566G |
| [11] | Yao Q, Yuan X, Fung V, et al. Understanding seed-mediated growth of gold nanoclusters at molecular level[J]. Nat Commun, 2017, 8: 927. DOI:10.1038/s41467-017-00970-1 |
| [12] | Huang R, Chen H, Xia Z. Ultrasonic-microwave heating synthesis and latent fingermarks development of gold nanoclusters[J]. Bull Chem Soc Jap, 2017, 90: 754–759. DOI:10.1246/bcsj.20170016 |
| [13] | Helmbrecht C, Lützenkirchenhecht D, Frank W. Microwave- assisted synthesis of water-soluble, fluorescent gold nanoclusters capped with small organic molecules and a revealing fluorescence and X-ray absorption study[J]. Nanoscale, 2015, 7: 4978–4983. DOI:10.1039/C4NR07051H |
| [14] | Attia YA, Abdel-Hafez SH. One-step synthesis of photoluminescent catalytic gold nanoclusters using organoselenium compounds[J]. New J Chem, 2018, 42: 9606–9611. DOI:10.1039/C8NJ00919H |
| [15] | Shichibu Y, Negishi Y, Tsunoyama H, et al. Extremely high stability of glutathionate-protected Au25 clusters against core etching[J]. Small, 2007, 3: 835–839. DOI:10.1002/(ISSN)1613-6829 |
| [16] | Zhang Y, Shuang S, Dong C, et al. Application of HPLC and MALDI-TOF MS for studying as-synthesized ligand-protected gold nanoclusters products[J]. Anal Chem, 2009, 81: 1676–1685. DOI:10.1021/ac8026349 |
| [17] | Li Z, Peng H, Liu J, et al. Plant protein-directed synthesis of luminescent gold nanocluster hybrids for tumor imaging[J]. ACS Appl Mater Interfaces, 2018, 10: 83–90. DOI:10.1021/acsami.7b13088 |
| [18] | Kong Y, Chen J, Gao F, et al. Near-infrared fluorescent ribonuclease-A-encapsulated gold nanoclusters: preparation, characterization, cancer targeting and imaging[J]. Nanoscale, 2013, 5: 1009–1017. DOI:10.1039/C2NR32760K |
| [19] | Cui M, Zhao Y, Song Q. Synthesis, optical properties and applications of ultra-small luminescent gold nanoclusters[J]. Trac Trend Anal Chem, 2014, 57: 73–82. DOI:10.1016/j.trac.2014.02.005 |
| [20] | Yao H, Liu B, Mosa IM, et al. Electrocatalytic oxidation of alcohols, tripropylamine, and DNA with ligand-free gold nanoclusters on nitrided carbon[J]. ChemElectroChem, 2016, 3: 2100–2109. DOI:10.1002/celc.v3.12 |
| [21] | Yuan X, Yu Y, Yao Q, et al. Fast synthesis of thiolated Au25 nanoclusters via protection-deprotection method[J]. J Phys Chem Lett, 2012, 3: 2310–2314. DOI:10.1021/jz300960b |
| [22] | Fang J, Zhang B, Yao Q, et al. Recent advances in the synthesis and catalytic applications of ligand-protected, atomically precise metal nanoclusters[J]. Coordina Chem Rev, 2016, 322: 1–29. DOI:10.1016/j.ccr.2016.05.003 |
| [23] | Cao S, Ding S, Liu Y, et al. Biomimetic mineralization of gold nanoclusters as multifunctional thin films for glass nanopore modification, characterization, and sensing[J]. Anal Chem, 2017, 89: 7886–7892. DOI:10.1021/acs.analchem.7b00802 |
| [24] | Xie J, Zheng Y, Ying JY. Protein-directed synthesis of highly fluorescent gold nanoclusters[J]. J Am Chem Soc, 2009, 131: 888–889. DOI:10.1021/ja806804u |
| [25] | Richards CI, Choi S, Hsiang JC, et al. Oligonucleotide- stabilized Ag nanocluster fluorophores[J]. J Am Chem Soc, 2008, 130: 5038–5039. DOI:10.1021/ja8005644 |
| [26] | West AL, Griep MH, Cole DP, et al. DNase 1 retains endodeoxyribonuclease activity following gold nanocluster synthesis[J]. Anal Chem, 2014, 86: 7377–7382. DOI:10.1021/ac5005794 |
| [27] | Lystvet SM, Volden S, Singh G, et al. Anticancer activity from gold-alpha-lactalbumin nanoconstructs[J]. J Phys Chem C, 2013, 117: 2230–2238. DOI:10.1021/jp3104886 |
| [28] | Yarramala DS, Baksi A, Pradeep T, et al. Green synthesis of protein protected fluorescent gold nanoclusters (AuNCs): reducing the size of AuNCs by partially occupying the Ca2+ site by La3+ in apo-α-lactalbumin[J]. ACS Sustain Chem Eng, 2017, 5: 6064–6069. DOI:10.1021/acssuschemeng.7b00958 |
| [29] | Baksi A, Xavier PL, Chaudhari K, et al. Protein-encapsulated gold cluster aggregates: the case of lysozyme[J]. Nanoscale, 2013, 5: 2009–2016. DOI:10.1039/c2nr33180b |
| [30] | Xavier PL, Chaudhari K, Verma PK, et al. Luminescent quantum clusters of gold in transferrin family protein, lactoferrin exhibiting FRET[J]. Nanoscale, 2010, 2: 2769–2776. DOI:10.1039/c0nr00377h |
| [31] | Maity B, Abe S, Ueno T. Observation of gold sub-nanocluster nucleation within a crystalline protein cage[J]. Nat Commun, 2017, 8: 14820. DOI:10.1038/ncomms14820 |
| [32] | Su L, Shu T, Wang J, et al. Hidden dityrosine residues in protein-protected gold nanoclusters[J]. J Phys Chem C, 2015, 119: 12065–12070. DOI:10.1021/acs.jpcc.5b03224 |
| [33] | Pinheiro AV, Han D, Shih WM, et al. Challenges and opportunities for structural DNA nanotechnology[J]. Nat Nanotechnol, 2011, 6: 763–772. DOI:10.1038/nnano.2011.187 |
| [34] | Chakraborty S, Babanova S, Rocha RC, et al. A hybrid DNA-templated gold nanocluster for enhanced enzymatic reduction of oxygen[J]. J Am Chem Soc, 2015, 137: 11678–11687. DOI:10.1021/jacs.5b05338 |
| [35] | Jena NK, Chandrakumar KRS, Ghosh SK. DNA base-gold nanocluster complex as a potential catalyzing agent: an attracttive route for CO oxidation process[J]. J Phys Chem C, 2012, 116: 17063–17069. DOI:10.1021/jp3046609 |
| [36] | Jin R. Atomically precise metal nanoclusters: stable sizes and optical properties[J]. Nanoscale, 2015, 7: 1549–1565. DOI:10.1039/C4NR05794E |
| [37] | Whetten RL, Khoury JT, Alvarez MM, et al. Nanocrystal gold molecules[J]. Adv Mater, 1996, 8: 428–433. DOI:10.1002/(ISSN)1521-4095 |
| [38] | Schaaff TG, Knight G, Shafigullin MN, et al. Isolation and selected properties of a 10.4 kDa gold: glutathione cluster compound[J]. J Phys Chem B, 1998, 102: 10643–10646. DOI:10.1021/jp9830528 |
| [39] | Negishi Y, Nobusada K, Tsukuda T. Glutathione-protected gold clusters revisited: bridging the gap between gold (Ⅰ)-thiolate complexes and thiolate-protected gold nanocrystals[J]. J Am Chem Soc, 2005, 127: 5261–5270. DOI:10.1021/ja042218h |
| [40] | Yuan X, Zhang B, Luo Z, et al. Balancing the rate of cluster growth and etching for gram-scale synthesis of thiolate- protected Au25 nanoclusters with atomic precision[J]. Angew Chem, 2014, 53: 4623–4627. DOI:10.1002/anie.201311177 |
| [41] | Zhu M, Aikens CM, Hollander FJ, et al. Correlating the crystal structure of a thiol-protected Au25 cluster and optical properties[J]. J Am Chem Soc, 2008, 130: 5883–5885. DOI:10.1021/ja801173r |
| [42] | Qian H, Eckenhoff WT, Zhu Y, et al. Total structure determination of thiolate-protected Au38 nanoparticles[J]. J Am Chem Soc, 2010, 132: 8280–8281. DOI:10.1021/ja103592z |
| [43] | Qian H, Zhu Y, Jin R. Size-focusing synthesis, optical and electrochemical properties of monodisperse Au38 (SC2H4Ph)24 nanoclusters[J]. ACS Nano, 2009, 3: 3795–3803. DOI:10.1021/nn901137h |
| [44] | Qian H, Jin R. Ambient synthesis of Au144(SR)60 nanoclusters in methanol[J]. Chem Mater, 2011, 23: 2209–2217. DOI:10.1021/cm200143s |
| [45] | Qian H, Jin R. Controlling nanoparticles with atomic precision: the case of Au144(SCH2CH2Ph)60[J]. Nano Lett, 2009, 9: 4083–4087. DOI:10.1021/nl902300y |
| [46] | Zeng C, Li T, Das A, et al. Chiral structure of thiolate- protected 28-gold-atom nanocluster determined by X-ray crystallography[J]. J Am Chem Soc, 2013, 135: 10011–11013. DOI:10.1021/ja404058q |
| [47] | Zeng C, Chen Y, Li G, et al. Synthesis of a Au44(SR)28 nanocluster: structure prediction and evolution from Au28(SR)20, Au36(SR)24 to Au44(SR)28[J]. Chem Commun, 2014, 50: 55–57. DOI:10.1039/C3CC47089J |
| [48] | Jin R, Qian H, Wu Z, et al. Size focusing: a methodology for synthesizing atomically precise gold nanoclusters[J]. J Phys Chem Lett, 2010, 1: 2903–2910. DOI:10.1021/jz100944k |
| [49] | Parker JF, Fieldszinna CA, Murray RW. The story of a monodisperse gold nanoparticle: Au25L18[J]. Acc Chem Res, 2010, 43: 1289–1296. DOI:10.1021/ar100048c |
| [50] | Heaven MW, Dass A, White PS, et al. Crystal structure of the gold nanoparticle[N(C8H17)4][Au25(SCH2CH2Ph)18][J]. J Am Chem Soc, 2008, 130: 3754–3755. DOI:10.1021/ja800561b |
| [51] | Akola J, Walter M, Whetten RL, et al. On the structure of thiolate-protected Au25[J]. J Am Chem Soc, 2008, 130: 3756–3757. DOI:10.1021/ja800594p |
| [52] | Shichibu Y, Negishi Y, Tsukuda T, et al. Large-scale synthesis of thiolated Au25 clusters via ligand exchange reactions of phosphine-stabilized Au11 clusters[J]. J Am Chem Soc, 2005, 127: 13464–13465. DOI:10.1021/ja053915s |
| [53] | Zhu M, Lanni E, Garg N, et al. Kinetically controlled, high- yield synthesis of Au25 clusters[J]. J Am Chem Soc, 2008, 130: 1138–1139. DOI:10.1021/ja0782448 |
| [54] | Green TD, Yi C, Zeng C, et al. Temperature-dependent photoluminescence of structurally-precise quantum-confined Au25(SC8H9)18 and Au38(SC12H25)24 metal nanoparticles[J]. J Phys Chem A, 2014, 118: 10611–10621. DOI:10.1021/jp505913j |
| [55] | Qian H, Zhu M, Andersen UN, et al. Facile, large-scale synthesis of dodecanethiol-stabilized Au38 clusters[J]. J Phys Chem A, 2009, 113: 4281–4284. DOI:10.1021/jp810893w |
| [56] | Zhang HF, Stender M, Zhang R, et al. Toward the solution synthesis of the tetrahedral Au20 cluster[J]. J Phys Chem B, 2004, 108: 12259–12263. DOI:10.1021/jp048636q |
| [57] | Mckenzie L, Zaikova TO, Hutchison JE. Structurally similar triphenylphosphine-stabilized undecagolds, Au11(PPh3)7Cl3 and[Au11(PPh3)8Cl2]Cl, exhibit distinct ligand exchange pathways with glutathione[J]. J Am Chem Soc, 2014, 136: 13426–13435. DOI:10.1021/ja5075689 |
| [58] | Wan XK, Yuan SF, Lin ZW, et al. A chiral gold nanocluster Au20 protected by tetradentate phosphine ligands[J]. Angew Chem, 2014, 126: 2967–2970. DOI:10.1002/ange.v126.11 |
| [59] | Heinecke CL, Ni TW, Malola S, et al. Structural and theoretical basis for ligand exchange on thiolate monolayer protected gold nanoclusters[J]. J Am Chem Soc, 2012, 134: 13316–13322. DOI:10.1021/ja3032339 |
| [60] | Tran ML, Zvyagin AV, Plakhotnik T. Synthesis and spectroscopic observation of dendrimer-encapsulated gold nanoclusters[J]. Chem Commun, 2006, 22: 2400–2401. |
| [61] | Duan H, Nie S. Etching colloidal gold nanocrystals with hyperbranched and multivalent polymers: a new route to fluorescent and water-soluble atomic clusters[J]. J Am Chem Soc, 2007, 129: 2412–2413. DOI:10.1021/ja067727t |
| [62] | Yang X, Shi M, Zhou R, et al. Blending of HAuCl4 and histidine in aqueous solution: a simple approach to the Au10 cluster[J]. Nanoscale, 2011, 3: 2596–2601. DOI:10.1039/c1nr10287g |
| [63] | Goswami N, Yao Q, Chen T, et al. Mechanistic exploration and controlled synthesis of precise thiolate-gold nanoclusters[J]. Coordin Chem Rev, 2016, 329: 1–15. DOI:10.1016/j.ccr.2016.09.001 |
| [64] | Yu Y, Chen X, Yao Q, et al. Scalable and precise synthesis of thiolated Au10-12, Au15, Au18, and Au25 nanoclusters via pH controlled CO reduction[J]. Chem Mater, 2013, 25: 946–952. DOI:10.1021/cm304098x |
| [65] | Yu Y, Luo Z, Teo CS, et al. Tailoring the protein conformation to synthesize different-sized gold nanoclusters[J]. Chem Commun, 2013, 49: 9740–9742. DOI:10.1039/c3cc46005c |
| [66] | Chen T, Yao Q, Yuan X, et al. Heating or cooling: temperature effects on the synthesis of atomically precise gold nanoclusters[J]. J Phys Chem C, 2015, 121: 10743–10751. |
| [67] | Voitekhovich SV, Lesnyak V, Gaponik N, et al. Tetrazoles: unique capping ligands and precursors for nanostructured materials[J]. Small, 2015, 11: 5728–5739. DOI:10.1002/smll.201501630 |
| [68] | Jung J, Kang S, Han YK. Ligand effects on the stability of thiol-stabilized gold nanoclusters: Au25(SR)18, Au38(SR)24, and Au102(SR)44[J]. Nanoscale, 2012, 4: 4206–4210. DOI:10.1039/c2nr30501a |
| [69] | Le Guevel X, Tagit O, Rodríguez CE, et al. Ligand effect on the size, valence state and red/near infrared photoluminescence of bidentate thiol gold nanoclusters[J]. Nanoscale, 2014, 6: 8091–8099. DOI:10.1039/C4NR01130A |
| [70] | Mu X, Qi L, Dong P, et al. Facile one-pot synthesis of L-proline-stabilized fluorescent gold nanoclusters and its application as sensing probes for serum iron[J]. Biosens Bioelectron, 2013, 49: 249–255. DOI:10.1016/j.bios.2013.05.019 |
| [71] | Sun J, Yang F, Zhao D, et al. Highly sensitive real-time assay of inorganic pyrophosphatase activity based on the fluorescent gold nanoclusters[J]. Anal Chem, 2014, 86: 7883–7889. DOI:10.1021/ac501814u |
| [72] | Cheng TM, Chu HL, Lee YC, et al. Quantitative analysis of glucose metabolic cleavage in glucose transporters overexpressed cancer cells by target-specific fluorescent gold nanoclusters[J]. Anal Chem, 2018, 90: 3974–3980. DOI:10.1021/acs.analchem.7b04961 |
| [73] | Nie XT, Qian HF, Ge QJ, et al. CO oxidation catalyzed by oxide-supported Au25(SR)18 nanoclusters and identification of perimeter sites as active centers[J]. ACS Nano, 2012, 6: 6014–6022. DOI:10.1021/nn301019f |
| [74] | Corma A, Concepción P, Boronat M, et al. Exceptional oxidation activity with size-controlled supported gold clusters of low atomicity[J]. Nat Chem, 2013, 5: 775–781. DOI:10.1038/nchem.1721 |
| [75] | Tao Y, Lin YH, Huang ZZ, et al. Incorporating graphene oxide and gold nanoclusters: a synergistic catalyst with surprisingly high peroxidase-like activity over a broad pH range and its application for cancer cell detection[J]. Adv Mater, 2013, 25: 2594–2599. DOI:10.1002/adma.201204419 |
| [76] | Li S, Nienhaus GU. Gold nanoclusters as novel optical probes for in vitro and in vivo fluorescence imaging[J]. Biophys Rev, 2012, 4: 313–322. DOI:10.1007/s12551-012-0076-9 |
| [77] | Duan Y, Duan RP, Liu R, et al. Chitosan-stabilized self- assembled fluorescent gold nanoclusters for cell imaging and bio-distribution in vivo[J]. ACS Biomater-Sci Eng, 2018, 4: 1055–1063. DOI:10.1021/acsbiomaterials.7b00975 |
| [78] | Ding CF, Xu YJ, Zhao YN, et al. Fabrication of BSA@AuNC- based nanostructures for cell fluoresce imaging and target drug delivery[J]. ACS Appl Mater Interfaces, 2018, 10: 8947–8954. DOI:10.1021/acsami.7b18493 |
| [79] | Govindaraju S, Rengaraj A, Arivazhagan R, et al. Curcumin- conjugated gold clusters for bioimaging and anticancer applications[J]. Bioconjugate Chem, 2018, 29: 363–370. DOI:10.1021/acs.bioconjchem.7b00683 |
| [80] | Hong EJ, Choi DG, Shim MS. Targeted and effective photodynamic therapy for cancer using functionalized nanomaterials[J]. Acta Pharm Sin B, 2016, 6: 297–307. DOI:10.1016/j.apsb.2016.01.007 |
| [81] | Zhang XD, Luo ZT, Chen J, et al. Ultrasmall glutathione- protected gold nanoclusters as next generation radiotherapy sensitizers with high tumor uptake and high renal clearance[J]. Sci Rep, 2015, 5: 8669. DOI:10.1038/srep08669 |
| [82] | Fu C, Ding CZ, Sun XC, et al. Curcumin nanocapsules stabilized by bovine serum albumin-capped gold nanoclusters (BSA-AuNCs) for drug delivery and theranosis[J]. Mater Sci Eng C, 2018, 87: 149–154. DOI:10.1016/j.msec.2017.12.028 |
| [83] | Yahia-Ammar A, Sierra D, Mérola F, et al. Self-assembled gold nanoclusters for bright fluorescence imaging and enhanced drug delivery[J]. ACS Nano, 2016, 10: 2591–2599. DOI:10.1021/acsnano.5b07596 |
| [84] | Zhang XD, Wu FG, Liu PD, et al. Synthesis of ultrastable and multifunctional gold nanoclusters with enhanced fluorescence and potential anticancer drug delivery application[J]. J Colloid Interface Sci, 2015, 455: 6–15. DOI:10.1016/j.jcis.2015.05.029 |
 2018, Vol. 53
2018, Vol. 53


