果糖-1, 6-二磷酸酶(fructose 1, 6-bisphosptase, FBPase)是糖异生代谢途径中的关键酶[1]。早在1943年, Gomori等[2]发现动物肾脏和肝脏中存在着一种磷酸酶, 可将果糖-1, 6-二磷酸(fructose-1, 6-disphosphate, FDP)水解成磷酸盐和果糖-6-磷酸(fructose-6- bisphosphate, F6P), 该磷酸酶即为D-果糖-1, 6-二磷酸酶(FBPase)。FBPase的酶动力学基本特征是需要二价金属阳离子(如Zn2+、Mg2+)的催化, 酶激活后动力学曲线为S型, Hill常数接近于2[3]。
近年, 随着对FBPase的生理作用及其与糖尿病、肿瘤发生发展相关研究的深入, 发现FBPase具有广泛的生物学功能, 以及可能参与调节机体中的多种生理环节。本文主要阐述FBPase基本特征、生理作用、其抑制剂研发以及该酶在其他疾病中调控机制。
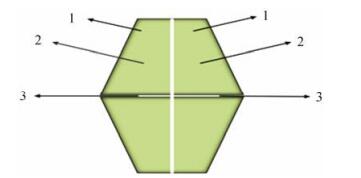
1 FBPase的生物学特征 1.1 FBPase的结构特征根据氨基酸序列和蛋白质结构特征将FBPase分为5大类[4]。其中, Ⅰ型FBPase分布最为广泛, 存在于所有的真核生物、大多数细菌(含大肠杆菌)和少数古生菌中, 多以同源四聚体的形式存在。Ⅱ型FBPase存在于大肠杆菌中的GlpX和集胞藻PCC6803中。Ⅲ型存在于枯草芽孢杆菌中, Ⅳ型存在于热球菌中, Ⅴ型存在于火球菌中。因Ⅱ型至Ⅴ型的FBPase较少见, 现研究多围绕Ⅰ型FBPase展开, 其分布广泛, 且生理功能明确。该酶的基本生物学特征是:它是一个分子质量约为140 kDa的同源四聚体蛋白(图 1), 由4个完全相同的含有337个氨基酸残基多肽链组成的蛋白, 4个亚基排列在同一平面, 每一个亚基的分子质量约为37 kDa[5]。Ⅰ型FBPase的每个亚基都含有3个结合位点:底物结合位点、单磷酸腺苷(adenosine monophosphate, AMP)变构位点和金属离子结合位点, 金属离子结合位点介于底物结合位点和AMP结合位点之间[6, 7]。此外, 亚基之间还存在一个亚单位界面间结合位点[8]。
|
Figure 1 Homotetramer of FBPase. 1: Substrate binding site; 2: AMP allosteric site; 3. Subunit inter plane binding site |
FBPase广泛地分布在微生物、植物和动物体内。在不同物种体内, FBPase参与的代谢途径也存在一些差异。在微生物中[4], FBPase主要参与甘油醋酸和琥珀酸等物质的合成; 在植物中, 于细胞质中参与糖异生过程; 于叶绿体基质中参与光合碳还原[9];在哺乳动物体内, FBPase在肝脏或肾脏组织中参与糖异生的过程。其中, 哺乳动物体内, 特别是人类的FBPase研究最为深入, 以下主要围绕人FBPase的组织细胞分布进行介绍。
人类FBPase的基因分为fbp1和fbp2两种, 分别表达两种亚型的同工酶, 即肝型FBPase (FBP1)和肌型FBPase (FBP2), 它们在蛋白质结构上的同源性大约为77%[10]。FBP1主要分布在肝脏和肾脏, 肝脏是糖异生的主要器官, 参与机体血糖水平的调节; 而肾脏在长时间饥饿或糖尿病时也会参与糖异生的调节。FBP2主要在非糖异生的细胞中广泛表达[11], 但具体功能尚不明确, 可能与细胞分裂、分化及凋亡的调节有关[12]。此外, 在人的肾上腺、胰腺、心脏、胃和小肠、前列腺、卵巢、睾丸、Ⅰ型肺细胞、Ⅱ型肺细胞和粒性白细胞中也发现了FBPase[13]。
不同组织的FBPase, 其分布也受到体内不同生物信号分子的调节。研究发现, 原代肝细胞中FBPase的分布受到葡萄糖、二羟基丙酮(dihydroxypropanone, DHA)和胰岛素的调节, 在缺乏以上3种物质时, FBPase主要存在于细胞质中; 但当葡萄糖和DHA存在时, FBPase会由细胞质转移到细胞核中。在高浓度的葡萄糖或者DHA存在时, FBPase会从细胞质基质移到细胞的边缘和糖原合成酶共处[14]。上述变化体现了FBPase的细胞分布对血糖和机体糖代谢调节的重要性。
1.3 FBPase活性调节FBPase在正常生理条件下, 可处于两种状态, 激活状态(R状态)和失活状态(T状态)。FBPase处于何种状态, 主要取决于其不同配体的相对浓度[7, 15]。其中, 金属离子(Mg2+)和FDP等配体能稳定FBPase的激活构象; 而AMP与FBPase形成复合物为失活构象, 即活性抑制。生理性抑制剂AMP与FBPase酶结合, 酶的亚基之间发生相对旋转, 顺时针旋转15°[16], 从而影响Mg2+结合位点, 干扰酶的活性位点, 使酶失活[6, 7]。另外有研究发现, 肌肉型的FBPase (FBP2)比肝脏型的FBPase (FBP1)与AMP的结合更敏感[17]。
此外, FBPase的活性还可受到多种激素(主要是胰岛素和胰高血糖素)调节, 激素调节使FBPase活性产生较长时间的变化。其中, 胰高血糖素可通过其信号通路使FBPase表达增加[18], 亦可降低内源性抑制剂果糖-2, 6-二磷酸浓度, 减少对FBPase的抑制, 增加FBPase活性[19];而胰岛素则通过抑制胰高血糖素的作用, 使FBPase表达降低, 增加FDP浓度, 抑制FBPase活性[18, 19]。另外, 最新研究报道, 在正常的单核细胞中, 1, 25-二羟维生素D3也可以上调FBPase的活性[20]。
2 FBPase的生理作用截止目前, 对FBPase的生理作用的报道主要集中在公认的参与糖异生环节, 以及其可能参与调节葡萄糖刺激的胰岛素分泌功能。另外, 还有一些关于其参与体重调节、脂肪调节和肿瘤发生等方面的报道。
2.1 FBPase参与糖异生途径在正常生理状态下, 机体处于饥饿缺乏外源的葡萄糖摄入时, 体内非糖物质(如丙酮酸、乳酸、草酰乙酸、氨基酸和甘油等)在一系列酶作用下生成葡萄糖, 以维持机体重要器官特别是大脑的血糖浓度。这一过程称之为糖异生[21]。糖异生在体内分布广泛。除肝脏外, 肾脏也具有糖异生功能。另外, 在哺乳动物的肠道内也存在糖异生[22]。
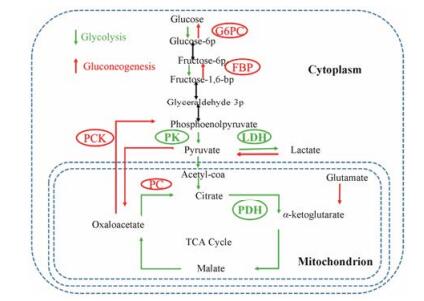
FBPase是糖异生途径中间环节的高度可控的关键限速酶, 只参与糖异生途径FDP的水解, 并不参与其他的代谢途径。糖异生途径中, 起关键作用的酶还有丙酮酸羧化酶(pyruvic carboxylase, PC)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)、葡萄糖-6-磷酸酶(glucose 6 phosphatase, G6Pase) (图 2)[23], 其中FBPase位于糖异生反应的第二步, 且为限速酶。因此, FBPase在机体内源性葡萄糖的合成、输出及调控中发挥重要作用。
|
Figure 2 The pathway of gluconeogenesis[23]. There are three irreversible steps in the gluconeogenic pathway: ① conversion of pyruvate to PEP via oxaloacetate, catalyzed by PC and PCK; ② dephosphorylation of fructose 1, 6-bisphosphate by FBP; ③ dephosphorylation of glucose 6-phosphate by G6PC. G6PC: Glucose-6-phosphatase; FBP: Fructose-1, 6-bisphosptase; PCK: Phosphoenolpyruvate carboxykinase; PC: Pyruvic carboxylase; PK: Phosphoenolpyruvate kinase; LDH: Lactate dehydrogenase; PDH: Pyruvate dehydrogenase |
另外, FBPase与糖酵解中的限速酶6-磷酸果糖激酶(6-phosphofructokinase, PFK)协同, 决定了细胞内F6P与FDP间的动态转化, 以及葡萄糖在酵解与异生间的动态平衡。FBPase的催化水解产物F6P是一个在各种生物合成途径的重要前体。FBPase催化的反应与果糖磷酸激酶催化糖酵解反应为不逆反应。由于糖异生途径, FBPase参与葡萄糖-6-磷酸(glucose-6-phosphate, G6P)的合成, 而G6P又是糖原合成的前期底物, 所以, FBPase在糖原合成方面, 也发挥着一定的生理作用[24]。由于FBPase可以位于细胞核和细胞浆, 也可推测, FBPase穿梭在细胞核和细胞质之间, 其可能作为一种转录因子, 通过磷酸化和去磷酸化的方式调节转录因子的活性, 或者是参与DNA的代谢[24]。
糖异生是2型糖尿病空腹血糖升高的主要原因。研究发现, 在肥胖和胰岛素抵抗动物模型中, FBPase的活性及其调节的糖异生作用均增加[25]。由于50%肝脏葡萄糖生成都来自糖异生, 且FBPase在糖异生调节中起重要作用, 因此, 抑制FBPase, 可以有效减少糖异生的增加, 进而有效控制空腹血糖。且由于FBPase处于糖异生的中间环节, 抑制该酶相比于抑制第一步或第三步关键酶不良反应要小, 如抑制PC会发生脂肪肝, 而抑制第三步的关键酶G6Pase会发生严重低血糖。因此, 基于其调节糖异生的重要生理作用, 寻找FBPase抑制剂将会是糖尿病新药研发的一个重要方向。
2.2 FBPase影响胰岛素分泌最初研究发现[26], 在啮齿动物和人的胰岛β细胞内有肝脏型FBPase (FBP1)的表达。Zhang等研究者[27]通过在小鼠β细胞内过表达FBP1, 发现小鼠β细胞内的葡萄糖代谢率下降, 同时胰岛素分泌降低; 在胰岛β细胞系MIN6中给予FBP1抑制剂MB05032处理后, 可以使其葡萄糖利用率、糖刺激产生的ATP及糖刺激的胰岛素分泌均有所增加。上述结果提示: FBP1是正常β细胞葡萄糖刺激胰岛素分泌的一个重要负调节因子, 发挥着重要的生物学作用[27], 其FBP1活性与胰岛素的分泌调控有着密切的联系。
最新研究发现, 有一种含有BTB结构域的新型锌指蛋白ZBTB20, 可以抑制β细胞内FBP1的活性。在全基因敲除ZBTB20的小鼠中表现出严重的糖代谢紊乱, 该小鼠β细胞内FBP1表达显著升高。进一步研究发现, ZBTB20能够结合到fbp1基因的启动子区域, 且ZBTB20能够抑制FBPase启动子报告基因的活性[28]。该结果亦表明FBP1活性变化确实影响β细胞的胰岛素分泌功能。
因此, 上述研究提示, FBP1抑制剂除了可以抑制内源性葡萄糖的产生外, 还可能促进β细胞的胰岛素分泌增加。FBP1的这两种生理功能决定了其抑制剂可能具有双重的降糖作用, 将会有更好的临床应用前景。
2.3 FBPase的其他生理作用除上述主要生理功能外, FBPase也可能参与其他一些生理环节的调节作用。FBPase可能参与食欲调节。Fam等研究者[29]首次发现了肝脏FBPase作为非中枢食欲调节的一个重要因子, 其活性增加可以抑制刺激食欲的神经肽Y (neuropeptide Y, NPY)和刺鼠基因相关蛋白(agouti gene-related protein, AGRP)的表达, 从而达到抑制食欲的作用。此外, FBPase在多数肿瘤患者体内[30, 31]表达水平显著下降, 表达低的患者预后较差, 可作为判断肿瘤患者预后的参考指标[32]之一。
3 FBPase抑制剂的研发进展 3.1 FBPase生理抑制剂及调节机制FBPase有两种内源性生理抑制剂, 一种是底物FDP的类似物果糖-2, 6-二磷酸, 它与FDP竞争性地结合于FBPase的激活位点, 抑制其活性; 另一种是与FBPase变构位点结合的AMP, 可使FBPase处于失活状态[33]。
因此, 根据FBPase的结构特点及抑制剂的调节方式, 以FBPase为靶点设计抑制剂可以有3种可能结合的作用位点: ①底物FDP和内源性抑制剂结合的催化活性位点(竞争性抑制剂); ② AMP结合的变构调节位点(非竞争性抑制剂); ③位于4个亚基之间接触面的变构调节位点(反竞争性抑制剂)[34]。其中, FBPase的激活位点和变构位点已经作为新药研发的两个靶点。
3.2 新型小分子FBPase抑制剂的发现目前, 已经报道的新结构类型的小分子FBPase抑制剂主要分为两类[16]: ①反竞争性抑制剂[34], 主要包括苯胺喹唑啉衍生物[35]、拟肽和喹啉衍生物, 其半数抑制浓度(IC50)为微摩尔级。②非竞争性抑制剂, 即针对AMP结合位点的抑制剂, 分为含磷抑制剂和非磷基抑制剂两个种类。其中含磷抑制剂包括嘌呤衍生物[36]、苯并咪唑衍生物[35]和噻唑衍生物(其中的代表化合物为目前已进入临床的候选药物的先导抑制剂MB05032, IC50 = 16 nmol·L-1 [37])和恶唑衍生物[38];非磷基抑制剂包括吲哚衍生物[39, 40] (代表化合物为MDL-29951, IC50 = 0.99 µmol·L-1)、苯并恶唑衍生物、不同的N、O、S杂环衍生物、磺酰基衍生物[41]和植物素[42]等, 这一部分新结构化合物的抑酶活性IC50值也均达到了微摩尔级。
目前, 针对FBPase抑制剂的研发主要在Metabasis、辉瑞、Sanofi等几家国际药物研发公司进行, 上述FBPase抑制剂中进展最快的已完成临床Ⅱ期试验。其中, 第一代FBPase抑制剂CS-917 (噻唑衍生物, 即MB05032的前药), 以AMP结构为基础的衍生物, 主要结合于AMP类似的变构位点, 临床Ⅱ期获得较好的降糖疗效, 但因其与二甲双胍联合应用引起了几例乳酸酸中毒不良反应[16], 目前已停止研发。第二代FBPase抑制剂MB07803改进了第一代的缺点, 也已进入了临床Ⅱ期研究, 后续进展尚未报道。本研究团队也发现了一系列新型的吲哚衍生物类小分子FBPase变构抑制剂, 在重组人源FBPase活性评价体系中, 得到了抑制活性较强的化合物14c, 其IC50可达到1×10-7 mol·L-1 [40]。基于该结构进行后续的结构优化和体内活性评价工作也在继续进行, 期望发现基于该靶点的新型抗糖尿病候选药物。
4 FBPase对其他疾病的调控作用针对FBPase与其他疾病相关的研究也有较多篇文献报道。其中, 最为详细的研究主要针对FBPase缺乏症和其与肿瘤发生发展关系。
4.1 果糖-1, 6-二磷酸酶缺乏症1970年, Baker和Winegrad[43]首次描述FBPase缺乏症, 其缺乏主要导致机体糖异生环节异常。这种疾病的特征是低血糖和代谢性酸中毒的反复性发作、呼吸暂停与困难和酮症。这是一种罕见的常染色体隐性遗传性代谢性疾病, 发病率为万分之一[44]。
目前, 针对FBPase缺乏症的诊断主要可通过确定检测基因突变来确诊。FBP1由7个外显子组成, 其在染色体9q22.2~q22.3跨度超过31 kb。自从1995年始至今, 已发现FBPase至少有36种突变可导致该类疾病发生[44]。在分子水平上确诊时, 首要的基因标记物是c.472C > T和c.841G > A突变。在巴基斯坦人中, FBPase缺乏症对于婴儿期和儿童常是致命性的疾病[45];我国曾报道了2例FBPase缺乏症[46], 1例为23个月的男性幼儿, 1例为3岁女童。针对FBPase缺乏症的患者, 治疗方案主要以紧急接受蔗糖和果糖治疗, 且要求长期限制饮食。
4.2 FBPase与肿瘤的相关性研究FBP1在肿瘤组织中的表达普遍下调[47], FBP1低表达可能与肿瘤分期、总生存期缩短及肿瘤复发等存在一定相关性。在肝癌患者中, FBP1低表达患者具有更高的恶性分型, 包括肿瘤变大、低分化、糖异生受损和富氧条件下糖酵解(瓦伯格效应)增强等表征[48]。另外发现在乳腺癌[49]、肝癌[48]、透明肾细胞癌[31]、肺癌[50]、胶质瘤[51]等肿瘤中FBPase的表达也受到抑制。但乳腺癌脑转移瘤中的FBP表达是上调的[52], 可见肿瘤代谢重排的复杂性。
对FBPase和肿瘤调节机制相关性的研究报道主要有以下4个方面[53]: ① FBP1下调主要受到DNA的甲基化和组蛋白去乙酰化调节。在很多肿瘤内[47, 48, 50], FBP1的启动子发生了甲基化; 而对于组蛋白去乙酰化调节, 只有一项报道[32], 在肝癌(hepatocellular carcinoma, HCC)患者中, 高表达组蛋白去乙酰化酶(histone deacetylase, HDAC)下调FBP1增强子中H3K27Ac水平, 抑制FBP1的表达。② FBP1低表达与肿瘤组织糖代谢异常显著相关。瓦伯格效应是指肿瘤细胞在富氧的情况下仍表现出高速的糖酵解代谢。众多文献[31, 48-50, 52]报道, FBP1的下调可增强瓦伯格效应。此外, 由于肿瘤内部含氧量极低, 肿瘤细胞需要通过稳定表达低氧诱导因子(hypoxia-inducible factor, HIF-1), 来维持自身的生存和增殖。FBP1下调可缓解对HIF-1的抑制。③ FBP1与肿瘤组织的凋亡与增殖也有一定联系。FBP1可增加活性氧(reactive oxygen species, ROS)的产生, 降低肿瘤干细胞的产生, 引起凋亡。在肺癌干细胞、乳腺癌和胃癌中, 增强FBP1会促进凋亡[54, 55]。在肝细胞癌和结肠癌中[30], 强制性增加FBP1的表达, 会抑制细胞的分裂, 但具体作用机制尚不十分清楚。④ FBP1可拮抗肿瘤的耐药性。在一些耐药的患者体内发现, 细胞外信号调节激酶(extracellular signalling-regulated kinases, ERKs)的活性增加。FBP1可以抑制ERKs的磷酸化, 进而抑制其活性, 改善耐药。但FBP1拮抗胰腺癌耐药的具体分子机制仍有待进一步研究[56]。
5 结语与展望2型糖尿病的主要特征是胰岛素分泌缺陷、胰岛素抵抗和内源性葡萄糖输出增加(endogenous glucose production, EGP, 又称糖异生异常)[57]。其中, 糖异生异常是2型糖尿病患者空腹血糖升高的重要原因[58]。目前, 市场上的抗糖尿病药物(如胰岛素增敏剂、磺脲类、DPP-Ⅳ抑制剂和α糖苷酶抑制剂等)主要是围绕改善胰岛素抵抗, 增加胰岛素分泌和减少糖类吸收的环节, 缺乏针对抑制EGP的药物。因此, 靶向于糖异生重要限速酶FBPase, 研发针对EGP环节的FBPase抑制剂类降血糖药物, 不仅可减少内源性葡萄糖生成, 亦可能通过增加葡萄糖刺激的胰岛素分泌, 发挥双重作用而控制血糖, 为糖尿病的防治提供新思路、新策略和新选择, 具有广阔的市场前景[59]。
| [1] | Paksu MS, Kalkan G, Asilioglu N, et al. Gluconeogenesis defect presenting with resistant hyperglycemia and acidosis mimicking diabetic ketoacidosis[J]. Pediatr Emerg Care, 2011, 12: 1180–1181. |
| [2] | Gomori G. Hexosediphosphatase[J]. J Biol Chem, 1943, 148: 139–149. |
| [3] | Tejwani GA. Regulation of fructose-bisphosphatase activity[J]. Adv Enzymol Relat Areas Mol Biol, 1983, 54: 121–194. |
| [4] | Zhu H. The Study with Fluorescent Probe TNP-AMP on Binding Sites of Inhibitors to Cyanobacteria FBPase (荧光探针分子TNP-AMP识别蓝藻FBPase抑制剂作用位点的研究)[D]. Wuhan: Central China Normal University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10511-1015449490.htm |
| [5] | Marcus F, Edelstein I, Reardon I, et al. Complete amino acid sequence of pig kidney fructose-1, 6-bisphosphatase[J]. Proc Natl Acad Sci U S A, 1982, 23: 7161–7165. |
| [6] | Mcininch JK, Kantrowitz ER. Use of silicate sol-gels to trap the R and T quaternary conformational states of pig kidney fructose-1, 6-bisphosphatase[J]. Biochim Biophys Acta, 2001, 2: 320–328. |
| [7] | Zhang Y, Liang JY, Huang S, et al. Toward a mechanism for the allosteric transition of pig kidney fructose-1, 6-bisphosphatase[J]. J Mol Biol, 1994, 5: 609–624. |
| [8] | Li ZM, Bie JB, Song HR, et al. Recent advance in the discovery of allosteric inhibitors binding to the AMP site of fructose-1, 6-bisphosphatase[J]. Acta Pharm Sin (药学学报), 2011, 11: 1291–1300. |
| [9] | Chiadmi M, Navaza A, Miginiac-Maslow M, et al. Redox signalling in the chloroplast: structure of oxidized pea fructose- 1, 6-bisphosphate phosphatase[J]. EMBO J, 1999, 23: 6809–6815. |
| [10] | Tillmann H, Eschrich K. Isolation and characterization of an allelic cDNA for human muscle fructose-1, 6-bisphosphatase[J]. Gene, 1998, 2: 295–304. |
| [11] | Gizak A, Sok AJ, Lipinska A, et al. A comparative study on the sensitivity of Cyprinus carpio muscle and liver FBPase toward AMP and calcium[J]. Comp Biochem Physiol B Biochem Mol Biol, 2012, 1-3: 51–55. |
| [12] | Mamczur P, Sok AJ, Rzechonek A, et al. Cell cycle- dependent expression and subcellular localization of fructose 1, 6-bisphosphatase[J]. Histochem Cell Biol, 2012, 1: 121–136. |
| [13] | Yanez AJ, Nualart F, Droppelmann C. Broad expression of fructose-1, 6-bisphosphatase and phosphoenolpyruvate carboxykinase provide evidence for gluconeogenesis in human tissues other than liver and kidney[J]. J Cell Physiol, 2003, 1: 189–197. |
| [14] | Yanez AJ, Garcia-Rocha M, Bertinat R, et al. Subcellular localization of liver FBPase is modulated by metabolic conditions[J]. FEBS Lett, 2004, 1-2: 154–158. |
| [15] | Ke HM, Liang JY, Zhang YP, et al. Conformational transition of fructose-1, 6-bisphosphatase: structure comparison between the AMP complex (T form) and the fructose 6-phosphate complex (R form)[J]. Biochemistry, 1991, 18: 4412–4420. |
| [16] | Kaur R, Dahiya L, Kumar M. Fructose-1, 6-bisphosphatase inhibitors: a new valid approach for management of type 2 diabetes mellitus[J]. Eur J Med Chem, 2017, 141: 473–505. DOI:10.1016/j.ejmech.2017.09.029 |
| [17] | Shi R, Chen ZY, Zhu DW, et al. Crystal structures of human muscle fructose-1, 6-bisphosphatase: novel quaternary states, enhanced AMP affinity, and allosteric signal transmission pathway[J]. PLoS One, 2013, 9: e71242. |
| [18] | El-Maghrabi MR, Lange AJ, Kummel L, et al. The rat fructose-1, 6-bisphosphatase gene. Structure and regulation of expression[J]. J Biol Chem, 1991, 4: 2115–2120. |
| [19] | Pilkis SJ, Claus TH. Hepatic gluconeogenesis/glycolysis: regulation and structure/function relationships of substrate cycle enzymes[J]. Annu Rev Nutr, 1991, 11: 465–515. DOI:10.1146/annurev.nu.11.070191.002341 |
| [20] | Fujisawa K, Umesono K, Kikawa Y, et al. Identification of a response element for vitamin D3 and retinoic acid in the promoter region of the human fructose-1, 6-bisphosphatase gene[J]. J Biochem, 2000, 3: 373–382. |
| [21] | Li B. Recent proceedings in research of tumor-associated disorders of glucose metabolism[J]. J Sun Yat-sen Univ (Med Sci) (中山大学学报(医学科学版)), 2017, 2: 222–228. |
| [22] | Penhoat A, Fayard L, Stefanutti A, et al. Intestinal gluconeogenesis is crucial to maintain a physiological fasting glycemia in the absence of hepatic glucose production in mice[J]. Metabolism, 2014, 1: 104–111. |
| [23] | Yip J, Geng X, Shen J, et al. Cerebral gluconeogenesis and diseases[J]. Front Pharmacol, 2016, 7: 521. |
| [24] | Yanez AJ, Bertinat R, Concha Ⅱ, et al. Nuclear localization of liver FBPase isoenzyme in kidney and liver[J]. FEBS Lett, 2003, 1-3: 35–40. |
| [25] | Visinoni S, Fam BC, Blair A, et al. Increased glucose production in mice overexpressing human fructose-1, 6- bisphosphatase in the liver[J]. Am J Physiol Endocrinol Metab, 2008, 5: E1132–E1141. |
| [26] | Laybutt DR, Sharma A, Sgroi DC, et al. Genetic regulation of metabolic pathways in beta-cells disrupted by hyperglycemia[J]. J Biol Chem, 2002, 13: 10912–10921. |
| [27] | Zhang Y, Xie Z, Zhou G, et al. Fructose-1, 6-bisphosphatase regulates glucose-stimulated insulin secretion of mouse pancreatic beta-cells[J]. Endocrinology, 2010, 10: 4688–4695. |
| [28] | Zhang Y, Xie Z, Zhou L, et al. The zinc finger protein ZBTB20 regulates transcription of fructose-1, 6-bisphosphatase 1 and beta cell function in mice[J]. Gastroenterology, 2012, 7: 1571–1580. |
| [29] | Fam BC, Joannides CN, Andrikopoulos S. The liver: key in regulating appetite and body weight[J]. Adipocyte, 2012, 4: 259–264. |
| [30] | Chen M, Zhang J, Li N, et al. Promoter hypermethylation mediated downregulation of FBP1 in human hepatocellular carcinoma and colon cancer[J]. PLoS One, 2011, 10: e25564. |
| [31] | Li B, Qiu B, Lee DS, et al. Fructose-1, 6-bisphosphatase opposes renal carcinoma progression[J]. Nature, 2014, 7517: 251–255. |
| [32] | Yang J, Jin X, Yan Y, et al. Inhibiting histone deacetylases suppresses glucose metabolism and hepatocellular carcinoma growth by restoring FBP1 expression[J]. Sci Rep, 2017, 7: 43864. DOI:10.1038/srep43864 |
| [33] | Rakus D, Tillmann H, Wysocki R, et al. Different sensitivities of mutants and chimeric forms of human muscle and liver fructose-1, 6-bisphosphatases towards AMP[J]. Biol Chem, 2003, 1: 51–58. |
| [34] | Wright SW, Carlo AA, Carty MD, et al. Anilinoquinazoline inhibitors of fructose 1, 6-bisphosphatase bind at a novel allosteric site: synthesis, in vitro characterization, and X-ray crystallography[J]. J Med Chem, 2002, 18: 3865–3877. |
| [35] | Wright SW, Hageman DL, Mcclure LD, et al. Allosteric inhibition of fructose-1, 6-bisphosphatase by anilinoquinazolines[J]. Bioorg Med Chem Lett, 2001, 1: 17–21. |
| [36] | Erion MD, Dang Q, Reddy MR, et al. Structure-guided design of AMP mimics that inhibit fructose-1, 6-bisphosphatase with high affinity and specificity[J]. J Am Chem Soc, 2007, 50: 15480–15490. |
| [37] | Erion MD, Van Poelje PD, Dang Q, et al. A potent and selective inhibitor of fructose 1, 6-bisphosphatase for controlling gluconeogenesis in type 2 diabetes[J]. Proc Natl Acad Sci U S A, 2005, 22: 7970–7975. |
| [38] | Dang Q, Liu Y, Cashion DK, et al. Discovery of a series of phosphonic acid-containing thiazoles and orally bioavailable diamide prodrugs that lower glucose in diabetic animals through inhibition of fructose-1, 6-bisphosphatase[J]. J Med Chem, 2011, 1: 153–165. |
| [39] | Bie JB, Liu SN, Zhou J, et al. Design, synthesis and biological evaluation of 7-nitro-1H-indole-2-carboxylic acid derivatives as allosteric inhibitors of fructose-1, 6-bisphosphatase[J]. Bioorg Med Chem, 2014, 6: 1850–1862. |
| [40] | Bie JB, Liu SN, Li ZM, et al. Discovery of novel indole derivatives as allosteric inhibitors of fructose-1, 6 bisphosphatase[J]. Eur J Med Chem, 2015, 90: 394–405. DOI:10.1016/j.ejmech.2014.11.049 |
| [41] | Rudnitskaya A, Huynh K, Torok B, et al. Novel heteroaromatic organofluorine inhibitors of fructose-1, 6-bisphosphatase[J]. J Med Chem, 2009, 3: 878–882. |
| [42] | Heng S, Harris KM, Kantrowitz ER. Designing inhibitors against fructose 1, 6-bisphosphatase: exploring natural products for novel inhibitor scaffolds[J]. Eur J Med Chem, 2010, 4: 1478–1484. |
| [43] | Baker L, Winegrad AI. Fasting hypoglycaemia and metabolic acidosis associated with deficiency of hepatic fructose-1, 6- diphosphatase activity[J]. Lancet, 1970, 7662: 13–16. |
| [44] | Nagahara K, Ariyasu D, Igaki J, et al. A Japanese boy with fructose-1, 6-bisphosphatase deficiency who had a novel FBP1 mutation[J]. Clin Pediatr Endocrinol, 2017, 4: 275–278. |
| [45] | Ijaz S, Zahoor MY, Imran M, et al. Genetic analysis of fructose-1, 6-bisphosphatase (FBPase) deficiency in nine consanguineous Pakistani families[J]. J Pediatr Endocrinol Metab, 2017, 11: 1203–1210. |
| [46] | Xu K, Liu XQ, Zhang C, et al. Genetic diagnosis of fructose- 1, 6-bisphosphatase deficiency: a case report[J]. J Peking Univ (Health Sci) (北京大学学报(医学版)), 2014, 46: 681–685. |
| [47] | Dong C, Yuan T, Wu Y, et al. Loss of FBP1 by Snail- mediated repression provides metabolic advantages in basal- like breast cancer[J]. Cancer Cell, 2013, 3: 316–331. |
| [48] | Hirata H, Sugimachi K, Komatsu H, et al. Decreased expression of fructose-1, 6-bisphosphatase associates with glucose metabolism and tumor progression in hepatocellular carcinoma[J]. Cancer Res, 2016, 11: 3265–3276. |
| [49] | Li K, Ying M, Feng D, et al. Fructose-1, 6-bisphosphatase is a novel regulator of Wnt/beta-catenin pathway in breast cancer[J]. Biomed Pharmacother, 2016, 84: 1144–1149. DOI:10.1016/j.biopha.2016.10.050 |
| [50] | Zhang J, Wang J, Xing H, et al. Down-regulation of FBP1 by ZEB1-mediated repression confers to growth and invasion in lung cancer cells[J]. Mol Cell Biochem, 2016, 1-2: 331–340. |
| [51] | Liu X, Wang X, Zhang J, et al. Warburg effect revisited: an epigenetic link between glycolysis and gastric carcinogenesis[J]. Oncogene, 2010, 3: 442–450. |
| [52] | Chen J, Lee HJ, Wu X, et al. Gain of glucose-independent growth upon metastasis of breast cancer cells to the brain[J]. Cancer Res, 2015, 3: 554–565. |
| [53] | Liu GM, Zhang YM. Targeting FBPase is an emerging novel approach for cancer therapy[J]. Cancer Cell Int, 2018, 18: 36. DOI:10.1186/s12935-018-0533-z |
| [54] | Dai J, Ji Y, Wang W, et al. Loss of fructose-1, 6-bisphosphatase induces glycolysis and promotes apoptosis resistance of cancer stem-like cells: an important role in hexavalent chromium-induced carcinogenesis[J]. Toxicol Appl Pharmacol, 2017, 331: 164–173. DOI:10.1016/j.taap.2017.06.014 |
| [55] | Liu Y, Jiang Y, Wang N, et al. Invalidation of mitophagy by FBP1-mediated repression promotes apoptosis in breast cancer[J]. Tumour Biol, 2017, 6: 1–13. |
| [56] | Jin X, Pan Y, Wang L, et al. Fructose-1, 6-bisphosphatase inhibits ERK activation and bypasses gemcitabine resistance in pancreatic cancer by blocking IQGAP1-MAPK interaction[J]. Cancer Res, 2017, 16: 4328–4341. |
| [57] | Van Poelje PD, Potter SC, Erion MD. Fructose-1, 6-bisphosphatase inhibitors for reducing excessive endogenous glucose production in type 2 diabetes[J]. Handb Exp Pharmacol, 2011, 203: 279–301. DOI:10.1007/978-3-642-17214-4 |
| [58] | Giaccari A, Morviducci L, Pastore L, et al. Relative contribution of glycogenolysis and gluconeogenesis to hepatic glucose production in control and diabetic rats. A re-examination in the presence of euglycaemia[J]. Diabetologia, 1998, 3: 307–314. |
| [59] | Visinoni S, Khalid NF, Joannides CN, et al. The role of liver fructose-1, 6-bisphosphatase in regulating appetite and adiposity[J]. Diabetes, 2012, 5: 1122–1132. |
 2018, Vol. 53
2018, Vol. 53


