阿尔茨海默病是(Alzheimer's disease, AD)中枢退行性疾病, 与年龄有关, 多发于老年人[1]。关于AD发病机制有许多假说, 如炎症反应、淀粉样蛋白(Aβ)沉积、tau蛋白异常磷酸化、胆碱能假说、氧化应激反应和细胞凋亡学说等[2]。当今治疗AD的临床药物存在较多不良反应, 而中药毒副作用小, 可以安全有效地治疗AD。
开心散是治疗老年痴呆的经典方剂, 首见于《备急·千金要方》。开心散由人参、茯苓、远志和石菖蒲4味药组成。君药为人参具有补益元气、补五脏之功; 臣药为茯苓具有养心安神功效; 佐药为远志有宁心化痰之效; 使药为石菖蒲具有益智醒神和引药入经功效[3]。研究表明, 开心散主要活性成分具有改善学习和记忆的作用。人参皂苷Rg2抑制乙酰胆碱酯酶活性改善AD小鼠的学习记忆功能[4]。远志茯苓醇提物能改善东莨菪碱模型小鼠的学习记忆能力, 可能通过提高脑内乙酰胆碱水平而发挥改善学习记忆的作用[5]。石菖蒲挥发油的主要活性成分β-细辛醚能够增强突触功能可塑性而改善Aβ1-42导致的大鼠认知功能障碍状况[6]。
网络药理学通过检索网络数据库、构建“药物-靶点-疾病”网络关系并进行网络拓扑学分析, 是一种从整体层次来预测药物治疗疾病作用机制的新方法[7]。中药复方通过君臣佐使多味中药协同作用治疗疾病, 强调系统性和整体性。中药复方治疗疾病的理论同网络药理学相似。开心散成分复杂, 治疗AD具有多成分、多靶点的优点, 但开心散治疗AD的有效活性成分及作用机制不明确, 因此应用网络药理学方法筛选中药复方开心散治疗AD的活性成分及其靶点具有重要意义。
材料与方法查找阿尔茨海默病相关靶蛋白 Therapeutic target database (TTD)数据库[8]是一个提供了已知或正在探索的可用作治疗的蛋白质靶点的信息, 以及与之相对应的靶疾病、靶通路和相应的药物/配体信息的数据库。中药系统药理学数据库和分析平台(TCMSP)[9, 10]是一个整合药物代谢动力学、药物化学和药物-靶点-疾病网络的平台。在TTD和TCMSP数据库中输入“Alzheimer”关键词搜索与AD相关的蛋白。将两种方法得到的靶蛋白信息合并, 取两个数据库交集的靶蛋白确定为阿尔茨海默病靶蛋白。同时使用蛋白质数据库(Uniprot Database)选择物种为“human”的靶点, 将蛋白名称和基因名称进行转换。
根据ADME筛选开心散的活性成分 ADME是药物动力学, 指机体对外源化学物的吸收(absorption)、分布(distribution)、代谢(metabolism)及排泄(excretion)过程。ADME的3个关键参数为血脑屏障(blood brain barrier, BBB)、口服生物利用度(oral bioavailability, OB)和类药性(druglikeness, DL)[11, 12]。根据ADME (BBB≥-0.3、OB≥30%和DL≥0.18)筛选开心散活性化合物。
筛选开心散治疗阿尔茨海默病的靶点 PharmMapper是通过反向分子对接预测靶点的服务平台, 以活性小分子为探针, 通过对Targetbank、Drugbank、Binding DB和PDTD 4个数据库进行检索找到最佳靶点信息[13]。将满足OB、BBB和DL的化合物, 以SDF格式上传到Pharmmapper服务平台, 参数选择: select targets set选human protein targets only (v2010, 2241), 其他参数默认, 得到开心散活性成分的靶蛋白。由于部分靶点名称不规范, 所以将靶点名称输入Uniprot数据库中统一为基因名。将预测的开心散靶点信息与TTD和TCMSP数据库中阿尔茨海默病靶点进行验证, 筛选出开心散治疗阿尔茨海默病的作用靶点。
构建开心散活性成分与AD疾病相关靶点网络图 根据开心散化学成分-靶点预测结果和靶点-疾病预测结果, 应用Cytoscape 3.5.1中的Merge功能, 将两个预测结果合并成化学成分-靶点-疾病网络图, 并通过network analysis计算网络参数, 分析相互关系。Cytoscape3.5.1是一种可视化软件, 能更直观地分析药物治疗疾病的作用机制[14]。其中的节点(node)是化合物、靶蛋白或疾病。其中的边(edge)代表这些分子之间的互作关系, 即某个成分与靶点或靶点与疾病存在联系。
GO功能富集分析和KEGG通路富集分析 利用STRING数据库对开心散调控的阿尔茨海默病靶蛋白进行GO功能富集分析, 将开心散治疗阿尔茨海默病涉及的8个蛋白输入到检索框中, 选择“homo sapines”开始分析。DAVID (Database for Annotation, Visualization and Integrated Discovery)是整合生物学信息和分析工具的生物信息数据库, 可以从多个基因或蛋白质中提取生物学信息并提供系统的生物功能注释信息[15]。打开DAVID数据库, 在基因列表中输入与AD有关的靶点基因名称, 在基因标识符栏中选择“official-gene-symbol”, 基因背景栏选择“homo sapiens”, 最后分析工具选择“functional annotation tool”。根据P < 0.05作为筛选条件得到KEGG通路富集分析结果。
Discovery Studio分子对接软件验证网络药理学筛选结果 Discovery Studio (DS)主要应用于蛋白质结构功能的研究、药物发现和结构生物学等领域。DS基于结构药物设计工具, 包括配体-蛋白质相互作用和分子对接, 基于小分子药物设计工具包括定量构效关系、药效团和ADMET等。
将阿尔茨海默病靶蛋白糖原合成激酶3β (glycogen synthase kinase-3 beta, GSK3β)和乙酰胆碱酯酶(acetylcholinesterase, AchE)作为分子对接的受体, 再对蛋白质晶体结构数据库PDB中的目标蛋白的三维结构活性部位进行分析, 采用Discovery Studio分子对接软件(版本3.0)中的LibDock模块将degree > 5的成分beta-sitosterol和stigmasterol (配体)、阳性药盐酸多奈哌齐(donepezil)、GSK3β抑制剂与受体蛋白分子对接来验证网络药理学筛选结果。
用ChemDraw软件绘制beta-sitosterol、stigmasterol、donepezil和GSK3β抑制剂的化学结构, 作为对接的配体。配体和受体分子在对接前需要进行能量最小化处理, 删除受体分子(PDB文件中)水分子, 加上极性氢原子, 赋予电荷, 添加磁场。以原配体化合物所在的位置作为结合位点, 半径为0.65 nm内的所有子结构作为结合位点的活性口袋部分。采用LigandDock方法采集配体分子在受体活性口袋中的构象模式。
结果 1 阿尔茨海默病相关的靶蛋白在TTD中与阿尔茨海默病有关的靶点共95个, 在TCMSP中与阿尔茨海默病相关的靶点有30个, 将两种方法得到的靶点取交集即确定为阿尔茨海默病相关的靶点。将靶点与阿尔茨海默病建立联系, 共得到14个阿尔茨海默病靶点(表 1)。
| Table 1 Fourteen proteins relating to Alzheimer |
符合ADME (BBB≥-0.3、OB≥30%和DL≥0.18)筛选条件的共31种, 其中人参18种、茯苓6种、远志4种、石菖蒲3种。开心散活性成分信息见表 2。
| Table 2 Information sheet of active compound of Kai Xin San. OB: Bioavailability; DL: Drug-likeness; BBB: Blood brain barrier level |
将上述31个开心散活性成分, 通过Phammapper服务器与TCMSP、TTD数据库验证后, 预测关于AD的作用靶点共8个:环氧合酶2 (prostaglandin G/H synthase 2, COX2)、AchE、胆碱能受体M1 (muscarinic acetylcholine receptor M1, CHRM1)、胆碱能受体M2 (muscarinic acetylcholine receptor M2, CHRM2)、GSK3β、丁酰胆碱酯酶(bcetylcholinesterase, BCHE)、γ-氨基丁酸受体α5亚基(gamma-aminobutyric-acid receptor alpha-5 subunit, GABRA5)、神经元乙酰胆碱受体蛋白α-7链(neuronal acetylcholine receptor protein, alpha-7 chain, CHRNA7) (表 3)。分析发现, 化合物onjixanthone I的口服生物利用度最高(79.16%), 说明该化合物经口服后能被胃肠道较好地吸收。化合物dehydroeburicoic acid、fumarine、gomisin B的类药性最好, 表明这3个化合物被开发为药物的可能性最高; 化合物beta-asarone能较好地通过血脑屏障, 且有实验表明该化合物能够影响海马神经元的突出可塑性而改善大鼠的认知功能[6]。
| Table 3 Information of protein targets from active ingredients of Kai Xin San. COX2: Prostaglandin G/H synthase 2; AchE: Acetylcholinesterase; CHRM1: Muscarinic acetylcholine receptor M1; CHRM2: Muscarinic acetylcholine receptor M2; GSK3β: Glycogen synthase kinase-3 beta; BCHE: Bcetylcholinesterase; GABRA5: Gamma-aminobutyric-acid receptor alpha-5 subunit; CHRNA7: Neuronal acetylcholine receptor protein, alpha-7 chain |
运用Cytoscape 3.5.1构建成分-靶点-疾病网络(图 1), 包含23个化学成分, 8个靶点及1个疾病, 其中粉色菱形代表阿尔茨海默病, 绿色圆形代表靶蛋白, 正方形代表开心散的活性成分, 浅绿色为人参, 黄色为茯苓, 蓝色为远志, 紫色为石菖蒲。Network analysis发现(表 4), 网络中的网络度(degree)越大, 说明开心散通过该靶点治疗疾病的可能性越大。COX2与AchE为C-T-D网络中的核心靶点, 23个活性成分均与这两个靶点有潜在的结合作用, 其次分别为CHRM1、CHRM2、GSK3β、BCHE、CHRNA7和GABRA5。开心散可能通过多个发病机制治疗AD:胆碱能学说是AD发病学说的假说之一, 研究表明[16], 开心散能够抑制乙酰胆碱酯酶的表达从而改善大鼠的学习记忆能力; Aβ沉积是AD的主要发病机制, Aβ聚集可引起神经系统炎性反应, 造成神经元凋亡, 认知系统受损[17]。COX2是PGE2合成的关键酶, PGE2是重要的炎症介质, 可直接引起血管渗透性增加, 促进相关组织分泌IL-6等炎症因子诱导炎症反应发生[18]; tau蛋白磷酸化引起的神经纤维缠结也是AD发病公认学说, GSK3β调控tau蛋白磷酸化[19]且GSK3β参与细胞凋亡, 因此开心散可能通过GSK3β调控tau蛋白磷酸化从而治疗AD。CHRM1和CHRM2为胆碱能受体, BCHE为丁酰胆碱酯酶, 三者都属于胆碱能系统, 与胆碱能学说有关。CHRNA7是乙酰胆碱受体亚基α7, 实验证明[20-22], CHRNA7的基因多态性与AD有关, CHRNA7多态性可以调节突触前神经递质的释放和胆碱能神经传递来增强记忆功能。综上所述, 开心散可能通过减少炎症因子的释放减轻Aβ沉积、平衡胆碱能系统和抑制tau蛋白过度磷酸化等多个靶点治疗阿尔茨海默病。

|
Figure 1 Components-targets-disease network. The size of the graphic area indicates the importance of the nodes in the network. (      |
| Table 4 Targets of Kai Xin San related to Alzheimer in the network characteristics |
利用STRING数据库进行GO功能富集分析, 对开心散治疗阿尔茨海默病涉及的8个蛋白在基因功能中的作用进行了分析。根据错误发现率(false discovery rate, FDR)确定31个GO富集分析结果(FDR < 0.05, 表 5)。其中生物学过程的结果最多, 有13个, 主要涉及认知学习或记忆过程、胆碱能过程、神经系统过程、突触传递、代谢过程等方面; 分子功能结果有7个, 主要包括乙酰胆碱受体活性、乙酰胆碱酯酶活性和β-淀粉样蛋白结合等方面; 细胞组成结果有11个, 主要关于突触部分、树突部分和神经元细胞体等方面。
| Table 5 List of GO enrichment results to target network of Kai Xin San related to Alzheimer. BP: Biological process; MF: Molecular function; CC: Cellular component; FDR: False discovery rate |
通过DAVID数据库对开心散治疗阿尔茨海默病涉及的8个蛋白在信号通路中的作用进行研究, 根据P < 0.05得到5条通路(表 6), 包括胆碱能突触、钙信号通路和PI3K-Akt信号通路等通路。研究表明[23], 胆碱能突触传递和Aβ对记忆的神经毒性之间可能存在联系, Aβ42过度表达能明显减少神经元的胆碱能突触传递, 结果造成短期记忆损害。有文献表明, 激活钙信号通路可以对抗Aβ的神经毒性保护神经细胞[24]。此外, Aβ可以通过抑制PI3K-Akt信号通路激活GSK3β, 增加tau蛋白磷酸化加重AD发病。所以激活PI3K-Akt信号通路抑制tau蛋白磷酸化治疗AD具有重要意义[25]。Li[26]发现, 开心散能降低快速老化小鼠模型AchE活性, 减少Aβ沉积, 降低tau蛋白和p-tau蛋白含量来改善学习记忆功能。
| Table 6 List of pathway enrichment results to target network of Kai Xin San related to alzheimer |
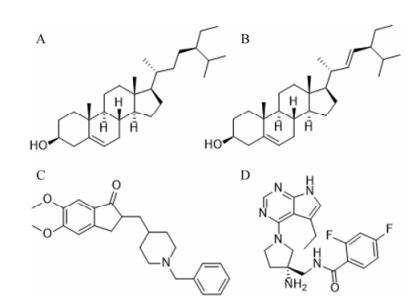
Beta-sitosterol、stigmasterol、donepezil和GSK3β抑制剂的分子结构如图 2;开心散活性成分配体与阿尔茨海默病蛋白受体的对接结果如表 7;分子对接过程如图 3; LibDockscore代表分子对接吻合度, 分数越高代表配体与受体蛋白结合性越好。分子对接结果表明, 开心散活性成分与AchE蛋白分子对接吻合度大于与GSK3β蛋白分子对接吻合度, 网络药理学筛选结果中AchE蛋白的网络度也高于GSK3β蛋白, 而且在富集分析中胆碱能通路排名也在PI3K-Akt信号通路之前, 该结果说明分子对接结果与网络药理学筛选结果一致, 用分子对接的方式验证了网络药理学的可靠性。但是开心散活性成分与阳性药盐酸多奈哌齐和GSK3β抑制剂相比, 分子对接吻合度不如上市的阳性药物效果好。
|
Figure 2 Chemical structures of beta-sitosterol (A), stigmasterol (B), donepezil (C) and GSK3β inhibitor (D) |
| Table 7 Results of ligand-receptor protein molecular docking |

|
Figure 3 Results of molecular docking. A: Donepezil and AchE; B: Stigmasterol and AchE; C: Beta-sitosterol and AchE; D: GSK3β inhibitor and GSK3β; E: Stigmasterol and GSK3β; F: Beta-sitosterol and GSK3β |
通过网络药理学分析发现, COX2和AchE是成分-靶点-疾病网络中网络度最好的靶点, 说明COX2和AchE可能是核心靶点。在动物实验中发现鼠模型脑中的COX2过度表达可促进Aβ的产生从而出现记忆能力衰退[27]。乙酰胆碱(Ach)是胆碱能传导通路重要的神经递质。AchE是Ach水解酶, 研究表明[28]在AD患者大脑中Ach含量降低, 则表现为AchE活性增高。参芪醒脑方可通过降低脑内AchE的含量来治疗阿尔茨海默病[29]。开心散也可以通过抑制GSK3β防止tau蛋白过度磷酸化, 通过CHRNA7多态性调节突触前神经递质的释放和胆碱能神经传递等多途径治疗AD。反向药效团匹配结果表明: beta- asarone、onjixanthone I、perlolyrine、dehydroeburicoic acid、beta-sitosterol等16个活性成分与COX2对接, 预测该16个活性成分通过减少COX2的释放, 减轻炎症反应治疗AD; α-spinasterol、onjixanthone I、ergosterol peroxide、deoxyharringtonine、stigmasterol等活性成分与AchE和胆碱能受体相互作用, 预测可能通过胆碱能信号通路治疗AD; beta-sitosterol、suchilactone、fumarine、inermin、frutinone A、girinimbin等成分与GSK3β对接, 预测其可能抑制tau蛋白过度磷酸化, 减少Aβ沉积治疗AD。
通过GO功能和KEGG富集分析发现, 开心散治疗阿尔茨海默病主要通过胆碱能突触信号通路, 可能降低乙酰胆碱酯酶活性, 也可能作用于CHRM1和CHRM2胆碱能受体和CHRNA7来治疗AD。同时GSK3β与PI3K-Akt信号通路有关, Qi等[30]发现, 温郁挥发油通过PI3K-Akt信号通路, 降低AD模型小鼠脑内tau蛋白磷酸化发挥抗AD的疗效。因此, 开心散可能通过PI3K-Akt信号通路抑制tau蛋白过度磷酸化治疗AD。钙信号通路在AD发病进展中有重要作用, Aβ沉积导致神经元钙离子浓度升高, 引发神经元凋亡而使记忆下降, 因此平衡钙离子浓度稳定治疗AD具有研究意义[31]。
结论本研究基于网络药理学方法对开心散治疗阿尔茨海默病的活性成分和作用机制进行了分析, 并通过Discovery Studio分子对接软件验证开心散活性成分与重要靶点之间存在较好的结合活性, 验证了网络药理学预测靶点的可靠性。建立成分-靶点-疾病网络图发现, 开心散中三萜类化合物、口山酮类化合物、挥发油类化合物和甾类化合物等药效成分可能通过减轻炎症反应, 降低乙酰胆碱酯酶活性, 通过PI3K-Akt信号通路抑制tau蛋白过度磷酸化, 稳定钙离子浓度减少神经元凋亡而发挥治疗AD的作用, 说明中药多成分-多靶点-多通路治疗疾病, 为发病机制复杂的阿尔茨海默病提供了研究方向。
| [1] | Selkoe DJ. Alzheimer's disease: genes, proteins, and therapy[J]. Physiol Rev, 2001, 81: 741–766. DOI:10.1152/physrev.2001.81.2.741 |
| [2] | Yang L, Chai Y, Fang F, et al. The pathogenesis and treatment of Alzheimer's disease[J]. Yunnan J Trad Chin Med Mat Med (云南中医中药杂志), 2014, 35: 88–90. |
| [3] | Wang TT. Kaixinsan Ingredients on Behalf of BDNF Signal Transduction Pathways Activated Drug-Confirm Network Target (开心散代表性成分激活CREB-BDNF信号转导通路的药物—网络靶标研究)[D]. Beijing: School of Military Medicine, PLA General Hospital, PLA Medical College, 2014. http://cdmd.cnki.com.cn/article/cdmd-90115-1015521808.htm |
| [4] | Shang CM, Zhao ML. Influence of ginsenoside-Rg2 on scopolamine-induced learning and memory impairment in mice and its mechanism[J]. J Pract Diagn Ther (中华实用诊断与治疗杂志), 2017, 31: 444–447. |
| [5] | Li FR, Chou LL, Fan XT. Experimental studies on effects of EEPP on learning and memory dysfunctions[J]. J Beihua Univ (北华大学学报), 2011, 12: 172–176. |
| [6] | Ma YX, Li GY, Liu J, et al. Effect of β-asarone on synaptic plasticity of hippocampal neurons in rats with Alzheimer's disease[J]. Guangdong Med J (广东医学), 2017, 38: 1489–1492. |
| [7] | Hopkins AL. Network pharmacology[J]. Nat Biotechnol, 2007, 25: 1110–1111. DOI:10.1038/nbt1007-1110 |
| [8] | Pang XC, Liu AL, Du GH. Review on the application of drug target database[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1969–1972. |
| [9] | Ru JL. Construction and Utilization of Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (中药系统药理学数据库和分析平台的构建和应用)[D]. Yangling: Northwest A & F University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015332723.htm |
| [10] | Zheng C, Pei T, Huang C, et al. A novel systems pharmacology platform to dissect action mechanisms of traditional Chinese medicines for bovine viral diarrhea disease[J]. Eur J Pharm Sci, 2016, 94: 33–45. DOI:10.1016/j.ejps.2016.05.018 |
| [11] | Qin W, Ho L, Pompl PN, et al. Cyclooxygenase (COX)-2 and COX-1 potentiate β-amyloid peptide generation through mechanisms that involve γ-secretase activity[J]. J Biol Chem, 2003, 278: 50970–50977. DOI:10.1074/jbc.M307699200 |
| [12] | Um HS, Kang EB, Koo JH, et al. Treadmill exercise represses neuronal cell death in an aged transgenic mouse model of Alzheimer's disease[J]. Neurosci Res, 2011, 69: 161–173. DOI:10.1016/j.neures.2010.10.004 |
| [13] | Gao Y, Gao L, Gao XX, et al. An exploration in the action targets for antidepressant bioactive components of Xiaoyaosan based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2015, 50: 1589–1595. |
| [14] | Zhang WJ, Wang YH. The theory and methods of systems pharmacology and its application in traditional Chinese medicine[J]. World Chin Med (世界中医药), 2015, 10: 280–286. |
| [15] | Huang DW, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4: 44. DOI:10.1038/nprot.2008.211 |
| [16] | Li ZQ. Effects of Modified Kaixin Powder on Behavior and Acetylcholine Esterase Mrna in Vascular D Ementia Rat. MS Thesis (开心散加减对血管性痴呆大鼠行为学和AchE mRNA的影响)[D]. Guangzhou: Ji'nan University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10559-2007191272.htm |
| [17] | Zhang JJ, Meng FX, Ma T, et al. Protective effect of Tianqi Yizhi granule on inflammatory reaction in rats with Alzheimer's disease[J]. Glob Tradit Chin Med (环球中医药), 2017, 10: 688–691. |
| [18] | Bao J, Wang GX. Mechanism of COX-2/PGE-2 and IL-6 in Wnt/β-catenin-bone metabolism signaling pathway[J]. Chin J Sports Med (中国运动医学杂志), 2012, 31: 76–81. |
| [19] | Wang JJ, Tian Q. Excessive phosphorylation of Tau protein and its role in neuronal degeneration in Alzheimer's disease[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2012, 39: 771–777. DOI:10.3724/SP.J.1206.2012.00333 |
| [20] | Ancín I, Barabash A, Vázquez- lvarez B, et al. Evidence for association of the non-duplicated region of CHRNA7 gene with bipolar disorder but not with schizophrenia[J]. Psychiatr Genet, 2010, 20: 289–297. DOI:10.1097/YPG.0b013e32833a9b7a |
| [21] | Braga IL, Silva PN, Furuya TK, et al. Effect of APOE and CHRNA7 genotypes on the cognitive response to cholinesterase inhibitor treatment at different stages of Alzheimer's disease[J]. Am J Alzheimers Dis Other Demen, 2015, 30: 139–144. DOI:10.1177/1533317514539540 |
| [22] | Joo EJ, Lee KY, Kim HS, et al. Genetic association study of the alpha 7 nicotinic receptor (CHRNA7) with the development of schizophrenia and bipolar disorder in korean population[J]. Psychiatr Investig, 2010, 7: 196–201. DOI:10.4306/pi.2010.7.3.196 |
| [23] | Fang LQ, Xu JJ, Fu SB. Toxic effects of amyloid-β peptides on cholinergic synapses in transgenic Drosophila models of Alzheimer's disease[J]. J Int Neurol Neurosurg (国际神经病学神经外科学杂志), 2013, 4: 299–303. |
| [24] | Wang XL, Deng YX, Guan ZZ, et al. Effects of α7 neurotype nicotine receptor on synaptic function and calcium signaling pathway and neuroprotective mechanism in Alzheimer's disease[J]. Acta Neuropharmacol (神经药理学报), 2018, 8: 35–37. |
| [25] | Yin G. PI3K/Akt Signaling Pathway in Alzheimer's Disease (PI3K/Akt信号通路在AD发病中的作用)[D]. Wuhan: Huazhong University of Science and Technology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10487-1011110173.htm |
| [26] | Li MH. The Pharmacological Action and Mechanism of Six Kaixinsan Prescriptions on Alzheimer's Disease (6首开心散类方对阿尔茨海默症的药理作用及机制初探)[D]. Beijing: Beijing University of Chinese Medicine, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10026-1016069848.htm |
| [27] | Sheng T. Drug-likeness Analysis on the Compounds in Traditional Chinese Medicines[C]. Summary of the 14th Session of the 28th Annual Academic Meeting of the Chinese Chemical Society (中国化学会第28届学术年会第14分会场摘要集). Chengdu: Chinese Chemical Society, 2012: 23. |
| [28] | Kwakowsky A, Milne MR, Waldvogel HJ, et al. Effect of estradiol on neurotrophin receptors in basal forebrain cholinergic neurons: relevance for Alzheimer's disease[J]. Int J Mol Sci, 2016, 17: E2122. DOI:10.3390/ijms17122122 |
| [29] | Jia XY, Zhang L, Luo Y. Effects of shenqi xingnao prescription on learning and memory ability, contents of choline acetyltransferase and acetylcholine esterase in brain tissue of mice models with Alzheimer disease[J]. Chin J Inf Tridit Chin Med (中国中医药信息杂志), 2018, 25: 56–61. |
| [30] | Qi Y, Qin WY, Kang K, et al. Effects of Wenyujin essential oil on tau protein phosphorylation in mice with Aβ-induced Alzheimer disease through PI3k/Akt pathway[J]. Chin J Inf Tridit Chin Med (中国中医药信息杂志), 2017, 24: 45–48. |
| [31] | Lu BL, Li WW, Zhou J. Progress in calcium signaling and Alzheimer's disease research[J]. Chin J Gerontol (中国老年学杂志), 2017, 37: 104. |
 2018, Vol. 53
2018, Vol. 53


