2. 南京中医药大学 江苏省方剂高技术研究重点实验室, 江苏 南京 210023
2. Jiangsu Province Key Laboratory of High Technology Research, Nanjing University of Chinese Medicine, Nanjing 210023, China
中药复方基于“整体观”、“辨证论治”的理论, 具有多成分、多靶点、多途径协同作用的特点, 作用机制复杂, 采用“一靶点、一药物”的模式阐述其作用机制困难较多[1]。然而, 随着公共生物医学数据的迅速发展, 网络药理学方法应运而生, 为阐明中药复方作用机制提供了一条新途径[2]。网络药理学是基于系统生物学、多向药理学和分子网络分析的一门新兴学科, 网络药理学技术的运用对于理解中药复方的整体性、互补性和协同性具有重要作用。
黄连解毒汤是清热解毒的传统名方, 该方由黄连、黄芩、黄柏和栀子四味中药组成, 具有清热泻火、解毒的功效。大量研究表明, 黄连解毒汤在肿瘤、糖尿病、关节炎、缺血性脑卒中和肝脏疾病等多种疾病中发挥着重要作用, 而代谢重编程启动的免疫细胞活化和炎症反应则参与了上述疾病的发生发展过程[3-6]。基于代谢调控网络调节免疫细胞功能有可能是黄连解毒汤抗炎作用的潜在生化机制, 本文将利用网络药理学分析技术, 对黄连解毒汤调节巨噬细胞炎症反应、糖酵解、鞘磷脂代谢和谷氨酰胺代谢等方面的多成分、多靶点、多通路的相互作用规律和调控网络进行了挖掘和分析, 以期为后续深入研究黄连解毒汤调控炎症的作用机制和发展新的有价值的药物奠定基础。
材料与方法软件与数据库 TCMSP数据库(http://lsp.nwsuaf.edu.cn/tcmsp.php)、Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)、PharmMapper数据库(http://lilab.ecust.edu.cn/pharmmapper/index.php)、OMIM数据库(http://www.omim.org/)、DAVID数据库(https://david.ncifcrf.gov/)、Kyoto Encyclopediaof Genes and Genomes (KEGG)通路数据库(http://www.Genome.jp/kegg/)、GENEMANIA数据库(http://genemania.org/)、System Dock Database Site数据库(http://systemsdock.unit.oist.jp)、Cytoscape 3.2.1软件。
黄连解毒汤中活性成分的筛选 黄连解毒汤包含黄连、黄芩、黄柏、栀子四味中药, 将这四味中药以中文名称作为关键词分别输入TCMSP数据库进行检索, 所得结果按照口服吸收利用度(OB) > 30%、药物相似性(DL) > 0.18进行筛选, 筛选后所得成分作为黄连解毒汤的活性成分。
黄连解毒汤中活性成分潜在靶点预测 将黄连解毒汤中筛选得到的活性成分以成分名作为关键词输入Pubchem数据库中进行检索, 查找并保存各活性成分的3D结构式为SDF (.sdf)格式, 再将各活性成分的3D结构式提交到PharmMapper数据库中进行靶点预测, 依次选择参数[7]: Generate Conformers-Yes; Maximum Generated Conformations-100; Select Targets Set-Human Protein Targets Only (2 241); Number of Reserved Matched Targets (Max 1 000)-100, 得到与各化合物相关的靶点名称(target name)、基因名称(gene)、Uniprot ID、匹配值(fit score)等结果。根据匹配值筛选前10个靶点作为该化合物的重要靶点蛋白。
炎症巨噬细胞靶点和代谢靶点预测 分别将“inflammation”、“macrophages”作为关键词输入OMIM数据库检索与炎症、巨噬细胞相关的靶点蛋白, 将“glycolysis”、“sphingolipid metabolism”、“glutamine metabolism”作为关键词输入OMIM数据库检索与糖酵解、鞘脂代谢、谷氨酰胺代谢相关的靶点蛋白, 整理这些靶点蛋白并与筛选得到的活性成分的靶点蛋白进行匹配, 得到黄连解毒汤中与炎症巨噬细胞相关靶点和代谢靶点。
相关通路的注释和分析 以标准基因名的形式将活性成分的相关靶点基因列表导入DAVID数据库, 依次勾选OFFICIAL_GENE_SYMBOL (官方基因标志)、Gene list、Submit list, 选择基因功能分类工具, 修改背景为人类, 选择Pathway得到“KEGG- Pathway”相关数据, 保存数据并挑选P < 0.01的通路作为可靠通路, 结合KEGG数据库进行通路注释和分析。
构建黄连解毒汤中抗炎和代谢作用的“药效成分-靶点-通路”网络关系图 将黄连解毒汤中的活性成分、对应预测靶点和通路分析结果, 在Excel表中分别构建“活性成分-靶点”、“靶点-通路”之间的相互关系, 然后将其导入Cytoscape软件中建立“活性成分-靶点”、“靶点-通路”网络关系图, 利用软件中Merge功能, 将两个网络图合并得到“活性成分-靶点-通路”网络。图中以活性成分、靶点蛋白和通路为3类节点(node), 它们之间的相互关系分别用边(edge)相连表示。利用软件中网络分析功能对所得网络进行分析, 以度(degree)、边介数(edge betweenness)分别反映网络中节点的大小和边的粗细。
蛋白质相互作用关系分析 将筛选得到的炎症巨噬细胞靶点蛋白和代谢靶点蛋白以标准基因名的形式上传到GENEMANIA数据库, 进行蛋白与蛋白之间的相互作用分析, 得到蛋白质相互作用网络图, 整理网络布局并保存图片。
主要活性成分-靶点分子对接 利用Systems Dock Web Site数据库, 将黄连解毒汤中主要药效成分小檗碱、黄芩苷和栀子苷与蛋白相互作用分析得到的5个共有靶点进行分子对接验证。登陆Systems Dock Web Site数据库, 依次上传靶点名称/PDB ID、小檗碱、栀子苷、黄芩苷SDF (.sdf)格式的3D结构式, 成功后开始对接, 整理对接结果中的Docking Score并分析。
结果 1 黄连解毒汤中有效成分筛选将黄连、黄芩、黄柏和栀子作为关键词分别输入TCMSP数据库进行检索后, 共得到429个成分, 其中黄连48个、黄芩143个、黄柏140个、栀子98个。根据各个成分的吸收、分布、代谢、排泄(ADME)参数中口服吸收利用度OB > 30%、药物相似性DL > 0.18进行筛选, 共得到84个活性成分。将这84个活性成分进行结构分类, 其中属于生物碱类的成分有17个, 包括小檗碱、表小檗碱、巴马汀等; 属于环烯醚萜类成分有1个, 为京尼平1-β-龙胆二糖苷; 属于黄酮类的成分有33个, 包括汉黄芩苷、去甲基汉黄芩苷、槲皮素等; 其他类成分有33个, 包括豆甾醇、谷甾醇、山奈酚等。
2 黄连解毒汤中活性成分潜在靶点蛋白信息黄连解毒汤中筛选得到的84个活性成分共涉及111个靶点蛋白, 与炎症相关的靶点蛋白有20个, 其中炎症靶点中与巨噬细胞相关的靶点蛋白有13个, 出现频度最多的靶点蛋白为丝裂原活化蛋白激酶8 (MAPK8)、氧化型胆固醇受体LXRβ (oxysterolsreceptor LXR-beta)等, 详细信息见表 1。将这13个靶点蛋白对应84个活性成分, 其中有38个活性成分可作用于这些靶点。
| Table 1 Target proteins associated with inflammation in Huanglian Jiedu Decoction (HLJDT) |
与糖酵解、鞘脂代谢和谷氨酰胺代谢相关的靶点共有34个, 出现频度最多的靶点蛋白为醛-酮还原酶家族1成员C2 (AKR1C2)、雄激素受体(AR)等, 详细信息见表 2。将这34个靶点对应84个活性成分, 显示84个活性成分都可作用于这些靶点。
| Table 2 Target proteins associated with metabolism in HLJDT |
将黄连解毒汤中与巨噬细胞炎症相关的13个靶点蛋白以标准基因名的形式输入DAVID数据库中进行KEGG通路注释和分析, 筛选P值小于0.01的通路作为潜在通路, 共得到14条代谢通路, 涉及4种类别, 其中与疾病相关的通路有4条, 与信号转导相关的通路有7条, 与细胞过程相关的通路有2条, 与感官系统相关的通路有1条, 详细信息见表 3。
| Table 3 Classification and information of macrophage-related pathways in HLJDT |
采用相同的方法对与糖酵解、鞘脂代谢、谷氨酰胺代谢相关的靶点蛋白进行通路注释和分析, 得到8条代谢通路, 涉及3种类别, 其中与疾病相关的通路有4条, 与信号转导相关的通路有3条, 与细胞过程相关的通路有1条, 详细信息见表 4。
| Table 4 Classification and information on metabolism-related pathways in HLJDT |
采用Cytoscape 3.2.1软件分别构建炎症巨噬细胞相关“活性成分-靶点-通路”网络模型图(图 1)、代谢相关“活性成分-靶点-通路”网络模型图(图 2), 以度(degree)的大小反映节点的大小, 以边介数(betweenness)反映边的粗细。
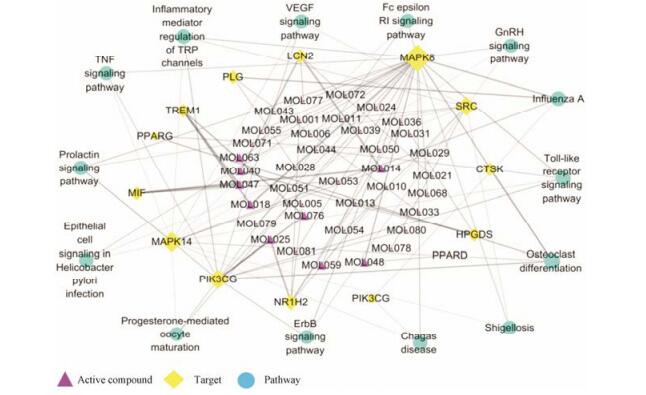
|
Figure 1 The "active compound-target-pathway" network of anti-inflammatory from HLJDT |
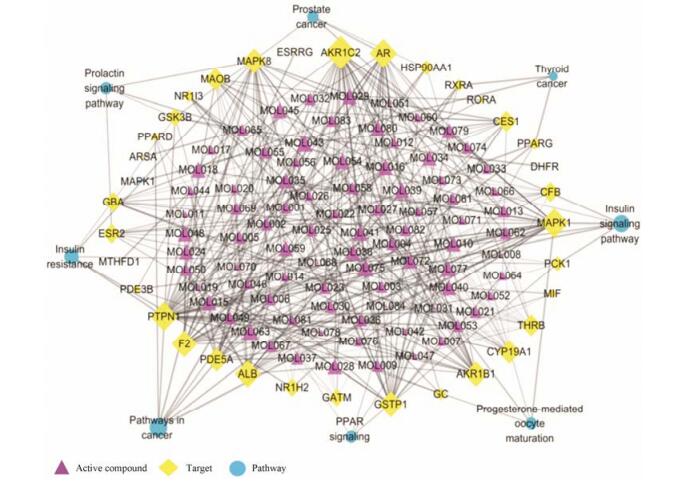
|
Figure 2 The "active compound-target-pathway" network of metabolism from HLJDT |
如图 1所示为炎症巨噬细胞相关“活性成分-靶点-通路”网络模型图, 图中共有65个节点, 其中38个为活性成分, 13个为靶点蛋白, 14个为代谢通路, 它们由202条边相连构成一个完整的网络。如图 2所示为代谢相关“活性成分-靶点-通路”网络模型图, 图中共有126个节点, 其中84个为活性成分, 34个为靶点蛋白, 8个为代谢通路, 它们通过354条边相连构成一个完整的网络。
5 蛋白质相互作用关系分析将13个与巨噬细胞相关的靶点蛋白和34个与糖酵解、鞘脂代谢、谷氨酰胺代谢相关的靶点蛋白以标准基因名的形式输入GENEMANIA数据库, 得到蛋白质相互作用关系网络图, 如图 3所示, 位于图片最内侧的为巨噬细胞炎症相关靶点蛋白, 最外侧为糖酵解、鞘脂代谢、谷氨酰胺代谢相关靶点蛋白, 中间5个靶点蛋白为炎症和代谢共有的靶点蛋白, 分别为丝裂原活化蛋白激酶8 (MAPK8)、氧化型胆固醇受体LXRβ (NR1H2)、巨噬细胞移动抑制因子(MIF)、过氧化物酶体增殖物激活受体δ (PPARD)、过氧化物酶体增殖物激活受体γ (PPARG)。蛋白之间相互作用主要通过物理相关性、蛋白共表达、共享蛋白域、预测、共定位、基因相关性和通路表现出来。其中, 物理相关性占34.47%、预测占28.41%、蛋白共表达占13.62%、共享蛋白域占11.30%、共定位占8.32%、基因相关性占2.61%、通路占1.26%。

|
Figure 3 Network diagram of protein interactions |
选择黄连解毒汤中主要的药效成分小檗碱、栀子苷和黄芩苷, 与结果5中得到的5个靶点MAPK8、NR1H2、MIF、PPARD、PPARG分别进行分子对接, 对接结果如表 5所示。一般认为Docking Score值大于4.25表示对接分子与靶点之间有一定的结合活性, 大于5.0表明对接分子与靶点之间有较好的结合活性, 大于7.0则说明具有强烈的结合活性[8]。分子对接结果显示小檗碱、黄芩苷、栀子苷与MAPK8、NR1H2、MIF、PPARD、PPARG的Docking Score值均大于5.0, 并且黄芩苷与PPARD的Docking Score值为7.024 > 7.0, 由此表明小檗碱、黄芩苷和栀子苷与这5个靶点均有较好的结合活性, 并且黄芩苷与PPARD有强烈的结合活性。
| Table 5 Molecular docking results between major drug ingredients and targets |
黄连解毒汤是清热解毒的传统名方, 具有保护脑神经元、降血糖、抗炎、抗肿瘤等作用[9-12], 本文利用网络药理学分析技术, 对黄连解毒汤调节巨噬细胞炎症反应、糖酵解、鞘脂代谢和谷氨酰胺代谢等方面的多成分、多靶点、多通路的相互作用规律和调控网络进行了挖掘和分析。由黄连解毒汤“活性成分-靶点-通路”网络可知:同一个活性成分可以通过同一个靶点与不同的代谢通路相连, 也可以通过不同的靶点与相同的代谢通路相连, 这与黄连解毒汤“多成分、多靶点、多途径”的特点符合。
黄连解毒汤中发挥药效作用的成分主要为生物碱、环烯醚萜和黄酮类成分, 本文筛选得到的84个活性成分中属于生物碱类的成分有17个, 环烯醚萜类成分有1个, 黄酮类的成分有33个, 其他类成分有33个。小檗碱、栀子苷和黄芩苷是黄连解毒汤的主要药效成分, 本课题组[13]在前期对小檗碱、栀子苷和黄芩苷在脑组织中的分布进行研究, 研究表明黄连解毒汤的主要药效成分可以透过血脑屏障进入脑组织发挥作用。
靶点预测结果显示, 黄连解毒汤中与巨噬细胞炎症相关的靶点有丝裂原活化蛋白激酶8、氧化型胆固醇受体LXRβ、原癌基因酪氨酸蛋白激酶Src、中性粒细胞明胶酶相关脂质运载蛋白、磷脂酰肌醇4, 5-二磷酸3-激酶催化亚基γ同种型等13个靶点蛋白, 涉及14条代谢通路, 其中与炎症相关的通路有Toll样受体信号通路、FcεRI信号通路、ErbB信号通路、TNF信号通路。与糖酵解、鞘脂代谢、谷氨酰胺代谢相关的靶点有醛-酮还原酶家族1成员C2、雄激素受体、酪氨酸蛋白磷酸酶非受体1型、血清白蛋白、凝血酶原等34个靶点, 涉及8条通路, 其中与三大代谢相关的通路有胰岛素信号通路、PPAR信号通路、催乳素信号通路。
黄连解毒汤巨噬细胞炎症相关靶点和代谢相关靶点的蛋白质相互作用网络结果显示, 巨噬细胞炎症靶点与代谢靶点可以通过多种途径相互作用, 其中MAPK8、NR1H2、MIF、PPARD、PPARG这5个靶点在巨噬细胞炎症靶点和鞘脂代谢、谷氨酰胺代谢靶点中都存在, 利用分子对接技术, 将黄连解毒汤中的主要药效成分小檗碱、栀子苷和黄芩苷与这5个靶点进行分子对接。对接结果表明小檗碱、栀子苷和黄芩苷与这5个靶点都具有较好的结合活性, 并且黄芩苷与PPARD有强烈的结合活性, 提示黄连解毒汤可能通过这5个靶点影响鞘脂代谢、谷氨酰胺代谢过程, 影响代谢调控网络从而对免疫细胞功能进行调节, 发挥抗炎作用。
通路结果也显示, MAPK8参与调控Toll样受体信号通路、FcεRI信号通路、ErbB信号通路、GnRH信号通路、TNF信号通路等炎症通路, 同时, 还参与调控胰岛素信号通路、催乳素信号通路等能量代谢通路; PPARD和PPARG调控PPAR信号通路。MAPK8是c-Jun氨基末端激酶1 (JNK1), 属于丝氨酸/苏氨酸(Ser/Thr)蛋白激酶, 应激反应发生时主要通过对JNK1调节实现对JNK整个信号通路的调控。研究表明, 炎症状态下可以活化巨噬细胞炎性标志物JNK蛋白磷酸化[14-16], Guo[17]研究发现小檗碱可以抑制JNK蛋白磷酸化, 并且通过小檗碱干预后的巨噬细
胞调节液与脂肪细胞作用等表明小檗碱可能通过抑制巨噬细胞炎症信号通路及炎性基因表达和分泌, 改善胰岛素抵抗。由此推测, 黄连解毒汤可能通过小檗碱与MAPK8蛋白作用抑制其磷酸化, 从而调控JNK信号通路抑制巨噬细胞炎症发生, 进而影响机体的能量代谢过程。PPARD和PPARG是过氧化物酶体增殖物激活受体PPARs的两种亚型, 是参与体内脂质代谢调节的核转录因子[18], 不仅广泛参与机体的脂质代谢、糖代谢、能量代谢过程, 在炎症过程中也发挥重要作用[19]。Jin等[20]研究表明, 黄连解毒汤干预后的高脂血症大鼠肝脏中PPARG的mRNA表达水平明显升高; Liu等[21]研究也表明小檗碱可以抑制脂肪细胞分化相关基因PPARG的mRNA和蛋白表达, 抑制脂肪细胞活化, 进而减少脂肪的积聚。并且, 脂肪细胞是产生促炎细胞因子的重要场所, 在肥胖状态下, 脂肪细胞会分泌一系列细胞因子从而诱发免疫和炎症过程[22]。因此, 黄连解毒汤可能通过上调组织中PPARG的mRNA表达从而调节脂质代谢紊乱, 或者通过抑制脂肪组织中PPARG的mRNA表达, 减少脂肪组织的分化, 从而减少促炎细胞因子的分泌进而减少炎症过程的发生。
上述得出的5个重要靶点均为鞘脂代谢、谷氨酰胺代谢和巨噬细胞炎症中共有的靶点, 因此猜测黄连解毒汤可能通过影响鞘脂代谢和谷氨酰胺代谢过程中代谢产物或相关酶从而影响炎症过程。鞘脂是一类以鞘氨醇为骨架的较复杂的化合物, 在维持细胞生长、信号转导、炎症过程中发挥重要作用, 鞘脂代谢异常会产生包括阿尔兹海默病、动脉粥样硬化、糖尿病、心肌病、癌症等多种疾病[23-25]。神经酰胺(Cer)是细胞内鞘脂代谢的中心[26], 具有诱导细胞凋亡、调节细胞分化、细胞免疫、炎症反应[27]等生物学功能。脑组织中Cer水平的升高, 一方面会对神经元产生毒性作用; 另一方面也会促进细胞因子IL-2和IL-6的产生, 引起神经炎症[28, 29], 而实验室前期研究[30]结果表明, 黄连解毒汤可以显著下调APP/PS1模型小鼠血浆和脑组织代谢物中Cer的含量。1-磷酸鞘氨醇(S1P)是具有生物活性的鞘脂代谢产物, 研究表明, 1-磷酸鞘氨醇受体激动剂TFY720可能通过与巨噬细胞表面的S1P受体结合, 抑制IL-23产生, 进而减少IL-17、IL-1β、TNF-α和MMP-3表达, 从而调控炎症反应[31], 实验室前期研究表明, 小檗碱预处理后的神经元中S1P发生显著上调[32]。谷氨酰胺是谷氨酰胺代谢的重要代谢物质, 为供能和生物合成提供主要的碳源和氮源。研究表明, 经脂多糖(LPS)刺激的巨噬细胞分泌IL-6和TNF-α的多少依赖于细胞外谷氨酰胺的可用量[33], 并且多项动物研究也表明谷氨酰胺的利用可以提高动物感染后的存活率, 体外研究和临床结果均表明谷氨酰胺对人免疫细胞数量和功能有促进作用[34]。由此推测, 黄连解毒汤可能通过调节鞘脂代谢和谷氨酰胺代谢过程中代谢产物的含量, 进而调控炎症过程的发生。
结论通过网络药理学技术, 将黄连解毒汤中四味中药进行活性成分筛选, 根据得到的活性成分进行靶点预测、通路分析、蛋白相互作用分析和分子对接分析, 构建“活性成分-靶点-通路网路”和蛋白相互作用网络, 发现黄连解毒汤可能通过作用于MAPK8、NR1H2、MIF、PPARD、PPARG等糖酵解、鞘脂代谢和谷氨酰胺代谢的相关靶点, 影响代谢过程中的有关代谢产物或酶而影响代谢调控网络, 从而对巨噬细胞炎症反应进行调节。
| [1] | Liu AL, Du GH. Network pharmacology: new guidelines for drug discovery[J]. Acta Pharm Sin (药学学报), 2010, 45: 1472–1477. |
| [2] | Liu ZH, Sun XB. Network pharmacology: new opportunity for the modernization of traditional Chinese medicine[J]. Acta Pharm Sinica (药学学报), 2012, 47: 696–703. |
| [3] | Wang PR, Wang JS, Yang MH, et al. Neuroprotective effects of Huang-Lian-Jie-Du-Decoction on ischemic stroke rats revealed by H NMR metabolomics approach[J]. J Pharm Biomed Anal, 2014, 88: 106–116. DOI:10.1016/j.jpba.2013.08.025 |
| [4] | Hsu YL, Kuo PL, Tzeng TF, et al. Huang-lian-jie-du-tang, a traditional Chinese medicine prescription, induces cell-cycle arrest and apoptosis in human liver cancer cells in vitro and in vivo[J]. Gastroenterol Hepatol, 2008, 23: 290–299. DOI:10.1111/jgh.2008.23.issue-2 |
| [5] | Zhang XJ, Deng YX, Shi QZ, et al. Hypolipidemic effect of the Chinese polyherbal Huanglian Jiedu decoction in type 2 diabetic rats and its possible mechanism[J]. Phytomedicine, 2014, 21: 615–623. DOI:10.1016/j.phymed.2013.11.004 |
| [6] | Hu Y, Hu Z, Wang S, et al. Protective effects of Huang-Lian- Jie-Du-Tang and its component group on collagen-induced arthritis in rats[J]. Ethnopharmacol, 2013, 150: 1137–1144. DOI:10.1016/j.jep.2013.10.038 |
| [7] | Sun LM, Liu LF, Zhu HX, et al. Network pharmacology- based study on intervention mechanism of Huanglian Jiedu decoction in the treatment of Alzheimer's disease[J]. Acta Pharm Sin (药学学报), 2017, 52: 1268–1275. |
| [8] | Hsin KY, Ghosh S, Kitano H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8: e83922. DOI:10.1371/journal.pone.0083922 |
| [9] | Qian ZL, Li H, Zhu HX, et al. Preliminary study on the correlation between pharmacokinetics and pharmacodynamics of index components in Huanglian Jiedu decoction[J]. Chin J Exp Form (中国实验方剂学杂志), 2011, 17: 122–128. |
| [10] | Xiao YL, Lu FE, Xu LJ, et al. Effect of Huanglian Jiedu decoction on vascular endothelial function in type 2 diabetic rats[J]. China J Chin Mater Med (中国中药杂志), 2005, 30: 1767–1770. |
| [11] | Ma YL, Wang BB, Han JY, et al. Effect of Huanglian Jiedu decoction on local and aortic vascular local immune response in high-fat diet ApoE-/- mice[J]. Chin J Integr Tradit Chin Western Med (中国中西医结合杂志), 2013, 33: 1520–1525. |
| [12] | Sun Y, Wang JP, Zhang YL, et al. The inhibitory effect of Huanglian Jiedu Tang on mouse S180 transplanted tumor[J]. J Northeast Agric Univ (东北农业大学学报), 2013, 44: 63–67. |
| [13] | Peng SL, Liu LF, Zhu HX, et al. Effects of combination drugs and Huanglian Jiedu decoction on the bioactivity of berberine in rat brain[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2877–2882. |
| [14] | Ho YT, Yang JS, Li TC, et al. Berberine suppresses in vitro, migration and invasion of human SCC-4 tongue squamous cancer cells through the inhibitions of FAK, IKK, NF-κB, u-PA and MMP-2 and -9[J]. Cancer Lett, 2009, 279: 155–162. DOI:10.1016/j.canlet.2009.01.033 |
| [15] | Bae DS, Kim YH, Pan CH, et al. Protopine reduces the inflammatory activity of lipopolysaccharide-stimulated murine macrophages[J]. BMB Rep, 2012, 45: 108–113. DOI:10.5483/BMBRep.2012.45.2.108 |
| [16] | Akhter MH, Sabir M, Bhide NK. Possible mechanism of antidiarrhoeal effect of berberine[J]. Indian J Med Res, 1979, 70: 233–241. |
| [17] | Guo C. Berberine Improves Insulin Resistance by Inhibiting Infiltration of Adipose Tissue Macrophages (小檗碱通过抑制脂肪组织巨噬细胞浸润改善胰岛素抵抗的研究)[D]. Nanjing: Nanjing Univ Chin Med, 2015. |
| [18] | Curi TC, Melo MP, Azevedo RB, et al. Glutamine utilization by rat neutrophils: presence of phosphate dependent glutaminase[J]. Am J Physiol, 1997, 273: 1124–1129. DOI:10.1152/ajpcell.1997.273.4.C1124 |
| [19] | Yassad A, Lavoinne A, Bion A, et al. Glutamine accelerates IL-6 production by rat peritoneal macrophages in culture[J]. FEBS Lett, 1997, 413: 81–84. DOI:10.1016/S0014-5793(97)00881-8 |
| [20] | Jin J. Analysis of Chemical Constituents of Huanglian Jiedu Decoction and Its Effect on Anti-hyperlipidemia (黄连解毒汤化学成分分析及其抗高脂血症作用的研究)[D]. Changchun: Jilin University, 2008. |
| [21] | Liu Y, Lou SY, He YM, et al. Effects of berberine on the proliferation and differentiation-related genes PPARγ C/EBPα mRNA and protein expression in 3T3-L1 preadipocytes[J]. Chin J Integr Tradit Chin Western Med (中国中西医结合杂志), 2008, 28: 1005–1009. |
| [22] | Piao CL, Yang SY, Tong XL, et al. Discussion on prevention and treatment of obesity type 2 diabetes by Chinese medicine from the mechanism of adipose tissue inflammation[J]. J Rehabil (康复学报), 2009, 19: 61–63. |
| [23] | He X, Huang Y, Li B, et al. Deregulation of sphingolipid metabolism in Alzheimer's disease[J]. Neurobiol Aging, 2010, 31: 398–408. DOI:10.1016/j.neurobiolaging.2008.05.010 |
| [24] | Gemma C, Smith MA, Samar B, et al. Increased isoprostane and prostaglandin are prominent in neurons in Alzheimer disease[J]. Mol Neurodegener, 2007, 2: 2. DOI:10.1186/1750-1326-2-2 |
| [25] | Haughey NJ, Bandaru VV, Bae M, et al. Roles for dysfunctional sphingolipid metabolism in Alzheimer's disease neuropathogenesis[J]. Biochim Biophys Acta, 2010, 1801: 878–886. DOI:10.1016/j.bbalip.2010.05.003 |
| [26] | Hannun YA, Obeid LM. The ceramide-centric universe of lipid-mediated cell regulation: stress encounters of the 1ipid kind[J]. J Biol Chem, 2002, 277: 25847–25850. DOI:10.1074/jbc.R200008200 |
| [27] | Nakao S, Moriyama S, Segawa M, et al. C-2-ceramide inhibits the prostaglandin E-2-induced accumulation of cAMP in human gingival fibroblasts[J]. Mol Cancer Ther, 2010, 9: 1378–1395. DOI:10.1158/1535-7163.MCT-09-1131 |
| [28] | Ballou LR, Laulederkind SJ, Rosloniec EF, et al. Ceramide signalling and the immune response[J]. Biochim Biophys Acta, 1996, 1301: 273–287. DOI:10.1016/0005-2760(96)00004-5 |
| [29] | Cutler RG, Kelly J, Storie K, et al. Involvement of oxidative stress-induced abnormalities in ceramide and cholesterol metabolism in brain aging and Alzheimer's disease[J]. Proc Nat Acad Sci U S A, 2004, 101: 2070–2075. DOI:10.1073/pnas.0305799101 |
| [30] | Sun LM, Zhu BJ, Cao HT, et al. Explore the effects of Huang-Lian-Jie-Du-Tang on Alzheimer's disease by UPLC- QTOF/MS-based plasma metabolomics study[J]. J Pharm Biomed Anal, 2017, 151: 75–83. |
| [31] | Sun GL, Sun W, Lan Q, et al. The sphingomyelin metabolism of cerebral ischemia[J]. Prog Mod Biomed (现代生物医学进展), 2015, 15: 1566–1569. |
| [32] | Zhang QC, Bian HM, Guo LW, et al. Berberine preconditioning protects neurons against ischemia via sphingosine-1- phosphate and hypoxia-inducible factor-1α[J]. Am J Chin Med, 2016, 44: 927–941. DOI:10.1142/S0192415X16500518 |
| [33] | Murphy CJ, Newsholme P. Importance of glutamine metabolism in murine macrophages and human monocytes to L-arginine biosynthesis and rates of nitrite or urea production[J]. Clin Sci, 1998, 95: 397–407. DOI:10.1042/cs0950397 |
| [34] | Ziegler TR, Daignault NM. Glutamine regulation of human immune cell function[J]. Nutrition, 2000, 16: 458–459. DOI:10.1016/S0899-9007(00)00359-2 |
 2018, Vol. 53
2018, Vol. 53


