2. 山西大学 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
3. 山西大学 大型仪器中心, 山西 太原 030006
2. Shanxi Key Laboratory of Active Constituents Research and Utilization of TCM, Shanxi University, Taiyuan 030006, China;
3. Scientific Instrument Center, Shanxi University, Taiyuan 030006, China
肾病综合征(NS)是一种由环境因素和遗传因素相互作用而引起的慢性代谢性疾病[1]。由各种原因引起的肾小球滤过膜通透性改变以及大量的尿蛋白产生是其主要特征和诱因, 且大量的尿蛋白会引起高血压和高脂血症, 从而促使肾小球硬化[2]。NS的发病机制非常复杂, 主要涉及循环和代谢系统。研究表明, 肾脏炎症、细胞凋亡、氧化应激和足细胞损伤与NS的病理特征[3-5]相关。在现有的抗肾病综合征药物中, 免疫抑制剂和糖皮质激素药物是治疗轻、中度肾病综合征的首选药物。然而, 免疫抑制疗法[6]可引起许多严重的不良反应, 如真菌感染、各种器官衰竭(心脏、肾脏和耳朵), 以及治疗后的快速复发。每日口服糖皮质激素的要求常常使患者依从性差, 限制了糖皮质激素在NS治疗中的使用[7]。此外, 免疫抑制剂和糖皮质激素药物在所有患者中并不普遍有效, 尽管它们是临床实践中肾病综合征的推荐药物。
黄芪总黄酮(total flavonoids of Astragali Radix, TFA)是从传统中药黄芪中分离出的黄酮类成分, 具有体内外抗炎作用、免疫作用、抑制内质网应激等生物活性。Guo等[8]研究了黄芪总黄酮对脂多糖刺激的RAW264.7细胞中炎症因子转录水平的影响, 得出黄芪总黄酮具有抗炎免疫的调节作用。Guo和Zhang[9, 10]均对黄芪总黄酮进行活性研究, 得出了黄芪总黄酮可以减少细胞凋亡, 并参与了细胞的抗氧化应激反应。本课题组前期实验得出黄芪总黄酮对肾病综合征有治疗作用。然而, 黄芪总黄酮多成分多靶点的调节作用, 使黄芪总黄酮治疗肾病综合征的作用机制仍不明确, 因此借助网络药理学的方法挖掘治疗肾病综合征的作用靶点与通路, 从系统生物学角度整体阐释黄芪总黄酮治疗肾病综合征的作用机制具有重要意义。
网络药理学是药理学中的新兴学科, 旨在以整体的方式了解药物在生物系统中的作用, 为理解药物成分与疾病靶点之间的复杂相互作用提供新的视角, 特别适合于多成分、多靶点、多途径的中药药效机制和物质基础研究。网络药理学对中药治疗疾病的作用机制研究越来越多, Wu等[11]基于网络药理学对柴胡抗抑郁的作用机制, 得出柴胡可能通过调节PI3K/Akt、MAPK、Rap1、Ras、FexO和neurotrophin等信号通路发挥抗抑郁作用。Zhai等[12]通过构建“成分-核心靶点-通路”网络模型, 预测二至丸主要干预胰岛素、FoxO、代谢通路与糖酵解等通路发挥保肝作用。
基于本课题组前期工作, 以多柔比星诱导的肾病大鼠为模型, 腹腔注射黄芪总黄酮后, 大鼠24 h尿蛋白、血清生化指标、组织病理切片等指标都有明显的改善, 且通过代谢组学的研究, 有68%代谢物有回调现象, 表明黄芪总黄酮对肾病综合征有确切疗效[13]。因此, 本文以黄芪中的黄酮类化合物为研究对象, 采用网络药理学方法阐释黄芪总黄酮多成分、多靶点、多途径的作用机制, 为后续实验提供理论依据。
材料与方法黄芪总黄酮化学成分的确定 将黄芪药材水提取液浓缩至0.5 g·mL-1, 将浓缩液通过预处理的AB-8大孔吸附树脂柱, 依次用20倍体积水、10倍体积10%乙醇、10倍体积35%乙醇进行洗脱, 收集35%乙醇洗脱液, 浓缩, 乙酸乙酯萃取3次, 浓缩至干, 80 ℃减压干燥24 h至恒重, 得黄芪总黄酮固体, 进而对其进行核磁与液质分析。对黄芪总黄酮的1H NMR图谱与UHPLC-Q-Exactive-Orbittrap-HRMS图谱鉴定出的化学成分[14]以及利用TCMSP数据库[15] (http://lsp.nwu.edu.cn/tcmsp.php)、TCMID数据库[16] (http://www.megabionet.org/tcmid/)整合的活性成分, 共同作为黄芪总黄酮的活性成分。因中药用药多为汤剂, 需通过吸收(absorption)、分布(distribution)、代谢(metabolism)和排泄(excretion)的过程发挥药效作用, 即ADME过程。通常, 中药有效成分的发现需要经过分离、提纯和结构鉴定等传统过程, 耗时耗力。为更有效地对中药有效成分进行研究, 计算机虚拟筛选方法应运而生, 通过模拟ADME过程筛选活性成分, 主要以脂溶性预测(AlogP)、口服利用度预测(OB%)、Caco-2渗透率预测、血脑屏障(BBB)、类药性(DL)等参数作为评价指标。其中OB和DL是用于筛选药物活性物质的重要参数, 是中药成分ADME的关键。OB指药物的有效成分或活性基被吸收到达体循环并被吸收的速度与程度; DL指药物包含一些特定的功能基团或者具有与大多数药物相同或相似的物理特征。因此利用TCMSP数据库与TCMID数据库, 筛选出同时满足OB≥30%和DL≥0.18的化学成分, 结合图谱鉴定出的化学成分共同作为黄芪总黄酮的活性成分。
黄芪总黄酮潜在作用靶点的筛选 筛选出的所有活性成分在PubChem数据库中下载其化学结构图的.sdf格式以及Smiles化学式。首先, 登录反向药效团匹配数据库“PharmMapper” (http://59.78.98.102/pharmmapper/submit_file.php), 上传黄芪总黄酮活性成分的.sdf格式文件, 然后选择Pharmacophore Models Whose Pkd≥6.0, 设置匹配的靶点数目为300, 点击submit, 即可得到每个活性成分对应得分排名前300的靶点。其次, 将活性成分对应的Smiles化学式输入到SEA (http://sea.bkslab.org/)与SIB (http://www.swisstargetprediction.ch/)数据库, 得到作用靶点。为提高作用靶点的准确度, 将这3个数据库得到的作用靶点取交集, 作为黄芪总黄酮潜在作用靶点, 即成分靶点。最后, 应用蛋白质数据库(UniProt)中UniProtKB搜索功能(http://www.uniprot.org/uniprot/), 通过输入靶点名称并限定物种为人, 将检索得到的所有靶点校正为其官方名称(official symbol)后, 获取与活性成分相关的靶点和Unitprot编号。
肾病综合征潜在作用靶点的筛选 利用在线文本挖掘服务器GeneCards (http://www.genecards.org/)、HOME-NCBI-GENE (https://www.ncbi.nlm.nih.gov/gene)、人类孟德尔遗传OMIM (http://www.omim.org/)数据库输入关键词查找分析相关的人类基因。通过输入关键词“nephrotic syndrome”得到与肾病综合征相关的作用靶点, 即疾病靶点。
靶点相互作用网络图构建与分析 将黄芪总黄酮成分靶点与肾病综合征疾病靶点取交集, 得到黄芪总黄酮治疗肾病综合征的潜在作用靶点, 即:黄芪总黄酮-靶点-肾病综合征。String Version 10.5数据库(https://string-db.org/)[17]是一种包含已知和预测的蛋白质-蛋白质相互作用(PPI)的数据库, 收集了大量的蛋白相互作用关系, 共涉及9 643 763个蛋白, 1 380 838 440种相互作用, 包括实验验证得到的和通过生物信息学方法预测得到的数据。将作用靶点导入String数据库, 限定物种为人, 获取其相互作用关系, 结果保存成RTF格式, 保留文件中节点(node 1、node 2)和结合率评分(combined score)信息并导入到Cytoscape version 3.5.1软件绘制相互作用网路, 并对网络进行分析, 保存网络分析结果, 使用Cytoscape中的“generate style from statistics”工具将节点大小和颜色设置用于反映成分连接靶点个数(degree)的多少, 边的粗细设置用于反映combine score的大小, 获得最终的蛋白相互作用网络。
作用靶点分布网络图构建 使用BioGPS (http://biogps.org/#goto=welcome)数据库[18], 以中位数的基因表达量为界限筛选出每个作用靶点主要分布的器官/部位; 构建作用靶点-组织分布(targets-organ, T-O图)网络图, 以得出黄芪总黄酮治疗肾病综合征主要分布的组织器官, 从而揭示其作用机制。
作用靶点富集分析网络图构建 应用ClueGO version 2.3.4软件与其插件CluePedia分析工具[19]对黄芪总黄酮作用靶点的生物过程(biological process, BP)、分子功能(molecular function, MF)、细胞成分(cell component, CC)和The Kyoto Encyclopedia of Genes and Genomes (KEGG)通路富集分析, 以进一步揭示黄芪总黄酮作用机制。
活性成分-作用靶点网络图构建 将黄芪总黄酮的活性成分和作用靶点导入Cytoscape软件, 构建黄芪总黄酮活性成分-作用靶点网络, 预测出黄芪总黄酮治疗肾病综合征发挥主要作用的作用靶点与主要的活性成分。
活性成分-作用靶点分子对接 Systems Dock Web Site是一个基于网络药理学预测和分析的网络服务器, 可以用于说明配体如何作用于复杂的分子网络。它通过DocK-IN评分的分子对接功能评估蛋白质-配体结合潜力[20]。采用Systems Dock Web Site Version 2.0 (http://systemsdock.unit.oist.jp)对作用靶点与活性成分进行分子对接验证。保存分子对接结果, 并对其Docking Score进行分析, 用以评价黄芪总黄酮活性成分与靶点之间的结合活性, 并对阳性药他克莫司(tacrolimus)与靶点进行对接分析。
通路图绘制 利用DAVID Bioinformatics Resources 6.8数据库[21] (https://david.ncifcrf.gov/)输入由ClueGO软件得出的前10条通路, 进行整合绘制最终的通路图。
结果 1 黄芪总黄酮的化学成分由1H NMR图谱与LC-MS图谱鉴定出19个黄酮类化学成分, 检索TCMSP数据库与TDMID数据库获得黄芪黄酮类化学成分12个, 共得到黄酮类化合物29个, 详见表 1。
| Table 1 Chemical constituents and the topological attributes of total flavonoids of Astragali Radix. *Represent the chemical constituents of TFA by 1H NMR and LC-MS; #Represent the chemical constituents of TFA by TCMSP and TCMID database |
将PharmMapper、SEA和SIA数据库得到的所有靶点, 删除重复并去除假阳性, 整合得到黄芪总黄酮作用靶点441个。由GeneCards、HOME-NCBI- GENE与OMIM数据库检索整合得到的肾病综合征靶点共745个, 黄芪总黄酮作用靶点与肾病综合征作用靶点取交集共得潜在作用靶点50个, 其具体靶点名称、Uniprot ID以及靶点的degree、betweenness见表 2。
| Table 2 Information of potential targets and the topological attributes of total flavonoids of Astragali Radix |
由String数据库得到靶点相互作用网络图(图 1), 其中“边” (edge)代表作用靶点之间的关联, 边的粗细用combine score表示, 边越粗, combine score值越大, 代表其结合度越大。节点(node)代表作用靶点, “degree”值代表其作用强度, 且degree值越大, 节点越大, 颜色由蓝变红对应的degree值越大。图中共48个节点, 231条边, 平均节点度为9.8, 平均局部聚类系数为0.652。如靶点丝裂原活化蛋白激酶14 (MAPK14)与激酶插入区域受体(KDR), 靶点MAPK14与RAC丝氨酸/苏氨酸蛋白激酶(Akt1), 靶点3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)和内皮一氧化氮合酶(NOS3)相连接的边较粗, 代表其结合度较大; 同时, 靶点血清白蛋白(ALB)、胰岛素(INS)、Akt1、肿瘤坏死因子(TNF)和MAPK14等degree值较大, 预测其在体内治疗肾病综合征发挥主要作用。其中ALB主要作为载体蛋白, 对细胞外液渗透压的稳定起着重要作用[22];若人体尿液中存在血清白蛋白, 表明肾脏疾病的存在。INS是一种肽类激素, 可以促进代谢碳水化合物、脂肪和蛋白质的吸收, 特别是从血液进入肝脏、脂肪与骨骼肌细胞的葡萄糖。最新研究表明[23]血脂异常引起炎症、氧化应激反应, 进而引起胆固醇从血循环向肾脏组织分布, 造成肾脏损害。Akt1属于丝氨酸/苏氨酸激酶Akt家族, 可以抑制细胞凋亡[24]。TNF是一类含有TNF同源结构域并形成三聚体的Ⅱ型跨膜蛋白超家族, 可以通过细胞外蛋白水解和细胞因子的功能从细胞膜中释放, 主要调节免疫反应与炎症反应[25]。MAPK14是一类丝裂原活化蛋白激酶, 参与细胞分化、凋亡和自噬[26]。可以看出这些靶点主要涉及细胞自噬、凋亡和氧化应激反应等。
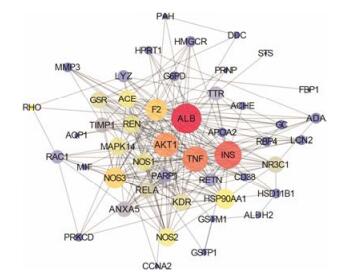
|
Figure 1 Protein interaction network of total flavonoids of Astragali Radix. The size and the color of the node represents the value of the degree, the thickness of the side indicates the value of the combine score |
使用Cytoscape软件构建黄芪总黄酮潜在作用靶点-组织分布的网络图, 如图 2如示, 图中共有92个节点, 226条边, 其中蓝色椭圆形节点代表潜在作用靶点, 红色三角形节点代表这些潜在作用靶点分布的器官/组织; 边代表靶点与器官的相互作用。由图可以看出, 15个基因在淋巴细胞(blymphoblasts)高表达, 14个基因主要分布在脂肪细胞(adipocyte), 有较多基因存在一些抗原蛋白上, 例如CD14、CD19、CD33、CD34、CD56和CD71。其中CD34在趋化因子依赖性的嗜酸性粒细胞和树突状细胞中迁移[27]; CD19表面免疫球蛋白(Sig)相关分子可以促进信号转导, 在B细胞上, 抗免疫球蛋白抗体可以模拟外源性抗原, 增强免疫作用[28]。

|
Figure 2 Potential targets-organ network. The targets-organ network was built by the potential targets and organ. 50 targets proteins (blue circular) were connected to 42 organs (red triangle) |
黄芪总黄酮治疗肾病综合征的作用靶点50个, 其中与炎症反应相关的靶点有F2、MMP3和TNF等[29, 30];与氧化还原/应激反应有关的靶点有ADA、Akt1、GSTP1、NOS1、NOS2和NOS3等[31, 32];与肾病直接相关报道的靶点有ALB、ACE、MAPK14、NOS1、NOS2、NOS3、RAC1和REN等[33, 34];与细胞凋亡有关的靶点有HSP90AA等[35]。因此, 由靶点分布状态与其自身特性推测黄芪总黄酮发挥药效主要通过提高体内免疫反应, 抑制氧化应激反应与细胞凋亡反应。
3.3 GO分类富集分析与KEGG富集分析ClueGO数据库将GO数据库与Cytoscape进行连接, 是Cytoscape可视化分析软件的一个重要插件。ClueGO分析技术能够使来源于不同数据库中的靶点产物功能使用相同的描述符, 进而从生物过程、分子功能、细胞成分3个水平对靶点进行分类分析, 以及KEGG通路富集分析, 预测黄芪总黄酮治疗肾病综合征的作用机制。
生物过程如图 3, 可以看出这些靶点主要涉及活性氧代谢过程(reactive oxygen species metabolic process)、炎症反应(inflammatory response)、细胞对氧化应激的反应(cellular response to oxidative stress)和一氧化氮的生物合成过程(nitricoxide biosynthetic process)等生物过程。有研究[36]指出氧化ATP代谢过程中的KATP通道结构和功能的改变与肾功能的改变密切相关, 而晚期氧化蛋白产物可以诱导细胞凋亡、肾小管上皮损伤和肾脏系膜细胞增生及分化。Zhu[37]研究得出黄芪能够调节肾脏疾病小鼠白细胞和单核细胞的数量, 从而抑制炎症反应发挥肾脏保护作用。提示炎症反应、氧化应激以及一氧化氮合成等生物过程可能与肾病综合征的发病机制密切相关。
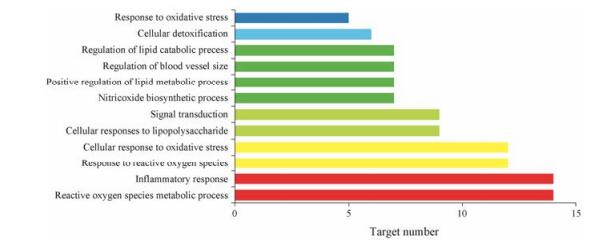
|
Figure 3 Enriched gene ontology terms for biological process (BP) of potential targets from main active ingredients of total flavonoids of Astragali Radix |
分子功能如图 4, 其靶点主要涉及蛋白体的活动(protein homodimerization activity)、蛋白激酶结合(protein kinase binding)、NADP结合(NADP binding)与一氧化氮合酶活性(nitric-oxide synthase activity)分子功能, 上述分子功能关联的基因较多, 且具有显著性。其中一氧化氮合酶催化左旋精氨酸可以产生一氧化氮(NO), 而NO具有强烈的扩血管作用, 能降低平均动脉血压, 调节全身各血管的静息张力, 也是肾血流动力学调节的重要因子[38]; Zhou等[39]对一氧化氮及其合酶研究, 推测在肾病综合征后期可以通过上调iNOS、cNOS和nNOS的表达, 升高NO含量, 扩张肾脏血管, 减少蛋白尿的排泄, 改善肾脏损伤程度。由此可以推测, 肾小球高灌注和高滤过等血流动力学的异常是通过NO合酶等分子诱导导致肾病综合征。
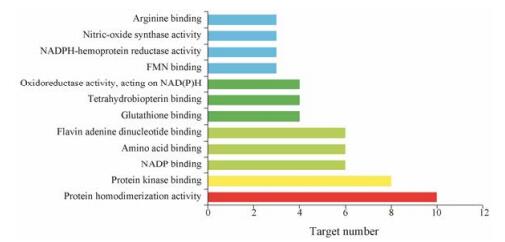
|
Figure 4 Enriched gene ontology terms for molecular function (MF) of potential targets from main active ingredients of total flavonoids of Astragali Radix |
细胞成分见图 5, 其靶点主要涉及内质网(endo plasmic reticulum)、膜的整体成分(integral component of membrane)、核(nucleus)与核浆(nucleoplasm)分子功能关联的基因。越来越多的研究[40-42]表明, 足细胞与神经元具有相似性, 在神经元细胞中, 敲低基质相互作用分子1 (STIM1)的表达可减轻细胞内钙超载, 保护线粒体膜电位, 减轻内质网应激和线粒体功能障碍, 抑制氧化应激损伤和细胞凋亡, 从而减轻多柔比星诱导的足细胞损伤[43]。
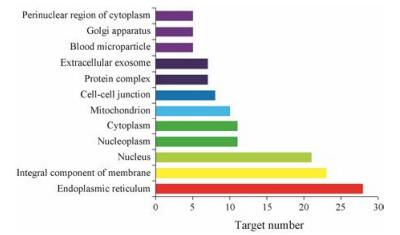
|
Figure 5 Enriched gene ontology terms for cell component (CC) of potential targets from main active ingredients of total flavonoids of Astragali Radix |
KEGG通路富集分析(图 6)可以得出, 这些作用靶点主要与AGE-RAGE、IL-17、MAPK、HIF-1和PI3K/Akt信号通路等通路相关。表明黄芪总黄酮主要活性成分的作用靶点分布于不同的代谢通路, 多成分、多靶点相互调节是治疗肾病综合征的可能作用机制。

|
Figure 6 Enriched KEGG pathways of potential targets from main active ingredients of total flavonoids of Astragali Radix |
使用Cytoscape软件构建黄芪总黄酮成分-作用靶点的网络图, 如图 7如示, 图中共有79个节点, 504条边, 其中蓝紫色节点代表黄芪总黄酮的50个作用靶点, 蓝色越深代表其关联的活性成分越多, 可能发挥的作用越大; 黄色节点代表黄芪总黄酮的活性成分; 每条边代表活性成分与靶点间的相互作用。分析结果显示, 靶点糖皮质激素受体(NR3C1)、乙酸胆碱酯酶(ACHE)、INS、甲状腺素运载蛋白(TTR)和视紫红质(RHO)等与化学成分的关联度较大。其中NR3C1与25个化学成分相关联; ACHE与24个活性成分相关联; INS、RHO、TTR、F2分别与21、20、20、20个活性成分相关联。ACHE作为一种水解酶, Baldissera等[44]研究得出乙酰胆碱酶活性降低, 可以防止感染引起的炎症损伤。NR3C1作为糖皮质激素受体, 调节控制发育、新陈代谢及免疫反应, 有研究得出NR3C1与肾脏疾病密切相关[45]。TTR作为转运蛋白, Li等[46]根据基因芯片技术、质谱分析以及免疫印迹实验, 得出过度的TTR能抑制细胞凋亡, 预测TTR是导致急性肾损伤的主要原因。RHO是一种感光受体蛋白, 有研究[47]表明Rho相关蛋白RhoA/ROCK, 对足细胞的肌动蛋白纤维具有保护作用。
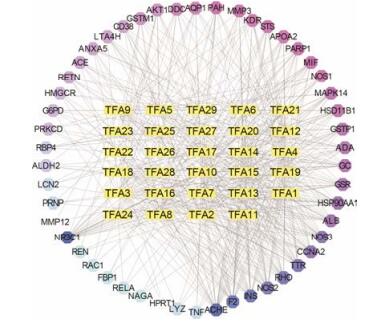
|
Figure 7 Components-targets network of total flavonoids of Astragali Radix. The components-targets network was built by the potential targets and active components. 50 targets (blue circular) were connected to 42 organs (square yellow) |
上述相互作用网络中degree表示某个靶点具有相互作用的靶点的数目。一般而言, 在一个网络中, 只有少数的节点具有很高的degree, 这些节点为“中枢节点”, 在整个网络中占据重要地位。也就是说, 在蛋白相互作用网络中筛选出的degree排名靠前的靶蛋白在黄芪总黄酮治疗肾病综合征的过程中发挥着重要的作用。对成分-靶点网络图中degree数值排名前5位的重要靶点进行分子对接验证。将排名前5的靶点ACHE、NR3C1、INS、RHO、TTR的PDB ID导入Systems Dock WebSite分子对接软件并与黄芪总黄酮的29个成分进行对接, 对接结果详见表 3 (得分大于4.25)。分子对接结果显示, docking score值大于7.0的有13个(10%), 介于7.0~5.0之间的有76个(58.5%), 介于5.0~4.25之间的有9个(7.0%), 小于4.25的有32个(24.5%)。一般认为docking score值在4.25以上时表示分子与靶点之间有一定的结合活性, 大于5.0表明分子与靶点有较好的结合活性, 大于7.0则说明具有强烈的结合活性。分子对接结果表明, 黄芪总黄酮18个活性成分与重要靶点的结合活性较好, 且阳性药他克莫司与靶点的结合有很高的评分, 进一步证明了靶点ACHE、NR3C1、INS、RHO和TTR的重要性。
| Table 3 Molecular docking of five important targets from total flavonoids of Astragali Radix |
利用KEGG Mapper工具获取黄芪总黄酮治疗肾病综合征作用的通路图, 将KEGG得出的前10条信号通路整合绘制最终的通路图(图 8)。图中通路靶点标记为浅绿色, 黄芪总黄酮治疗肾病综合征的靶点标记为深蓝色。图中显示出AGE-RAGE、MAPK、VEGF、IL-17和PI3K/Akt信号通路等, 涉及12个黄芪总黄酮治疗肾病综合征的靶点(占黄芪总黄酮治疗肾病综合征靶点的24%)。提示黄芪总黄酮治疗肾病综合征的靶点主要分散于这几条通路中, 通过调节其中的几个环节发挥作用, 绝大多数靶点在多条通路中发挥作用, 如MAPK14、Akt1等。
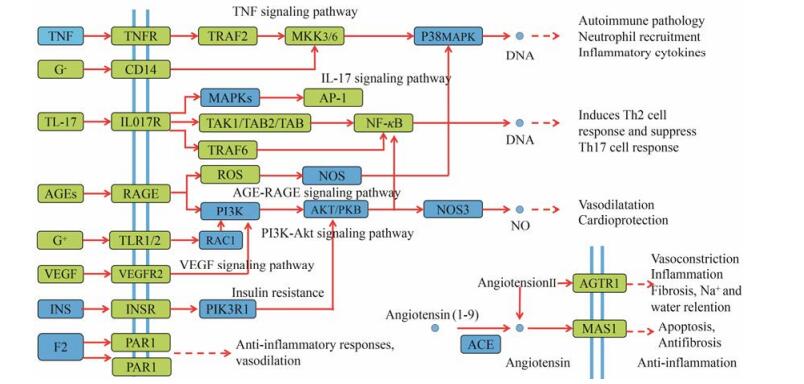
|
Figure 8 Distribution of partial targets of total flavonoids of Astragali Radix on the compressed pathway. The blue square represent target in pathway, the green square represent antinephrotic syndrome target of TFA in pathway |
黄芪具有利水消肿的作用, 以其为主要药物的复方在肾病综合征的治疗中占了绝大比例。因此, 对黄芪总黄酮治疗肾病综合征的研究具有重要意义, 黄芪总黄酮主要活性成分的作用靶点分布于不同的代谢通路, 多成分、多靶点相互调节是治疗肾病综合征的可能作用机制。
富集分析得出黄芪总黄酮主要涉及炎症反应、氧化应激以及一氧化氮合成的生物过程; 通过减轻内质网应激, 抑制氧化应激损伤和细胞凋亡, 可以减轻多柔比星诱导的足细胞损伤; 肾小球高灌注和高滤过等血流动力学异常也可诱导肾病综合征的发生。活性成分-组织分布图预测了黄芪总黄酮可能通过提高体内免疫反应, 抑制氧化应激与细胞凋亡反应发挥药效。
从通路图中可以看出, PI3K与Akt/PKB蛋白连接着AGE-RAGE信号通路、PI3K/Akt信号通路、VEGF信号通路以及insulin resistance信号通路, 预测黄芪总黄酮主要通过PI3K、Akt相关蛋白发挥药效作用。有研究[48]表明AGE与RAGE蛋白结合可以激活PI3K-Akt信号通路, PI3K/Akt信号通路为细胞内重要信号传导通路之一, 能够促进细胞代谢、增殖、存活以及生长。Zhong等[49]研究抗纤灵方对PI3K/ Akt/mTOR信号通路的影响, 预测抗纤灵方能够降低尿蛋白水平, 延缓肾纤维化的机制可能与抑制PI3K/ Akt/mTOR信号通路, 进而发挥肾保护作用相关。Shen[50]研究得出益气祛风通络通过降低p-PI3K、p-Akt、NF-κB、MCP-1蛋白及mRNA表达水平来调控糖尿病肾病大鼠PI3K/Akt/NF-κB信号通路, 减轻肾脏损伤。同样, MAPKs蛋白连接了IL-17信号通路与MAPK信号通路。IL-17生物学效应是促进炎性反应, IL-17A产生的主要途径是肾脏Th17细胞上的趋化因子受体CCR6与CCL20反应。Li[51]研究发现, IL-17可能通过MAPK信号通路对小鼠肾足细胞炎症因子进行调控, IL-17促进多柔比星肾病小鼠的炎症过程, 而且它还能促使Th1细胞分化降低, 大量的IL-17可导致多柔比星肾病小鼠严重的肾功能损害。Tong等[52]对p38MAPK在EVE小鼠免疫致炎机制方面进行综述, 阐述了p38MAPK在多种适应性和固有免疫细胞等多种细胞中参与免疫炎性损伤。Nan等[53]以筋骨草总黄酮(TFA)含药血清干预LPS诱导的肾小球系膜细胞, 结果显示, TFA含药血清能够抑制肾小球系膜细胞增殖, 下调炎症因子IL-1β、TNF-α等的表达, 其分子机制是通过抗氧化以及调控p38MAPK/NF-κB信号通路发挥肾保护作用, 进而改善肾组织功能。预测黄芪总黄酮发挥药效主要与PI3K、Akt/PKB、MAPKs蛋白相关。
综上所述, 网络药理结果显示黄芪总黄酮中29个活性成分作用于50个靶点, 涉及多种生物过程、分子功能和细胞成分, 体现了黄芪总黄酮多成分、多靶点、多途径的作用特点, 上述结果与文献报道基本一致。本文通过蛋白相互作用网络预测了黄芪总黄酮治疗肾病综合征的5个重要靶蛋白, 并对其进行了分子对接验证, 分子对接结果显示18个成分与重要靶点之间存在较好的结合活性, 从某种程度上验证了PharmMapper预测靶点的可靠性。此外, 活性成分-组织分布图预测了黄芪总黄酮可能通过提高体内免疫反应, 抑制氧化应激与细胞凋亡反应发挥药效。活性成分-靶点网络图显示了黄芪总黄酮多成分、多靶点治疗肾病综合征的作用特点。靶点相互作用网络结果显示, 黄芪总黄酮靶点间存在着相互关系, 是一个复杂交互的网络而并非单独起作用。通路图表明了AGE-RAGE、IL-17、MAPK、HIF-1和PI3K/Akt信号通路具有枢纽作用, 为深入阐明黄芪总黄酮治疗肾病综合征的作用机制提供科学依据。
| [1] | Orth SR, Ritz E. The nephrotic syndrome[J]. New Engl J Med, 1998, 338: 1202–1211. DOI:10.1056/NEJM199804233381707 |
| [2] | Eckardt KU, Coresh J, Devuyst O, et al. Evolving importance of kidney disease: from subspecialty to global health burden[J]. Lancet, 2013, 382: 158–169. DOI:10.1016/S0140-6736(13)60439-0 |
| [3] | Bulucu F, Vural A, Aydin A, et al. Oxidative stress status in adults with nephrotic syndrome[J]. Clin Nephrol, 2000, 53: 169–173. |
| [4] | Camici M. The nephrotic syndrome is an immunoinflammatory disorder[J]. Med Hypotheses, 2007, 68: 900–905. DOI:10.1016/j.mehy.2006.04.072 |
| [5] | Imig JD, Ryan MJ. Immune and inflammatory role in renal disease[J]. Compr Physiol, 2013, 3: 957–976. |
| [6] | Yilmaz S, Atessahin A, Sahna E, et al. Protective effect of lycopene on adriamycin-induced cardiotoxicity and nephrotoxicity[J]. Toxicology, 2006, 218: 164–171. DOI:10.1016/j.tox.2005.10.015 |
| [7] | Katsuyama T, Sada KE, Namba S, et al. Risk factors for the development of glucocorticoid-induced diabetes mellitus[J]. Diabetes Res Clin Pract, 2015, 108: 273–279. DOI:10.1016/j.diabres.2015.02.010 |
| [8] | Guo Z, Zhou J, Zhang X, et al. Anti-inflammatory effect of total flavonoids of Astragalus in vivo[J]. Prog Vet Med (动物医学进展), 2015, 36: 64–66. |
| [9] | Guo XC, Su JX, Li N, et al. Influence of end stage renal disease serum on endothelial cell apoptosis and intervention action of total flavonoids of Astragalus[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2014, 20: 229–233. |
| [10] | Zhang DQ, Wang DQ. Progressive studies on biological activity of total flavonoids of Astragalus[J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 253–256. |
| [11] | Wu D, Gao Y, Xiang H, et al. Exploration into mechanism of antidepressant of Bupleuri radix based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 210–219. |
| [12] | Zhai YY, Liu QN, Xu J, et al. Network pharmacology-based study on mechanism of liver protection of Erzhi Pill[J]. Acta Pharm Sin (药学学报), 2018, 53: 567–573. |
| [13] | Zhang WN, Li AP, Qi YS, et al. Metabolomics coupled with system pharmacology reveal the protective effect of total flavonoids of Astragali Radix against adriamycin-induced rat nephropathy model[J]. J Pharm Biomed Anal, 2018. DOI:10.1016/j.jpba.2018.05.045 |
| [14] | Qu TL. Study on the Effective Ingredients and Mechanism on Leucopenia of Huangqi Injection (黄芪注射液升白药效成分及作用机制研究)[D]. Taiyuan: Shanxi University (山西大学), 2017. |
| [15] | Ru J, Li P, Wang J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminf, 2014, 6: 13–15. DOI:10.1186/1758-2946-6-13 |
| [16] | Xue R, Fang Z, Zhang M, et al. TCMID: traditional Chinese medicine integrative database for herb molecular mechanism analysis[J]. Nucleic Acids Res, 2012, 41: D1089–D1095. DOI:10.1093/nar/gks1100 |
| [17] | Von Mering C, Jensen LJ, Snel B, et al. STRING: known and predicted protein-protein associations, integrated and transferred across organisms[J]. Nucleic Acids Res, 2005, 33: 433–437. |
| [18] | Wu C, Orozco C, Boyer J, et al. BioGPS: an extensible and customizable portal for querying and organizing gene annotation resources[J]. Genome Biol, 2009, 10: R130. DOI:10.1186/gb-2009-10-11-r130 |
| [19] | Bindea G, Galon J, Mlecnik B. CluePedia Cytoscape plugin: pathway insights using integrated experimental and in silico data[J]. Bioinformatics, 2013, 29: 661–663. DOI:10.1093/bioinformatics/btt019 |
| [20] | Hsin KY, Matsuoka Y, Asai Y, et al. systemsDock: a web server for network pharmacology-based prediction and analysis[J]. Nucleic Acids Res, 2016, 44: W507–W513. DOI:10.1093/nar/gkw335 |
| [21] | Huang DW, Sherman BT, Tan Q, et al. DAVID bioinformatics resources: expanded annotation database and novel algorithms to better extract biology from large gene lists[J]. Nucleic Acids Res, 2007, 35: W169–W175. DOI:10.1093/nar/gkm415 |
| [22] | Harper ME, Dugaiczyk A. Linkage of the evolutionarily- related serum albumin and alpha-fetoprotein genes within q11-22 of human chromosome 4[J]. Am J Hum Genet, 1983, 35: 564–567. |
| [23] | Ruan XZ. The lipid nephrotoxicity hypothesis[J]. Sci China Press (中国科学), 2018, 48: 47–55. |
| [24] | Cohen MM. Proteus syndrome review: molecular, clinical, and pathologic features[J]. Clin Genet, 2014, 85: 111–119. DOI:10.1111/cge.2014.85.issue-2 |
| [25] | Malagoli D. The Evolution of the Immune System: Conservation and Diversification[M]. London: Academic Press, 2016: 46. |
| [26] | Segalés J, Perdiguero E, Muňoz-Cánoves P. Regulation of muscle stem cell functions: a focus on the p38 MAPK signaling pathway[J]. Front Cell Dev Biol, 2016, 4: 91. |
| [27] | Blanchet MR, Maltby S, Haddon DJ, et al. CD34 facilitates the development of allergic asthma[J]. Blood, 2007, 110: 2005–2012. DOI:10.1182/blood-2006-12-062448 |
| [28] | Scheuermann RH, Racila E. CD19 antigen in leukemia and lymphoma diagnosis and immunotherapy[J]. Leuk Lymphoma, 1995, 18: 385–397. DOI:10.3109/10428199509059636 |
| [29] | De Hooge AS, van de Loo FA, Koenders MI, et al. Local activation of STAT1 and STAT3 in the inflamed synovium during zymosan-induced arthritis: exacerbation of joint inflammation in Stat1 gene-knockout mice[J]. Arthritis Rheum, 2004, 50: 2014–2023. DOI:10.1002/(ISSN)1529-0131 |
| [30] | Irbesartan attenuate high glucose-induced inflammation and apoptosis in H9C2 cell through NF-κB signaling pathway[J]. Chin J Diabetes (中国糖尿病杂志), 2017, 25: 630-634. |
| [31] | Xin Y. Study on Antioxidant Activity of Anthocyanins Extracted from Three Kinds of Padus Mill Fruits (三种红豆杉果实花色苷抗氧化活性的研究)[D]. Shenyang: Northeastern University (东北林业大学), 2013. http://cdmd.cnki.com.cn/Article/CDMD-10225-1013371227.htm |
| [32] | Zhang L. Akt2 Is the Major Akt Kinase against Oxidative Stress and Regulates Multiple Signaling Pathways to Resist H2O2-Induced Apoptosis (Akt2是Akt家族中抗氧化应激的主要激酶并通过多条信号途径抑制过氧化氢诱导的细胞凋亡) [D]. Changsha: Human Normal University (湖南师范大学), 2011. http://cdmd.cnki.com.cn/Article/CDMD-10542-1011169045.htm |
| [33] | Qin YL. Nephrosis candidate gene research development[J]. Mod Prev Med (现代预防医学), 2012, 39: 1062–1064. |
| [34] | Liang H, Chen HW, Deng H, et al. Progresses on genetics of hereditary nephritis[J]. Life Sci Res (生命科学研究), 2013, 17: 465–470. |
| [35] | Chen KK, Chen Y, He ZM, et al. Influence of co-inhibiting mTORC2 and HSP90 on proliferation apoptosis of multiple myeloma cells[J]. J Exp Hematol (中国实验血液学杂志), 2016, 24: 1086–1090. |
| [36] | Zhao Y. Protection Effects and Molecular Mechanisms of KATP Channel Openers on Uric Acid-Induced Renal Injury (ATP敏感性钾通道开放剂对尿酸肾脏损伤的保护作用及其分子机制的研究)[D]. Beijing: Academy of Military Medical Sciences (解放军军事医学科学院), 2012. |
| [37] | Zhu LK. Regulatory Effect of Astragalus Membranaceus on Expression of Inflammatory Factors in Kidney of db/db Mice (黄芪对db/db小鼠肾脏炎症因子表达的调节作用)[D]. Shijiazhuang: Hebei Medical University (河北医科大学), 2017. |
| [38] | Liu YS. Relationship between Genetic Polymorphisms of Endothelial Nitric Oxide Synthase Gene and Essential Hypertension (内皮型一氧化氮合酶基因多态性与原发性高血压发病相关性的研究)[D]. Chuangchun: Jilin University (吉林大学), 2014. |
| [39] | Zhou M, Wang YL, Fang Q, et al. Effect of Danggui Shaoyao San on the expression of NO and its synthose in rats with adriamycin induced nophrotic syndrome[J]. J Liaoning Univ of TCM (辽宁中医药大学学报), 2018, 20: 44–47. |
| [40] | Dunér F, Patrakka J, Xiao ZJ, et al. Dendrin expression in glomerulogenesis and in human minimal change nephrotic syndrome[J]. Nephrol Dial Transplant, 2008, 23: 2504–2511. DOI:10.1093/ndt/gfn100 |
| [41] | Ihara k, Asanuma K, Fukuda T, et al. MAGI-2 is critical for the formation and maintenance of the glomerular filtration barrier in mouse kidney[J]. Am J Pathol, 2014, 184: 2699–2708. DOI:10.1016/j.ajpath.2014.06.019 |
| [42] | Puliti A, Rossi Pi, Carid G, et al. Albuminuria and glomerular damage in mice lacking the metabotropic glutamate receptor 1[J]. Am J Pathol, 2011, 178: 1257–1269. DOI:10.1016/j.ajpath.2010.11.050 |
| [43] | Miao L. Study on the Role and Mechanism of STIM1 in Renal Foot Cell Injury (基质相互作用分子1 (STIM1)在肾脏足细胞损伤中的作用及机制研究)[D]. Nanjing: Nanjing Medical University (南京医科大学), 2016. |
| [44] | Baldissera MD, Souza CF, Doleski PH, et al. Involvement of cholinergic and purinergic systems during the inflammatory response caused by Aeromonas hydrophila in Rhamdia quelen[J]. Microb Pathog, 2016, 99: 78–82. DOI:10.1016/j.micpath.2016.08.009 |
| [45] | Christakoudi S, Runglall M, Mobillo P, et al. Steroid regulation: an overlooked aspect of tolerance and chronic rejection in kidney transplantation[J]. Mol Cell Endocrinol, 2018. DOI:10.1016/j.mce.2018.01.021 |
| [46] | Li O, Geng X, Ma Q, et al. Gene microarray integrated with high-throughput proteomics for the discovery of transthyretin in rhabdomyolysis-induced acute kidney injury[J]. Cell Physiol Biochem, 2017, 43: 1–6. DOI:10.1159/000480306 |
| [47] | Saito K, Shiino T, Kurihara H, et al. Afadin regulates RhoA/ Rho-associated protein kinase signaling to control formation of actin stress fibers in kidney podocytes[J]. Cytoskeleton, 2015, 72: 146–156. DOI:10.1002/cm.v72.3 |
| [48] | Li XM, Xu SX, Zhou ZQ, et al. Effects of neurotrophic factors in depression[J]. Pharm Clin Res (药学与临床研究), 2012, 20: 52–55. |
| [49] | Zhong LP, Ma ZH, Yu KN, et al. Mechaism of Kanxianling Docotion in intervening renal fibrosis through PI3K/AKT/mTOR signaling pathway[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2015, 21: 126–129. |
| [50] | Shen ZL. Research on Treatment of Diabetic Kidney Disease from the Wind Governs Based PI3K/Akt/NF-κB Signaling Pathway (糖尿病肾脏病证候要素分布特点与基于PI3K/Akt/ NF-κB通路"从风论治"机制研究)[D]. Beijing: Beijing University of China Medicine (北京中医药大学), 2016. |
| [51] | Li YY. Mechanism of IL-17 and Related Chemokines in Adriamycin Induced Nephropathy in Mice and Podocytes (IL-17及相关趋化因子在阿霉素肾病小鼠和足细胞中的作用机制研究)[D]. Ji'nan: Shandong University (山东大学), 2016. |
| [52] | Tong MY, Deng XH, Liu HJ, et al. Research progress of p38 MAPK in the immuno inflammatory mechanism of EAE mice[J]. Chin J Neuroimmunol Neural (中国神经免疫学和神经病学杂志), 2017, 24: 129–132. |
| [53] | Nan LH, Peng WH, Huang ZH, et al. Effect of serum containing total flavonoid of Ajuga on p38MAPK/NF-κB signaling pathway of glomerular mesangial cells[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2017, 32: 3764–3767. |
 2018, Vol. 53
2018, Vol. 53


