2. 陕西步长制药有限公司, 陕西 西安 710075;
3. 中国中医科学院中药研究所, 北京 100700
2. Shaanxi Buchang Pharmaceutical Co., Ltd., Xi'an 710075, China;
3. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
中医学的理、法、方、药是一个完整且完善的体系, 其知识是中医理论体系的核心内容。中药的“理法-方药-成分-活性”关联性研究, 能促进中药传统知识与现代科学之间融合发展, 是推动中医传统理论发展与创新的有效途径。糖尿病是一种内分泌代谢疾病, 基本病理特点为胰岛素分泌绝对或相对不足, 或外周组织对胰岛素敏感性下降, 引起以糖代谢紊乱为主, 包括脂肪、蛋白质代谢紊乱的一种全身性疾病[1]。糖尿病也是临床一种常见病、多发病, 已成为现代疾病中的第二杀手, 它对人体的危害仅次于癌症。西医虽然在治疗糖尿病方面有很好的稳定血糖作用, 但对于一些常见的糖尿病并发症, 单纯靠西药有时很难见效。而中医药治疗糖尿病, 无论在改善或减轻临床症状、体征、提高患者的生存质量, 还是改善血糖、血脂、血液循环等实验室指标方面, 均有明确的疗效, 特别是在防治糖尿病血管并发症方面显示出较好的优势。
中医上糖尿病属“消渴”范畴, 本病的形成主要是素体阴虚, 饮食不节, 复因情志失调, 劳欲过度, 耗伤肺胃肾之阴, 导致阴虚燥热而出现消渴。其病机在于阴虚为本, 燥热为标, 并可出现耗气而现气阴两伤之象。传统中医主要是以“三消”理论对糖尿病进行分型论治。近年来, 随着中医临床对糖尿病致病及治疗研究不断的深入, 相继提出了胃肠燥热型、肝胃郁热型、胃肠湿热型、气机郁滞型、瘀热互结型等糖尿病证型, 为糖尿病的中医治疗开辟了新的道路。其中, 对肝胃郁热型糖尿病治宜清肝和胃, 中药主要以柴胡、黄芩、芍药、半夏、枳实等为主, 常用的方剂有大柴胡汤, 小柴胡汤等, 而此二方的核心药对均为“柴胡-黄芩”, 柴胡苦平质清, 能疏散胆火之郁滞, 黄芩苦寒味重, 善清里热, 二者相须为用, 可调肝胆之气机、清内蕴之湿热, 为治疗肝胃郁热型糖尿病常用药对[2]。
传统理、法、方、药理论因缺少化学以及生物学的表征, 难以和现代科学有机的融合。近年来, 网络药理学对中药复方的“病证-药对-成分-靶标-通路-活性”关联性研究起到了很大的推动作用[3]。本研究基于中药整合药理学平台(TCMIP, http://www.Tcmip.cn/), 从中医经典名方大、小柴胡汤核心药对“柴胡-黄芩”的“理法-方药-成分-活性”关联性切入, 明确其治疗糖尿病的物质基础, 构建其分子网络机制, 为进一步对此药对的深入研究和新药开发提供科学依据, 同时为“单味药-药对-复方”的系统研究打下基础。
材料与方法“柴胡-黄芩”药对化学成分来源 在TCMIP中“我的任务”项下新建任务, 然后在任务单中“中药信息设定”项下依次添加柴胡、黄芩中药材, 收集二药的化学成分, 建立“柴胡-黄芩”药对化学成分数据库。
“柴胡-黄芩”药对候选靶标来源 在“疾病靶标信息”项下以“diabetes”为关键词进行检索, 将检索出来的所有靶标作为疾病候选靶标。然后在“中药靶标预测”界面中对“柴胡-黄芩”药对中化学成分库中成分的靶标进行预测, 选择“相似性分数≥0.8”的成分预测靶标作为候选靶标。TCMIP采用二维结构(.mol)进行相似性比对, 以Tanimoto系数定义的相似度计量方法, 与FDA上市药物的化学结构进行比对[4]。
蛋白质-蛋白质相互作用信息(PPI) TCMIP镶嵌了HAPPI、Reactome、MINT (Molecular Interaction Database)、OPHID (Online Predicted Human Interaction Database)、DIP (Database of Interacting Proteins)等数据库中蛋白质-蛋白质相互作用数据, 可直接获得“柴胡-黄芩”药对的潜在靶标与糖尿病疾病靶标之间的蛋白质-蛋白质相互作用信息[5]。
靶标网络构建与分析 TCMIP基于靶标-靶标相互作用关系建立“柴胡-黄芩”药对的潜在靶标与糖尿病疾病靶标之间的相互作用网络, 以“节点连接度(degree)”的2倍中位数为卡值, 选取中药靶标-疾病基因互作网络的核心节点(hubs); 在此基础上, 以“degree”、“节点紧密度(closeness)”和“节点介度(betweenness)”的中位数为卡值, 选取同时满足3个卡值的节点作为“柴胡-黄芩”药对治疗糖尿病的关键靶标网络。然后对关键靶标网络所参与的通路进行富集分析, 选取P值排名前30的通路, 构建可视化的“中药方剂-中药材-化学成分-核心靶标-关键通路-疾病关键病理环节”多层次网络关联图[6, 7]。
基因功能和通路富集分析 TCMIP基于基因本体数据库GO (http://www.geneontology.org)和KEGG通路数据库(http://www.genome.jp/kegg/)资源, 可直接针对“柴胡-黄芩”药对作用的潜在靶标与糖尿病疾病靶标进行基因功能和通路分析, 并将所得结果按照P值降序排列。
主要活性物质与靶点的分子对接 以罗格列酮(rosiglitazone)作为阳性对照, 研究“柴胡-黄芩”药对的主要活性物质与过氧化物酶体增殖物激活受体γ (peroxisome proliferators activated receptor γ, PPAR-γ)及糖原合成酶激酶-3β (glycogen synthase kinase-3β, GSK-3β)的对接, 验证此药对治疗糖尿病的药效物质基础。
结果与讨论 1 “柴胡-黄芩”药对中“成分-靶标”研究通过TCMIP相关数据库, 共收集到柴胡化学成分62个, 黄芩化学成分54个。其中, 柴胡中的化学成分类型为:皂苷、挥发油、脂肪酸等。黄芩中的化学成分主要为:黄酮、脂肪酸等。为了保证靶标预测结果可信度, 设定“柴胡-黄芩”药对中化学成分与FDA药物之间的相似性分数≥0.8, 得到二者的靶标数目分别为95个、133个。文献[8, 9]表明, 柴胡和黄芩在治疗糖尿病及其并发症方面均表现出较显著的协同作用。本研究中, “柴胡-黄芩”药对含有64个共同靶标, 暗示它们之间可能存在潜在的叠加作用。对“柴胡-黄芩”药对作用的潜在靶标进行基因功能和通路富集分析, 结果表明其基因功能和通路主要与内分泌系统、循环系统、消化系统、胰岛素分泌等有关[10-12], 推测“柴胡-黄芩”药对可能通过调节内分泌系统、循环系统、消化系统改善体脂质代谢、脂肪酸代谢、半乳糖代谢及胰岛素分泌等来起到治疗糖尿病的作用[13-16]。
2 “柴胡-黄芩”药对治疗糖尿病的核心靶标网络、基因功能和通路富集分析 2.1 “柴胡-黄芩”药对治疗糖尿病的核心靶标网络通过TCMIP数据库, 根据设定条件构建“柴胡-黄芩”药对的潜在靶标与疾病靶标相互作用网络, 筛选出关键靶标110个, 其中“柴胡-黄芩”药对治疗糖尿病的已知靶标(known disease target) 28个, 潜在的作用靶标(putative drug target) 28个, 其他作用靶标(others) 54个。图 1仅显示了连接度(degree)值排名前100的靶标, 节点的大小与degree值成正比关系。
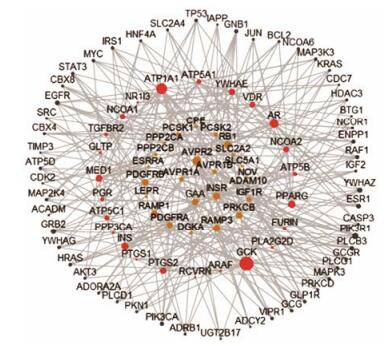
|
Figure 1 The network of Bupleuri Radix and Scutellariae Radix drug pair candidate targets for diabetes. Red: Putative drug target; Yellow: Known disease target; Gray: Others |
直接作用靶标主要有:精氨酸加压素受体基因(arginine vasopressin receptor gene, AVP)、视网膜母细胞瘤1 (retinoblastoma 1, RB1)、受体活性修饰蛋白(receptor active modified protein, RAMP)、血小板生长因子受体(platelet growth factor receptor, PDGFR)、胰岛素受体(insulin receptor, INSR)、α-葡萄糖苷酶(glucosidase alpha, GAA)等。文献表明, AVP是一种神经内分泌激素, 可治疗高钠血症, 而糖尿病患者并发重症感染后可致高钠血症, 因此可通过限制钠离子的输入防止高钠血症, 而达到降低血糖的目的[17]; INSR可增加药物与胰岛素信号通路敏感性, 缓解糖尿病胰岛素抵抗及高血糖症[18, 19]。此外, “柴胡-黄芩”药对也能直接作用于GAA, 通过抑制GAA活性的作用, 多靶点调控血糖, 直接达到治疗糖尿病的作用[20]。
间接作用靶标主要有:葡萄糖激酶(glucokinase, GCK)、ATP1A1基因、醛糖还原酶(aldose reductase, AR)、胰岛素(insulin, INS)等。有文献报道[21], GCK是糖代谢的限速酶, 如果GCK功能缺隐或表达减少将使肝脏葡萄糖利用受阻及胰岛β细胞胰岛素分泌减少, 因此, GCK基因的变异可能是糖尿病的发病原因之一, 因此, “柴胡-黄芩”药对能间接作用于GCK, 说明此药对可刺激胰岛素的分泌, 从而达到防治糖尿病的目的; INS可与胰岛素受体(insulin receptor, IR)结合后, 促进肝脏、骨骼肌、脂肪等外周组织细胞对葡萄糖的利用, 或抑制肝脏葡萄糖的异生, 以达降低血糖之效; 而AR是一种多元醇通路的限速酶, 该基因表达异常或酶活性改变, 将促进糖尿病微血管并发症的发生, 引发糖尿病肾病, 该药对作用于AR, 可防治糖尿病肾病[22]。
2.2 “柴胡-黄芩”药对治疗糖尿病的基因功能及通路信息分析“柴胡-黄芩”药对靶标与疾病靶标基因功能见表 1, 通过关键靶标功能信息可以推测, “柴胡-黄芩”药对治疗糖尿病及其并发症主要是通过调节IR、胰岛素受体底物、血糖及信号转导效应蛋白和代谢途径关键酶的基因表达, 改变IR及IRS的磷酸化状态, 并通过PPAR间接调节其他基因的表达而逆转IR的损伤[23]。
| Table 1 The target functional information of Bupleuri Radix and Scutellariae Radix drug pair on the diabetes |
“柴胡-黄芩”药对通路富集分析见表 2, 主要涉及内分泌系统、神经系统、循环系统、癌症通路等。如FOXO作为转录调节因子, 受PI3K-Akt磷酸化调节, 对糖异生基因及脂肪酸合成基因的表达具有重要的调控作用[24];催乳素受体可调节胰岛素敏感性, 进而起到预防和治疗糖尿病的作用[25];甲状腺激素水平下降, 能引发糖尿病患者糖尿病肾病的发生[26]; ErbB受体对心脏的结构及心功能维护有重要的作用, 可用于糖尿病心肌病[27]。此外, 文献报道[28-31]表明, 糖尿病还可引发内分泌激素失衡、神经系统变性或退行引起的前列腺癌、胶质瘤、乙型肝炎、非小细胞肺癌、黑色素瘤、结直肠癌、子宫内膜癌等病症。
| Table 2 The target pathway information of Bupleuri Radix and Scutellariae Radix drug pair on the diabetes. #Big pathway |
“柴胡-黄芩”药对治疗糖尿病的“中药-成分-靶标-通路”多维网络关系见图 2。“柴胡-黄芩”药对治疗糖尿病的活性成分共计59个(主要为皂苷、黄酮、挥发油、脂肪酸等类型), 其中, 柴胡成分28个, 黄芩成分31个, 分别作用于22个核心靶标和26条主要通路, 这也体现出中药配伍“多成分、多层次、多靶点”的特性, 彰显了中医药在疑难杂症治疗中的优势。

|
Figure 2 The "compound-target-pathway" network of Bupleuri Radix and Scutellariae Radix drug pair. Green: Traditional Chinese medicine; Purple: Compound; Blue: Target; Red: Pathway |
文献[9, 32]研究表明, 药对配伍前后核心成分皂苷和黄酮的含量有一定的差别。柴胡-黄芩按不同的比例配伍后, 总皂苷含量均较单味药提高, 且柴胡皂苷a和柴胡皂苷d的含量配伍后比配伍前高, 说明柴胡与黄芩配伍有利于皂苷的溶出。柴胡-黄芩配伍后黄芩苷(黄酮)的含量比单个黄芩药材高, 且与药对间的配伍比例相关性不大, 说明两药物混煎可使黄芩苷增溶。所以柴胡、黄芩配伍可增加核心成分的含量, 提高药效。药对中, 柴胡皂苷具有解热、抗炎、保肝、护肾、免疫系统的调节等作用, 所以有文献显示小柴胡汤加减可治“少阳型”糖尿病[33, 34];黄芩总黄酮具有抗菌、抗炎、抗肿瘤、神经保护、抗高血糖等作用, 是临床用于治疗糖尿病的常用中药之一, 对于糖尿病及其并发症有一定的预防和治疗[35]。药对中柴胡、黄芩均可清热泻尿火, 和解少阳, 二者合用对于“肝胃郁热型”糖尿病有一定的作用。
4 “柴胡-黄芩”药对治疗糖尿病的可能有效成分及调控靶点从PDB (Protein Data Bank)库中下载GSK-3β、PPAR-γ蛋白与罗格列酮的X-射线共结晶结构后, 用Schrodinger 2013软件定义蛋白受体及配体, 确定活性位点, 并对其进行力场优化[36]。用Glide将“柴胡-黄芩”药对中主要成分与GSK-3β及PPAR-γ蛋白进行对接计算打分, 打分值越小说明能量越低, 结合越好。主要活性成分与靶蛋白的对接结果见表 3。
| Table 3 The dock result of main components from Bupleuri Radix and Scutellariae Radix drug pair |
由表 3可以看出, 黄芩苷与黄芩素均与GSK-3β、PPAR-γ对接成功, 柴胡皂苷A和柴胡皂苷D对接不成功, 推测“柴胡-黄芩”药对治疗糖尿病的主要药效成分为黄芩中的黄酮类化合物。此外柴胡中主要活性成分皂苷对黄芩中的黄酮类成分具有助溶作用[9, 32], 从而起到协同增效的作用。
5 “柴胡-黄芩”药对治疗糖尿病的“理法-方药-成分-靶标-通路-活性”关联性研究分析通过中医药对糖尿病病机的认识、“柴胡-黄芩”药对的功效与其配伍阐述, 现代医学对糖尿病的发病机制、药对中柴胡、黄芩主要化学成分和药理活性之间的相关性, 借助中药整合药理学平台大数据, 将中医药和现代医学相结合, 以期探析“柴胡-黄芩”药对中主要治疗糖尿病的药效物质基础及其作用机制, 为其他经典方剂的配伍、药效物质基础及作用机制的阐述提供思路。本文采用“理法-方药-成分-靶标-通路-活性”结合研究有利于揭示经典方剂的药效物质基础及作用机制, 总体研究思路及它们之间的部分内在联系如图 3所示。

|
Figure 3 The "principle-recipe-composition-target-pathway-activity" of Bupleuri Radix and Scutellariae Radix drug pair diagrammatic sketch |
对于中药“多成分、多靶点、整体调节”的特点, 如果不将“病证-药对-成分-靶标-通路-活性”有机地结合起来, 对于中药复杂的作用机制很难阐明。本文将中医药与现代医学结合起来, 以糖尿病为例, 试图找到中医药所认识的肝失疏泄、肝郁化火、脾胃肾三脏失调与现代医学研究的糖尿病发病机制之间的相关性, 找到皂苷、黄酮、挥发油、脂肪酸等主要成分的药理作用与糖尿病发病机制之间的关联性, 并试图找到主要成分的药理活性与“柴胡-黄芩”药对核心靶标、通路及功效之间的关联性, 为“柴胡-黄芩”药对的进一步研究提出研究策略, 同时, 也为大小柴胡汤及其他经典方剂的配伍、药效物质基础及作用机制的研究提供思路。
综上所述, 通过平台预测的“柴胡-黄芩”药对治疗糖尿病的皂苷、黄酮、挥发油、脂肪酸等活性成分均具有一定降糖作用, 其化学成分与靶标和通路之间的关联性, 在一定程度上证实了整合药理学研究方法的可靠性。
药对[37, 38]源于经典方剂的核心配伍, 是历代医家在中医药基本理论的基础上, 经过长期医疗实践的经验总结。用于方剂的随证加减, 也可以是对新知识、新经验的提炼, 并可根据病机、治法理论组成新的方剂。所以, 药对是使中医辨证论治落到实处的配伍核心与用药灵魂。若以西药思路进行研究, 则对其配伍的内涵难以阐释清楚, 因此, 必须从吸收、分布、代谢及排泄等环节入手对中药方剂进行研究, 对于其药理作用可结合网络药理学来全面认识[39]。
“柴胡-黄芩”作为大、小柴胡汤的核心药对, 临床上治疗糖尿病具有显著疗效[40], 但目前缺乏对其活性成分及其作用机制的研究。本研究预测得到活性成分共计59个, 分别作用于22个直接靶标和26条主要通路, 其药效物质基础主要为皂苷、黄酮、挥发油、脂肪酸等成分。有研究表明[2], 皂苷类成分主要作用于INS、INS及胰腺分泌等通路, 通过刺激INS分泌, 改善INS抵抗, 来达到治疗糖尿病的作用。黄酮主要作用于PI3K-Akt、PPAR等通路, 参与调控炎症因子、促进糖异生、改善内分泌、调节糖脂代谢等生理过程。以罗格列酮作为阳性对照, 采用分子对接技术进行的虚拟筛选结果表明, “柴胡-黄芩”药对中的黄酮类化合物易与PPAR-γ及GSK-3β形成较好的对接模式与较高亲和力, 具有治疗糖尿病的活性。同时柴胡中主要活性成分皂苷对黄芩中的黄酮类成分具有助溶作用, 进而起到协同增效的作用。上述研究结果在一定程度上证明了TCMIP在预测中药及复方作用机制方面的可靠性。
本研究是基于网络大数据所做的预测, 研究结果还需要通过进一步的实验研究加以验证。希望本研究能为“柴胡-黄芩”药对的进一步开发利用提供参考, 为大、小柴胡汤复方及其他药对的研究探索提供新的思路。
| [1] | Chen XF. Drug Screening and Mechanism of Chinese Medicine for Diabetes Mellitus based on Literature Mining (基于文献挖掘的中药治疗糖尿病用药筛选及作用机制研究)[D]. Beijing: Beijing University of Chinese Medicine, 2016. |
| [2] | Shi JB, Huang BY, Liu F. Clinical observation on Dachaihu Decotion in treating pre-diabetes with syndrome of heat stagnation in liver and stomach[J]. Chin Med Mod Dis Edu China (中国中医药现代远程教育), 2017, 15: 72–74. |
| [3] | Tao J, Jiang M, Chen LY, et al. Mechanism study of prescription to treat Xiaoke based on the property and flavor theory of Chinese medicine and network pharmacology[J]. Acta Pharm Sin (药学学报), 2017, 52: 236–244. |
| [4] | Zhang YQ, Guo QY, Li QY, et al. Main active constituent identification in Guanxinjing capsule, a traditional Chinese medicine, for the treatment of coronary heart disease complicated with depression[J]. Acta Pharmacol Sin, 2018, 39: 975–987. DOI:10.1038/aps.2017.117 |
| [5] | Zhang YQ, Mao X, Su J, et al. A network pharmacology- based strategy deciphers the underlying molecular mechanisms of Qixuehe Capsule in the treatment of menstrual disorders[J]. Chin Med, 2017, 12: 23–31. DOI:10.1186/s13020-017-0145-x |
| [6] | Yu G, Zhang Y, Ren W, et al. Network pharmacology-based identification of key pharmacological pathways of Yin-Huang- Qing-Fei capsule acting on chronic bronchitis[J]. Int J Chron Obstruct Pulmon Dis, 2017, 12: 85–94. |
| [7] | Peng XJ, Yang XJ, Chen YB, et al. Action mechanism of Baihe Dihuang decoction on depression based on integrative pharmacology of traditional Chinese medicine[J]. Chin J Chin Mater Med (中国中药杂志), 2018, 43: 1338–1344. |
| [8] | Pan H. Efficacy of Chaihuqinggantang and Western Medicine Treated Patients with Bacterial Liver Abscess with Type 2 Diabetes Mellitus (柴胡清肝汤联合西医治疗合并糖尿病的细菌性肝脓肿疗效观察)[D]. Tianjin: Tianjin Medical University, 2017. |
| [9] | Li PT. Study in Chemical Component Changes and RCT Effects of Radix Bupleuri and Its TCM Compatibility (柴胡药对配伍对皂苷类成分影响及调节RCT的实验研究) [D]. Guangzhou: Guangzhou University of Traditional Chinese Medicine, 2016. |
| [10] | Pan XP, Xing ZL, Jia WG, et al. Identification and preparation of a glycol-protein fraction AN from tea extracts and its in vivo and in vitro anti-hyperglycosemia activity[J]. Chin J Chin Mater Med (中国中药杂志), 2018, 43: 736–742. |
| [11] | Huang Q. Study on Long-chain Fatty Acid Receptors: Agonists Screening and Pharmacological Investigations of the Anti-diabetic Effect (长链脂肪酸受体激动剂筛选及其抗糖尿病药理机制研究)[D]. Shanghai: University of Chinese Academy of Sciences, 2017. |
| [12] | Ogawa S, Abe T, Nako K, et al. Eicosapentaenoic acid improve glycemic control in elderly bedridden patients with type 2 diabetes[J]. Tohoku J Exp Med, 2013, 231: 63–74. DOI:10.1620/tjem.231.63 |
| [13] | Yanai H, Hamasaki H, Katsuyama H, et al. Effects of intake of fish or fishoils on the development of diabetes[J]. J Clin Med Res, 2015, 7: 8–12. DOI:10.14740/jocmr1964w |
| [14] | Pang GC, Chen QS, Hu ZH, et al. On the relationship between food nutrition and immunometabolism[J]. Food Sci (食品科学), 2018, 39: 1–15. |
| [15] | Huang YB, Zhang LX, Zhang LQ. Clinical characteristic analysis of type 2 diabetes mellitus complicated with digestive system malignant tumor[J]. Clin J Med Offic (临床军医杂志), 2015, 43: 43–47. |
| [16] | Li SW, Xia W, Deng HH, et al. Effect of haplotype in fatty acid desaturase gene on plasma lipids and fatty acids in type 2 diabetes mellitus[J]. Chin J Diabetes (中国糖尿病杂志), 2018, 26: 3–9. |
| [17] | Du M. Relation between Hypernatremia and Urine Sodium in Critical Patients (重症患者高钠血症与尿钠关系研究)[D]. Guangzhou: Southern Medical University, 2015. |
| [18] | Jiang NN, Guo MF, Gao JR, et al. Mechanism of Huangdi Anxiao capsules improving insulin resistance in spontaneous T2DM rats[J]. Pharmacol Clin Chin Mater Clin Med (中药药理与临床), 2017, 33: 109–114. |
| [19] | Fu LJ, Hu MH, Ying XQ, et al. Therapeutic effects of leaf extract from Cyclocarya paliurus on rats with type 2 diabetes mellitus[J]. Chin Tradit Pat Med (中成药), 2017, 39: 1134–1138. |
| [20] | Hong JN, Yang JX, Wang XM. Research progress in hypoglycemic effect and mechanism of heat-clearing and detoxifying Chinese materia medica[J]. Chin Tradit Herbal Drugs (中草药), 2015, 46: 2656–2662. |
| [21] | Wang JH, Ou Y. Glucokinase and diabetes mellitus[J]. Pharm Biotechnol (药物生物技术), 2012, 19: 552–556. |
| [22] | Zhang BX, Kong Q, Zhao HL, et al. Association between C-106T gene polymorphisms of aldose reductase and diabetic kidney disease in Chinese with type 2 diabetes[J]. J China Japan Friendship Hosp (中日友好医院学报), 2015, 29: 352–358. |
| [23] | Wang QH. Engineered Ubiquitin Ligase PTB-U-box Targets Insulin/Insulin-like Growth Factor Receptor for Degradation and Inhibits Tumor Malignancy (PTB-U-box靶向性降解胰岛素样生长因子受体和胰岛素受体的肿瘤治疗策略)[D] Xi'an: Forth Military Medical University, 2014. |
| [24] | Chi YJ, Li J, Guang YF, et al. PI3K/Akt signaling axis in regulation of glucose homeostasis[J]. Chin J Biochem Mol Biol (中国生物化学与分子生物学报), 2010, 26: 879–885. |
| [25] | Hao BJ, Liu X, Zhao ZC, et al. Quantitative analysis and developing trends of anti-type 2 diabetes drug targets[J]. Chin New Drug (中国新药杂志), 2013, 22: 1236–1242. |
| [26] | Liang Y, Mei J. Relationship between thyroid hormone level and metabolic syndrome in patients with type 2 diabetes mellitus[J]. J Parct Diabetol (临床糖尿病杂志), 2018, 14: 43–45. |
| [27] | Lei L, Gu C, Hu M, et al. Change of Erb B2 expression and phospho-Erb B2 level in diabetic cardiomyopathy rats[J]. South China J Cardiovasc Dis (岭南心血管病杂志), 2011, 17: 228–232. |
| [28] | Yu JJ, Hua F, Hu ZW. Advances in the studies of the link between diabetes and cancer[J]. Acta Pharm Sin (药学学报), 2016, 57: 1017–1025. |
| [29] | Ma X, Wang YY, Yang WS, et al. Meta-analysis of type 2 diabetes and the risk of reproductive system malignancy[J]. China Cancer (中国肿瘤), 2014, 23: 265–275. |
| [30] | Fu XL, Tian YL, Zang ZD, et al. Clinical study on correlation between type 2 diabetes mellitus or impaired glucose tolerance and hepatocellular carcinoma in patients with hepatitis B cirrhosis[J]. Oncol Prog (癌症进展), 2017, 15: 540–544. |
| [31] | He XX, Shang CY, Chang B, et al. Investigation on big data and visualized relationship between cancer and diabetes[J]. J Xinjiang Med Univ (新疆医科大学学报), 2017, 40: 229–232. |
| [32] | Liu MH. Pharmaceutical and Pharmacokinetic Research on Radix Scutellare and Radix Bupleuri in Compatibility (药对配伍对柴胡-黄芩主要药效作用影响的研究)[D]. Shandong: Shandong Traditional Chinese Medicine University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10441-1011204884.htm |
| [33] | Yang JP. The Research of The Effective Fraction about Antifebrile Action from Bupleurum Chinese-Scutellaria and Its Compatibility Mechanism (柴胡-黄芩药对退热有效部位及其配伍作用机制的研究)[D]. Beijing: Beijing University of Chinese Medicine, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10026-1012348734.htm |
| [34] | Xie SY. Study on Quality of Life of Xiao Chaihu Decoction on Type 2 Diabetes Mellitus with Shaoyang Syndrome (小柴胡汤加减治疗少阳型消渴病(2型糖尿病)的生存质量研究)[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10572-1017110506.htm |
| [35] | Cui X, Shang EX, Jiang S, et al. Interaction of Scutellaria- Coptis herb pair in improvement of glucose and lipid metabolism of type 2 diabetes rats based on response surface method[J]. Acta Pharm Sin (药学学报), 2018, 53: 630–635. |
| [36] | Xiao Y, Xiao B, Zhao N, et al. Screening of PPAR-γ agonist active ingredient of flavonoids from Artemisia ordosica by molecular docking technology[J]. J China Pharm (中国药房), 2018, 29: 58–62. |
| [37] | Song J, Gao XX, Tian JS, et al. Modern research on compatibility mechanism of Chinese materia medica pair[J]. Chin Tradit Herbal Drugs (中草药), 2017, 48: 4367–4374. |
| [38] | Tang YP, Duan JA. Drug Pair Modern Research (药对现代研究)[M]. Beijing: Science Press, 2014: 3-7. |
| [39] | Xu HY, Huang LQ, Lu P, et al. Application of ADME process in vivo in combination with network pharmacology in study of traditional Chinese medicine[J]. Chin J Chin Mater Med (中国中药杂志), 2012, 37: 142–146. |
| [40] | Pang B. Heritage Research on The Academic Thoughts and Experience of Prestigious TCM Doctors from Shi Jinmo's School in The Diagnosis and Treatment of Diabetes (施今墨学派名老中医诊治糖尿病学术思想与经验传承研究)[D]. Beijing: Beijing University of Chinese Medicine, 2012. |
 2018, Vol. 53
2018, Vol. 53


