2. 辽宁药联制药有限公司, 辽宁 本溪 117004
2. Liaoning Yaolian Pharmaceutical Co., Ltd., Benxi 117004, China
磷酸钙是一种天然的生物材料, 具有良好的生物相容性和可降解性[1], 在组织修复、药物递送、基因转染及诊断成像等生物医学领域具有广阔的应用前景[2-4], 因此近年来备受人们的关注。由于其在化学组成和生物性能上与脊椎动物骨骼无机相具有相似性而广泛地用作骨组织替代材料, 安全性已为大量的实验及临床应用所证明[5, 6]。此外, 磷酸钙在生理pH下保持较高的稳定性, 但在内涵体(pH 5.0~6.0)或溶酶体(pH 4.0~5.0)的酸性环境中可迅速解离, 通过改变内涵体/溶酶体的渗透压而使其破环, 从而将所载药物释放至胞质[7]。由于磷酸钙纳米粒具有较高的比表面积和强烈的聚集倾向, 且化学稳定性不高而难以直接应用[8]; 作为无机材料, 磷酸钙的细胞摄取率较低, 用于抗肿瘤治疗缺乏相应的靶向基团, 从而降低了药物疗效[9]。为了解决这些问题, 必须对纳米粒进行表面修饰。
脂质体是由磷脂和胆固醇形成的、具有脂质双分子层的封闭囊泡, 已被广泛应用于药物传递领域, 尤其是肿瘤的靶向治疗[10]。传统脂质体由流动的动态磷脂膜构成, 粒子间极易发生相互融合从而导致聚集和药物泄露[11]。另外, 脂质体作为药物载体用于肿瘤靶向治疗时, 通常需要进行聚乙二醇(PEG)化修饰以延长体内的循环时间, 改善药物动力学和体内分布[12]。但具有表面活性剂性质的PEG修饰材料过多(> 10%)往往会裂解磷脂膜从而影响脂质体的表面修饰程度[13]。鉴于传统脂质体存在的问题, Huang课题组[14]设计了一种将磷酸钙与脂质体相结合的纳米粒靶向药物递送系统, 即脂质磷酸钙(lipid coated calcium phosphate, LCP)纳米粒。一方面, 脂质膜可以改善磷酸钙纳米粒的表面性质, 增加细胞的亲和性和摄取率, 从而提高药物在细胞内的蓄积, 进一步提高药效[15]; 另一方面, 以磷酸钙为固体内核的脂质纳米粒克服了传统脂质体不能修饰大量PEG的缺点, 改善了脂质体的稳定性[16]。
本文以多柔比星(DOX)为模型药物, 采用反相微乳液法在Triton X-100/己醇/己烷/反相微乳体系中制备了尺寸均一、分散性良好且具有核-壳结构的载药脂质磷酸钙纳米粒(DOX/LCP), 并对制备条件进行了考察, 同时对所得脂质磷酸钙纳米粒的理化性质、细胞摄取及体外抗肿瘤活性进行了初步评价。
材料与方法主要仪器 JEM-1200EX型透射电子显微镜(日本电子公司); Nano-ZS90激光散射粒度仪(英国马尔文公司); Bio-RAD 680酶标仪(美国Bio-RAD公司); FV1000-IX81激光共聚焦显微镜(日本Olympus公司); FACSAria流式细胞仪(美国BD公司); CS120GXL低温超速离心机(日本Hitachi公司)。
药品和试剂 二油酰磷脂酸(1, 2-dioleoyl-sn-glycero-3-phosphatidic acid, DOPA)、二油酰基卵磷脂(1, 2-dioleoyl-sn-glycero-3-phosphocholine, DOPC)、二硬脂酰磷脂酰乙醇胺-聚乙二醇2000 [1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-methoxy(polyethylene glycol)-2000, DSPE-PEG 2K] (美国Avanti Polar Lipids公司); 偶联叶酸(folic acid, FA)的聚乙二醇化磷脂(DSPE-PEG2K-FA) (本实验室自制); 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)、胆固醇(美国Sigma公司); RPMI 1640培养基和胎牛血清(美国Gibco公司); 实验用水为去离子水, 甲醇、乙腈为色谱纯; 其余试剂或药品均为分析纯, 购自国药集团化学试剂有限公司。
LCP纳米粒的制备[17] 采用油包水型反相微乳法制得: ①取一定量的环己烷、正己醇和Triton X-100按一定比例混合均匀制成油相; 将DOX溶解在600 μL CaCl2 (2.5 mol·L-1)水溶液中, 滴入20 mL油相中形成A溶液; ②将Na2HPO4 (12.5 mmol·L-1, pH 9.0) 600 μL和DOPA (20 mmol·L-1) 200 μL加入另一份20 mL油相中形成B溶液; ③将A、B两溶液分别搅拌15 min形成均一溶液后, 混合并在室温下继续搅拌30 min。待磷酸钙沉淀反应完全后, 加入乙醇40 mL破乳, 10 000 r·min-1离心20 min分离沉淀; ④无水乙醇洗涤两次除去溶剂和表面活性剂后, 将磷酸钙内核沉淀溶解在氯仿中, 置于-20 ℃冰箱中备用。
为制备稳定的水溶性LCP, 将溶解在氯仿中的内核与20 mmol·L-1 DOPC/胆固醇(20 mmol·L-1, 1: 1) 100 μL、20 mmol·L-1 DSPE-PEG2K 10 μL和20 mmol·L-1 DSPE-PEG2K-FA 10 μL共溶于氯仿中混匀。减压旋转蒸发除去氯仿后, 加入5%葡萄糖溶液1 mL水化, 即得载有DOX的LCP纳米粒(DOX/LCP)。
包封率和载药量的测定 采用高效液相色谱法(HPLC)测定DOX/LCP的载药量及包封率。色谱条件:流动相为甲醇-水-冰醋酸(体积比55: 45: 0.5), 流速为0.8 mL·min-1, 检测波长258 nm, 进样量20 μL。建立标准曲线A = 36 061 X - 28 202, R2 = 0.999 1。将DOX/LCP用裂解液(2 mmol·L-1 EDTA和0.05% Triton X-100)破坏, 过0.22 μm微孔滤膜过滤, 精密吸取0.1 mL加入乙腈稀释至10 mL。采用HPLC法测定纳米粒中的药物质量(m1), 根据下列公式计算包封率(EE)和载药量(DL): EE% = (m1/mDOX) × 100%, DL% = (m1/mtotal) × 100%, 其中mDOX为投药量, mtotal为载体材料总质量。
形态观察及粒径、zeta电位测定 取LCP纳米粒及磷酸钙内核5 μL滴加于铜网上, 1 min后吸去多余液体, 自然晾干, 透射电镜下观察其形态并拍照。采用马尔文激光粒度测定仪测定其粒径, 多分散指数(polydispersity index, PDI)及zeta电位。
体外释放度测定 采用动态膜透析法考察DOX/LCP纳米粒的体外释放性质。精密量取一定量的DOX/LCP纳米粒, 装入预处理过的透析袋中(截留分子质量为8 000~12 000 Da), 两端扎紧后置于30 mL不同pH的释放介质中, 在37 ℃、100 r·min-1的条件下恒温振荡。分别于0.5、2、4、8、12和24 h取样0.2 mL, 并补充相同体积的新鲜释放介质。HPLC法测定释放介质中药物的浓度, 计算累积释放度。以释放时间为横坐标、累积释放百分率为纵坐标绘制释放曲线。
DOX的体外细胞摄取 为定性观察细胞对载药LCP的摄取情况, 乳腺癌耐药株(MCF-7/DOX)细胞以细胞数1×105/mL接种于12孔板中, 置于二氧化碳培养箱中贴壁过夜。给予相同浓度(1 μg·mL-1)的游离DOX及DOX/LCP分别培养4 h。吸去培养基, 经漂洗、固定后, 加入含4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)的封片剂, 共聚焦显微镜定性观察细胞摄取情况。
为定量比较细胞对载药LCP的摄取情况, MCF-7/DOX细胞以细胞数1×106/mL接种在6孔板中, 置于二氧化碳培养箱中贴壁过夜。给予相同浓度(1 μg·mL-1)的游离DOX及DOX/LCP分别培养4 h。吸去培养基, 经漂洗、消化后, 加入500 μL磷酸盐缓冲液(phosphate buffered saline, PBS)调成单细胞悬液, 流式细胞仪分析细胞荧光强度。DOX的激发/发射波长为485/595 nm。
体外细胞毒性实验 取对数生长期的MCF-7/DOX细胞, 以细胞数5×104/mL接种在96孔板中, 置于二氧化碳培养箱中贴壁过夜。实验分3组, 即游离DOX组、DOX/LCP组和空白LCP组。加入100 μL含不同浓度DOX的培养基, 同时设置阴性对照孔和空白调零孔, 每个浓度重复6孔。细胞在常规培养条件下培养24 h后, 每孔加入5 mg·mL-1 MTT液20 μL, 37 ℃继续培养4 h后, 吸弃上清液, 每孔加入DMSO 150 μL, 避光震荡20 min, 使结晶物充分溶解。以酶标仪检测490 nm处的吸光度(A), 按照如下公式计算细胞存活率(SR): SR (%) = (Asample - Ablank)/(Acontrol - Ablank)×100%, 式中Asample、Acontrol和Ablank分别为加药孔、阴性对照孔及空白调零孔的吸光度值。
统计学方法 采用SPSS 22.0程序进行统计学分析, 实验结果以x±s表示。多样本均数间比较采用单因素方差分析, P < 0.05为显著性差异, P < 0.01为极显著性差异。
结果 1 微乳液体系组成的确定按照乳化剂(Triton X-100)和助乳化剂(正己醇)的体积比(Km, 1: 1、2: 1、3: 1)配制成混合表面活性剂。将环己烷与混合表面活性剂按不同比例混合均匀, 分别向这些体系中滴定水溶液并观察微乳液透明度的变化; 在混合溶液出现浑浊时记录加入水的体积。以Triton X-100+正己醇、环己烷、水为三相绘制三元相图, 确定微乳区域。通过滴定法确定此体系的拟三元相图如图 1所示, 图中线左侧区域即为W/O微乳区域, 在此区域内配制溶液均为微乳液, 外观澄清透明, 超速离心后没有分层的现象。由各比例下的表面活性剂所绘制成的曲线围成的左侧成乳区域大小, 可以看出表面活性剂的乳化剂与助乳化剂比例为Km = 2: 1时的相图面积较大, 即Triton X-100与正己醇体积比为2: 1时, 微乳最易获得。
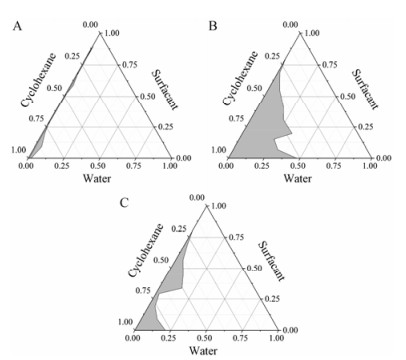
|
Figure 1 Pseudo-ternary phase diagram of Triton X-100-hexanol/cyclohexane/water microemulsion system with Km value of 1: 1 (A), 2: 1 (B) and 3: 1 (C) |
在确定微乳液体系最佳组成的基础上, 采用反相微乳模板法制备油溶性的载药磷酸钙内核, 进而采用薄膜法在磷酸钙内核表面重建非对称的磷脂双分子层, 其制备过程如图 2所示。

|
Figure 2 Schematic illustration of the synthesis of doxorubicin-loaded lipid calcium phosphate nanoparticles (DOX/LCP). DOPA: 1, 2-Dioleoyl-sn-glycero-3-phosphatidic acid; DOPC: 1, 2-Dioleoyl-sn-glycero-3-phosphocholine; PEG2K: Polyethylene glycol-2000; FA: Folic acid |
在LCP制备过程中, 固定其他条件不变, 考察关键因素前体钙磷比(Ca/P)对粒径及包封率的影响(表 1)。结果表明, 当Ca/P < 100时粒径在100 nm以上; 随着Ca/P逐渐增加, 粒径显著降低, Ca/P > 200时粒径达到50 nm以下。包封率随着Ca/P的增加而有所降低, 当Ca/P > 300时包封率 < 80%。综合分析实验结果, Ca/P选择200: 1作为最佳比例。
| Table 1 The effect of Ca/P ratios on preparation of DOX/LCP. n = 3, x±s. PDI: Polydispersity index; DL: Drug loading; EE: Entrapment efficiency |
采用透射电镜观察磷酸钙内核及LCP的形态, 结果如图 3所示。由图可见, 内核外观圆整, 呈球形, 分散性好, 透射电镜测得的粒径约30 nm左右。表面包裹磷脂双层后, 粒径略有增加, 平均粒径为(48.6 ± 3.9) nm, zeta电位为(-12.1 ± 1.2) mV。LCP的zeta电位绝对值比较低, 是由于DSPE-PEG2K的亲水链为聚乙二醇, 遮蔽了磷脂层的部分负电荷。

|
Figure 3 Typical TEM morphology of calcium phosphate cores (A) and LCP (B) |
图 4A中曲线为油溶性磷酸钙内核的FTIR图谱, 在560和1 030 cm-1处的吸收峰是由PO43-引起的, 这些特征峰表明所得样品确为磷酸钙。3 400和1 540 cm-1处的吸收峰分别是由产物中H2O的伸缩振动和弯曲振动引起的。图 4B为磷酸钙内核的EDS能谱分析, 从图中可见, 粒子的主要成分为Ca、P和O, 即磷酸钙的组成成分。其中Ca和P的含量比值大约为1.4: 1, 与文献[18]报道中合成的磷酸钙的比例是一致的。

|
Figure 4 Physicochemical characterization of calcium phosphate cores. A: FT-IR spectra of CaP cores; B: EDS spectrum of synthesized CaP cores |
LCP在37 ℃条件下分别置于模拟血浆(含10%胎牛血清的Tris缓冲液)及Tris缓冲液中24 h内的粒径和PDI变化见图 5。由图可见, LCP显示了较好的物理稳定性, 粒径和PDI无显著性变化。

|
Figure 5 Particle size-stability of LCP in 10% fetal bovine serum (FBS) and Tris buffer |
DOX/LCP在不同pH条件下的释放曲线如图 6所示。在pH为7.4介质中, DOX/LCP释放呈现较低的释放速率, 24 h累计释放度低于20%, 说明其在体循环中存在一定的稳定性; 随着释放介质pH值的降低, DOX/LCP释放速度逐渐加快, pH 4.5介质中在24 h累计释放量超过90%, 说明LCP具有一定的pH敏感性, 可以在肿瘤微环境中及时释放药物。

|
Figure 6 In vitro release profiles of DOX from LCP in medium with different pH values. n = 3, x±s |
共聚焦显微镜定性观察结果(图 7)表明, MCF-7/DOX细胞与游离药物组孵育3 h后, 仅有微弱红色荧光分布在细胞核内, 流式细胞术分析结果显示细胞摄取率仅为30.7%, 说明耐药细胞株对DOX有较强的外排性。而与DOX/LCP孵育相同时间后在细胞核观察到较强的荧光信号, 细胞摄取率提高至72.6%, 说明LCP可以显著促进耐药细胞对DOX的摄取和蓄积。

|
Figure 7 Cellular uptake of DOX/LCP. A: Intracellular localization of free DOX and DOX/LCP by confocal microscopy. Scale bar indicates 10 μm. B: Quantifying intracellular uptake of DOX and DOX/LCP by flow cytometry analysis. Untreated cells were used as control. C: The quantified mean fluorescence intensity of DOX positive cells by flow cytometry analysis. n = 3, x±s. *P < 0.05, **P < 0.01 vs control group |
从图 8可以看出, 空白LCP纳米粒不呈现细胞毒性, 与空白对照组相比无显著性差异(P > 0.05)。随着其浓度的增加, 细胞存活率几乎不受影响, 当其浓度达到50 mg·L-1时, 细胞存活率在80%以上。DOX/LCP的抗肿瘤活性比游离DOX组明显增强, IC50值分别为4.6 ± 0.3和11.8 ± 0.7 μg·mL-1, 两者相比具有显著性差异(P < 0.05), 说明DOX/LCP是通过DOX而非药物载体起到肿瘤细胞抑制作用。

|
Figure 8 Cytotoxicity of LCP (A) and DOX/LCP (B) in MCF-7/DOX cells. n = 6, x±s. *P < 0.05, **P < 0.01 vs control group |
本文采用反相微乳法制备了粒径可控的磷酸钙纳米粒, 其中反相微乳是由水溶液分散到由Triton X-100/正己醇/环己烷组成的三元油相溶液中制备得到[19]。将氯化钙溶液/DOX和磷酸钠溶液分别分散于油相中形成W/O型微乳, 两相混合过程中乳滴之间经过交换后发生共沉淀反应。DOPA是一种亲水头部为磷酸基的负电荷磷脂, 与多价钙离子有很强的络合能力。在磷酸钙沉积过程中, DOPA分子的疏水性尾基分布朝向油相, 而磷酸极性头部分布在乳滴水相中与生成的纳米粒在油水界面络合, 从而形成一层脂质膜稳定纳米粒的生长。经乙醇破乳、洗涤后, 表面覆盖磷脂单层的磷酸钙纳米核可重新分散于氯仿中。在LCP重建过程中, 外膜成分(DOPC、胆固醇、DSPE-PEG)通过疏水相互作用以磷酸钙纳米核为模板进行自组装, 形成表面包覆不对称脂质双分子层的磷酸钙纳米粒。
在本研究中, LCP的粒径受前体钙磷摩尔比例的影响较大, 只有当钙磷比大于100时才能得到粒径在50 nm以下的LCP, 该结果与已有文献[20]报道相一致。当钙磷比较高时(200: 1), 油水界面的DOPA可以和磷酸钙内核表面的过量钙离子络合, 从而保证磷酸钙的表面能够被DOPA充分覆盖改性。但过高的钙磷比会因较多的正电荷排斥而导致粒子产率下降, 从而影响药物的包封率。采用反相微乳法制得的LCP表面电势较低(-12~-14 mV), 这是由于DOPA负电荷磷脂主要富集在内层膜与磷酸钙内核锚定, 而中性磷脂(DOPC)、胆固醇及PEG高分子通过疏水相互作用排列在脂质膜的外层。
脂质体在体内循环过程中会被网状内皮系统的单核巨噬细胞吞噬而迅速从体内清除, 从而导致药物在肿瘤部位的富集不足。因此传统脂质体用于肿瘤靶向治疗时通常需要用DSPE-PEG2K进行表面修饰以延长体内循环时间[21]。研究表明, 当脂质体表面的PEG修饰摩尔比达到5%~8%时, PEG会由“蘑菇状”构象部分转变成具有更好保护性能的“毛刷状”构象[22]。当PEG修饰摩尔比继续增加时, 脂质体会被具有表面活性的DSPE-PEG裂解成胶束而导致药物泄露[23]。本研究制备的LCP以磷酸钙为固体内核, 磷脂膜通过DOPA与钙离子之间的强烈络合作用锚定在其表面, 相较于传统脂质体具有很高的物理稳定性, 其表面PEG修饰摩尔比可高达20%。高密度的PEG可以保证LCP在体内外具有较高的物理稳定性。
游离DOX很难在耐药株细胞内蓄积, 其可被肿瘤细胞膜表面的P-gp糖蛋白泵出[24]。药物通过包封于LCP中, 可避免耐药相关蛋白的识别、结合及外排, 使药物在细胞内的摄取及滞留能力均增加, 从而发挥独特的逆转耐药效应[25]。LCP以受体介导的内吞方式被细胞摄取内化形成胞内体后, 在酸性内涵体/溶酶体环境中发生解离, 一方面会形成高浓度的胞内离子从而改变内涵体渗透压使其发生破裂; 另一方面解离产生的大量磷酸氢根离子具有较强的pH缓冲作用, 通过捕获质子能防止早期内涵体内pH下降而过早与溶酶体融合, 从而可以避免溶酶体内发生的酶降解[26]。在后续研究中将对LCP克服肿瘤耐药的机制进行深入的探讨。
| [1] | Ridi F, Meazzini I, Castroflorio B, et al. Functional calcium phosphate composites in nanomedicine[J]. Adv Colloid Interface Sci, 2017, 244: 281–295. DOI:10.1016/j.cis.2016.03.006 |
| [2] | Yin H, Kanasty RL, Eltoukhy AA, et al. Non-viral vectors for gene-based therapy[J]. Nat Rev Genet, 2014, 15: 541–555. DOI:10.1038/nrg3763 |
| [3] | Choi AH, Ben-Nissan B. Calcium phosphate nanocoatings and nanocomposites, part Ⅰ:recent developments and advancements in tissue engineering and bioimaging[J]. Nanomedicine (Lond), 2015, 10: 2249–2261. DOI:10.2217/nnm.15.57 |
| [4] | Tabaković A, Kester M, Adair JH. Calcium phosphate-based composite nanoparticles in bioimaging and therapeutic delivery applications[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2012, 4: 96–112. DOI:10.1002/wnan.163 |
| [5] | Xu HH, Wang P, Wang L, et al. Calcium phosphate cements for bone engineering and their biological properties[J]. Bone Res, 2017, 5: 17056. DOI:10.1038/boneres.2017.56 |
| [6] | Parent M, Baradari H, Champion E, et al. Design of calcium phosphate ceramics for drug delivery applications in bone diseases:a review of the parameters affecting the loading and release of the therapeutic substance[J]. J Control Release, 2017, 252: 1–17. DOI:10.1016/j.jconrel.2017.02.012 |
| [7] | Li J, Yang Y, Huang L. Calcium phosphate nanoparticles with an asymmetric lipid bilayer coating for siRNA delivery to the tumor[J]. J Control Release, 2012, 158: 108–114. DOI:10.1016/j.jconrel.2011.10.020 |
| [8] | Ginebra MP, Canal C, Espanol M, et al. Calcium phosphate cements as drug delivery materials[J]. Adv Drug Deliv Rev, 2012, 64: 1090–1110. DOI:10.1016/j.addr.2012.01.008 |
| [9] | Elzoghby AO, Hemasa AL, Freag MS. Hybrid protein- inorganic nanoparticles:from tumor-targeted drug delivery to cancer imaging[J]. J Control Release, 2016, 243: 303–322. DOI:10.1016/j.jconrel.2016.10.023 |
| [10] | Deshpande PP, Biswas S, Torchilin VP. Current trends in the use of liposomes for tumor targeting[J]. Nanomedicine (Lond), 2013, 8: 1509–1528. DOI:10.2217/nnm.13.118 |
| [11] | Yang Y, Xie X, Yang Y, et al. A review on the influences of size and surface charge of liposome on its targeted drug delivery in vivo[J]. Acta Pharm Sin (药学学报), 2013, 48: 1644–1650. |
| [12] | Fang Y, Xue J, Gao S, et al. Cleavable PEGylation:a strategy for overcoming the "PEG dilemma" in efficient drug delivery[J]. Drug Deliv, 2017, 24: 22–32. DOI:10.1080/10717544.2017.1388451 |
| [13] | Zhang D, Xu H, Hu M, et al. "PEG dilemma" for liposomes and its solving approaches[J]. Acta Pharm Sin (药学学报), 2015, 50: 252–260. |
| [14] | Haynes MT, Huang L. Lipid-coated calcium phosphate nanoparticles for nonviral gene therapy[J]. Adv Genet, 2014, 88: 205–229. |
| [15] | Satterlee AB, Huang L. Current and future theranostic applications of the lipid-calcium-phosphate nanoparticle platform[J]. Theranostics, 2016, 6: 918–929. DOI:10.7150/thno.14689 |
| [16] | Haynes MT, Huang L. Maximizing the supported bilayer phenomenon:liposomes comprised exclusively of PEGylated phospholipids for enhanced systemic and lymphatic delivery[J]. ACS Appl Mater Interfaces, 2016, 8: 24361–24367. DOI:10.1021/acsami.6b05534 |
| [17] | Li J, Chen YC, Tseng YC, et al. Biodegradable calcium phosphate nanoparticle with lipid coating for systemic siRNA delivery[J]. J Control Release, 2010, 142: 416–421. DOI:10.1016/j.jconrel.2009.11.008 |
| [18] | Uskoković V, Desai TA. Phase composition control of calcium phosphate nanoparticles for tunable drug delivery kinetics and treatment of osteomyelitis. I. Preparation and drug release[J]. J Biomed Mater Res A, 2013, 101: 1416–1426. |
| [19] | Guo S, Miao L, Huang L. Lipid coated calcium phosphate nanoparticles for drug delivery[J]. Acta Biophy Sin (生物物理学报), 2013, 29: 823–830. DOI:10.3724/SP.J.1260.2013.30165 |
| [20] | Tang J, Li L, Howard CB, et al. Preparation of optimized lipid-coated calcium phosphate nanoparticles for enhanced in vitro gene delivery to breast cancer cells[J]. J Mater Chem B, 2015, 3: 6805–6812. DOI:10.1039/C5TB00912J |
| [21] | Zhang L, Wang Y, Gao H, et al. The construction of cell- penetrating peptide R8 and pH sensitive cleavable polyethylene glycols co-modified liposomes[J]. Acta Pharm Sin (药学学报), 2015, 50: 760–766. |
| [22] | Huang L, Liu Y. In vivo delivery of RNAi with lipid-based nanoparticles[J]. Annu Rev Biomed Eng, 2011, 13: 507–530. DOI:10.1146/annurev-bioeng-071910-124709 |
| [23] | Suk JS, Xu Q, Kim N, et al. PEGylation as a strategy for improving nanoparticle-based drug and gene delivery[J]. Adv Drug Deliv Rev, 2016, 99: 28–51. DOI:10.1016/j.addr.2015.09.012 |
| [24] | Ma P, Mumper RJ. Anthracycline nano-delivery systems to overcome multiple drug resistance:a comprehensive review[J]. Nano Today, 2013, 8: 313–331. DOI:10.1016/j.nantod.2013.04.006 |
| [25] | Markman JL, Rekechenetskiy A, Holler E, et al. Nanomedicine therapeutic approaches to overcome cancer drug resistance[J]. Adv Drug Deliv Rev, 2013, 65: 1866–1879. DOI:10.1016/j.addr.2013.09.019 |
| [26] | Hu Y, Haynes MT, Wang Y, et al. A highly efficient synthetic vector:nonhydrodynamic delivery of DNA to hepatocyte nuclei in vivo[J]. ACS Nano, 2013, 7: 5376–5384. DOI:10.1021/nn4012384 |
 2018, Vol. 53
2018, Vol. 53


