2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
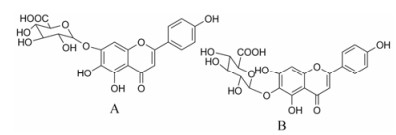
灯盏花素是从灯盏花中提取的黄酮类有效成分, 其中90%以上成分为灯盏乙素(scutellarin, 结构如图 1所示)。药理学研究揭示, 灯盏乙素能够显著降低血液黏度和血脂水平, 改善脑血流量, 降低血管阻力和抗血小板凝集及抗血栓形成[1-5]。临床上主要以口服和注射两种形式用药。
|
Figure 1 Chemical structures of scutellarin (A) and isoscutellarin (B) |
文献[6]报道, 受试者口服灯盏花素60 mg, 灯盏乙素血浆浓度不足5 ng·mL-1, 血浆中主要成分是其代谢产物异灯盏乙素(isoscutellarin, 结构如图 1所示)。大鼠药动学研究结果也显示灯盏乙素的口服生物利用度很低, 灌胃给药后异灯盏乙素也是大鼠血浆中的主要代谢产物[7]。进一步体外代谢机制研究表明[8-11], 灯盏乙素在肠道菌群作用下可水解成苷元, 进一步代谢生成灯盏乙素和异灯盏乙素, 虽然灯盏乙素在肠壁代谢生成速率远高于异灯盏乙素, 但其与肝脏摄取转运体OATP2B1的亲和力大于异灯盏乙素, 更容易进入肝细胞发生进一步代谢和胆汁排泄, 从而引起更强的肝脏首过清除效应, 导致灯盏乙素和异灯盏乙素的药动学差异, 但两者在组织分布是否有差异未见报道。而了解组织分布特征, 有利于研究灯盏乙素的药效机制、明确其毒性靶器官。
本研究旨在建立一种简单、快速能同时测定大鼠血浆和各组织中灯盏乙素和异灯盏乙素的LC-MS/MS定量方法, 探索静脉和灌胃给予灯盏花素后, 灯盏乙素和异灯盏乙素在大鼠体内组织分布的差异, 为不同给药途径药效学和安全性评价提供参考。
材料与方法药品和试剂 注射用灯盏花素(批号20170407-1, 其中灯盏乙素纯度为99.0%)、灯盏乙素对照品(批号110842-201508, 纯度99.31%)、异灯盏乙素对照品(批号20170626, 纯度98.98%)均由昆明龙津药业股份有限公司提供, 黄芩苷对照品(批号B0321AS, 含量99.34%)购于大连美仑生物技术有限公司, 甲酸(德国Fluka公司)、甲醇和乙腈(德国Merck公司)均为色谱纯, 磷酸(国药集团化学试剂有限公司)、二甲亚砜(国药集团化学试剂有限公司)均为分析纯, 去离子水由法国Millipore超纯水仪制备。
仪器 Triple quad 5500型三重四极杆串联质谱仪, 配备电喷雾电离源(ESI源), 加拿大AB Sciex公司; Analyst 1.6.3定量处理软件, 加拿大AB Sciex公司; 液相色谱系统, 包括LC-30AD型输液泵, SIL-30AC型自动进样器和CTO-20A型柱温箱, 日本岛津公司; Precellys 24多功能样品均质器, 法国Bertin公司。
色谱条件 色谱柱为Agilent Eclipse plus C18色谱柱(100 mm × 2.1 mm, 3.5 μm, 美国Agilent公司); 流动相: A相(含有0.1%甲酸的水溶液), B相(甲醇); 采用梯度洗脱程序, 如下: 0~0.5 min, 40% B; 0.5~1.5 min, 40%~65% B; 1.5~1.8 min, 65%~95% B; 1.8~2.2 min, 95% B; 2.2~2.3 min, 95%~40%; 2.3~3.0 min, 40% B。流速为0.8 mL·min-1, 柱温为40 ℃, 进样量为8.0 μL。
质谱条件 离子源为电喷雾电离源(ESI源); 正离子方式检测; 源喷射电压: 5 500 V; 温度为550 ℃; 离子源气体1 (N2)压力为50 psi (1 psi ≈ 6.9 kPa); 离子源气体2 (N2)压力为60 psi; 气帘气体(N2)压力为30 psi; 扫描方式为多反应监测(MRM), 碰撞气压力为9 psi; 扫描时间为45 ms。检测离子对: m/z 463→123 (灯盏乙素), m/z 463→123 (异灯盏乙素)和m/z 447→123 (黄芩苷, 内标)。
标准系列样品和质控样品的制备 精密称取灯盏乙素和异灯盏乙素适量, 用含1%甲酸的甲醇溶解并定容, 获得各自的储备液。
分别精密吸取灯盏乙素和异灯盏乙素储备液适量, 以含1%甲酸的甲醇稀释, 获得质量浓度为100/50.0、40.0/20.0、16.0/8.00、4.00/2.00、1.20/0.600、0.400/0.200、0.200/0.100 μg·mL-1灯盏乙素/异灯盏乙素的标准系列溶液及80.0/40.0、12.0/6.00、0.600/0.300、0.200/0.100 g·mL-1的质控工作溶液。上述溶液采用经酸化处理的大鼠空白血浆进一步稀释, 获得灯盏乙素/异灯盏乙素血浆质量浓度分别为5 000/2 500、2 000/1 000、800/400、200/100、60.0/30.0、20.0/10.0和10.0/5.00 ng·mL-1的标准系列样品和血浆质量浓度为4 000/2 000、600/300、30.0/15.0 ng·mL-1的质控样品。
组织浓度测定的标准系列样品和质控样品是采用空白肝组织匀浆液(以含10%的8 mol·L-1磷酸的乙腈制备组织匀浆, 1: 5, w/v)配制。灯盏乙素/异灯盏乙素的组织样品测定的标准曲线质量浓度分别为30.0/15.0、60.0/30.0、150/75.0、500/250、1 000/500、2 000/1 000、5 000/2 500、10 000/5 000 ng·g-1; 质控样品质量浓度分别为30.0/15.0、90.0/45.0、800/400、8 000/4 000 ng·g-1。
生物样品预处理 取经磷酸酸化处理的血浆样品25.0 μL, 加入黄芩苷溶液(100 ng·mL-1) 25.0 μL和含1%甲酸的乙腈100 μL, 涡流1 min, 离心10 min (4 ℃, 14 000 r·min-1)后, 取上清液50 μL, 加入去离子水100 μL, 混匀后取8.0 μL进行LC-MS/MS分析。
大鼠各组织样品在室温解冻后, 剪取一半以上的组织, 置于冰盘上, 用手术剪将组织剪碎(小于1 cm × 1 cm), 再混合, 进一步剪碎。精密称取组织样品适量, 置于匀浆管中。加入相当于其重量5倍体积的含10%的8 mol·L-1磷酸的乙腈制备匀浆。取组织匀浆液样品25.0 μL, 加入内标溶液(100 ng·mL-1) 25.0 μL和含1%甲酸的乙腈100 μL, 涡流1 min, 离心5 min后, 取上清液50.0 mL加入去离子水150 μL, 混匀后取8.0 μL进行LC-MS/MS分析。
方法学验证
交叉干扰 用大鼠酸化空白血浆配制5 000 ng·mL-1灯盏乙素样品和2 500 ng·mL-1异灯盏乙素样品, 考察测定时灯盏乙素和异灯盏乙素是否相互干扰。
选择性 分别取6个不同来源的经酸化处理的大鼠空白血浆或空白组织样品以及用相应空白基质配制的定量下限(LLOQ)样品(灯盏乙素/异灯盏乙素血浆质量浓度为10.0/5.00 ng·mL-1; 灯盏乙素/异灯盏乙素组织浓度为30.0/15.0 ng·g-1)进行LC-MS/MS分析测定, 考察不同来源空白基质中的内源性物质是否干扰待测物及内标的测定。
标准曲线与定量下限 血浆或组织的标准系列样品按照“生物样品预处理”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权(W = 1/X2)最小二乘法进行回归运算, 求得的标准曲线的相关系数(r2)均大于0.99。取LLOQ样品, 进行6样本分析, 根据当日标准曲线计算每一样本的测得浓度, 计算该浓度的日内和日间精密度和准确度。
精密度和准确度 取灯盏乙素/异灯盏乙素血浆或组织的低、中、高质控样品, 按“生物样品预处理”项下操作, 每个浓度进行6样本分析。血浆质控样品连续进行3天的测定, 根据每日结果求算待测物的日内、日间精密度和准确度。组织的质控样品进行一个分析批的测定, 根据结果求算待测物的日内精密度和准确度。
基质效应 分别取6个不同来源的经酸化处理的大鼠空白血浆或空白组织样品, 除不加内标外, 其余按“生物样品预处理”项下操作, 取上清液置于另一试管中, 加入灯盏乙素/异灯盏乙素对照质控溶液和内标溶液, 涡流1 min, 取8.0 μL进行LC-MS/MS分析, 获得相应峰面积(A)。同时另取去离子水代替空白基质, 按上述处理, 获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算血浆或组织样品的基质效应, 计算公式为A/B×100%。以分析物和内标的基质效应比值计算内标归一化的基质效应因子。
稳定性 考察了灯盏乙素和异灯盏乙素在酸化的大鼠血浆样品室温放置6 h、6次冷冻-解冻循环、-70 ℃放置93天、-20 ℃放置93天的稳定性以及大鼠血浆样品经沉淀蛋白处理后室温放置6 h、自动进样器放置26 h的稳定性。考察了灯盏乙素/异灯盏乙素在大鼠肝组织匀浆样品室温放置19 h、4次冷冻-解冻循环、-70 ℃放置54天的稳定性以及经沉淀蛋白处理后的组织匀浆样品自动进样器放置32 h的稳定性。
样品预处理回收率 取低、中、高3个浓度的血浆质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行6样本分析, 获得相应峰面积(A)。同时另取大鼠酸化空白血浆。除不加内标外, 其余按“血浆样品预处理”项下操作, 取上清液置于另一试管中, 加入灯盏乙素/异灯盏乙素对照质控溶液和内标溶液, 涡流1 min, 取8.0 μL进行LC-MS/MS分析, 获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算回收率, 计算公式为A/B×100%。
组织分布研究及数据分析 静脉给药组: SD大鼠30只, 体重180~220 g, 年龄7~8周, 随机分成5个时间组, 每一时间组6只, 雌雄各半。单次静脉注射给予20 mg·kg-1灯盏花素, 给药剂量为5 mL·kg-1。实验期间自由进食和饮水。5组大鼠分别于给药前(0 h)、给药后15 min、1 h、3 h和12 h, 麻醉后经腹主动脉放血处死, 立即解剖采集脑、心、肝、脾、肺、肾、膀胱、胃壁、小肠(空肠)、肾上腺。收集部分全血; 剩余全血离心后, 分离血浆, 加入1/10倍血浆体积的8 mol·L-1磷酸溶液; 各组织用冷生理盐水冲净表面残留血液及内容物, 吸干后贴好标签, -70 ℃保存待测。
灌胃给药组: SD大鼠24只, 体重180~220 g, 年龄7~8周, 随机分成4个时间组, 每一时间组6只, 雌雄各半。单次灌胃给予80 mg·kg-1灯盏花素, 给药体积为10 mL·kg-1。实验期间自由进食和饮水。4组大鼠分别于给药后2、4、8和12 h如上采集血浆和组织样品。
所得的血浆和组织浓度-时间数据采用Phoenix WinNonlin® 6.3 (美国Pharsight公司)软件以非房室模型进行处理和统计分析。
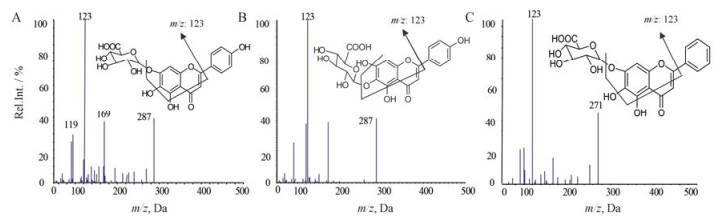
结果 1 质谱分析在本实验色谱/质谱条件下, 灯盏乙素、异灯盏乙素以及内标黄芩苷主要产生m/z 463、m/z 463、m/z 447的[M+H]+峰。选择性对[M+H]+峰进行产物离子扫描, 三者均易生成脱去葡萄糖醛酸的碎片离子m/z 287 (灯盏乙素和异灯盏乙素)和m/z 271 (黄芩苷), 为提高检测时选择性, 进一步增加碰撞能量, 获得均为m/z 123的特征碎片离子, 用于作为MRM扫描时的检测的产物离子。待测物及内标的产物离子扫描质谱图及可能的断裂方式见图 2。
|
Figure 2 Product ion mass spectra of [M+H]+ ions for scutellarin (A), isoscutellarin (B) and internal standard baicalin (C) |
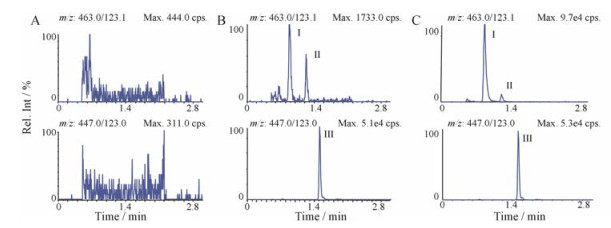
在本实验色谱条件下, 灯盏乙素的色谱保留时间约0.90 min, 异灯盏乙素的色谱保留时间约1.24 min, 黄芩苷的色谱保留时间约1.51 min (图 3)。选择性实验结果表明大鼠空白血浆和空白肝匀浆中内源性物质均不干扰待测物的测定。待测物间色谱完全分离, 无相互干扰。
|
Figure 3 Representative MRM chromatograms of scutellarin (Ⅰ), isoscutellarin (Ⅱ) and baicalin (Ⅲ, IS). A: Blank plasma sample; B: Blank plasma spiked with scutellarin/isoscutellarin (10.0/5.00 ng·mL-1) and baicalin (100 ng·mL-1); C: A plasma sample at 1 h after an intravenous administration to rats |
测定大鼠血浆中灯盏乙素和与异灯盏乙素的线性范围分别为10.0~5 000 ng·mL-1和5.00~2 500 ng·mL-1。典型标准曲线回归方程为:灯盏乙素, y = 0.005 58 x + 0.003 09 (r = 0.998 1);异灯盏乙素, y = 0.001 07 x + 0.003 51 (r = 0.997 5)。取大鼠LLOQ血浆样品(灯盏乙素/异灯盏乙素质量浓度为10.0/5.00 ng·mL-1)进行6样本分析, 连续测定3天并分别根据当日标准曲线求得每一样本的测得浓度。求得灯盏乙素的日内精密度为6.2%, 日间精密度为6.5%, 准确度(RE)为-5.1%;异灯盏乙素的日内精密度为9.6%, 日间精密度为9.5%, 准确度(RE)为-3.3%。实验结果表明, LC-MS/MS法测定大鼠血浆中灯盏乙素、异灯盏乙素的定量下限分别为10.0和5.00 ng·mL-1。
测定大鼠组织匀浆中灯盏乙素与异灯盏乙素的线性范围分别为: 30.0~10 000 ng·g-1和15.0~5 000 ng·g-1。典型标准曲线回归方程为:灯盏乙素, y = 0.001 53 x + 0.004 25 (r = 0.999 1);异灯盏乙素, y = 0.001 07 x + 0.003 51 (r = 0.997 5)。取大鼠组织匀浆LLOQ样品(灯盏乙素/异灯盏乙素组织质量浓度为30.0/15.0 ng·g-1)进行6样本分析, 根据当日标准曲线求得每一样本的测得浓度。求得灯盏乙素的日内精密度为3.1%, 日内准确度(RE)为6.8%;异灯盏乙素的日内精密度为11.1%, 准确度(RE)为-6.8%。实验结果表明, LC-MS/MS法测定大鼠组织中灯盏乙素和异灯盏乙素的定量下限分别为30.0和15.0 ng·g-1。
2.3 精密度与准确度灯盏乙素与异灯盏乙素血浆样品和组织样品测定准确度与精密度数据分别见表 1和表 2。各待测物低、中、高质控样品的日内和日间的精密度和准确度均符合生物样品测定相关要求。
| Table 1 Precision and accuracy data for the determination of scutellarin/isoscutellarin in rat plasma. n = 6, x±s |
| Table 2 Precision and accuracy data for the determination of scutellarin/isoscutellarin in rat liver tissue. n = 6, x±s |
大鼠血浆样品中, 灯盏乙素在低、高浓度经内标校正的基质效应因子分别为119.2%和102.9%, 相对标准差均小于6.2%;异灯盏乙素在低、高浓度经内标校正的基质效应因子分别为104.4%和100.5%, 相对标准差均小于7.8%。在大鼠组织样品中, 灯盏乙素在低、高浓度经内标校正的基质效应因子分别为87.6%和88.7%, 相对标准差均小于3.5%;异灯盏乙素在低、高浓度经内标校正的基质效应因子分别为91.6%和93.1%, 相对标准差均小于5.1%。结果表明, 待测物和内标在本实验选择的色谱和质谱条件下, 可忽略生物基质效应的影响。
2.5 稳定性低、高两浓度灯盏乙素和异灯盏乙素血浆(组织匀浆)样品, 在本实验所考察的储存条件下放置后再进行测定, 获得偏差(RE)均在±15%之内, 表明待测物在本实验条件下放置稳定。
2.6 回收率大鼠血浆样品经蛋白沉淀处理后, 灯盏乙素在低、中、高浓度的回收率分别为96.9%、105.8%和102.4%, 异灯盏乙素在低、中、高浓度的回收率分别为93.6%、102.5%和101.2%。
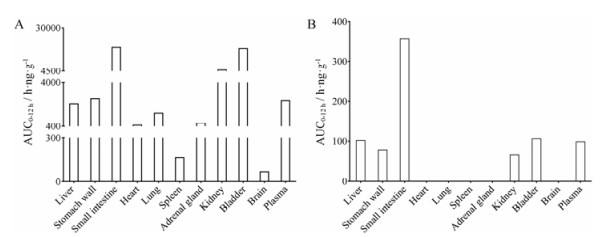
3 组织分布差异研究将所建立并经验证的方法应用于灯盏乙素及其代谢物异灯盏乙素的组织分布差异研究, 待测物各组织浓度经时数据用WinNonlin药动学软件拟合, 拟合方法选择非房室模型, 计算大鼠各组织中灯盏乙素及异灯盏乙素的AUC0-12 h值。不同给药途径, 大鼠各组织中灯盏乙素与异灯盏乙素的AUC0-12 h比较见图 4和图 5。以AUCplasma 0-12 h为参比, 计算两种给药方式下的组织/血浆暴露量比值, 数据处理结果见表 3。
|
Figure 4 The tissue AUC0-12 h data of scutellarin and isoscutellarin in rats after 20 mg·kg-1 intravenous administration. A: Scutellarin; B: Isoscutellarin |
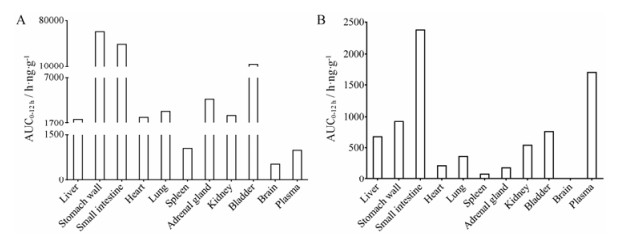
|
Figure 5 The tissue AUC0-12 h data of scutellarin and isoscutellarin in rats after 80 mg·kg-1 intragastric administration. A: Scutellarin; B: Isoscutellarin |
| Table 3 The AUCtissue/AUCplasma ratios of scutellarin and isoscutellarin with different administration routes in rats (n = 6). n.d.: Not detected; iv: Intravenous injection; ig: Intragastrically |
大鼠静脉注射灯盏花素后, 灯盏乙素主要分布于消化道、膀胱和肾脏组织, 代谢物异灯盏乙素的血浆和组织暴露量均不足灯盏乙素暴露量的5%。灌胃给予灯盏花素后, 大部分组织中灯盏乙素暴露量高于血浆暴露量, 灯盏乙素主要分布于消化道、膀胱、肾上腺和肺组织; 异灯盏乙素血浆暴露量高于灯盏乙素, 但其组织暴露量明显低于灯盏乙素。在给药后12 h, 除了在灌胃组的小肠和胃壁组织还可检测到约200 ng·mL-1左右的灯盏乙素浓度外, 静脉和灌胃组其他组织中灯盏乙素和异灯盏乙素浓度均低于定量下限。
讨论灯盏乙素与异灯盏乙素为同分异构体, 具有相同的MRM离子对, 本文通过优化流动相的组成和比例, 利用梯度洗脱的方式使二者达到色谱完全分离, 且色谱运行时间不到3 min, 满足大批量样品测定的需求。
灯盏乙素结构中含有邻二酚羟基, 易被氧化, 为确保生物样品采集、储存和分析过程中待测物稳定, 本文在大鼠血浆样品采集时加入了1/10样品体积的8 mol·L-1磷酸溶液; 组织样品匀浆时, 采用了含10% 8 mol·L-1磷酸的乙腈溶液作为匀浆试剂。生物样品预处理, 则以简单且易操作的蛋白沉淀法代替文献报道的液-液萃取或固相萃取法[7, 8], 使处理后的待测物保持在pH 2左右的环境中, 保证其稳定。
大鼠静脉或灌胃给药后, 灯盏乙素与异灯盏乙素在体内消除快速, 在给药后12 h大部分组织的灯盏乙素与异灯盏乙素浓度低于定量下限。异灯盏乙素在两种给药方式中均在小肠的药物浓度最高, 这可能是由于异灯盏乙素是在小肠中代谢产生。静脉和灌胃两种给药方式下, 灯盏乙素和异灯盏乙素在大鼠体内分布存在明显差异。灌胃给药组灯盏乙素的组织/血浆暴露量比值明显高于静脉给药组; 异灯盏乙素在小肠、胃壁、肝、肾和膀胱的组织/血浆暴露量比值静脉组略高于灌胃给药组, 在静脉给药组的血浆暴露量明显低于灌胃给药组, 这可能与异灯盏乙素是由首过代谢生成有关。两种给药方式下, 在脑组织中均可检测到灯盏乙素, 但未检测到异灯盏乙素, 推测是因为脑组织OATP转运体对灯盏乙素的亲和力远高于异灯盏乙素。
本实验建立了能同时测定大鼠血浆和各组织中灯盏乙素和异灯盏乙素的LC-MS/MS法并成功应用于不同给药途径下灯盏乙素及其代谢物在大鼠体内处置差异研究。在静脉和灌胃给药方式下, 灯盏乙素和异灯盏乙素在大鼠体内的分布存在差异, 提示应关注不同给药方式对灯盏乙素药效和安全性的影响。
致谢: 中国科学院上海药物研究所杨瑛、孙斯文和沈光莹开展动物实验。| [1] | Zhang J, Wang LQ, Li YP. Application of Erigeron breviscapine and related products[J]. Chin J Ethn Ethn (中国民族民间医药), 2001, 10: 197–199. |
| [2] | Ding GH. Progress in pharmacological research and clinical application of breviscapine[J]. Lishizhen Med Mater Med Res (时珍国医国药), 1999, 10: 68–69. |
| [3] | Wu JS, Hu TT, Zhang L. Clinical observation of Breviscapine Injection on myocardial ischemia of coronary heart disease[J]. J Math Med (数理医药学杂志), 2000, 13: 318–319. |
| [4] | Yang JM. Clinical application progress of breviscapine[J]. Chin Pharm (中国药业), 2000, 9: 64–65. |
| [5] | Wei N. Advances of Breviscapine in Clinical Application and its Side-effects[J]. Chin Pharm (中国药师), 2001, 4: 144–146. |
| [6] | Chen XY, Cui L, Duan XT, et al. Pharmacokinetics and metabolism of the flavonoid scutellarin in humans after a single oral administration[J]. Drug Metab Dispos, 2006, 34: 1345. DOI:10.1124/dmd.106.009779 |
| [7] | Gao CY. Absorption and Disposition Study of Scutellarin (大鼠和人体内灯盏乙素吸收及处置机制的研究)[D]. Shanghai: Graduate University of Chinese Academy of Sciences, 2012. |
| [8] | Gao CY, Chen XY, Zhong DF, et al. Absorption and disposition of scutellarin in rats:a pharmacokinetic explanation for the high exposure of its isomeric metabolite[J]. Drug Metab Dispos, 2011, 39: 2034–2044. DOI:10.1124/dmd.111.040550 |
| [9] | Gao CY, Zhang HJ, Guo ZT, et al. Mechanistic studies on the absorption and disposition of scutellarin in humans:selective OATP2B1-mediated hepatic uptake is a likely key determinant for its unique pharmacokinetic characteristics[J]. Drug Metab Dispos, 2012, 40: 2009–2020. DOI:10.1124/dmd.112.047183 |
| [10] | Gao CY, Li Q, Chen XY, et al. Study of the absorption mechanism of scutellarin in human intestine (灯盏乙素口服吸收机制的研究)[C]//The Ninth Chinese Drug and Xenobiotics Metabolism Academic Conference Symposium (第九届全国药物和化学异物代谢学术会议论文集). Wuhan: Chinese Pharmacology Society, 2009: 151-154. |
| [11] | Gong YJ, Wang JX, Zhang Y, et al. Intestinal lymphatic transport of breviscapine orally administered in rat[J]. Acta Pharm Sin (药学学报), 2011, 46: 1262–1267. |
 2018, Vol. 53
2018, Vol. 53


