2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
黄酮醇糖苷(3', 4'-二甲氧基黄酮醇-D-葡萄糖苷)是人工合成的黄酮醇糖苷类化合物, 能够改善血液循环, 降低胆固醇, 其原型为某一中药提取的黄酮化合物3, 3', 4'-三羟基黄酮[1]。上海捌加壹医药科技有限公司研究开发一类新药黄酮醇糖苷, 目前处于临床试验阶段。
王秀云等[2]采用LC-MS/MS法, 以泮托拉唑为内标测定黄酮醇糖苷在SD大鼠体内的血浆浓度。该实验测定了SD大鼠灌胃给予黄酮醇糖苷后血浆中原形药物黄酮醇糖苷的浓度, 发现其药时曲线呈现双峰现象, 但没有给出合适的解释, 且该实验仅测定SD大鼠血浆中原形药物的浓度, 没有测定相应代谢物, 所得数据不能完整地体现黄酮醇糖苷在SD大鼠体内的药代动力学特点。娄琼等[3]采用LC-MS/MS法, 以泮托拉唑为内标测定黄酮醇糖苷在SD大鼠体内的组织分布及排泄。该实验结果表明, 黄酮醇糖苷灌胃后快速广泛地分布于各组织中, 且无长时间蓄积, 在尿液、粪便、胆汁中排泄量极少, 说明黄酮醇糖苷在大鼠体内存在着广泛的代谢过程, 大多以代谢产物形式排出体外, 但关于黄酮醇糖苷在SD大鼠体内的代谢途径以及以何种代谢物形式排出体外等均未得出结论。
本实验室通过UPLC/Q-TOF MS技术, 分析了受试者口服黄酮醇糖苷片后血浆和尿样中黄酮醇糖苷及代谢产物的相关信息, 在血浆中主要检测到原形药物黄酮醇糖苷(M0)和葡萄糖醛酸结合物(M2), 在尿样中除M0和M2外还检测到少量的苷元(M1), 结构式见图 1。结果表明代谢物的暴露量较高, 在药物处置过程中占有重要地位, 但尚未有文献报道黄酮醇糖苷在人体或动物体内的代谢情况。

|
Figure 1 The chemical structures of flavonol glycoside (M0), aglycone (M1) and glucuronide conjugate (M2) |
本实验旨在建立准确、快速、灵敏的LC-MS/MS法同时测定SD大鼠血浆中黄酮醇糖苷、苷元和葡萄糖醛酸结合物, 并将验证后的方法应用于临床前药动学研究, 以支持临床药动学试验设计。
材料与方法药品和试剂 黄酮醇糖苷(含量95.72%)、苷元(含量99.0%)、葡萄糖醛酸结合物(含量96.2%)、d6-黄酮醇糖苷和黄酮醇糖苷原料药均由第二军医大学、上海捌加壹医药科技有限公司提供, 甲醇(德国Merck公司)、乙腈(德国Merck公司)、甲酸(上海TCI公司)均为色谱纯, 二甲亚砜(国药集团化学试剂有限公司)为分析纯, 去离子水由Millipore纯水仪制备。
仪器 kTriple quad 5500型三重四极杆串联质谱仪, 配备电喷雾电离源, 加拿大AB Sciex公司; 岛津液相色谱系统(包括DGU-20A3型脱气机, LC-20AD型二元液相泵, SIL-20AC型自动进样器和CTO-20A型柱温箱), 日本岛津公司。
色谱条件 析柱: XDB C18 (50 mm × 4.6 mm, 1.8 μm, Agilent); 预柱: C18保护柱(4 mm × 3.0 mm, 5 μm, 美国Phenomenex公司); 流动相: A相(含0.2%甲酸的去离子水)-B相(甲醇); 采用的梯度洗脱程序如下: 0~0.5 min, 65% B; 0.5~1.3 min, 65%~95% B; 1.3~3.0 min, 95% B; 3.0~3.1 min, 95%~65% B; 3.1~4.5 min, 65% B; 流速: 0.6 mL·min-1; 柱温为40 ℃; 进样量: 2.00 μL。
质谱条件 离子源为电喷雾电离源; 正离子方式检测; 源喷射电压为5 500 V; 温度为500 ℃; 离子源气体1 (N2)压力为50 psi (1 psi ≈ 6.9 kPa); 离子源气体2 (N2)压力为50 psi; 气帘气体(N2)压力为35 psi; 扫描方式为多反应监测, 碰撞气压力为9 psi; 扫描时间为100 ms。待测物的离子反应分别为: m/z 461.3→m/z 299.1 (M0)、m/z 299.1→m/z 283.1 (M1)、m/z 475.0→m/z 299.1 (M2)、m/z 467.3→m/z 305.1 (d6-黄酮醇糖苷)。
标准系列样品和质控样品的制备 分别精密称取黄酮醇糖苷、苷元、葡萄糖醛酸结合物对照品各两份, 用二甲亚砜溶解并用甲醇定容, 获得质量浓度均为1.00 mg·mL-1的M0、M1、M2储备液各两份, 分别用于配制标准系列样品和质控样品。
以甲醇-水(50: 50, v/v)稀释M0、M1、M2储备液及质控储备液, 获得标准系列溶液和质控溶液, 分别取标准系列溶液10 μL, 加入大鼠空白血浆190 μL, 获得M0/M1/M2浓度为2.00/2.00/5.00、4.00/4.00/10.0、10.0/10.0/25.0、20.0/20.0/50.0、50.0/50.0/125、100/100/ 250、200/200/500、400/400/1 000 ng·mL-1的标准系列样品。以甲醇稀释内标储备液(970 ng·mL-1)获得8 ng·mL-1的内标工作溶液。用大鼠空白血浆配制质控样品[M0/M1/M2质量浓度为: 2.00/2.00/5.00 ng·mL-1 (LLOQ)、6.00/6.00/15.0 ng·mL-1 (LQC)、40.0/40.0/100 ng·mL-1 (MQC)和320/320/800 ng·mL-1 (HQC)]均储存于-70 ℃条件下备用。
血浆样品预处理 血浆样品预处理采用蛋白沉淀法。向35 μL大鼠血浆样品中加入内标工作溶液35 μL和甲醇(含0.2%甲酸) 140 μL, 涡流混合10 min后, 离心15 min (3 700 r·min-1), 取上清液130 μL加入去离子水(含0.2%甲酸) 70 μL, 涡流混合10 min, 取2.00 μL进行LC-MS/MS分析。
方法验证 对建立的方法进行方法验证, 参照中国药典2015年版指导原则和相关国际规范的相关要求[4, 5], 从方法的选择性、标准曲线和定量下限、精密度和准确度、稳定性、回收率、基质效应和稀释效应等方面进行方法验证。
选择性 分别取6个不同来源的大鼠空白血浆样品以及用相应大鼠空白血浆配制的LLOQ样品进行LC-MS/MS分析测定, 考察不同来源空白血浆中的内源性物质是否干扰待测物及内标的测定。
标准曲线 大鼠血浆样品2.00/2.00/5.00~400/ 400/1 000 ng·mL-1 8个浓度点, 分别按照“血浆样品预处理”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 采用加权(W = 1/X2)最小二乘法进行回归运算, 求得的直线回归方程即为标准曲线。
精密度与准确度 取大鼠低、中、高3个浓度质控样品, 按照“血浆样品预处理”项下操作, 每个浓度进行6样本分析并在3日内测试, 分别根据当日标准曲线计算每一样本的测得浓度并根据QC样品结果计算本方法日内、日间精密度和准确度。
基质效应 分别取6个不同来源大鼠空白血浆和一份空白溶血血浆50.0 μL加入甲醇(含0.2%甲酸) 200 μL, 涡流10 min, 离心15 min (3 700 r·min-1), 取上清液168 μL于另一试管, 分别加入对应的低、高浓度对照质控溶液7.00 μL和35.0 μL内标溶液, 涡流10 min后取上清液130 μL, 加入去离子水(含0.2%甲酸) 70.0 μL, 涡流10 min, 取2.00 μL进行LC-MS/MS分析, 获得相应峰面积(A)。同时另取去离子水50 μL代替大鼠空白血浆, 按上述方法操作获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算基质效应, 公式为A/B×100%, 并以分析物和内标的基质效应比值计算内标归一化的基质效应。
回收率 采用大鼠空白血浆配制的的低、中、高3个浓度的血浆样品, 按照“血浆样品预处理”项下操作, 每个浓度进行6样本分析。同时另取大鼠空白血浆50.0 μL加入甲醇(含0.2%甲酸) 200 μL, 涡流10 min, 离心15 min (3 700 r·min-1), 取上清液168 μL于另一试管, 加入对应的低、中、高浓度对照质控溶液7.00 μL和内标溶液35.0 μL, 涡流10 min后取上清液130 μL, 加入去离子水(含0.2%甲酸) 70.0 μL, 涡流10 min, 取2.00 μL进行分析, 获得相应峰面积(n = 3)。用提取后色谱峰面积与未经提取的色谱峰面积之比计算提取回收率。
稳定性 考察了黄酮醇糖苷、苷元和葡萄糖醛酸结合物大鼠血浆样品室温放置6 h, 全血样品室温放置2 h, 经沉淀蛋白处理后室温放置6 h, 自动进样器放置24 h, 大鼠血浆样品-20 ℃经历3次冷冻-解冻循环, 大鼠血浆样品-70 ℃经历3次冷冻-解冻循环的稳定性。
药动学研究及数据分析 动物实验部分在中国科学院上海药物研究所实验动物中心完成。SD大鼠, 体重180~220 g, 雌雄各半; 年龄7~8周, 给药前禁食12 h, 自由饮水, 给药后4 h统一进食。SD大鼠灌胃给予黄酮醇糖苷原料药30 mg·kg-1, 分别于给药前0 h和给药后10 min、20 min、40 min、1.0 h、2.0 h、4.0 h、6.0 h、8.0 h、10 h、24 h和32 h经眼球后静脉丛取血0.2 mL置于EDTA-K2抗凝试管中, 离心5 min (11 600×g, 4 ℃)分离血浆, -70 ℃保存待测。
所得的血浆浓度-时间数据采用Phoenix Win Nonlin® 6.3 (美国Pharsight公司)软件以非房室模型进行处理和统计分析。
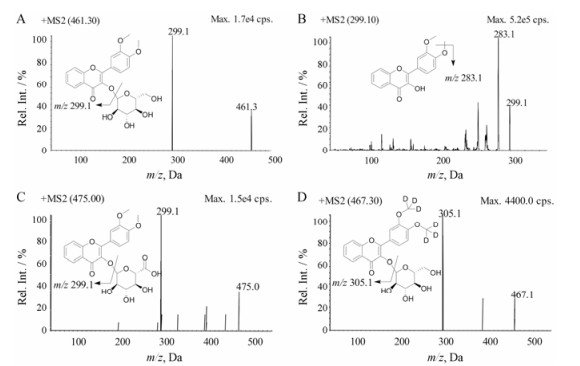
结果 1 质谱分析本实验首先考察了M0、M1和M2在ESI离子源下的质谱响应, 结果表明在ESI源正离子模式下响应较好, 均可产生[M+H]+峰和[M+Na]+峰, 所以选择了ESI源正离子模式。在正离子检测模式下, 选择性对[M+H]+峰进行产物离子扫描, 并对碰撞能量和去簇电压进行条件优化, 确定用于定量分析M0、M1和M2的离子对分别为m/z 461.3→m/z 299.1、m/z 299.1→m/z 283.1和m/z 475.0→m/z 299.1, 用于定量分析内标d6-黄酮醇糖苷的离子对为m/z 467.3→m/z 305.1。待测物及内标的产物离子扫描质谱图及可能的断裂方式见图 2。
|
Figure 2 The chemical structures and product mass spectra of [M+H]+ ions of M0 (A), M1 (B), M2 (C) and d6-flavonol glycoside (IS, D) |
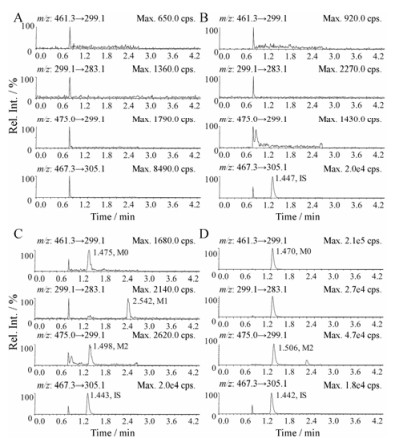
结果表明, 大鼠空白血浆中的内源性物质不干扰M0、M1、M2的测定, 同时同位素内标不干扰待测物的测定, 待测物对内标也无影响。典型色谱图见图 3: M0的出峰时间约1.47 min, M2的出峰时间约1.50 min, M1的出峰时间在2.5 min左右, 在M1的离子通道中1.50 min处的色谱峰来自于M0和M2的源内裂解。
|
Figure 3 Typical MRM chromatograms of M0, M1, M2 and d6-flavonol glycoside in rat plasma. A: Blank plasma; B: Blank plasma spiked with 8 ng·mL-1 d6-flavonol glycoside; C: LLOQ (2.00/2.00/5.00 ng·mL-1) sample spiked with 8 ng·mL-1 d6-flavonol glycoside; D: A plasma sample spiked with 8 ng·mL-1 d6-flavonol glycoside of 40 min after oral 30 mg·kg-1 flavonol glycoside |
求得的标准曲线的相关系数(r2)均大于0.99。测定大鼠血浆样品中M0、M1、M2的线性范围分别为2.00~400、2.00~400和5.00~1 000 ng·mL-1。典型标准曲线方程为: M0, y = 0.058 1 x + 0.01 (r2 = 0.998 6); M1, y = 0.067 1 x - 0.004 83 (r2 = 0.998 0); M2, y = 0.030 9 x - 0.008 41 (r2 = 0.998 0)。取大鼠LLOQ血浆样品(M0/M1/M2质量浓度为2.00/2.00/5.00 ng·mL-1)进行6样本分析, 连续测定3天并分别根据当日标准曲线求得每一样本的测得浓度。求得该质量浓度M0的日内精密度为5.4%, 日间精密度为6.5%, 准确度(RE)为-0.6%; M1的日内精密度为6.0%, 日间精密度为8.2%, 准确度为-1.5%; M2的日内精密度为5.1%, 日间精密度为6.4%, 准确度为-0.4%。实验结果表明, LC-MS/MS法测定大鼠血浆中M0、M1、M2的定量下限分别为2.00、2.00和5.00 ng·mL-1。
2.3 精密度与准确度准确度与精密度数据见表 1。大鼠每一浓度水平M0的QC样品的日内精密度均小于5.4%, 日间精密度均小于3.7%, 准确度在-0.4%~3.3%;每一浓度水平M1的QC样品的日内精密度均小于4.0%, 日间精密度均小于5.9%, 准确度在2.2%~5.2%;每一浓度水平M2的QC样品的日内精密度均小于3.0%, 日间精密度均小于3.1%, 准确度在0.1%~1.7%。待测物低、中、高质控样品的日内和日间的精密度和准确度均符合生物样品测定相关要求。
| Table 1 The intra-and inter-day precision and accuracy of the QC samples of M0, M1 and M2. n = 6, x±s |
大鼠血浆样品经蛋白沉淀处理后, M0在低、中、高浓度的回收率分别为108.0%、103.2%和100.3%, M1在低、中、高浓度的回收率分别为108.1%、107.6%和109.9%, M2在低、中、高浓度的回收率分别为96.7%、96.2%和92.8%。在大鼠血浆样品中, M0在低、高浓度经内标校正后的基质效应分别为102.0%和100.1%, 相对标准差分别为3.3%和1.1%; M1在低、高浓度经内标校正后的基质效应分别为74.2%和76.1%, 相对标准差分别为11.6%和5.8%; M2在低、高浓度经内标校正后的基质效应分别为90.5%和91.5%, 相对标准差分别为6.6%和4.2%。结果表明, 待测物在本实验选择的色谱和质谱条件下, 可忽略基质效应的影响。
2.5 稳定性本文考察了黄酮醇糖苷、苷元和葡萄糖醛酸结合物低、高两浓度血浆、全血样品在不同储存条件下的稳定性:大鼠全血样品室温放置2 h; 大鼠血浆样品室温放置6 h; 血浆样品经预处理后室温放置6 h; 血浆样品经预处理后自动进样器放置24 h; 经历-20 ℃下3次冷冻-解冻循环; 经历-70 ℃下3次冷冻-解冻循环, 在上述条件下, 血浆及全血样品均稳定。
2.6 稀释实验本实验考察了血浆浓度超出定量上限的大鼠血浆样品, 经空白大鼠血浆稀释后的准确度。取M0/M1/M2的稀释质控样品(大鼠血浆样品质量浓度为1 600/1 600/4 000 ng·mL-1), 用空白大鼠血浆稀释5倍后, 按“血浆样品预处理”项下操作, 进行6样本分析。结果表明, 大鼠血浆样品经空白大鼠血浆稀释5倍后测定不影响结果的准确度。
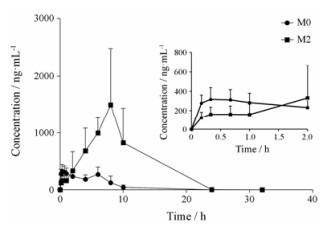
3 药动学研究将所建立并经过验证的方法应用于黄酮醇糖苷的动物药动学研究。SD大鼠灌胃给予黄酮醇糖苷30 mg·kg-1后, M0和M2的药时曲线见图 4, M0、M1和M2的药动学参数见表 2。
|
Figure 4 Plasma concentration-time curves of M0 and M2 in rats after oral 30 mg·kg-1 flavonol glycoside. n = 6, x±s |
| Table 2 Pharmacokinetic parameters of M0, M1 and M2 in rat plasma (30 mg·kg-1). n = 6, x±s. N.A.: Not applicable |
目前, 运用LC-MS/MS法研究其他黄酮类化合物的药动学生物分析方法已有很多报道[6-12], 但没有黄酮醇糖苷代谢物的相关报道。本实验将稳定同位素标记物d6-黄酮醇糖苷作为待测物M0、M1和M2的内标, 减少了基质对于定量测定的影响, 提高了分析结果的准确度与精密度。实验过程中, M0和M2发生源内裂解, 影响M1的测定, 通过改变液相色谱条件, 本实验实现了M1与M0和M2的色谱分离, 避免了M0和M2在离子源内裂解而对M1测定的影响。经考察, M0、M1和M2在本实验条件下均稳定。
本实验对黄酮醇糖苷进行了定量分析, 并首次对黄酮醇糖苷的代谢物苷元和葡萄糖醛酸结合物进行了直接测定。SD大鼠经灌胃给予黄酮醇糖苷30 mg·kg-1后, M0的Cmax为(341 ± 106) ng·mL-1、AUC0-t为(1 960 ± 725) h·ng·mL-1; M1在血浆中的含量低于分析方法的定量下限2 ng·mL-1, 无法测定相应浓度计算Cmax和AUC0-t; M2的Cmax为(1 720 ± 843) ng·mL-1、AUC0-t为(8 510 ± 2 920) h·ng·mL-1。其中M2的Cmax为M0的5.0倍, AUC0-t为M0的4.3倍。结果表明, 在SD大鼠血浆中, 黄酮醇糖苷主要以原形和代谢物葡萄糖醛酸结合物这两种形式存在。
根据黄酮类化合物如黄芩苷[13]、灯盏乙素[14, 15]等的相关研究, 推测黄酮醇糖苷经口服给药后在体内经肠菌群水解成苷元被吸收, 经历较强的首过代谢, M1在肝脏中进一步发生葡萄糖醛酸化反应从而生成M2。在SD大鼠体内, M1的含量极少, 仅能测得少数时间点的血药浓度, 可能是由于M1发生葡萄糖醛酸化生成M2的速度远大于M0水解生成M1的速度。且M0的药时曲线明显存在双峰现象, 体现为黄酮醇糖苷在大鼠体内很快达峰(约1.36 h), 之后约于6 h左右出现浓度回升现象, 这可能是因为胃肠道的不同部位存在多个吸收位点, 黄酮醇糖苷在不同部位的吸收速率并不一致从而引起双峰现象。
本实验确定了大鼠灌胃给予黄酮醇糖苷后体内主要代谢物形式, 并首次测定代谢物的血药浓度, 对黄酮醇糖苷的代谢途径做出推测, 为黄酮醇糖苷的临床试验设计提供了依据。结果表明, 对于黄酮类化合物的药动学研究, 不仅要关注原形药物, 而且更要关注其代谢物, 后者在血浆中的暴露量通常远高于前者。
致谢: 中国科学院上海药物研究所杨瑛、孙斯文和沈光莹开展动物实验。| [1] | Jin YS, Jiang YY, Wu QY, et al. 3-Oxy-3', 4'-dimethoxy flavonoid with hypolipidemic effect: CN, 101244057[P]. 2008-08-20. |
| [2] | Wang XY. Quality Control and Therapeutic Drug Monitoring on SD Rat of Innovative Drugs GDH (创新药物GDH的质量控制及其在SD大鼠体内血药浓度监测)[D]. Fuzhou: Fujian University of Traditional Chinese Medicine, 2015. |
| [3] | Lou Q. The Study on Tissue Distribution and Excretion of GDH in Rats (GDH在大鼠体内的组织分布和排泄研究)[D]. Guangzhou: Guangdong Pharmaceutical University, 2015. |
| [4] | European Medicines Agency. Guideline on Bioanalytical Method Validation[S/OL]. London: European Medicines Agency. 2011[2015-12-10]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf. |
| [5] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Vol 4. Beijing: China Medical Science Press, 2015: 363-368. |
| [6] | Zhong DF, Yang BH, Chen XY, et al. Determination of scutellarin in rat plasma by high-performance liquid chromatography with ultraviolet detection[J]. J Chromatogr B, 2003, 796: 439–444. DOI:10.1016/j.jchromb.2003.08.002 |
| [7] | Li CR, Zhang L, Lin G, et al. Identification and quantification of baicalein, wogonin, oroxylin A and their major glucuronide conjugated metabolites in rat plasma after oral administration of Radix Scutellariae product[J]. J Pharm Biomed Anal, 2011, 54: 750. DOI:10.1016/j.jpba.2010.10.005 |
| [8] | Duan KF, Yuan ZF, Guo W, et al. LC-MS/MS determination and pharmacokinetic study of five flavone components after solvent extraction/acid hydrolysis in rat plasma after oral administration of Verbena officinalis L. extract[J]. J Ethnopharmacol, 2011, 135: 201–208. DOI:10.1016/j.jep.2011.01.002 |
| [9] | Fong SY, Wong YC, Zuo Z. Development of a SPE-LC/MS/MS method for simultaneous quantification of baicalein, wogonin, oroxylin A and their glucuronides baicalin, wogonoside and oroxyloside in rats and its application to brain uptake and plasma pharmacokinetic studies[J]. J Pharm Biomed Anal, 2014, 97: 9–23. DOI:10.1016/j.jpba.2014.03.033 |
| [10] | Chang L, Ren YP, Cao L, et al. Simultaneous determination and pharmacokinetic study of six flavonoids from Fructus Sophorae extract in rat plasma by LC-MS/MS[J]. J Chromatogr B, 2012, 904: 59–64. DOI:10.1016/j.jchromb.2012.07.015 |
| [11] | Wan LL, Guo C, Yu Q, et al. Quantitative determination of apigenin and its metabolism in rat plasma after intravenous bolus administration by HPLC coupled with tandem mass spectrometry[J]. J Chromatogr B, 2007, 855: 286–289. DOI:10.1016/j.jchromb.2007.05.007 |
| [12] | Tong L, Wan MX, Zhang LH, et al. Simultaneous determination of baicalin, wogonoside, baicalein, wogonin, oroxylin A and chrysin of Radix Scutellariae extract in rat plasma by liquid chromatography tandem mass spectrometry[J]. J Pharm Biomed Anal, 2012, 70: 6–12. DOI:10.1016/j.jpba.2012.03.051 |
| [13] | Xing J, Chen XY, Zhong DF. Absorption and enterohepatic circulation of baicalin in rats[J]. Life Sci, 2005, 78: 140–146. DOI:10.1016/j.lfs.2005.04.072 |
| [14] | Chen XY, Cui L, Duan XT, et al. Pharmacokinetics and metabolism of the flavonoid scutellarin in humans after a single oral administration[J]. Drug Metab Dispos, 2006, 34: 1345–1352. DOI:10.1124/dmd.106.009779 |
| [15] | Gao CY, Chen XY, Zhong DF. Absorption and disposition of scutellarin in rats:a pharmacokinetic explanation for the high exposure of its isomeric metabolite[J]. Drug Metab Dispos, 2011, 39: 2034–2044. DOI:10.1124/dmd.111.040550 |
 2018, Vol. 53
2018, Vol. 53


