以靶标为核心的药物创制, 要旨是将安全性、活性、选择性和药代等全部性质融汇于分子结构之中, 为达到此目标, 分子既要精致地配置微观结构, 以保障活性强度、选择性和安全性, 以便有宽阔的治疗窗; 又要具备适宜的宏观性质, 确保药物在时空上有预期的吸收分布代谢排泄等性质。微观结构与宏观性质都体现于分子结构之中, 它们交织于结构中, 相互影响与制约。将活性化合物转化为药物, 其优化过程本质是协调二者的相关性, 这也是研发新药难度之所在。
小分子药物的作用机制, 大都是通过与靶标结合, 比如占据酶的催化中心或变构域, 占据受体和离子通道的活性部位, 结合核酸的转录区段等, 从而阻断大分子的生理生化功能(抑制剂)或提高其生物功能(激动剂)。
为了避免对靶标众多亚型的脱靶性, 药物与靶标结合的特异性或选择性是必要的前提, 实质是限制药物杂泛性(promiscuity)于所希冀的效应。此外, 为呈现持续的药理作用, 依照药物与靶标可逆性结合的质量作用定律, 药物须在体内保持足够的水平, 例如超过IC50或IC90等, 体内这样持续存在一定浓度的药物, 增加了脱靶作用风险, 产生不良反应, 例如一些激酶抑制剂作为靶向药物因结合的共性(例如ATP结合位点或变构域)而误识脱靶。
人体数万种蛋白调控机体的生理生化功能, 蛋白失去平衡是疾病的成因之一。药物干预并恢复蛋白的网络正常调控与平衡, 当今主打的是小分子化合物, 但所干预的靶标却只占蛋白总数的20%, 其余80%的蛋白尚无药物干预, 究其原因, 一是功能尚待解析, 另一是这些蛋白缺乏明确的结合位点, 例如催化中心、结合腔穴或裂隙, 被认为是非可药性靶标(non-druggable targets), 因而研制作用于这类靶蛋白的药物具有挑战性。晚近发展的双功能分子是针对提高选择性和探索非可药性靶标的新药研究, 本文从药物化学视角拟对某些方法作简要的讨论。
2 提高选择性的双功能分子 2.1 双靶标药物与双功能分子双靶标药物与双功能分子没有严格的界限, 若硬作区分, 笔者认为双靶标药物是一个化合物可作用于两个(或多个)不同的靶标蛋白, 以各自独立的方式产生药理作用的加和或协同效应。在分子设计上, 是由于结构中存在适配于两个靶标的药效团, 或以不同的构象体结合所致。本文讨论的双功能分子是指一个分子先后与两个靶标或一个靶标的两个位点结合, 引发相继的级联效应, 发生了前面的结合, 再启动后继的作用, 由于级联性的协调作用, 使得选择性作用增强。
2.2 抗体药物偶联物抗体与抗原分子的特异性识别与结合是生物医药的治疗基础, 本世纪以来抗体药物迅速发展, 尤其针对肿瘤细胞表面抗原的抗体药物成为肿瘤治疗的有效手段, 第一个获美国FDA批准上市(1997)的抗肿瘤抗体药物利妥昔单抗(rituximab), 用于治疗B细胞性非霍奇金淋巴瘤。随后陆续有一系列的抗肿瘤抗体药物应用于临床。
为了增强抗体药物杀伤肿瘤细胞的活性, 也为了提高常规化疗药物的选择性毒性, 将单抗与小分子细胞毒药物偶联, 形成抗体药物偶联物(anti body-drug conjugates, ADC), 这是目前抗肿瘤药物研究的活跃领域。
解析ADC的作用原理, 可认为是双功能性分子:利用抗体对细胞表面抗原的特异性识别与结合, 把ADC引向拟杀伤的肿瘤部位, 履行了输送、定位和被吞噬摄入的功能; 细胞毒药物(甚至是毒物)作为弹头, 释放于癌细胞中, 对靶标起杀伤作用。
为保障ADC的化学稳定性, 抗体与细胞毒分子的连接, 是用连接域片段(linker)经共价键相连。这样, ADC是由三部分构成:抗体、连接域和细胞毒化合物。作用过程是, ADC在随机转运中相遇并结合抗原受体, 经受体介导的胞吞作用进入细胞, 形成转运过程的核内体(endosome), 后经溶酶体(lysosome)裂解释放出毒性“弹头”, 实施对肿瘤细胞的选择性杀伤。图 1是ADC的作用机制示意图[1]。
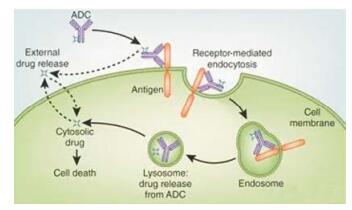
|
Figure 1 Diagram of ADC function |
本文不拟对ADC的设计原理和细节展开讨论, 读者可参阅有关综述[2, 3]。仅以治疗霍奇金淋巴瘤和间变性大细胞淋巴瘤的上市ADC药物brentuximab vedotin (图 2)为例, 分析结构特征。cAC10是抗CD30的单抗, 经连接域共价键合于抗微管蛋白的小分子化合物单甲基奥瑞他汀E (MMAE), 连接域可细分为连接片段、裂解片段和间隔片段, 是为了保障ADC的稳定性和双功能的各自独立活性以及可释放性。在确定了单抗目标和毒性分子后, ADC的成败与优劣在很大程度上取决于连接域的结构优化[4]。
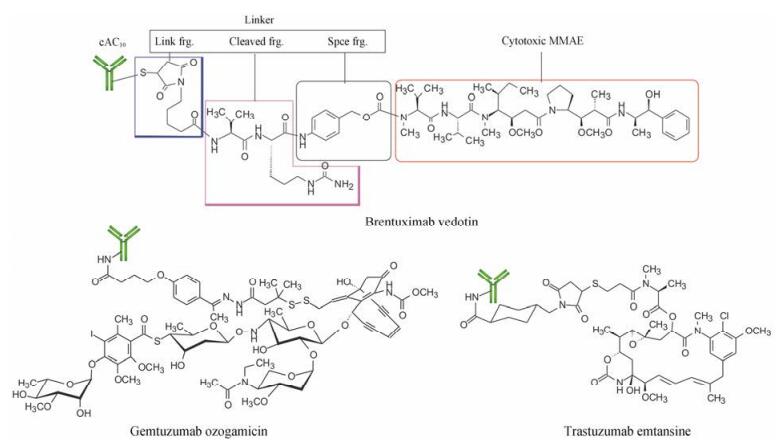
|
Figure 2 Structures of the marketed ADC |
图 2还列出另外两个上市的ADC, gemtuzumab ozogamicin和trastuzumab emtansine, 前者是以CD33为靶标的单抗经连接域同烯二炔类的DNA交联剂卡奇霉素(calicheamicin)缀合而成, 临床用于治疗急性髓系白血病(AML)。连接域中含有腙和二硫键的组成[5]; trastuzumab emtansine是第一个针对实体瘤的ADC药物, 治疗HER2阳性的转移性乳腺癌[6], 其组成是结合于HER2/neu受体的曲妥珠单抗(trastu zumab), 经含有硫代琥珀酰亚胺片段的连接域与美登素(DM1)共价键结合。
2.3 激酶的不可逆抑制剂结构生物学提供的靶标结构信息可指导设计双作用位点的药物, 以呈现双功能作用, 在研制激酶不可逆抑制剂获得了诸多成功。阿法替尼(afatinib)是EGFR激酶第二代抑制剂, 其结构特征与药效团分布与第一代的可逆性抑制剂吉非替尼(gefitinib)相似, 都作用于ATP结合位点, 所不同的是阿法替尼在喹唑啉环的6位连接有4-二甲胺基丁烯酰胺片段(二甲胺基为助溶基团, 并协同麦克尔加成反应), 丁烯酰胺是亲电性适度的基团, 可与EGFR激酶开口处Cys797的巯基发生麦克尔加成, 而其亲电性不足以同氨基等亲核性基团发生反应, 由于只与特定的巯基形成共价结合, 使酶活性彻底失活。这个麦克尔片段, 赋予分子以第二个功能位点, 对发生T790M变异、耐受厄洛替尼的EGFR发生有效的不可逆抑制作用[7] (图 3)。

|
Figure 3 Structure comparison of gefitinib to afatinib and other irreversible tinibs |
EGFR激酶第三代抑制剂奥西替尼(osimertinib)也是不可逆抑制剂, 只作用于发生T790M变异的EGFR激酶, 消除了对野生型EGFR和胰岛素生长因子受体(IGFR)激酶的脱靶效应。结构中的丙烯酰胺开辟了第二个功能位点, 提高了选择性活性[8]。
Bruton酪氨酸激酶(BTK)在B细胞抗原受体的信号通路中起重要作用, 其不可逆抑制剂依鲁替尼(ibrutinib)是治疗与B淋巴细胞相关的套细胞白血病的一线用药。为了提高对BTK的选择性抑制, 避免与强同源性的LCK激酶的脱靶作用, 利用了二者氨基酸残基481的不同, 设计了第二个功能位点的不可逆抑制剂, 氨基酸残基在BTK是Cys481, LCK是Ser481, 半胱氨酸巯基的亲核性强于丝氨酸的羟基, 抑制剂结构中的哌啶环连接了N-丙烯酰基, 与Cys481发生麦克尔加成, 而低亲核性的丝氨酸不发生共价结合, 提高了对突变株的选择性[9]。
2.4 疏水标签技术蛋白表面若被疏水性片段结合, 可诱导构象发生改变, 此时具有两面性(修复和降解)的伴侣蛋白(chaperones)启动蛋白降解机制(蛋白正确的折叠也需要伴侣蛋白协助), 促成蛋白酶体将构象错误的蛋白降解[10]。
疏水标签技术(hydrophoboc tags, HyT)是将疏水性片段或基团经连接域(linker)与对目标蛋白(POI)可结合的配体经共价键连接的化合物。其作用原理是, HyT的配体片段(例如受体的配体或酶底物或类似物)识别和结合POI, 并引导所连接的疏水性片段结合于蛋白的疏水部位, 后者因此使蛋白构象发生变化, 在伴侣蛋白的参与下, 被蛋白酶体降解。过程中HyT是募集伴侣蛋白和蛋白酶体的招募剂, HyT此时犹如催化剂促进目标蛋白的解体, 因为在裂解中并未消耗, 理论上可循环使用。图 4是疏水标签分子裂解目标蛋白的示意图。Crews等[11]对此有全面的论述。
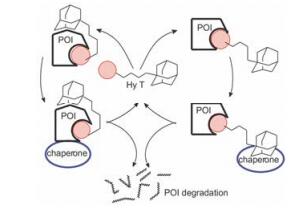
|
Figure 4 Protein degradation by hydrophobic tags |
选择性雌受体降解剂氟维司群(fluvestrant)可视作HyT类型的药物。氟维司群实属幸运发现(serendipity)。当初为研制选择性雌受体调节剂(SERM), 设计了在雌二醇的7位连接较长疏水链的化合物(末端氟代是为了提高代谢稳定性), 却意外地发现氟维司群可选择性地诱导雌受体降解, 因而是不可逆的拮抗剂。氟维司群于2002年上市治疗绝经妇女雌受体呈阳性的乳腺癌。氟维司群与他莫昔芬等SERM不同, 是雌受体降解剂(SERD), 完全拮抗剂[12]。虽然氟维司群诱导受体蛋白的降解机制未完全解析清楚, 但认为雌二醇的7R-疏水链结合于受体的疏水域, 导致构象改变, 招募了蛋白酶体, 降解了高表达的雌受体蛋白。
氟维司群的成功联想到对雄受体的降解, 开始了雄受体降解剂(SARD)的研究领域。抑制雄激素受体是治疗前列腺癌的重要途径, 以期SARD治疗去势后出现的耐药性前列腺癌。阿斯利康照搬氟维司群的思路合成的化合物, 是在睾酮的7位连接同样的疏水侧链, 但作用很弱, 未能成功[13]。
Crews等[14]研究SARD的母体分子是将非甾体类雄受体拮抗剂RU59063 (恩杂鲁胺的类似物, 非药)经聚乙二醇链连接金刚烷, 金刚烷是HyT常用的疏水片段。实验表明该RU59063衍生物是雄受体降解剂, 可抑制耐药前列腺癌细胞的增殖, 不过活性不高仍需优化。用3个叔丁氧羰基修饰的精氨酸(Boc3Arg)也是常用的疏水标签, 例如利尿药依他尼酸(etacrynic acid)连接Boc3Arg的HyT分子是谷胱甘肽S转移酶α1的裂解剂, 三甲氧苄啶(trimethoprim)与Boc3Arg形成的HyT是二氢叶酸还原酶(DHFR)蛋白裂解剂(图 5)。

|
Figure 5 Some examples of HyT technique |
基于疏水标签技术设计的降解剂大都针对以小分子为配体或底物的受体或酶系, 这类靶标蛋白有明确的结合位点, 比如结合腔或裂隙, 因而疏水片段的连接有比较明确的小分子结构, 切入点清晰。
然而更多的靶标的“配体”是蛋白, 生物效应往往是蛋白-蛋白相互作用(PPI)的结果, 由于PPI的结合面平坦, 范围广泛, 缺乏明显的活性中心作“抓手”, 因而这类蛋白常被认为非药性靶标(undruggable)。晚近发展的蛋白裂解靶向嵌合技术(proteolysis targeting chimera, PROTAC), 其策略原理是用小分子化合物诱导和募集与蛋白酶体降解相关的蛋白到靶标蛋白处, 将其降解失活。
2.5 蛋白裂解靶向嵌合体技术 2.5.1 原理PROTAC技术是构建双功能小分子化合物, 通过化学诱导一系列酶促反应, 实现裂解蛋白的方法。该过程的核心是将E3连接酶(泛素化的催化剂)募集到细胞内有害的拟降解的目标蛋白处, 由蛋白酶体降解清除。本文不拟深入叙述该生物学过程, 读者可参阅本刊最近的综述和有关文章[15, 16]。
被蛋白酶体裂解的目标蛋白(POI)需要预先连接泛素(ubiquitin, Ub), 泛素是蛋白质, 通过E1和E2酶促反应被活化, 后经连接酶E3将泛素催化连接到POI上。E3有数百种, 特异性催化不同蛋白的泛素化, POI与E3亚型须匹配。
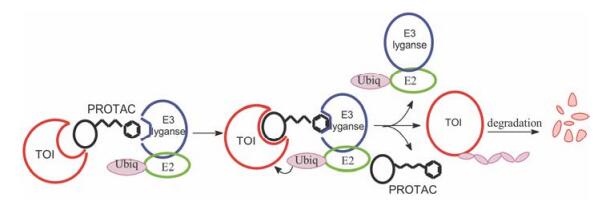
PROTAC技术是利用泛素-蛋白酶体系统, 设计具有双功能作用的小分子, 一端识别并结合目标蛋白, 另端识别并结合E3连接酶, PROTAC分子的功能是将目标蛋白与E3连接酶募集成三元体, 在时空上促进目标蛋白发生泛素化, 连接了泛素的目标蛋白被蛋白酶体裂解, 释放出泛素, PROTAC分子复原, 循环履行招募功能。图 6是PROTAC分子(
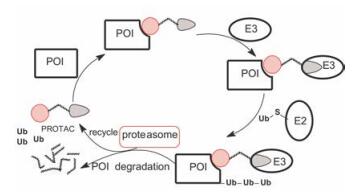
|
Figure 6 Schematic model of POI degradation by the action of bifunctional PROTAC |
E3酶家族有数百个亚型, 特异性地催化目标蛋白泛素化, 所以, PROTAC分子设计的双功能性, 应使POI和E3匹配, 才能有效地泛素化和裂解, 因而结合E3的功能片段因目标蛋白而异。
就非肽类的小分子片段而言, 例如已经报道的nutlin 3a, 由于与E3连接酶MDM2有高亲和力(Ki为nmol·L-1水平, 因而可阻断MDM2与底物p53的结合)。MDM2有E3酶的催化功能。Crews等[17]将nutlin 3a与雄受体拮抗剂(比卡鲁胺类似物)经聚乙二醇共价连接, 生成的PROTAC分子(图 7a)用转染雄受体蛋白的HeLa细胞证明, 在化合物a的诱导募集下, 经上述过程被蛋白酶体裂解, 降低了雄受体蛋白的水平, 而加入蛋白酶体抑制剂则阻止雄受体的裂解。
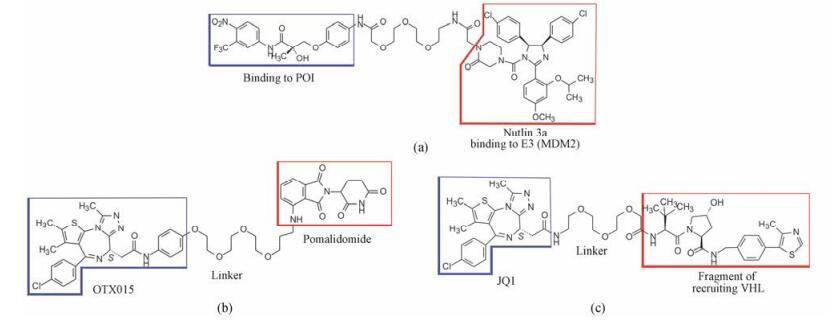
|
Figure 7 Examples of PROTAC technique |
溴域蛋白4 (BRD4)是BET蛋白家族成员, 与RNA聚合酶Ⅱ等蛋白参与癌基因MYC、BCL2等的转录过程, BRD4在多种肿瘤高表达, 因而是肿瘤治疗药物的靶标。一些噻吩三唑并二氮䓬化合物(如OTX015和JQ1)是BED4的结合剂(也是抑制剂); 另一方面, E3裂解酶cereblon的配体沙利度胺和泊马度胺等邻苯二甲酰亚胺类之间有高亲合力, 将泊马度胺(pomalidomide)经聚乙二醇共价连接OTX015, 得到的PROTAC分子(图 7b, ARV-825)具有双重功能:可将各种Burkitt淋巴瘤细胞内的BRD4招募到E3连接酶cereblon处, 结合成三元复合物, cereblon催化BRD4泛素化后, 被蛋白酶体高效率地迅速裂解。化合物b对BRD4蛋白裂解的选择性显著强于BRD3和BRD2, 说明PROTAC设计的化合物有高度选择性[18]。
具有E3连接酶特性的VHL (von Hippel-Lindau)蛋白也可作为设计PROTAC的靶向模板, 将可募集VHL蛋白的分子如含有羟基脯氨酸片段作为结合基团, 与噻吩三唑并二氮䓬化合物JQ1经聚乙二醇连接成PROTAC分子MZ1 (图 7c), 在nmol·L-1下即诱导裂解BRD4, 对BRD2和BRD3的作用需要μmol·L-1水平, 提示有较高的选择性。BRD4-MZ1-VHL三元复合物的晶体结构表明, MZ1采取折叠构象介于两个蛋白之间。图 8是晶体结构的结合面, MZ1形似弯弓样构象嵌合于两个蛋白形成的腔穴中[19]。
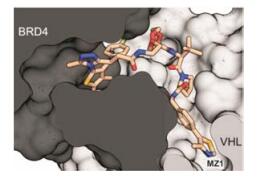
|
Figure 8 Binding interface of crystallographic structure of the triple complex BRD4-MZ1-VHL |
发现和确证新的药物靶标是研发首创性药物的原动力和起步点, 化学生物学使用探针分子不仅可研究蛋白的功能, 同时也为新药研究提供苗头化合物。创新药物涵盖了化学生物学和药物化学学科内容和知识价值链。
降解标签(degradation tag, dTAG)是个平台技术, 由哈佛大学Gray等[20]在前述的PROTAC的基础上发展而成。它的特点是可以绕过寻找结合于目标蛋白的配体分子这一环节, 经“万能的”配体将与特定蛋白融合的目标蛋白招募到E3连接酶的“麾下”, 泛素化后被蛋白酶体裂解。为了实现识别目标蛋白的通用性, dTAG技术应用了变异的FKBP蛋白(一类参与含有脯氨酸残基的蛋白构象折叠的伴侣分子) FKBP12F26V, 后者因具有特异空腔的构象, 可被小分子AP-1867选择性结合(Kd = 94 pmol·L-1, 而对野生型FKBP12WT Kd = 67 nmol·L-1), 所以在很低的浓度下实现选择性结合, 不影响胞内野生型FKBP12WT的功能[21] (图 9)。
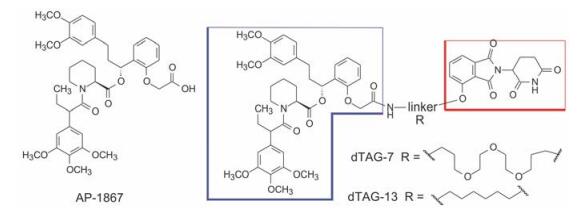
|
Figure 9 Examples of dTAG technique |
dTAG是用CRISPR-Cas9技术将FKBP12F26V基因敲入到目标蛋白(例如BRD4蛋白)的基因中, 产生的融合蛋白可被双功能分子例如dTAG-7或dTAG-13选择性裂解, dTAG-7和dTAG-13分子的左侧(AP1867)是结合融合蛋白中FKBP12F26V的片段, 右侧(沙利度胺)是E3连接酶CRBN的结合片段, 中间为连接域。图 10是dTAG裂解过程的示意图。此外, 这系列dTAG还裂解了KRASG12V、HDAC1、EZH2、MYC、PLK1等与FKBP12F26V融合蛋白, 并在细胞和小鼠体内降解了靶标蛋白的水平, 其功能得到了验证[20]。
|
Figure 10 Schematic depiction of degrading process by bifunctional dTAG molecule |
dTAG是用“通用”分子(不直接结合目标蛋白)的双功能性利用化学诱导结合的性质, 将融合蛋白裂解, 对于发现和验证蛋白的功能(化学生物学)以及发现苗头化合物(药物化学)都是有价值的平台技术。
3 结语药物的活性强度和选择性是药效的本质所在, 高选择性决定了优质的治疗窗和避免脱靶的不良反应。本世纪以来, 上市的抗体药物偶联物虽然为数不多, 但疗效显著, 反映在销售额高居不下。目前处于临床阶段的ADC有数十种, 作为大分子(旨在靶向输送的载体)和小分子(杀伤靶标)的缀合物, 发展势头强劲。基于靶标结构设计不可逆抑制剂, 已有多个激酶抑制剂上市。在靶位结合的基础上, 通过优化而精确定位, 将亲电性适度的基团引入, 因而也列为双功能性分子。亲电基团不温不亢的设计, 对于耐药的靶标提供精准性的打击。HyT、PROTAC和dTAG在结构上有双功能的化学特征, 在机制上则经化学募集, 诱导蛋白-蛋白相互作用, 最终裂解清除错误有害的蛋白靶标。诚然, 一个分子为了同时实现结合两个蛋白的目的, 微观结构的安排势必较大和复杂, 加上连接域的间隔, 分子尺寸加大, 造成宏观性质上不利的药代动力学和生物药剂学, 在一定程度上形成瓶颈。不过, 药物化学不必受Lipinski的类药5规则(RO5)的束缚(甚至应摒弃RO5对创新药物的阻碍)。运用这些技术虽然尚无新药诞生, 但合理的策略和对广泛蛋白靶标的适用性, 已被制药界广泛认可, 一旦成功, 意味着药物分子设计发生颠覆性的革命。
| [1] | Geoij BECG, Lambert JM. New developments for antibody- drug conjugate-based therapeutic approaches[J]. Curr Opin Immunol, 2016, 40: 14–23. DOI:10.1016/j.coi.2016.02.008 |
| [2] | Mullard A. Maturing antibody-drug conjugate pipline hits 30[J]. Nat Rev Drug Discov, 2013, 12: 329–332. DOI:10.1038/nrd4009 |
| [3] | Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates[J]. Chem Soc Rev, 2017, 19: 315–337. |
| [4] | Senter P, Sievers EL. The discovery and development of brentuximabvedotin for use in relapsed Hodgkin lymphoma and systemic anaplastic large cell lymphoma[J]. Nat Biotechnol, 2012, 30: 631–637. DOI:10.1038/nbt.2289 |
| [5] | Teicher BA, Chari RV. Antibody conjugate therapeutics:challenges and potential[J]. Clin Cancer Res, 2011, 17: 6389–6397. DOI:10.1158/1078-0432.CCR-11-1417 |
| [6] | Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2- positive breast cancer with trastuzumab-DM1, an antibody- cytotoxic drug conjugate[J]. Cancer Res, 2008, 68: 9280–9290. DOI:10.1158/0008-5472.CAN-08-1776 |
| [7] | Barl T, Kaptein A. Irreversible protein kinase inhibitors:balancing the benefits and risks[J]. J Med Chem, 2012, 55: 6243–6264. DOI:10.1021/jm3003203 |
| [8] | Finlay MR, Anderton M, Ashton S, et al. Discovery of a potent and selective EGFR inhibitor (AZD9291) of both sensitizing and T790M resistance mutations that spares the wild type form of the receptor[J]. J Med Chem, 2014, 57: 8249–8267. DOI:10.1021/jm500973a |
| [9] | Pan Z, Scheerens H, Li S, et al. Discovery of selective irreversible inhibitors for Bruton's tyrosine kinase[J]. ChemMedChem, 2007, 2: 58–61. DOI:10.1002/(ISSN)1860-7187 |
| [10] | Neklesa TK, Crews CM. Chemical biology:greasy tags for protein removal[J]. Nature, 2012, 487: 308–309. DOI:10.1038/487308a |
| [11] | Neklesa TK, Tae HS, Schneeklith AR, et al. Small-molecule hydrophobic tagging-induced dereadation of Halo Tag fusion proteins[J]. Nat Chem Biol, 2011, 7: 538–543. DOI:10.1038/nchembio.597 |
| [12] | Wu YL, Yang X, Ren Z, et al. Structural basis for an unexpected mode of SERM-mediated ER antagonism[J]. Mol Cell, 2005, 18: 413–424. DOI:10.1016/j.molcel.2005.04.014 |
| [13] | Bradbury RH, Hales NH, Rabow AA, et al. Small-molecule androgen receptor downregulators as an approach to treatment of advanced prostate cancer[J]. Bioorg Med Chem Lett, 2011, 21: 5442–5445. DOI:10.1016/j.bmcl.2011.06.122 |
| [14] | Gustafson JL, Neklesa TK, Cox CS, et al. Small-molecule- mediated degradation of the androgen receptor through hydrophobic tagging[J]. Angew Chem Int Ed, 2015, 54: 9659–9662. DOI:10.1002/anie.v54.33 |
| [15] | You QD, Lu MC, Jiang ZY. Protein degradation as an innovative strategy in drug discovery[J]. Acta Pharm Sin (药学学报), 2017, 52: 1777–1782. |
| [16] | Lu MC, Liu T, Jiang Q, et al. Discovery of a keap1-dependent peptide PROTAC to knockdown Tau by ubiquitination protea some degredation pathyway[J]. Eur J Med Chem, 2018, 146: 251–259. DOI:10.1016/j.ejmech.2018.01.063 |
| [17] | Schneekloth AR, Pucheault M, Tae HS, et al. Targeted intracellular protein degradation induced by a small molecule:En route to chemical proteomics[J]. Bioorg Med Chem Lett, 2008, 18: 5904–5908. DOI:10.1016/j.bmcl.2008.07.114 |
| [18] | Lu J, Qian YM, Altieri M, et al. Hijacking the E3 ubiquitin ligase cereblon to efficiently target BRD4[J]. Chem Biol, 2015, 22: 755–763. DOI:10.1016/j.chembiol.2015.05.009 |
| [19] | Gadd MS, Testa A, Lucas X, et al. Structural basis of PROTAC cooperative recognition for selective protein degra dation[J]. Nat Chem Biol, 2017, 13: 514–521. DOI:10.1038/nchembio.2329 |
| [20] | Nabet B, Roberts JM, Buckley DL, et al. The dTAG system for immediate and target-specific protein degradation[J]. Nat Chem Biol, 2018, 14: 431–441. DOI:10.1038/s41589-018-0021-8 |
 2018, Vol. 53
2018, Vol. 53


