2. 中国科学院系统微生物工程重点实验室, 天津 300308;
3. 中国中医科学院中药资源中心, 北京 100700
2. Key Laboratory of Systems Microbial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
3. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
人参皂苷(ginsenosides)是西洋参(Panax quinquefolius)、人参(Panax ginseng)和三七(Panax notoginseng)等药用植物中的主要活性成分, 在中枢神经系统、心血管系统、内分泌系统及免疫系统方面具有广泛的药理学活性[1-4]。人参皂苷属于三萜类化合物, 由苷元和糖基两部分组成。依据苷元特征, 人参皂苷主要可分达玛型四环三萜和齐墩果烷型五环三萜, 其中主要为原人参二醇和原人参三醇衍生的达玛型, 包括人参皂苷CK、Rh2、Rg3和Rg1等; 及含量较低的齐墩果烷型人参皂苷Ro。
人参皂苷在西洋参和人参中的含量较低, 有限的天然资源及人工种植西洋参和人参存在栽培周期长(超过4年)、连作障碍、农药及重金属残留等问题, 极大的限制了人参皂苷的应用和推广[5]。利用合成生物学原理, 设计和改造微生物生产天然产物被认为是一种最有潜力的替代方法[6]。在人参皂苷的异源合成方面, 虽然取得了不错的进展, 如中国科学院天津工业生物技术研究所和中国中医科学院中药资源中心合作, 在国际上首次创建出原人参二醇生产能力达到每升克级的酿酒酵母细胞工厂[7];随后又构建出能同时合成原人参二醇、原人参三醇和齐墩果酸三种人参基本皂苷元的酿酒酵母细胞[8];另外, Zhou等[9]鉴定出具有合成人参皂苷Rh2、Rg3活性的糖基转移酶UGTPg45、UGTPg29, 并成功构建出能生产2.145 μmol·g-1 DCW Rh2和3.49 μmol·g-1 DCW Rg3的酿酒酵母细胞工厂; Jung等[10]从人参转录组中挖掘出能催化PPD/CK形成Rh2/F2的糖基转移酶PgUGT74AE2及能催化Rh2/F2形成Rg3/Rd的糖基转移酶PgUGT94Q2, 并构建出能生产1.3 mg·L-1 Rg3的酵母细胞工厂; Yang等[11]从枯草芽孢杆菌中克隆到一个能分别催化达玛烯二醇Ⅱ C3位和C20位、原人参二醇和原人参三醇C3位和C12位发生糖基化反应生成非天然的人参皂苷3β-O-Glc-DM、3β, 20S-di-O-Glc- DM、3β, 12β-di-O-Glc-PPD和3β, 12β-di-O-Glc-PPT的酶UGT109A1, 通过抗癌活性分析发现, 3β, 12β-di- O-Glc-PPT的抗肺癌活性高于人参皂苷中抗肺癌活性最高的Rg3, 并最终构建出一株可生产9.05 mg·L-1 3β, 12β-di-O-Glc-PPT的酵母细胞工厂。但是从产业化水平来看, 目前微生物细胞工厂的生产能力还需要显著提高, 因此构建前体供给充足的三萜底盘菌株是构建高产人参皂苷工程菌株的关键。
如图 1, 达玛烯二醇Ⅱ (dammarenediol-Ⅱ)是达玛型人参皂苷生物合成的前体物质, 其基本单元异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)可由MVA途径或2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径分别合成; 然后, IPP和DMAPP依次在法尼基焦磷酸合酶(FPS)和鲨烯合酶(SQS)的催化下形成法尼基焦磷酸(FPP)和三萜基本前体物质鲨烯(SQ); 最后鲨烯可被2, 3-环氧鲨烯合酶(SQE)和达玛烯二醇Ⅱ合酶(DDS)逐步催化形成达玛烯二醇Ⅱ[7]。酿酒酵母是模式安全真核生物, 遗传背景清晰, 是构建人参皂苷细胞工厂的理想菌株。本研究在优化过MVA途径工程菌的基础上, 通过基因模块组合优化的方法获得能显著提高三萜前体的功能模块C30-M; 在进一步工作中, 高酶活的2, 3-环氧鲨烯合酶(AtSQE2)被发现。然后, 通过调控达玛烯二醇Ⅱ合酶基因的表达, 采用反义RNA技术对麦角固醇合成途径中的ERG7基因进行调控, 及发酵工艺优化等策略, 最终构建出产量达到15 g·L-1达玛烯二醇Ⅱ的高效酵母细胞工厂, 为达玛烷型人参皂苷的产业化合成奠定了坚实的基础。

|
Figure 1 Ergosterol and dammarenediol-Ⅱ synthetic pathways in engineered yeast. Abbreviations: HMG-CoA: 3-hydroxy-3- methylglutaryl coenzyme A; IPP: Isopentenyldip-hosphate; DMAPP: Dimethylallyldiphosphate; FPP: Farnesyl diphosphate; FPS: FPP synthase; SQS: Squalene synthase; SQE: Squale-neepoxidase; DDS: Dammarenediol-Ⅱ synthase |
材料 PrimeSTAR HS DNA聚合酶、酵母基因组DNA提取试剂盒、酵母质粒提取试剂盒、质粒小量快速提取试剂盒、DNA清洁试剂盒与DNA回收试剂盒、氨苄青霉素、酵母选择培养基来源见文献[10];羊毛甾醇、鲨烯和麦角固醇标准品购自美国Sigma- Aldrich公司; 羽扇豆醇和达玛烯二醇Ⅱ标准品购自云南西力生物技术股份有限公司; 其他试剂均为分析纯。
培养基 按照文献[12-14]配置LB培养基、SM-Ura筛选培养基、SM-Ura-Trp筛选培养基、SM-Ura-Trp- Leu筛选培养基和高密度发酵培养基。SM-Ura-Trp- Leu-His筛选培养基: 0.8%酵母选择培养基(四缺, Ura-Trp-Leu-His), 2%葡萄糖。上述液体培养基加2%的Agar可配成相应的固体培养基。
质粒、菌株及引物 本次研究所用的质粒、菌株及引物序列信息分别见表 1和表 2, 功能基因来源见表 3。
| Table 1 Plasmids and strains used in this study |
| Table 2 Primers used in this work |
| Table 3 Gene annotations |
NK2-SQ01~NK2-SQ09菌株的构建 在SM-Ura培养基中活化菌株NK2-SQ, 并用醋酸锂法制备感受态细胞。按照表 4的引物搭配方案, 并参照文献[12]的菌株构建方法构建菌株NK2-SQ01~NK2-SQ09。
| Table 4 Modules amplification proposal |
LUP01~LUP05菌株的构建 在SM-URA-TRP培养基中活化菌株NK2-SQ09, 并用醋酸锂法制备感受态细胞。按照表 5的引物搭配方案, 并参照文献[12]的菌株构建方法构建菌株LUP01~LUP05。
| Table 5 Modules amplification proposal |
WD-2091菌株的构建 在SM-Ura培养基中活化菌株NK2-SQ, 并用醋酸锂法制备感受态细胞。按照表 6的引物搭配方案, 并参照文献[12]的菌株构建方法构建菌株WD-2091。
| Table 6 Modules amplification proposal |
313-DD和425-DD菌株的构建 在SM-Ura-Trp培养基中活化菌株WD-2091, 并用醋酸锂法制备感受态细胞。参照文献[13]的菌株构建方法构建菌株313-DD和425-DD。
DD01~DD04菌株的构建 在SM-Ura-Trp-Leu培养基中活化菌株425-DD, 并用醋酸锂法制备感受态细胞。按照表 7的引物搭配方案, 并参照文献[12]的菌株构建方法构建菌株DD01~DD04。
| Table 7 Modules amplification proposal |
菌株摇瓶发酵方法及产物提取方法 挑取平板上的单克隆于相应液体培养基中, 30 ℃、250 r·min-1过夜制备种子液。将种子液接种至含15 mL相应液体培养基的100 mL的三角瓶中, 30 ℃、250 r·min-1振荡培养6天后, 进行产物的提取。产物提取的方法如下:取2 mL的发酵液于破碎管中, 13 000 r·min-1离心3 min, 去培养基, 无菌水清洗后, 加入适量玻璃珠(直径为0.5 mm)和0.5 mL萃取剂(丙酮-甲醇= 1:1), 震荡破碎5 min, 超声破碎30 min, 1.3×103 r·min-1离心3 min, 取上清。重复处理第3次, 合并上清。上清过0.22 μL有机尼龙滤膜后备用。
高密度发酵方法 挑取平板上的单克隆至装有SD-Ura-His-Leu-Trp培养基的试管, 30 ℃、250 r·min-1振荡培养过夜; 吸取500 μL菌液至装有50 mL SD- Ura-His-Leu-Trp培养基的250 mL三角瓶中, 30 ℃、250 r·min-1振荡培养24 h; 分别吸取2 mL菌液至3个装有100 mL种子培养基的1 L三角瓶中, 30 ℃、250 r·min-1振荡培养48 h; 最后经火焰接种环, 将种子液加入含3 L发酵培养基的7 L发酵罐中。发酵过程中参数设定值分别为:温度30 ℃, pH 5.0, 溶氧30%, 通气流量3~20 L·min-1, 搅拌转速300~1 000 r·min-1, 溶氧与搅拌转速、通气级联。补料策略为:溶氧值大于60%时, 向发酵罐中加入补料培养基至发酵液中乙醇浓度为10 g·L-1。每12 h检测A600、羊毛甾醇、鲨烯、麦角固醇和达玛烯二醇Ⅱ的含量。
羊毛甾醇、鲨烯、麦角固醇、羽扇豆醇的检测方法 GC-MS测定:进样口温度300 ℃, 进样体积1 μL, 不分流, 溶剂延时12 min; 色谱柱: HP-5ms (30 m × 0.25 mm × 0.5 μm); 色谱条件: 80 ℃, 1 min; 20 ℃·min-1到300 ℃保温18 min; MS条件: SIM: 69、109、135、363和411;羊毛甾醇、鲨烯、麦角固醇和羽扇豆醇标准品用于定性和定量分析。
达玛烯二醇Ⅱ的检测方法 HPLC测定: DAD检测器, Waters Symmetry® C18色谱柱(250 mm × 4.6 mm, 5 μm), 流动相A为乙腈, 流动相B为水, 等梯度洗脱, A:B为90:10, 流速1.0 mL·min-1, 检测时间20 min, 柱温30 ℃, 检测波长203 nm; 达玛烯二醇Ⅱ的标准品用于定性和定量分析。
结果 1 高效三萜功能模块C30-M的构建鲨烯是三萜生物合成途径的通用前体, 课题组前期研究发现过表达FPS和SQS可以增加三萜化合物及固醇的产量[7]。本研究中, 为了进一步提高三萜底盘菌中三萜前体的合成通量, 通过基因模块组合优化的方法, 将不同植物中来源的FPS和SQS分别进行模块化组装后整合到经过MVA途径优化的NK2-SQ菌株中, 转化子经过缺陷培养基筛选后, 分别用相应的引物进行PCR验证和测序, 测序正确的菌株命名为NK2-SQ01~NK2-SQ09。
由发酵结果(图 2)可以看出, 组合表达FPS和SQS后, 工程菌株鲨烯的产量均有不同程度的增加; 在三种不同来源的的FPS中, 丹参来源的SmFPS 效果最佳; 在三种不同来源的SQS中, 拟南芥来源的AtSQS2效果最佳; SmFPS和AtSQS2二者的组合可使工程菌株鲨烯的含量进一步提高72.8%, 达到67.4 mg·g-1。
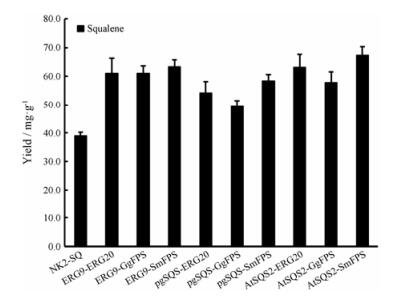
|
Figure 2 Squalene yield by engineered yeast. From left to right: NK2-SQ, NK2-SQ01-NK2-SQ09 |
2, 3-环氧鲨烯合酶(squaleneepoxidase, SQE)可催化鲨烯形成2, 3-环氧鲨烯, 该酶(ERG1基因编码)被认为是麦角固醇生物合成途径限速酶之一, 过表达该酶可以增加固醇及三萜化合物的产量[7, 15]。为进一步筛选到高活性的SQE, 首先将来源于拟南芥的AtSQE1、AtSQE2、AtSQE3和酿酒酵母来源的ERG1等4个2, 3-环氧鲨烯合酶基因与羽扇豆醇合成酶基因LUS整合至工程菌株NK2-SQ09的染色体上, 获得工程菌株LUP02~LUP05, 单独整合LUS的表达盒工程菌为对照菌株LUP01。在此基础上分析工程菌中2, 3-环氧鲨烯的前体鲨烯与产物羽扇豆醇和羊毛甾醇产量变化获得目标基因。
发酵6天后的样品检测结果显示, 与对照菌LUP01相比, 过表达ERG1和AtSQE3的LUP02和LUP05菌株, 并不能增加羽扇豆醇的产量, 该结果可能是ERG1和AtSQE3酶活较低且麦角固醇生物合成途径受到严格控制造成的[16];但过表达AtSQE1 和AtSQE2的LUP03和LUP04菌株羽扇豆醇的含量分别提高了232%和217% (图 3)。然后, 对其他关键代谢物的产量进行测定后发现, LUP04菌株羊毛甾醇的含量是LUP03菌株5.97倍, 达到47.9 mg·g-1, 且LUP04鲨烯的产量较出发菌株NK2-SQ09降低最多, 达到43%。综上所述, 最终获得能显著提高2, 3-环氧鲨烯合成通量的2, 3-环氧鲨烯合酶AtSQE2。

|
Figure 3 Lupeol, lanosterol and squalene yield by engineered yeast. From left to right: NK2-SQ09, LUP01-LUP05 |
在完成甲羟戊酸途径(MVA途径)优化的工程菌基础上, 通过基因模块组合优化的方法将三萜合成通量的关键基因AtSQE2、SmFPS和AtSQS2分别与强启动子TDH3、TEF1和PGK1及相应的终止子连接后, 共同整合至NK2-SQ菌株的HIS3位点, 构建出三萜底盘细胞WD-2091。然后, 使用不同拷贝数质粒对达玛烯二醇Ⅱ合酶基因的表达做了进一步调控:将密码子优化过的人参来源达玛烯二醇Ⅱ合酶基因SpgDDS与强启动子TEF1及终止子CYC1t相连后, 分别连入高拷贝质粒pRS425及低拷贝pRS313中, 构建出质粒pRS425-DDS及pRS313-DDS; 最后将pRS425-DDS及pRS313-DDS分别转入三萜底盘细胞WD-2091中, 构建出工程菌313-DD和425-DD。
发酵6天后发现:工程菌313-DD和425-DD (图 4)均能生产较高产量的达玛烯二醇Ⅱ, 其中转入高拷贝质粒的425-DD工程菌达玛烯二醇Ⅱ的含量是转入低拷贝质粒工程菌313-DD的1.3倍, 达到88.2 mg·g-1, 二者较WD-2091工程菌鲨烯的含量分别下降了83.3%和81.9%, 羊毛甾醇的含量下降了74.6%和88.6%;另外, 与NK2-SQ09相比, WD-2091菌株中三萜前体鲨烯的含量降低了16.4%, 但羊毛甾醇的产量提高了15.1倍, 进一步说明2, 3-环氧鲨烯的供给在底盘菌中已显著提高(图 5)。

|
Figure 4 Product determination by HPLC |

|
Figure 5 Damarenediol-Ⅱ, lanosterol and squalene yield by engineered yeast |
在酿酒酵母中, ERG7基因编码的羊毛甾醇合酶和达玛烯二醇Ⅱ合酶竞争使用同一底物, 在本研究中, 拟通过反义RNA技术下调ERG7的表达来提高人工酵母细胞中非羊毛甾醇型三萜化合物的积累, 进一步促进工程菌达玛烯二醇Ⅱ的合成。
基于反义RNA的原理[17], 本研究分别选取了ERG7基因的启动子、终止子、基因内部及完整ORF的4个核酸区域设计反义片段(图 6), 构建相应的工程菌DD01~DD04。发酵结果显示:当对ERG7上游500 bp和阅读框架外500 bp进行干扰后, 达玛烯二醇Ⅱ的产量下降, 而羊毛甾醇及鲨烯的产量增加; 当对ERG7整个开放阅读框架进行干扰时, 达玛烯二醇Ⅱ、羊毛甾醇及鲨烯的产量没有明显变化; 当对ERG7下游500 bp和阅读框架外500 bp或ERG7内部820 bp到1 171 bp进行干扰后, 羊毛甾醇及鲨烯的合成量减少, 达玛烯二醇Ⅱ分别提高15.8%和16.2%, 达到102.1 mg·g-1和102.5 mg·g-1 (图 7)。

|
Figure 6 Anti-sense RNAs for ERG7 knock-down |
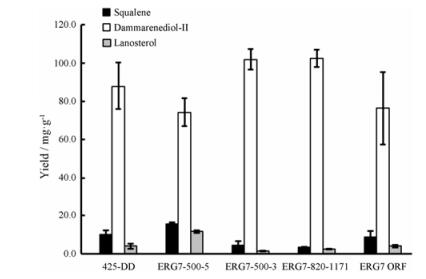
|
Figure 7 Damarenediol-Ⅱ, lanosterol and squalene yield by engineered yeast. From left to right: 425-DD, DD01-DD04 |
在酿酒酵母中, 乙酰辅酶A是MVA途径的底物, 它的供给决定了整个萜类及麦角固醇的代谢通量。当葡萄糖作为碳源时, 由葡萄糖至乙酰辅酶A需要13步反应, 且乙酰辅酶A是副产物; 而当乙醇作为碳源时, 由乙醇至乙酰辅酶A只需要三步反应, 且基本上胞内所有碳代谢都源于乙酰辅酶A, 因而, 直接以乙醇作为碳源补料可以缩短发酵时间并提升萜类化合物的产量[15]。本研究在生物反应器中利用DD03菌株进行了发酵工艺的优化。
发酵结果显示, 随着发酵时间的增加, 生物量、达玛烯二醇Ⅱ的含量及产量持续增加, 发酵120 h时, A600和达玛烯二醇Ⅱ的含量及产量分别达到526、67 mg·g-1和15 g·L-1; 与之相比, 麦角固醇、羊毛甾醇和鲨烯的含量一直处于较低水平: 60 h后, 三者的含量均在5 mg·g-1以下; 120 h时, 三者的含量分别为3.3、4.3和1.6 mg·g-1, 分别占达玛烯二醇Ⅱ含量的4.9%、6.4%和2.5% (图 8和图 9)。该结果表明, 整个萜类合成方向代谢流大部分用于达玛烯二醇Ⅱ化合物的合成。

|
Figure 8 Titer of damarenediol-Ⅱ and A600 during high cell density fermentation of DD03 |
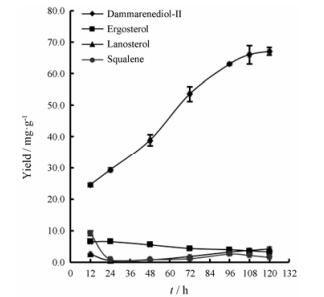
|
Figure 9 Yield of damarenediol-Ⅱ, ergosterol, lanosterol and squalene during high cell density fermentation of DD03 |
利用合成生物学技术创建具有商业化潜力的细胞工厂是本领域的难点。虽然目前天然药物的生物合成途径解析及初级细胞工厂的创建已在国际上取得了重要进展, 如O’Connor和Sattely研究组近期分别获得了抗癌药物长春花碱和依托泊苷元的完整生物合成途径; Smolke研究组通过基因挖掘、途径优化和酶工程等手段, 实现了生产蒂巴茵和氢可酮等阿片类生物碱化合物的微克每升级的初级酵母工程菌构建等[18-20], 但具有市场竞争力的天然药物微生物细胞工厂只有包括青蒿酸和β-榄香烯等少数品种成功[6, 21]。
本研究以达玛烷型人参皂苷的关键前体达玛烯二醇Ⅱ为研究案例, 通过途径的模块化及组合优化、基因元件筛选、密码子优化、反义RNA技术、发酵工艺等技术策略综合应用, 首次将三萜合成通量提高到10 g·L-1级别, 构建出产量达到15 g·L-1达玛烯二醇Ⅱ的高效酵母细胞工厂, 为达玛烷型等三萜皂苷的产业化合成奠定了坚实的基础。
| [1] | Christensen LP. Chapter 1 Ginsenosides:chemistry, biosyn-thesis, analysis, and potential health effects[J]. Adv Food Nutr Res, 2009, 55: 1–99. |
| [2] | Qi LW, Wang CZ, Yuan CS. Ginsenosides from American ginseng:chemical and pharmacological diversity[J]. Phyto-chemistry, 2011, 72: 689–699. |
| [3] | Radad K, Moldzio R, Rausch WD. Ginsenosides and their CNS targets[J]. CNS Neurosci Ther, 2011, 17: 761. DOI:10.1111/j.1755-5949.2010.00208.x |
| [4] | Zhou W, Zhou P. Advances in the study of ginsenoside compound K[J]. Acta Pharm Sin (药学学报), 2007, 42: 917–923. |
| [5] | Yang JL, Gao LL, Zhu P. Advances in the biosynthesis research of ginsenosides[J]. Acta Pharm Sin (药学学报), 2013, 48: 170–178. |
| [6] | Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi- synthetic production of the potent antimalarial artemisinin[J]. Nature, 2013, 496: 528–532. DOI:10.1038/nature12051 |
| [7] | Dai ZB, Liu Y, Zhang XN, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides[J]. Metab Eng, 2013, 20: 146–156. DOI:10.1016/j.ymben.2013.10.004 |
| [8] | Dai ZB, Wang BB, Liu Y, et al. Producing aglycons of ginsenosides in bakers' yeast[J]. Sci Rep-UK, 2014, 4: 3698–3698. |
| [9] | Wang PP, Wei YJ, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts[J]. Metab Eng, 2015, 29: 97–105. DOI:10.1016/j.ymben.2015.03.003 |
| [10] | Jung SC, Kim W, Park SC, et al. Two ginseng UDP- glycosyltransferases synthesize ginsenoside Rg3 and Rd[J]. Plant Cell Physiol, 2014, 55: 2177–2188. DOI:10.1093/pcp/pcu147 |
| [11] | Liang HC, Hu ZF, Zhang TT, et al. Production of a bioactive unnatural ginsenoside by metabolically engineered yeasts based on a new UDP-glycosyltransferase from Bacillus subtilis[J]. Metab Eng, 2017, 44: 60–69. DOI:10.1016/j.ymben.2017.07.008 |
| [12] | Lin TT, Wang D, Dai ZB, et al. Construction of cell factories for production of lupeol in Saccharomyces cerevisiae[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 1008–1015. |
| [13] | Li SL, Wang D, Liu Y, et al. Study of heterologous efficient synthesis of cucurbitadienol[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 3326–3331. |
| [14] | Lenihan JR, Tsuruta H, Diola D, et al. Developing an industrial artemisinic acid fermentation process to support the cost- effective production of antimalarial artemisinin-based combi-nation therapies[J]. Biotechnol Prog, 2008, 24: 1026–1032. DOI:10.1002/btpr.v24:5 |
| [15] | Sun Y, Zhao HW, Ge F. The construction of over-expression vector for Panax notoginseng SS gene and its transformation[J]. Acta Pharm Sin (药学学报), 2013, 48: 138–143. |
| [16] | Lorenz RT, Parks LW. Regulation of ergosterol biosynthesis and sterol uptake in a sterol-auxotrophic yeast[J]. J Bacteriol, 1987, 169: 3707–3711. DOI:10.1128/jb.169.8.3707-3711.1987 |
| [17] | Eguchi Y, Itoh T, Tomizawa JI. Antisense RNA[J]. Annu Rev Biochem, 1991, 60: 631. DOI:10.1146/annurev.bi.60.070191.003215 |
| [18] | Galanie S, Thodey K, Trenchard IJ, et al. Complete biosynthesis of opioids in yeast[J]. Science, 2015, 349: 1095–1100. DOI:10.1126/science.aac9373 |
| [19] | Caputi L, Franke J, Farrow SC, et al. Missing enzymes in the biosynthesis of the anticancer drug vinblastine in Madagascar periwinkle[J]. Science, 2018, 360: 1235–1239. DOI:10.1126/science.aat4100 |
| [20] | Lau W, Sattely ES. Six enzymes from mayapple that complete the biosynthetic pathway to the etoposide aglycone[J]. Science, 2015, 349: 1224–1228. DOI:10.1126/science.aac7202 |
| [21] | Zhang XL, Huang LQ, Dai ZB et al. A recombinant microorganism and its application: PCT/CN2017/109029[P]. 2017-11-02. |
 2018, Vol. 53
2018, Vol. 53


