2. 中国中医科学院中药资源中心, 北京 100700
2. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
雷公藤(Tripterygium wilfordii Hook. f.)是传统中药雷公藤的植物来源, 具有清热解毒、祛风除湿、杀虫止痒、消肿散结等功效[1, 2]。现代研究表明雷公藤可用于风湿性关节炎、肾小球肾炎、肾病综合征等病的治疗[3]。雷公藤中含有多种活性化学成分, 其中二萜类化合物雷公藤甲素(triptolide)和三萜类化合物雷公藤红素(celastrol)是雷公藤中活性最强的有效成分[4, 5]。雷公藤甲素可抑制多种肿瘤的增殖[6], 从机制上来说, 雷公藤甲素直接与转录因子2 (TFIIH)的亚基结合, 抑制RNA聚合酶Ⅱ介导的转录和可能的核苷酸切除修复[7]。雷公藤红素已被证实为HSP90的新型抑制剂, 通过诱导HSP90的下游蛋白降解发挥作用[8, 9]。此外, 研究表明, 雷公藤红素作为一种瘦素致敏剂, 将成为一种很有前景的肥胖治疗药[10]。
萜类化合物在高等植物中的合成途径主要有两种, 一是位于细胞质中的甲羟戊酸(MVA)途径, 主要生成倍半萜和三萜类化合物; 二是发生于质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径, 主要生成单萜、二萜和四萜类化合物[11]。以上两条途径在亚细胞空间上是隔离的, 但均生成萜类化合物的共同前体IPP[12, 13]。HMGR存在于细胞质中的MVA途径中, 催化3-羟基-3-甲基戊二酰辅酶A (HMG-CoA)生成甲羟戊酸(MVA), 是细胞质中的萜类代谢途径中的重要调控位点, 也是MVA途径中的第一个限速酶[14, 15]。研究发现加入HMGR酶的竞争抑制剂-洛伐他丁(MEV)后会导致人参不定根中的人参皂苷明显降低[16]。缺失HMGR1基因会导致拟南芥植株矮小、早衰、雄性不育, 且甾醇含量比野生型植株明显降低[17]。因此, HMGR在MVA途径中的作用极为重要。
基因过表达是将某个基因大量表达的过程, 其基本原理是通过人工构建载体的方式在目的基因上游加入调控元件, 使基因可以在人为控制的条件下实现大量转录和翻译, 从而实现基因产物的过表达。过表达技术是用来研究基因功能, 提升代谢产物产量的一种极为有效的研究手段[18]。基因枪技术, 又被称为生物弹道技术(biolistic technology)或微粒轰击技术(particle bombardment technology), 其基本原理就是采用一种微粒加速装置, 使裹着外源基因的微米级的金或钨颗粒获得足够的动能打入靶细胞或组织, 是向植物细胞中快速稳定转入外源基因的一种方法。
雷公藤植物生长周期长, 且植物中次生代谢物含量低, 利用传统化学提取方法获得活性成分面临成本高、产量低的问题[19]。通过提高关键酶的基因表达, 有效地调控萜类产物的生物合成, 进而从整体上提高萜类化合物的前体以及目标萜类产物的总量是分子生药学常用的研究策略。本研究利用Gateway技术构建HMGR的过表达载体, 再使用基因枪将包裹着过表达载体的金属粒打入雷公藤悬浮细胞, 希望通过研究过表达TwHMGR基因后雷公藤甲素和雷公藤红素积累量的变化, 来探讨TwHMGR在雷公藤萜类化合物生物合成途径上的作用, 为以后从整体上提高目标萜类化合物的产量提供科学依据。
材料与方法植物材料 雷公藤悬浮细胞为本实验室在0.5 mg·L-1 2, 4-D + 0.1 mg·L-1 KT的MS液体培养基中, 25 ℃、120 r·min-1暗培养所得。
菌株和质粒 E. coli Trans5α感受态细胞购自北京全式金生物技术有限公司、TwHMGR模板质粒(由课题组前期实验克隆得到, 经北京睿博兴科有限公司测序验证)。
试剂 Murashige & Skoog基本培养基购自美国PhytoTechnology Laboratories公司、植物生长激素和抗生素购自北京鼎国昌盛生物技术有限责任公司、pENTER/D-TOPO CLONING KIT购自美国Invitrogen公司、Gateway® LR Clonase® Ⅱ Enzyme Mix购自美国Invitrogen公司、Gel Extraction Kit购自美国OMEGA公司、Plasmid Mini Kit Ⅰ购自美国OMEGA公司、Plasmid Maxi Kit购自美国OMEGA公司、植物总RNA提取试剂盒购自上海普洛麦格生物产品有限公司、Fast Quant cDNA第一链合成试剂盒购自天根生化科技(北京)有限公司、KAPA SYBR® FAST Universal 2×qPCR Master Mix购自美国KAPA biosystems公司、Trans2K Plus DNA Marker和Trans2K DNA Marker购自北京全式金公司、Phusion®超保真DNA聚合酶购自美国NEB公司、EasyTaq® DNA聚合酶购自北京全式金公司、亚精胺盐酸盐购自美国Sigma公司。
使用NCBI (http://www.ncbi.nlm.nih.gov/)分析了TwHMGR的核苷酸序列, 利用NCBI ORF Finder确定TwHMGR的开放阅读框, 用BLAST程序在NCBI数据库中进行同源性检索, 用DNAMAN 8.0软件对序列进行多重序列比对, 并在MEGA 7.0中通过Clustal W比对, 采用neighbor- joining方法构建系统进化树[20]。
BP反应构建入门载体 根据已知的TwHMGR- ORF, 使用Premier 5.0设计相应引物, 并在正向引物前加CACC的粘性末端, HMGR-F: CACCATGGAGG CCCGCCGGAG, HMGR-R: CTAAGAAGAACCAGC AGCAGAAATATTG。PCR反应体系为: 25 μL 2× Phusion HF, 2.5 μL 10 mmol·L-1 HMGR-R, 2.5 μL 10 mmol·L-1 HMGR-F, 1 μL HMGR模板质粒, 19 μL ddH2O, 总体系为50 μL。反应程序: 98 ℃ 30 s; 98 ℃10 s, 56 ℃ 15 s, 72 ℃ 1 min共35个循环; 最后72 ℃ 5 min。PCR产物切胶回收后, 按照pENTR/D-TOPO®载体说明书操作, 用于构建入门载体, 转化E. coli Trans5α感受态细胞, 取阳性克隆进行测序, 测序成功后, 使用美国OMEGA公司的Plasmid Mini Kit Ⅰ试剂盒, 按照说明书提取TwHMGR过表达的入门载体质粒。
LR反应构建表达载体 入门载体质粒用于构建表达载体, PCR反应体系为: OE-HMGR质粒300 ng, pH7WG2D载体300 ng, 1 μL LR酶, 0.6 μL TE Buffer (PH 8.0)。反应程序: 25 ℃, 4 h。PCR产物转化E. coli Trans5α感受态细胞, 取阳性克隆进行测序, 测序成功后, 使用美国OMEGA公司的Plasmid Maxi Kit Ⅰ试剂盒, 按照说明书提取TwHMGR过表达的表达载体质粒, 命名为OE-HMGR质粒。
目的基因转化雷公藤悬浮细胞 本实验使用基因枪瞬时转化法将含有目的片段的质粒打入雷公藤悬浮细胞, 过程如下:将MS固体培养基(含0.8%琼脂)分装于直径为35 mm的小型培养皿中, 取实验室继代培养3代以上的雷公藤悬浮细胞继代于固体培养基中, 每皿继代0.2 g细胞, 25 ℃暗培养7天。以OE-HMGR质粒为例, 包埋体系如下: 5 000 μg金粉、100 μL 2.5 mol·L-1 CaCl2、40 μL亚精胺稀释液(6 μL原液稀释到40 μL)、20 μg过表达质粒。按上述体系加入各试剂, 涡旋震荡2~3 min, 静置后离心, 弃上清。分别用70%乙醇和100%乙醇清洗两次后, 向离心管中加入100 μL 100%乙醇, 轻弹管壁数次后, 在低速的混合器上充分震荡2~3 s, 置于冰中保存待用。按相同方法进行pH7WG2D空载质粒的包埋。氦气瓶气压1 300 psi, 使用1 100 psi可裂膜, 轰击距离3 cm, 按照Biorad公司PDS-1000/He型基因枪说明书进行操作, 每盘细胞打两枪, 每组做5个生物学重复。转化完成的雷公藤悬浮细胞于25 ℃暗培养7天, 待检测。
表达载体成功转化悬浮细胞验证 细胞培养7天后, 每盘称取约50 mg表面浮有金粉的雷公藤悬浮细胞, 使用植物总RNA提取试剂盒, 按照说明书进行雷公藤悬浮细胞的总RNA提取。使用Fast Quant cDNA第一链合成试剂盒, 按说明书将总RNA反转为cDNA。由于pH7WG2D载体中, 包含hygromycin (Hyg)片段。因此, 以反转得到的cDNA为模板, 用Hyg特异引物Hyg-F: ATCAGCTTGCATGCCGGTC, Hyg-R: ATCATACATGAGAATTAAGGGAGTCAC进行PCR扩增, PCR反应体系为: 25 μL 2×Phusion HF、2.5 μL 10 mmol·L-1 Hyg-R、2.5 μL 10 mmol·L-1 Hyg-F、1 μL模板cDNA、19 μL ddH2O, 总体系50 μL。反应程序: 98 ℃ 30 s; 98 ℃ 10 s, 56 ℃ 15 s, 72 ℃ 1 min共35个循环; 最后72 ℃后延伸5 min。
qRT-PCR检测TwHMGR相对表达量 以逆转录获得的cDNA作为qRT-PCR的模板, 使用Premier 5.0设计相应引物, Q-HMGR-F: GGTTTCTTTGGCG TTGACTT, Q-HMGR-R: GACGACCTTGGGCTTGA; 以β-actin基因作为内参, β-actin-F: AGGAACCACC GATCCAGACA, β-actin-R: GGTGCCCTGAGGTCCT GTT。使用KAPA SYBR® FAST qPCR Master Mix Kit进行qRT-PCR反应, 反应体系: 10.0 μL 2×Fast qPCR Master Mix、0.4 μL 10 μmol·L-1正向引物、0.4 μL 10 μmol·L-1反向引物、1.0 μL cDNA、8.2 μL PCR-grade water, 总体积20.0 μL, 反应程序: 95 ℃ 3 min; 95 ℃ 3 s, 60 ℃ 30 s重复45个循环。使用LightCycler® 480Ⅱ实时荧光定量PCR系统分析TwHMGR的基因相对表达量。设置3个技术重复, 用2-ΔΔCt方法计算基因的相对表达量[21]。同时使用空载组cDNA和过表达组cDNA分别为模板进行TwHMGR特异扩增, 直观反映基因相对表达量的变化。
雷公藤悬浮细胞中雷公藤甲素和雷公藤红素的含量测定 每盘细胞称取约100 mg表面浮有金粉的雷公藤悬浮细胞, 用液氮球磨机粉碎后使用FDU- 1110/FDU-2100冷冻干燥机进行冷冻干燥。冷冻干燥后的样品精密称重20 mg, 加入80%甲醇1 mL, 4 ℃过夜, 以40 kHz、100%功率、25 ℃超声30 min后, 12 000×g离心10 min后取上清液过0.22 μm PTFE滤膜, 使用安捷伦1290型UPLC检测悬浮细胞中雷公藤甲素和雷公藤红素的含量。色谱条件: C18色谱柱(2.1 mm × 100 mm, 1.7 μm), 流动相A为纯乙腈, 流动相B为含0.1%甲酸水。梯度洗脱条件: 0 min 70% A, 5 min 65% A, 8 min 65% A, 15 min 30% A, 21 min 10% A。洗脱速度: 0.4 mL·min-1, 进样量: 5 μL, 柱温: 40 ℃。雷公藤甲素的检测波长为219.4 nm, 雷公藤红素的检测波长为426.0 nm。以80%甲醇为溶剂, 配制雷公藤甲素和雷公藤红素的标准曲线, 浓度梯度设置为1、2.5、3.5、10、25 μg·L-1。
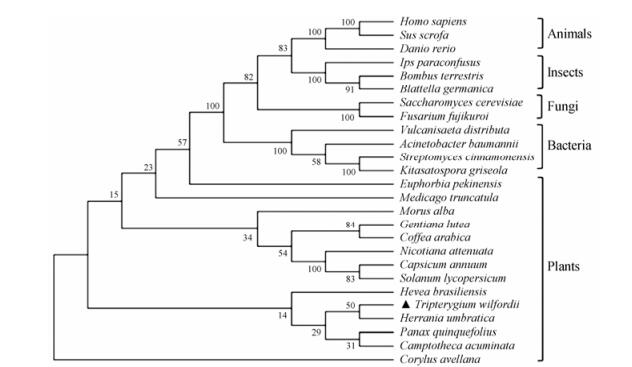
结果与分析 1 TwHMGR系统进化分析为了进一步探索TwHMGR与不同生物(包括植物、动物、昆虫、真菌和细菌)之间的进化关系, 基于不同的HMRG氨基酸序列构建了系统进化树。在进化过程中, 所有的HMGR都有共同的起源, TwHMGR和其他高等植物的HMGR酶构成了一簇, 如图 1。
|
Figure 1 Phylogenetic analysis tree of HMGRs from plants, animals, insects, fungi and bacteria. ALU11310.1: Tripterygium wilfordii, AAO85554.1: Nicotiana attenuate, Q9XEL8.1: Capsicum annuum, ABK56831.1: Euphorbia pekinensis, CAA38467.1: Hevea brasiliensis, ACV65036.1: Panax quinquefolius, AAB69727.1: Camptotheca acuminata, BAE92730.1: Gentiana lutea, ADR51242.1: Coffea arabica, ADX05300.1: Acinetobacter baumannii, ADN51044.1: Vulcanisaeta distributa, ADQ43: 377.1: Streptomyces cinnamonensis, BAB07821.1: Kitasatospora griseola, ABY20976.1: Medicago truncatula, AAD03789.1: Morus alba, ABP04052.1: Corylus avellana, XP_021282837.1: Herrania umbratica, AAB62581.1: Solanum lycopersicum, NP_000850.1: Homo sapiens, NP_001073446.2: Danio rerio, NP_001116460.1: Sus scrofa, NP_001295235.1: Bombus terrestris, AAD20975.2: Ips paraconfusus, P54960.1: Blattella germanica, AAB67527.1: Saccharomyces cerevisiae, S0DQM8.1: Fusarium fujikuroi |
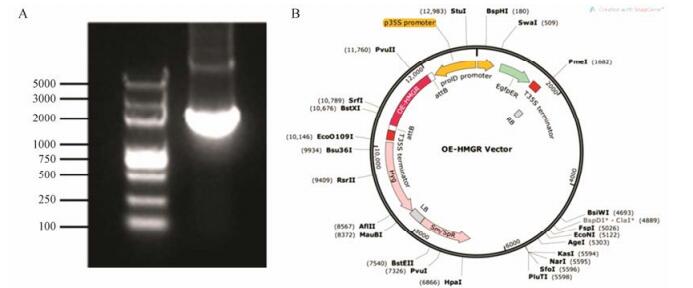
TwHMGR特异性引物扩增得到1 740 bp的OE- HMGR片段, 电泳结果如图 2A所示; 所构建的过表达载体示意图如2B所示。
|
Figure 2 Overexpression fragment and vector. A: TwHMGR overexpression fragment of 1 740 bp; B: Overexpression vector include OE-HMGR and Hyg fragment |
TwHMGR的开放阅读框起始密码子为ATG, 终止密码子为TAG, 长1 740 bp, 共编码579 AA。TwHMGR氨基酸序列与其他植物HMGR氨基酸序列进行比对后, 发现其均具有HMG-CoA结合基序(EMPVGYVQIP和TTEGCLVA)和两个NADP (H)结合基序(DAMGMNM和GTVGGG)[22], 如图 3。

|
Figure 3 Multiple alignment of the deduced amino acid sequence of HMGRs from plants. The conserved residues are shown in dark blue and homologous residues in pink, yellow boxes show the HMG-CoA-binding motifs and NADP (H)-binding motifs; ALU11310.1: Tripterygium wilfordii, AAO85554.1: Nicotiana attenuata, Q01559.1: Nicotiana sylvestris, Q9XEL8.1: Capsicum annuum, AAB62581.1: Solanum lycopersicum, ABK56831.1: Euphorbia pekinensis, CAA38467.1: Hevea brasiliensis, ACV65036.1 3: Panax quinquefolius |
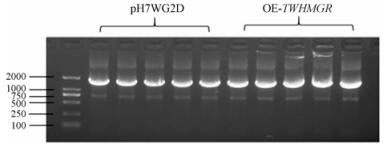
空载组和过表达组的cDNA均可以扩增得到1 787 bp的Hyg片段, 琼脂糖凝胶电泳结果如图 4所示, 说明载体成功转入雷公藤悬浮细胞。
|
Figure 4 Verification of successful transformation of expression vector. Hyg fragments of 1 787 bp |
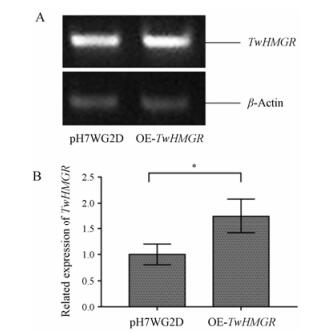
分别以空载组和过表达组的cDNA为模板, TwHMGR特异引物扩增产物进行琼脂糖凝胶电泳检测, 如图 5A所示, 以过表达组cDNA为模板扩增的目的基因条带较空载组亮, 而内参基因亮度差异不大。qRT-PCR结果分析显示, 在过表达组中, TwHMGR的表达量是空载组的1.75倍, 如图 5B所示。
|
Figure 5 Gene expression analysis of TwHMGR. A: Gel electrophoresis of gene expression; B: qRT-PCR of gene relative expression. Single asterisks "*" indicates P < 0.05, n = 5 |
UPLC检测样品和对照品中的雷公藤甲素和雷公藤红素如图 6所示, 在219.4 nm检测波长下, 峰1为雷公藤甲素, 在426.0 nm检测波长下, 峰2为雷公藤红素。

|
Figure 6 UPLC chromatograms of triptolide and celastrol standards and samples. Peak 1: Triptolide; Peak 2: Celastrol |
相比于空载组, 过表达HMGR后, 雷公藤悬浮细胞中雷公藤甲素和雷公藤红素的含量都明显上升, 结果如图 7所示。雷公藤甲素在空载组中含量为(98.56 ± 8.98) μg·g-1, 在过表达组为(161.56 ± 1.57) μg·g-1; 雷公藤红素在空载组中含量为(124.07 ± 7.23) μg·g-1, 在过表达组为(235.77 ± 9.86) μg·g-1。

|
Figure 7 Contents of triptolide and celastrol in Tripterygium wilfordii. The data represent the average ± standard. Double asterisks "**" indicate P < 0.01, n = 5 |
HMGR是植物甲羟戊酸代谢途径上游的一个关键限速酶, 对控制代谢途径中碳源流向起到非常重要的作用, 该酶基因表达上调会明显促进植物类异戊二烯物质含量的增加[23]。Schaller等[24]研究发现, 橡胶树HMGR1基因可使转基因烟草中总甾醇含量提高6倍, 中间代谢产物也在组织中有所累积; Wang等[25]研究发现, HMGR转基因青蒿中的基因最高表达量是野生型的2.8倍, 青蒿素含量也有明显提高。本实验成功构建了TwHMGR的过表达载体, 并通过基因枪将其转入雷公藤悬浮细胞中。实时荧光定量PCR的结果如预想的一样, 过表达组TwHMGR基因相对表达量相比于空载组升高了0.75倍。雷公藤甲素和雷公藤红素的含量较空载组分别上升了0.64和0.90倍。实验结果表明, 过表达TwHMGR对雷公藤甲素和雷公藤红素的生物合成有着明显的正向调控作用。
本实验中, 过表达TwHMGR后雷公藤甲素(二萜, 由MEP途径合成)和雷公藤红素(三萜, 由MVA途径合成)的含量均显著上升, 证实雷公藤萜类物质生物合成的两条途径并不是相互独立的, 而是互相联系的。过表达MVA途径限速酶HMGR, 使MVA和MEP途径的产物产量均有所上调, 但MVA途径产物雷公藤红素上调量更高。
基因枪法转化雷公藤悬浮细胞, 相比于传统的农杆菌转化法大大缩短了实验周期, 是一种十分高效的基因转化方法, 可用于基因体内功能的快速验证。Zhang等[26]发现过表达TwDXR对合成途径上游某些基因的表达量具有负反馈调节作用, 而本实验只单独考察了TwHMGR的基因相对表达量变化, 下一步将对基因彼此间的调控作用再做研究。
| [1] | Gao W, Liu MT, Cheng QQ, et al. Herbal textual research on Tripterygium Wilfordii[J]. World Chin Med (世界中医药), 2012, 7: 560–562. |
| [2] | Guan HY, Su P, Zhao YJ, et al. Cloning and protein expres sion of sterol-C-24-methyl transferase 2 in Tripterygium wilfordii[J]. Acta Pharm Sin (药学学报), 2016, 51: 1799–1805. |
| [3] | Liu XM, Liu ZH, Zhang J, et al. Study progress on clinical application and side effects of Tripterygium wilfordii[J]. J Pharm Prac (药学实践杂志), 2015, 33: 110–113. |
| [4] | Lin JR, Lin B, Song HT. Research progress on in vivo pharmacokinetics of triptolide and celastrol[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 528–532. |
| [5] | Ma J, Dey M, Yang H, et al. Anti-inflammatory and immunosuppressive compounds from Tripterygium wilfordii[J]. Phytochemistry, 2007, 68: 1172–1178. DOI:10.1016/j.phytochem.2007.02.021 |
| [6] | Liu MX, Dong J, Yang YJ, et al. Preparation and toxicity of triptolide-loaded poly (D, L-lactic acid) nanoparticles[J]. Acta Pharm Sin (药学学报), 2004, 39: 375–382. |
| [7] | Titov DV, Gilman B, He QL, et al. XPB, a subunit of TFⅡH, is a target of the natural product triptolide[J]. Nat Chem Biol, 2011, 7: 182–188. DOI:10.1038/nchembio.522 |
| [8] | Zhang T, Li Y, Yu Y, et al. Characterization of celastrol to inhibit hsp90 and cdc37 interaction[J]. J Biol Chem, 2009, 284: 35381–35389. DOI:10.1074/jbc.M109.051532 |
| [9] | Zhang T, Hamza A, Cao X, et al. A novel Hsp90 inhibitor to disrupt Hsp90/Cdc37 complex against pancreatic cancer cells[J]. Mol Cancer Ther, 2008, 7: 162. DOI:10.1158/1535-7163.MCT-07-0484 |
| [10] | Liu J, Lee J, Salazar Hernandez M A, et al. Treatment of obesity with celastrol[J]. Cell, 2015, 161: 999–1011. DOI:10.1016/j.cell.2015.05.011 |
| [11] | Chen Y, Xie QD, Tang YS, et al. Advances in plant terpene synthetic metabolic pathways and rate-limiting enzymes[J]. Mol Plant Breed (分子植物育种), 2018, 16: 2371–2379. |
| [12] | Laule O, Fürholz A, Chang HS, et al. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana[J]. Proc Natl Acad Sci U S A, 2003, 100: 6866–6871. DOI:10.1073/pnas.1031755100 |
| [13] | He YF, Gao W, Liu TS, et al. Research advances of diterpene synthase[J]. Acta Phar Sin (药学学报), 2011, 46: 1019–1025. |
| [14] | Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants[J]. Ann Rev Plant Physiol Plant Mol Biol, 2003, 46: 521–547. |
| [15] | Bach TJ. Hydroxymethylglutaryl-CoA reductase, a key enzyme in phytosterol synthesis?[J]. Lipids, 1986, 21: 82–88. DOI:10.1007/BF02534307 |
| [16] | Kim YJ, Yang DC. Functional analysis of 3-hydroxy-3- methylglutaryl coenzyme a reductase encoding genes in triterpene saponin-producing ginseng[J]. Plant Physiol, 2014, 165: 373–387. DOI:10.1104/pp.113.222596 |
| [17] | Suzuki M, Kamide Y, Nagata N, et al. Loss of function of 3-hydroxy-3-methylglutaryl coenzyme A reductase 1(HMG1) in Arabidopsis leads to dwarfing, early senescence and male steril-ity, and reduced sterol levels[J]. J Health Soc Policy, 2004, 37: 750–761. |
| [18] | Guo J. The impact of the overexpression of genes HMGR and DXR in terpenes biosynthesis in Tripterygium wilfordii Hook. f (HMGR与DXR基因过表达对雷公藤萜类物质生物合成的影响)[D]. Yangling: Northwest A & F University (西北农林科技大学), 2015. |
| [19] | Liu YJ, Su P, Wang XJ, et al. Cloning and expression analysis of squalene synthase gene in Tripterygium wilfordii[J]. Acta Pharm Sin (药学学报), 2016, 51: 657–661. |
| [20] | Kumar S, Stecher G, Tamura K. MEGA7:molecular evolu tionary genetics analysis version 7.0 for bigger datasets[J]. Mol Biol Evol, 2016, 33: 1870–1874. DOI:10.1093/molbev/msw054 |
| [21] | Livak KJ, Schmittgen TD. Analysis of relative gene expres sion data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25: 402–408. DOI:10.1006/meth.2001.1262 |
| [22] | Luo HM, Song JY, Li XY, et al. Cloning and expression analysis of a key device of HMGR gene involved in ginse noside biosynthesis of Panax ginseng via synthetic biology approach[J]. Acta Pharm Sin (药学学报), 2013, 48: 219–227. |
| [23] | Schaller H, Grausem B, Benveniste P, et al. Expression of the Hevea brasiliensis (H.B.K.) Mull. Arg. 3-hydroxy-3- methylglutaryl-coenzyme A reductase 1 in tobacco results in sterol overproduction[J]. Plant Physiol, 1995, 109: 761–770. DOI:10.1104/pp.109.3.761 |
| [24] | Wang Y, Jing F, Yu S, et al. Co-overexpression of the HMGR and FPS genes enhances artemisinin content in Artemisia annua L[J]. J Med Plants Res, 2011, 5: 3396–3403. |
| [25] | Chu W, Liu YY, Li YB, et al. Advances on plant 3-hydroxy- 3-methylglutaryl coenzyme A reductase (HMGR) genes[J]. Curr Biotechnol, 2018, 8: 93–102. |
| [26] | Zhang YF, Zhao YJ, Wang JD, et al. Overexpression and RNA interference of TwDXR regulate the accumulation of terpenoid active ingredients in Tripterygium wilfordii[J]. Biotechnol Lett, 2018, 40: 419–425. DOI:10.1007/s10529-017-2484-1 |
 2018, Vol. 53
2018, Vol. 53


