2. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700;
3. 首都医科大学中医药学院, 中医络病研究北京市重点实验室, 北京 100069
2. State Key Laboratory of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. Beijing Key Lab of TCM Collateral Disease Theory Research, School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China
中药雷公藤来源于卫矛科雷公藤属植物雷公藤(Tripterygium wilfordii Hook. f., Tw)的干燥根或根的木质部, 具有祛风除湿、活血通络等功效[1]。雷公藤主要有效化学成分是萜类, 如二萜类雷公藤甲素(triptolide)、三萜类雷公藤红素(celastrol)、雷公藤内酯甲等。现代药理研究表明, 雷公藤甲素有良好的抗肿瘤作用, 如肺癌[2]、乳腺癌[3]等, 还可用于治疗类风湿性关节炎[4]等。雷公藤红素可以减轻体重[5], 改善糖代谢[6]等。
Gateway®克隆技术主要运用BP和LR位点特异性重组反应, 使噬菌体λ能够整合进细菌染色体中或者整合后再从中分离[7], 这种方法可以利用一种入门载体进而高通量地产生各种表达载体。现在也已研发出用于研究植物基因功能的高通量Gateway载体[8]。RNA干扰(RNA interference, RNAi)是一种序列特异的基因沉默手段, 能高效、特异阻断基因的表达, 广泛应用于肿瘤基因治疗[9, 10]的研究。现在也越来越成为基因功能研究[11-13]及调节化合物生物合成研究的有力工具。
基因枪技术的基本原理就是将采用外源基因包被在钨粉或金粉颗粒表面, 然后在高压冲击的作用下, 将加速的粒子打入靶细胞或组织内。该技术操作简单, 能迅速、方便地转移基因, 而且可以获得持续时间较长的瞬时表达[14]。
萜类化合物在植物体内是由位于细胞质的甲羟戊酸(mevalonate, MVA)途径和位于质体的2-C-甲基- D-赤藓醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate, MEP)途径合成。其中2-C-甲基-D-赤藻醇-4磷酸胱氨酰转移酶(2-C-methyl-D-erythritol-4-phosphate cytidylyltransferase, MCT)是MEP途径中重要的关键酶, 其催化MEP生成4-(5-焦磷酸胞苷)-2-C-甲基- D-赤藓醇[4-(cytidine 5-diphospho)-2-C-methyl-D-erythritol, CDP-ME], 在合成萜类化合物的过程中发挥重要作用。Tong等[15]克隆得到了雷公藤MCT (TwMCT)基因, 但该基因的表达与对雷公藤甲素和雷公藤红素生物合成的影响目前尚未阐明。本研究利用Gateway技术构建了TwMCT的RNAi载体, 并将该载体通过基因枪技术转入到雷公藤悬浮细胞中, 测定转入载体的悬浮细胞中雷公藤甲素和雷公藤红素的含量, 同时确定TwMCT以及萜类生物合成途径上其他重要基因的表达情况, 以此在体内验证干扰TwMCT的表达对雷公藤萜类活性成分雷公藤甲素和雷公藤红素积累有抑制作用, 为进一步探究MCT基因调控雷公藤萜类生物合成的机制奠定基础。
材料与方法植物材料 本实验所用的雷公藤悬浮细胞培养于含有0.5 mg·L-1 2, 4-二氯苯氧乙酸(2, 4-D) + 0.1 mg·L-1激动素(KT) + 0.5 mg·L-1吲哚丁酸(IBA)的MS液体培养基中, 并于25 ℃、120 r·min-1黑暗条件下振荡培养。细胞由首都医科大学中药资源与分子生药实验室继代保存。
药品与试剂 pENTRTM/D-TOPO® Cloning Kit, LR Clonase TM Ⅱ Enzyme Mix, 载体pK7GWIWG2D (美国Invitrogen公司); 大肠杆菌Trans5α (E. coli Trans5α)感受态细胞(北京全式金生物技术有限公司); Plasmid Maxi Kit试剂盒(美国OMEGA公司); Phusion超保真聚合酶(美国New England Biolabs公司); KAPA SYBR FAST qPCR Master Mix Kit (美国KAPA Biosystems公司); 总RNA提取试剂盒(北京普洛麦格生物技术有限公司); 快速质粒小提试剂盒, Fast Quant RT kit (with gDNase)试剂盒(北京天根生化科技有限公司)。
仪器设备 基因枪(PDS-1000/He, 美国Bio-Rad公司); 实时荧光定量PCR仪(qRT-PCR, QuantStudio 5, 美国Thermo Fisher Scientific公司); 超高效液相色谱仪(UPLC, 1290 Infinity Ⅱ, 美国Agilent公司); T3超高效液相色谱柱(1.8 μm, 2.1 mm × 100 mm, 美国Waters公司); 引物合成及测序服务由北京睿博兴科生物技术有限公司完成。
TwMCT基因的RNAi片段扩增 根据TwMCT基因序列, 利用Primer Premier 5.0软件设计该序列RNAi片段的特异性引物MCTi F/R (表 1), 以TwMCT基因质粒为模板, 根据Phusion超保真聚合酶说明书进行PCR扩增反应。反应程序: 98 ℃预变性30 s, 35个循环(98 ℃变性10 s, 56 ℃退火15 s, 72 ℃延伸1 min), 最后72 ℃延伸7 min, 4 ℃保温。1%的琼脂糖凝胶电泳检测PCR产物。
| Table 1 The primers used for vector construction, verification and qRT-PCR |
入门载体的构建 按照pENTRTM/D-TOPO® Cloning Kit试剂盒的指导[16], 将所扩增的条带位置正确的PCR产物与入门载体pENTR SD/D-TOPO相连接, 也称BP反应。再将连接后的产物转化到E. coli Trans5α感受态细胞中, 在含有50 mg·L-1卡那霉素(kanamycin, Kan)的LB固体培养基的平板上进行筛选。待长出圆形单一克隆菌落后, 使用入门载体上的通用引物M13 F/R (表 1)进行PCR检测, 将得到的条带位置正确的菌液进行测序, 检测入门载体的构建是否成功。
TwMCT RNAi载体的构建 利用快速质粒小提试剂盒提取测序结果正确的入门载体的质粒, 根据Gateway LR ClonaseTM Ⅱ Enzyme Mix试剂盒说明书, 在LR Clone Ⅱ重组酶的作用下, 将入门载体与pK7GWIWG2D载体进行重组反应, 也称LR反应。再将重组反应后的产物转化到E. coli Trans5α感受态细胞中, 在含有50 mg·L-1壮观霉素(spectinomycin, Spe)的LB固体培养基的平板上进行筛选。待长出圆形单一克隆菌落后, 利用引物MCTi F/R进行PCR检测, 将得到的条带位置正确的菌液进行测序, 检测TwMCT RNAi载体的构建是否成功。
雷公藤悬浮细胞的培养 将实验室继代保存的雷公藤悬浮细胞转移到添加了0.5 mg·L-1 2, 4-D + 0.1 mg·L-1 KT的MS固体培养基中, 25 ℃、120 r·min-1黑暗条件下预培养7 d。每3 mL MS固体培养基对应培养200 mg雷公藤悬浮细胞。
TwMCT RNAi载体的转入 利用Plasmid Maxi Kit试剂盒提取pK7GWIWG2D载体和测序结果正确的TwMCT RNAi载体的质粒。以pK7GWIWG2D载体作为空载对照, 利用基因枪[17]将空载质粒和TwMCT RNAi载体的质粒分别转化到预培养7 d后的雷公藤悬浮细胞中, 转入后的细胞继续在相同条件下培养7 d。每种质粒设置5个生物学重复。
TwMCT RNAi载体成功转入悬浮细胞的验证 利用总RNA提取试剂盒, 分别提取继续培养7 d后的雷公藤悬浮细胞的总RNA, 按照FastQuant RT kit (with gDNase)试剂盒的指导, 将总RNA反转录成第一链cDNA。利用引物Kan F/R (表 1), 进行PCR反应, 反应条件与雷公藤MCT基因的RNAi片段扩增程序相同, 检测cDNA中是否含有Kan抗性标记基因片段, 以期来验证TwMCT RNAi载体是否成功转入到雷公藤悬浮细胞中。
雷公藤甲素和雷公藤红素的提取与含量测定 剩余的雷公藤悬浮细胞经液氮速冻后冷冻干燥48 h。冷冻干燥后的每个样品准确称量20 mg, 分别置于装有1 mL 80% (v/v)甲醇的离心管中, 于4 ℃浸泡过夜。之后在40 kHz、25 ℃条件下超声提取1 h, 然后将离心管于13 000 ×g下离心10 min, 上清液过0.22 μm滤膜后利用T3柱子和UPLC仪器检测雷公藤甲素和雷公藤红素的含量。进样量是5 μL, 流动相A是100%乙腈, 流动相B是0.1% (v/v)甲酸水。梯度洗脱过程: 0~5 min, 70%~65% A; 5~8 min, 65% A; 8~15 min, 65%~30% A; 15~21 min, 30%~10% A, 流速为0.4 mL·min-1, 柱温40 ℃。每个样品重复进样3次。
TwMCT基因表达量的检测 以cDNA为模板, 引物qMCT F/R (表 1), 参照KAPA SYBR FAST qPCR Master Mix Kit试剂盒说明书, 利用qRT-PCR仪器来检测目的TwMCT的表达情况。以Efα1作为内参基因, 其引物为qEf F/R (表 1)。反应体系: 10 μL 2×qPCR Master Mix, 0.4 μL 50×ROX reference Dye low, 0.4 μL引物(10 μmol·L-1), 1 μL cDNA, 加ddH2O补足至20 μL。反应条件:初始95 ℃进行3 min, 扩增循环40次: 95 ℃变性3 s, 60 ℃退火延伸30 s, 与此同时采集荧光图像, 然后添加熔解曲线: 95 ℃ 1 s, 60 ℃ 20 s, 在0.1 ℃·s-1升温过程中采集荧光图像, 95 ℃ 1 s。数据采用2-△△Ct方法计算各基因的相对表达量[18]。每个样品重复3次。
雷公藤萜类生物合成途径上主要基因表达量 的检测萜类生物合成途径上主要生物合成酶有1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5- phosphate synthase, DXS)、1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoi somerase, DXR)、法尼基二磷酸合酶(farnesyl di phosphate synthase, FPS)、香叶基香叶基二磷酸合酶(geranylgeranyl diphosphate synthase, GGPS)、羟甲基戊二酰-CoA还原酶(hydroxymethylglutaryl-CoA reductase, HMGR)、羟甲基戊二酰CoA合酶(hy droxymethylglutaryl-CoA synthase, HMGS)。以cDNA为模板, Efα1为内参基因, 检测雷公藤DXS (TwDXS)、雷公藤DXR (TwDXR)、雷公藤FPS (TwFPS)、雷公藤GGPS (TwGGPS)、雷公藤HMGR (TwHMGR)和雷公藤HMGS (TwHMGS)基因的表达量, 相关引物见表 1。参照KAPA SYBR FAST qPCR Master Mix Kit试剂盒说明书, 利用qRT-PCR仪器来检测萜类途径上TwDXS、TwDXR、TwFPS、TwGGPS、TwHMGR和TwHMGS的表达情况。数据采用2-△△Ct方法计算各基因的相对表达量。每个样品重复3次。
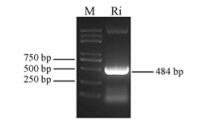
结果与分析 1 TwMCT RNAi载体构建的检测利用特异性引物MCTi F/R对在LB+Spe培养基中培养的菌液进行PCR检测, 电泳检测结果见图 1。得到的TwMCT RNAi片段大小为484 bp。提取阳性菌液的质粒, 进行测序, 结果与TwMCT序列一致。表明TwMCT RNAi载体构建成功。
|
Figure 1 PCR analysis of the expression vector construction. M: Trans 2K Plus Marker; Ri: TwMCT RNAi |
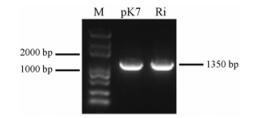
分别以反转录得到的pK7GWIWG2D组和TwMCT RNAi组的cDNA为模板, 利用引物Kan F/R进行PCR检测, 结果见图 2。所得到的产物大小为1 350 bp, 为抗性基因Kan片段, 表明对照pK7GWIWG2D载体和TwMCT RNAi载体已成功转入到雷公藤悬浮细胞中。
|
Figure 2 Verification of successful expression vector transfor mation. M: Trans 2K Plus Marker; pK7: pK7GWIWG2D; Ri: TwMCT RNAi |
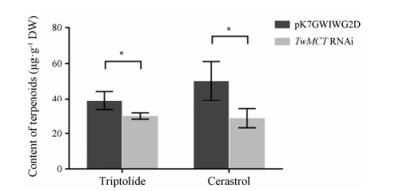
在TwMCT表达被干扰的情况下, 雷公藤悬浮细胞中的雷公藤甲素和雷公藤红素的含量变化见图 3。雷公藤甲素的含量在对照组pK7GWIWG2D中是39.0 ± 5.3 μg·g-1, 在TwMCT RNAi组中是29.9 ± 1.8 μg·g-1。雷公藤红素的含量在对照组中是50.2 ± 11.1 μg·g-1, 在RNAi组中是28.7 ± 5.4 μg·g-1, 且均具有显著性差异(P < 0.05)。
|
Figure 3 Contents of triptolide and celastrol in Tripterygium wilfordii suspension cells. The data represent the means ± SD of five biological replicates and three technical replicates; DW means dry weight. A single asterisk indicates *P < 0.05, n = 5 |
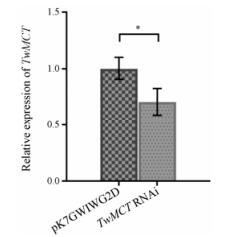
利用qRT-PCR仪器对TwMCT干扰后的表达量进行检测, 计算基因相对表达量, 结果见图 4。TwMCT RNAi的基因表达量相对于对照组pK7GWIWG2D显著下降了29.2%。
|
Figure 4 Relative expression of TwMCT. Values represent means ± SD of five biological replicates and three technical replicates. *P < 0.05, n = 5 |
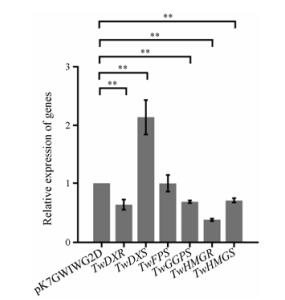
在TwMCT表达被干扰的情况下, 萜类合成相关基因表达量变化见图 5。相对于对照组pK7GWIWG2D, TwDXS的表达量上调了114.2%, TwDXR、TwGGPS、TwHMGR和TwHMGS的相对表达量分别下降了36.3%、31.3%、62.2%、29.1%, 但TwFPS相对于对照组没有显著性变化。
|
Figure 5 Relative expression analysis of genes in the terpenoid biosynthetic pathway. Values represent means ± SD of five biological replicates and three technical replicates. **P < 0.01, n = 5 |
在植物萜类合成MEP途径中, DXS催化丙酮酸(pyruvate)和甘油醛-3-磷酸(D-glyceraldehyde-3- phosphate, G3P)生成1-脱氧-木酮糖-5-磷酸(1- deoxy-D-xylulose-5-phosphate, DXP), DXP经DXR催化生成MEP, MEP经MCT催化生成CDP-ME, 再经过酶催化反应后生成(isopentenyl pyrophosphate, IPP), IPP和其同分异构体二甲基丙烯基焦磷酸(dimethylallyl diphosphate, DMAPP)经一系列反应后在GGPS催化下生成香叶基香叶基焦磷酸(geranyl geranyl pyrophosphate, GGPP), GGPP再经过一系列反应生成雷公藤甲素。IPP可以通过质体包膜转移, 连接MVA和MEP途径[19]。在MVA途径中, HMGS催化乙酰乙酰CoA (acetoacetyl-CoA)生成3-羟基-3-甲基戊二酰CoA (3-hydroxy-3methylglutaryl-CoA, HMG-CoA), HMGR催化HMG-CoA生成MVA, MVA经过一系列催化后可得到IPP, IPP和DMAPP经一系列反应后在FPS催化下生成法尼基焦磷酸(farnesyl pyrophosphate, FPP), FPP经过一系列反应生成雷公藤红素。本研究中, 建立了TwMCT RNAi表达载体, 主要考察雷公藤萜类活性成分生物合成的关键基因TwMCT干扰后的表达变化, 发现干扰TwMCT表达后, 经MEP途径生成的雷公藤甲素和经MVA途径生成的雷公藤红素含量均显著下降, TwMCT表达量明显下调, 由此验证干扰TwMCT的表达对雷公藤萜类活性成分雷公藤甲素和雷公藤红素的积累有显著抑制作用。分析雷公藤萜类生物合成途径上游主要基因的表达情况后发现, MEP途径上TwDXR和TwGGPS、MVA途径上TwHMGR和TwHMGS表达量均显著下调, 提示在干扰MEP途径上的TwMCT表达后, 萜类途径上游部分基因表达也发生相应的变化, 从而导致经MVA途径合成的雷公藤红素含量下降, 这可能归因于基因间的共同作用[20], 但TwDXS的表达量显著上调, 这可能是由基因表达的负反馈调节所引起的[21], 而TwFPS没有显著性变化的现象可能与基因沉默有关[22]。
目前雷公藤甲素和雷公藤红素生物合成途径下游的关键基因尚未完全解析清楚, 而雷公藤甲素和雷公藤红素合成所受抑制程度的不同, 说明TwMCT对雷公藤二萜类和三萜类合成的前体物质IPP和DMAPP生物合成的影响可能是一致的, 但下游不同萜类对前体物质的竞争能力不同, 导致二者的累积程度不同, 上游途径中TwMCT表达被干扰后对下游途径的基因是否有影响也有待进一步探究。目前已经从青蒿[23]、银杏[24]、萝芙木[25]等中克隆得到了编码MCT的基因, 本实验不仅可为进一步探讨TwMCT基因对雷公藤萜类活性成分生物合成的调控机制奠定基础, 还可为研究其他植物中MCT的作用, 探究雷公藤萜类生物合成途径上其他关键酶[26, 27]对雷公藤萜类活性成分生物合成的影响提供参考。
| [1] | Gao W, Liu M, Cheng QQ, et al. Herbal textual research on Tripterygium Wilfordii[J]. World Chin Med (世界中医药), 2012: 560–562. |
| [2] | Reno TA, Kim JY, Raz DJ. Triptolide inhibits lung cancer cell migration, invasion, and metastasis[J]. Ann Thorac Surg, 2015, 100: 1817-1824–1824-1825. |
| [3] | Shao HM, Ma JH, Guo TH, et al. Triptolide induces apoptosis of breast cancer cells via a mechanism associated with the Wnt/β-catenin signaling pathway[J]. Exp Ther Med, 2014, 8: 505–508. DOI:10.3892/etm.2014.1729 |
| [4] | Marcus DM. Comparison of Tripterygium wilfordii Hook. F with methotrexate in the treatment of rheumatoid arthritis[J]. Ann Rheum Dis, 2014, 73: e56–e56. DOI:10.1136/annrheumdis-2014-205971 |
| [5] | Liu J, Lee J, Salazar Hernandez MA, et al. Treatment of obesity with celastrol[J]. Cell, 2015, 161: 999–1011. DOI:10.1016/j.cell.2015.05.011 |
| [6] | Ma X, Xu L, Alberobello AT, et al. Celastrol protects against obesity and metabolic dysfunction through activation of a HSF1-PGC1α transcriptional axis[J]. Cell Metab, 2015, 22: 695–708. DOI:10.1016/j.cmet.2015.08.005 |
| [7] | Hartley JL, Temple GF, Brasch MA. DNA cloning using in vitro site-specific recombination[J]. Genome Res, 2000, 10: 1788–1795. DOI:10.1101/gr.143000 |
| [8] | Guo SS, Zhang M, Shan WX. Construction of a Gateway technology-based plant expression vector[J]. J Northwest A & F Univ (Nat Sci Ed) (西北农林科技大学学报(自然科学版)), 2010, 2010: 161–166. |
| [9] | Fei LN, Wang QZ, Xu RA. Combinatorial RNAi and its application in cancer gene therapy[J]. Acta Pharm Sin (药学学报), 2012, 47: 573–579. |
| [10] | Chang L, Gong F, Cui Y. RNAi-mediated A disintegrin and metalloproteinase 9 gene silencing inhibits the tumor growth of non-small lung cancer in vitro and in vivo[J]. Mol Med Rep, 2015, 12: 1197–1204. DOI:10.3892/mmr.2015.3477 |
| [11] | Asano T, Kobayashi K, Kashihara E, et al. Suppression of camptothecin biosynthetic genes results in metabolic modifica tion of secondary products in hairy roots of Ophiorrhiza pumila[J]. Phytochemistry, 2013, 91: 128–139. DOI:10.1016/j.phytochem.2012.04.019 |
| [12] | Cheng QQ, Su P, Hu YT, et al. RNA interference-mediated repression of SmCPS (copalyldiphosphate synthase) expression in hairy roots of Salvia miltiorrhiza causes a decrease of tanshinones and sheds light on the functional role of SmCPS[J]. Biotechnol Lett, 2014, 36: 363–369. DOI:10.1007/s10529-013-1358-4 |
| [13] | Zhang YF, Zhao YJ, Wang JD, et al. Overexpression and RNA interference of TwDXR regulate the accumulation of terpenoid active ingredients in Tripterygium wilfordii[J]. Biotechnol Lett, 2018, 40: 419–425. DOI:10.1007/s10529-017-2484-1 |
| [14] | He BL, Sun EJ, Huang W. The particle gun and its application advancement in gene therapy[J]. J Biol (生物学杂志), 2007, 24: 49–52. |
| [15] | Tong YR, Su P, Zhang M, et al. Cloning and expression analysis of 2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase gene in Tripterygium wilfordii[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4378–4383. |
| [16] | Zhao R, Rong QX, Liu YZ, et al. Construction of RNAi vectors for SmNAC1 transcription factors of Salvia miltiorrhiza using Gateway cloning technology[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 1569–1573. |
| [17] | Zhu JC, Bu DH, Yu XZ, et al. Instructions of biolistic PDS-1000/He gene gun[J]. Shaanxi J Agric Sci (陕西农业科学), 2003(1): 81–82. |
| [18] | Rao X, Huang X, Zhou Z, et al. An improvement of the 2-△△Ct method for quantitative real-time polymerase chain reaction data analysis[J]. Comput Stand Interfaces, 2013, 3: 165–165. |
| [19] | Hemmerlin A, Harwood JL, Bach TJ. A raison d'etre for two distinct pathways in the early steps of plant isoprenoid biosynthesis?[J]. Prog Lipid Res, 2012, 51: 95–148. DOI:10.1016/j.plipres.2011.12.001 |
| [20] | Singh S, Pal S, Shanker K, et al. Sterol partitioning by HMGR and DXR for routing intermediates toward withanolide biosynthesis[J]. Physiol Plant, 2014, 152: 617. DOI:10.1111/ppl.2014.152.issue-4 |
| [21] | Xi W, Yu H. MOTHER OF FT AND TFL1 regulates seed germination through a negative feedback loop modulating ABA signaling in Arabidopsis[J]. Plant Cell, 2010, 22: 1733. DOI:10.1105/tpc.109.073072 |
| [22] | Linn F, Heidmann L, Saedler H. Epigenetic changes in the expression of the maize Al gene in Petunia hybrida:role of numbers of integrated gene copies and state of methylation[J]. Mol Gen Genet, 1990, 222: 329–336. DOI:10.1007/BF00633837 |
| [23] | Zhang M, Xiang LE, Wang H, et al. Molecular cloning and characterization of the 2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase gene from Artemisia annua L.[J]. Acta Pharm Sin (药学学报), 2016, 51: 1334–1339. |
| [24] | Yuan HH. Clonging of MECT, MECPs Gene Promoters from Ginkgo biloba L. and Construction of Plant Expression Vector (银杏MECT、MECPs基因启动子克隆及植物表达载体构建)[D]. Wuhan: Wuhan Institute of Technology, 2013. |
| [25] | Zheng Y. Cloning of MCT, HDS and SGD Genes from Rauvolfia verticillata and Establishment of Genetic Transfor mation System(萝芙木MCT、HDS、SGD基因的克隆与遗传转化体系的建立)[D]. Chongqing: Southwest University, 2011. |
| [26] | Liu YJ, Su P, Wang XJ, et al. Cloning and expression analysis of squalene synthase gene in Tripterygium wilfordii[J]. Acta Pharm Sin (药学学报), 2016, 51: 657–661. |
| [27] | Cheng QQ, Tong YR, Wang ZH, et al. Molecular cloning and functional identification of a cDNA encoding 4-hydroxy- 3-methylbut-2-enyl diphosphate reductase from Tripterygium wilfordii[J]. Acta Pharm Sin B, 2017, 7: 208–214. DOI:10.1016/j.apsb.2016.12.002 |
 2018, Vol. 53
2018, Vol. 53


