2. 中国中医科学院中药资源中心, 北京 100700
2. National Resource Center for Chinese Meteria Medica, China Academy of Chinese Medicine Sciences, Beijing 100700, China
金银花为忍冬科植物忍冬Lonicera japonica Thunb.的干燥花蕾或初开的花[1], 是我国常用大宗药材。由于金银花在花蕾期、盛花期和败花期时绿原酸、芦丁等成分存在显著差异[2], 因此开展金银花花期调控研究将为进一步控制金银花质量奠定理论基础。
植物花期调节是其适应逆境的重要机制之一, 即适宜的开花时间能使植物达到最强的适应性和生殖能力[3]。在花期的基因调控网络中, miRNA是一类长度为20~25 bp的非编码内源性小分子单链RNA, 可以作为负调控因子参与转录后基因表达调控[4], 如miRNA参与调控了青梅雌蕊发育[5]、木绣球花可育性[6]、苹果花蕾形成[7]等。本实验室已建立了不同品种、不同产地的金银花miRNA数据库, 并获得了参与调控花蕾脂肪酸代谢的miRNA, 推测其与金银花品种间成分的差异有关[8]。
除品种外, 干旱[9, 10]、紫外[11]、盐[12]等环境胁迫对金银花花蕾发育以及次生代谢产物的积累也具有重要影响。作为与环境胁迫密切相关的保护性蛋白, 热休克蛋白Hsp70 (heat shock protein 70)家族是抵抗胁迫的主要分子伴侣之一[13]。目前已发表的植物Hsp70研究主要集中在基因功能和对胁迫的响应机制等[14], 但有关miRNA调控Hsp70基因表达的研究还鲜有报道。本文拟通过对Hsp70及其相关miRNA的生物信息学分析, 结合不同花期金银花Hsp70及其相关miRNA的表达情况, 为金银花花期调控、响应环境胁迫等机制研究提供新的思路。
材料与方法仪器 Light Cycler 480 Ⅱ型实时荧光定量PCR仪(Roche公司), DYY-12型电脑三恒多用电泳仪(北京市六一仪器厂), 5810R型低温冷冻离心(Eppendorf公司), MM400型混合型球磨仪(Retsch公司), 紫外凝胶成像分析仪(英国Syngene公司, 型号GBOXHR)。
材料 不同花期的金银花样本采于中国中医科学院院内, 经金艳鉴定为金银花Lonicera japonica Thunb., 采集后用灭菌水清洗擦干, 立即放入液氮, 于-80 ℃冰箱保存(图 1), 凭证标本号为Beijing201705LJ-1~3, 保存在中国中医科学院中药资源中心。

|
Figure 1 Different flowering stages of Lonicera japonica. a: Budding stage; b-f: Fuli-bloom stage; g-h: Late flowing stage |
植物RNA纯化试剂(Invitrogen); TransScript Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒; miRcute miRNA提取分离试剂盒(TIANGEN); miRcute增强型miRNA cDNA第一链合成试剂盒(TIANGEN); miRcute增强型miRNA荧光定量检测试剂盒(TIANGEN); SYBR Ⅱ荧光定量酶; 三氯甲烷、无水乙醇、异丙醇等试剂购自天津市永大化学试剂有限公司, 均为国产分析纯。
金银花Hsp70基因的获得及生物信息学分析 从金银花转录组数据库(本实验室保存)中的KEGG注释中搜索Hsp70关键词, 获得金银花Hsp70基因的序列号, 根据基因的序列号从转录组数据库中调取相应Hsp70基因的序列。使用ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf/)预测Hsp70基因序列的开放阅读框序列, 利用CDD (http://www.ncbi.mlm.nih.gov/Structure/cdd/wrpsb.cgi)软件进行蛋白质结构域功能分析。利用Expasy工具(https://web.expasy.org/protparam)进行氨基酸残基数目、组成、蛋白质相对分子质量、理论等电点和亲、疏水性的在线分析; 利用Expasy工具中的SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)在线预测分析α-螺旋、β-折叠和无规则卷曲; 使用WOLF PSORT (http://wolfpsort.org/)进行蛋白质亚细胞定位信号的预测; 利用MEGA 5.0软件中的邻接法(Neighbor-Joining)构建系统进化树, Bootstrap值为1 000, 其他参数使用默认值。
金银花Hsp70基因相关miRNA的获得及生物信息学分析 利用Target Finder软件根据获得的Hsp70基因序列号结合金银花miRNA库(本实验室保存)中的靶基因预测结果, 筛选可能靶向Hsp70基因并高表达的miRNA, 获得miRNA的成熟体和前体序列。采用RNAfold软件[15]对miRNA前体序列进行二级结构预测折叠, 同时获得其最小自由能。统计miRNA的前体序列长度、GC含量, 并参照文献计算该前体序列自由能指数[16]。采用Photoshop绘制miRNA与Hsp70基因的结合位点图。
金银花总RNA、miRNA的提取及逆转录 取冻存的样品经液氮研磨成粉, 使用植物RNA纯化剂(Invitrogen)试剂提取金银花叶片及不同开花期金银花总RNA。按照TransScript Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒步骤将总RNA反转录成cDNA。
取冻存的样品经液氮研磨成粉, 按照TIANGEN公司miRcute miRNA提取分离试剂盒中组织或细胞中miRNA富集部分的提取步骤提取样品miRNA。按照TIANGEN公司miRcute增强型miRNA cDNA第一链合成试剂盒步骤将miRNA反转录成cDNA。
Hsp70基因及相应miRNA的实时荧光定量特异引物设计 应用引物设计软件Primer Premier 6.0设计引物。参照文献[17]引物设计原则设计靶基因引物; miRNA上游引物设计原则: ①遵循引物设计的普遍原则; ②以成熟的miRNA序列为基础, 将U替换成T; ③ Tm在65 ± 5 ℃; ④若按照上述方式直接设计的引物Tm值过低, 可以在引物的5'端添加几个碱基(最好为G或C碱基)调整Tm, 但应避免引入二级结构; ⑤若按照上述方式直接设计的引物Tm值过高, 可以在引物的5'端或3'端去掉几个碱基。Hsp70基因、miRNA的特异性引物序列与内参基因Actin引物序列[18]、内参miRNA U3868172引物序列[19]见表 1。引物由上海生工生物工程技术服务有限公司合成。miRNA荧光定量下游引物由miRcute增强型miRNA荧光定量检测试剂盒(TIANGEN)提供。
| Table 1 Hsp70 gene and miRNA primer sequences |
实时荧光定量检测mRNA的表达 以Total RNA反转录得到的cDNA为模板, 每组设3个重复, 在Light Cycler 480 Ⅱ型实时荧光定量PCR仪上进行PCR扩增及熔解曲线分析。20 μL反应体系: 10 μL SYBR Ⅱ荧光定量酶, 正反向引物各0.4 μL, cDNA模板2.5 μL, ddH2O 6.7 μL。扩增程序如下: 94 ℃预变性2 min; 94 ℃变性5 s, 60 ℃退火延伸34 s (每次循环后采集荧光信号), 40个循环; 94 ℃变性10 s, 65~95 ℃做熔解曲线分析, 每个温度以每步0.5 ℃上升, 停留5 s, 获得基因的Ct值进行相对定量分析。
实时荧光定量检测miRNA的表达 以miRNA反转录得到的cDNA为模板, 每组设3个重复, 在Light Cycler 480Ⅱ型实时荧光定量PCR仪上进行PCR扩增及熔解曲线分析。20 μL反应体系: 10 μL 2×miRcute Plus miRNA Premix (with SYBR), 正反向引物各0.4 μL, cDNA模板2 μL, ddH2O 7.2 μL。扩增程序如下:起始模板变性95 ℃ 15 min; 富集低丰度目标miRNA (无需收集荧光信号) 94 ℃ 20 s, 64 ℃ 30 s, 72 ℃ 34 s, 共5个循环; PCR循环中模板变性94 ℃ 20 s, 退火以及延伸60 ℃ 34 s, 共45个循环。
数据处理 以花蕾期(c)作为对照组目的基因, 根据Q = E-△△Ct, 利用Excel软件对每个扩增样品的Ct值计算各基因及miRNA的相对表达量Q。其中E为基因扩增效率(一般情况下将扩增设为理想扩增, 扩增效率E默认为2), △△Ct = (Ct样品- Ct内参) - Cn (Ct样品为每个样品的目的基因Ct值, Ct内参为该样品内参基因的Ct值, Cn为对照组目的基因与内参基因的△Ct值)[20]。
结果与分析 1 金银花Hsp70基因的生物信息学分析从金银花转录组数据库中的KEGG注释中搜索Hsp70关键词, 选取其中的Hsp70基因Unigene 47960, 并获得相应序列。使用ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf/)预测Unigene 47960基因序列的开放阅读框序列, 结果显示Unigene 47960可编码267aa氨基酸; 利用CDD (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)软件对Unigene 47960进行蛋白质结构域功能分析, 结果表明Unigene 47960含有Hsp70家族结构域; 利用Expasy工具分析显示, Unigene 47960编码的蛋白相对分子质量为28.881 kDa, 理论等电点为5.10, 平均亲水系数(GRAVY)为-0.465, 二级结构分析表明, Unigene 47960的二级结构中α-螺旋占44.40%、β-折叠占9.33%、无规则卷曲占29.48%、延伸链占16.79%;使用WOLF PSORT对Unigene 47960进行蛋白质亚细胞定位的信号预测, 结果表明Unigene 47960被定位在细胞质和线粒体中。
分别从TAIR网站(http://www.arabidopsis.org/)和RGAP网站(http://rice.Plantbiology.msu.edu/index.shtml)下载拟南芥和水稻的Hsp70基因家族序列, 构建Unigene 47960和拟南芥、水稻Hsp70基因家族的系统进化树(图 2)。根据文献报道, 在拟南芥和水稻中, Hsp70基因家族成员分成Hsp70和Hsp110两个亚家族, 其中Hsp70又分为细胞质Hsp70、内质网Hsp70、线粒体Hsp70、叶绿体Hsp70 4个小家族, Hsp110根据亚细胞定位可分为细胞质型Hsp110a和内质网型Hsp110b[21, 22]。系统聚类树显示, Unigene 47960与拟南芥、水稻中的Hsp110亚家族中细胞质型Hsp110a基因AT1G11660.1、Os05g08840.1、Os01g08560.2、AT1G79920.1、AT1G79930.1聚为一类, 结合Unigene 47960的亚细胞定位结果可进一步推测Unigene 47960属于Hsp70基因家族的Hsp110亚家族中的细胞质型Hsp70。
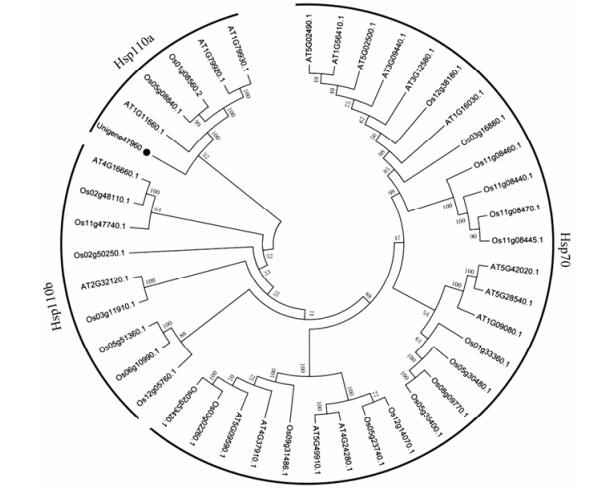
|
Figure 2 Phylogenetic relationships of Hsp70 gene families from Arabidopis thaliana, Oryza sativa and Unigene 47960 |
利用Target Finder软件根据获得的Unigene 47960结合金银花miRNA库(本实验室保存)中的靶基因预测结果, 获得了可能靶向Unigene 47960基因并高表达的novel-mir-102, 同时调取novel-mir-102的成熟体和前体序列。运用RNAfold在线软件对novel-mir- 102进行二级结构预测折叠(图 3A)并进行参数分析。结果表明, novel-mir-102前体序列具有典型的茎环结构特征, 成熟序列位于novel-mir-102前体序列的3'端, novel-mir-102前体序列长度为117, 其最小折叠自由能(MFE)为-61.81 kcal·mol-1, GC%为49.6%, 最小折叠自由能指数(MFEI)为1.07。由Photoshop绘制的novel-mir-102与Unigene 47960结合位点图(图 3B)可见, novel-mir-102与Unigene 47960之间存在3个G:U摆动, 两个碱基错配。

|
Figure 3 A: Secondary structure prediction of novel-mir-102 (Line coverage area is mature miRNA sequence); B: Unigene 47960 and novel-mir-102 binding site map. Vertical lines represent base complements, circles represent G:U swings, and crosses indicate base mismatches |
MFE和MFEI是区分miRNA与其他小分子RNA的重要参数, MFE的值越低, 前体序列的二级结构热力学稳定性相应越高; miRNA前体的MFEI应该大于0.66, 以便同tRNA (0.64)、rRNAs (0.59)和mRNA (0.62~0.66)区分[23];此外, 研究表明, miRNA前体的(A+U)含量高于(G+C)含量能够使miRNA前体更加稳定[23]。本研究所选miRNA的MFE和MFEI值均较高, 且(A+U)含量高于(G+C)含量; 并且novel-mir-102与Unigene 47960结合位点图符合miRNA与靶基因间不多于4个错配的原则[24], 说明novel-mir-102的可靠性高。
3 金银花总RNA与miRNA质检结果选取不同花期金银花提取总RNA、miRNA, 并进行琼脂糖凝胶电泳检测。由图 4A中可见3条清晰的电泳条带, 其中上面两条分别为28S和18S核糖体RNA, 最下面一条为更小稍微扩散的条带, 由相对分子质量低的tRNA和5S核糖体RNA组成, 图中可见28S和18S两条条带亮而浓, 且28S条带密度约为18S条带2倍, A260/A280均在1.80~2.00之间, 提示组织RNA完整性较好, 能够满足qRT-PCR的实验; 图 4B可见, 由试剂盒提取的miRNA条带清晰, 而且都富集, 能够用于常规RT-PCR和qRT-PCR等后续研究。
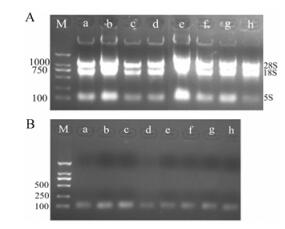
|
Figure 4 Agarose gel electrophoresis. A: Agarose gel electrophoresis of total RNA; B: Agarose gel electrophoresis of miRNA; M: Marker; a: Budding stage; b-f: Full-bloom stage; g-h: Late flowering stage |
为了进一步了解Unigene 47960与novel-mir- 102间的作用情况, 分别对不同花期Unigene 47960和novel-mir-102相对表达量进行分析。由图 5可见, Unigene 47960在盛花期e、f阶段的转录水平显著低于幼蕾、败花期, 推测其主要在金银花幼蕾和败花期阶段发挥功能。同时novel-mir-102与Unigene 47960在金银花不同花期中表达水平呈相反趋势, 推测novel-mir-102可能参与调控金银花Unigene 47960的表达。

|
Figure 5 The expression trend of novel-mir-102 and Unigene 47960 in different flowering stages of Lonicera japonica. a: Budding stage; b-f: Full-bloom stage; g-h: Late flowering stage; **P < 0.01 vs a, b, c, d, g, h flowering stages |
花蕾是金银花的主要药用部位, 有效控制花蕾的生长发育是丰富金银花产量、提高质量的重要环节。miRNA作为许多基因表达的关键调控因子, 能够参与植物从营养生长阶段到生殖生长阶段的转化[25-28]。前期研究表明, 环境胁迫对金银花花蕾的发育和次生代谢产物的积累也具有重要的调控作用[9-12], Hsp70基因在非生物胁迫环境的应答、抗病性及植物发育中扮演重要角色[29]。本研究通过从金银花转录组数据库中选取的金银花Hsp70基因(Unigene 47960)结合金银花miRNA库筛选出novel-mir-102, 分别对Unigene 47960和novel-mir-102进行生物信息学分析。系统进化树显示Unigene 47960与拟南芥、水稻的Hsp110亚家族聚为一类, 研究显示, AT1G11660.1、Os05g08840.1、Os01g08560.2、AT1G79920.1、AT1G79930.1在拟南芥和水稻中可能涉及营养器官的发育、花发育[21]等多种功能, 由此推测与这些基因聚为一类的Unigene 47960可能参与金银花的花发育过程。
目前对于金银花miRNA已有初步研究[8], 但miRNA与Hsp70基因的相互作用影响金银花等药用植物生长发育的研究还未有报道。本研究对Hsp70基因及相关miRNA在金银花不同花期的表达量变化和趋势进行分析, 结果进一步说明novel-mir-102可能靶向Unigene 47960参与金银花的花发育。后期可继续对miRNA及其靶基因如何相互作用及靶基因功能等进行深入研究, 以期为金银花花期调控、响应环境胁迫等机制研究提供新的思路。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopeia of People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2015: 294. |
| [2] | Qin SS, Yuan Y, Hu GQ, et al. Comparison of the content of effective components of Lonicera japonica and its varieties[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2010, 16: 81–82, 86. |
| [3] | Amasino R. Seasonal and developmental timing of flowering[J]. Plant J, 2010, 61: 1001–1013. DOI:10.1111/tpj.2010.61.issue-6 |
| [4] | Zhu FJ, Liu J, Yu NJ, et al. Progress on miRNA-based secondary metabolism regulation in medicinal plants[J]. Chem Life (生命的化学), 2017, 37: 1056–1064. |
| [5] | Wang W, Shi T, Ni X, et al. The role of miR319a and its target gene TCP4 in the regulation of pistil development in Prunus mume[J]. Genome, 2018, 61: 43–48. DOI:10.1139/gen-2017-0118 |
| [6] | Li W, He Z, Zhang L, et al. miRNAs involved in the development and differentiation of fertile and sterile flowers in Viburnum macrocephalum f. keteleeri[J]. BMC Genomics, 2017, 18: 783. DOI:10.1186/s12864-017-4180-x |
| [7] | Xing L, Zhang D, Zhao C, et al. Shoot bending promotes flower bud formation by miRNA-mediated regulation in apple (Malus domestica Borkh.)[J]. Plant Biotechnol J, 2016, 14: 749–770. DOI:10.1111/pbi.2016.14.issue-2 |
| [8] | Liu J, Yuan Y, Wang Y, et al. Regulation of fatty acid and flavonoid biosynthesis by miRNAs in Lonicera japonica[J]. RSC Adv, 2017, 7: 35426–35437. DOI:10.1039/C7RA05800D |
| [9] | Xie DF. Responses to Soil Drought-rehydration on Photosynthetic Characteristics of Lonicera japonica (金银花对土壤干旱-复水的光合生理响应)[D]. Taian: Shandong Agricultural University, 2017. |
| [10] | Liang H. Effect of Drought Stress on Physiological Characteristics and Yield and Quality of Lonicera macranthoides (干旱胁迫对灰毡毛忍冬生理特性及产量和质量的影响)[D]. Chongqing: Southwest University, 2013. |
| [11] | Ning W. Studies on Intervention in Secondary Metabolites in Lonicera japonica Thunb. and Mahonia bealei (Fort. ) Carr. in Response to the Technology of Ultraviolet Induction (紫外诱导技术对中药金银花与十大功劳次生代谢物的干预研究)[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2012. |
| [12] | Li SH. Physiological Analysis of Sale-tolerant Honeysuckle (Lonicera japonica) and ITS Amelioration Funtions in Addition to Exogenous K2SiO3·nH2O (药用金银花耐盐生理分析及外源硅对胁迫的缓解效应)[D]. Nanjing: Nanjing Agricultural University, 2015. |
| [13] | Qi Y, Xu ZS, Li PS, et al. Research progress on molecular mechanism and application of HSP70 in plants[J]. J Plant Genet Resour (植物遗传资源学报), 2013, 14: 507–511. |
| [14] | Li DB, Gao YH, Si JP, et al. Cloning and expression analysis of Hsp70 gene from Dendrobium officinale under low temperature stress[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 507–511. |
| [15] | Lorenz R, Bernhart SH, Honer Zu, C, et al. ViennanRNA Package 2.0[J]. Algorithm Mol Biol,, 2011, 6: 26. DOI:10.1186/1748-7188-6-26 |
| [16] | Li JL. Beta vulgaris microRNAs Bioinformatics Prediction and Salt-tolerant miRNA Expression Analysis (甜菜miRNA生物信息学预测及耐盐相关miRNA表达分析)[D]. Harbin: Harbin Institute of Technology, 2014. |
| [17] | Dong XM, Yuan Y, Zha LP, et al. Molecular ID for populations of Dendrobium officinale of Yunnan and Anhui Province based on SSR marker[J]. Mod Chin Med (中国现代中药), 2017, 19: 617–624. |
| [18] | Jiang XH, Yuan J. Cloning and expression characterization of LjCab gene of the light harvesting chlorophyll a/b binding protein from Lonicera japonica Thunb[J]. J Cent China Norm Univ Nat Sci (华中师范大学学报), 2016, 50: 409–414. |
| [19] | Wang YL. Screening of miRNA and SNP Markers in the Identification of Lonicera japonica (金银花产地鉴定miRNA及SNP标记的筛选)[D]. Kunming: Kunming University of Science and Technology, 2016. |
| [20] | Ao Y, Zhao LL, Jiang CY, et al. Analysis on differential expression of microRNAs in different types of Xanthoceras sorbifolia[J]. Acta Agric Boreali Sin (华北农学报), 2014, 29: 16–22. |
| [21] | Chen X, Shi L, Zhu L, et al. Molecular evolution characteristics and expression pattern analysis of the heat shock protein 70(Hsp70) gene superfamily in plant[J]. Genom Appl Biol (基因组学与应用生物学), 2017, 36: 4282–4294. |
| [22] | Chen XY, Xu RR, Xiong FQ, et al. Genomic-wide identification and bioinformatics analysis of Hsp70 genes in Arachis duranensis and Arachis ipaënsis[J]. Chin J Oil Crop Sci (中国油料作物学报), 2016, 38: 572–581. |
| [23] | Zhang BH, Pan XP, Cox B, et al. Evidence that miRNAs are different from other RNAs[J]. Cell Mol Life Sci, 2006, 63: 246–254. DOI:10.1007/s00018-005-5467-7 |
| [24] | Zhang B, Pan X, Anderson TA. Identification of 188 conserved maize microRNAs and their targets[J]. FEBS Lett, 2006, 580: 3753–3762. DOI:10.1016/j.febslet.2006.05.063 |
| [25] | Spanudakis E, Jackson S. The role of microRNAs in the control of flowering time[J]. Exp Bot, 2014, 65: 365–380. DOI:10.1093/jxb/ert453 |
| [26] | Srikanth A, Schmid M. Regulation of flowering time:all roads lead to rome[J]. Cell Mol Life Sci, 2011, 68: 2013–2037. DOI:10.1007/s00018-011-0673-y |
| [27] | Wang JW, Czech B, Weigel D. miR156 regulated SPL transcription factors define an endogenous flowering pathway in Arabidopsis thaliana[J]. Cell, 2009, 138: 738–749. DOI:10.1016/j.cell.2009.06.014 |
| [28] | Wang C, Zhang YY, Fang JG, et al. Spatiotemporal expression of micro RNA156b and micro RNA172c and their target genes during flower development of winter buds growing on cut-back treated shoots of grapevine[J]. J Nanjing Agric Univ (南京农业大学学报), 2012, 35: 59–64. |
| [29] | Du XH, Huang LL, Liu HC. Advance of heat shock protein 70(Hsp70) in plant[J]. J Henan Inst Sci Technol (河南科技学院学报), 2014, 42: 16–20. |
 2018, Vol. 53
2018, Vol. 53


