肿瘤的治疗普遍存在不良反应大、治疗效果不佳等问题, 开展局部特异性治疗有助于降低毒性, 提高疗效[1]。环境敏感型纳米载药系统[2]可对外界条件迅速响应, 从而控制药物的释放速度和部位, 达到局部治疗的效果。常见的响应因素包括pH[3]、温度[4]、磁场[5]和超声波[6]等, 其中, 由于温度的变化易于操作, 所以温敏纳米载药系统一直是研究的重点。温敏聚合物胶束是一种具有疏水性内核和亲水性外壳的纳米粒, 可以作为许多疏水抗癌药物的载体, 并可以在临界温度附近发生相变[7], 通过可逆性膨胀或收缩从而释放出药物。温敏胶束主要包括两大类:一种是基于低临界溶解温度(low critical solution temperature, LCST), 加热至相变温度时聚合物链由于去水合作用, 由溶解状态变成不溶状态, 发生收缩聚集, 如聚(N-异丙基丙烯酰胺) (PNIPAM)[8], 但在水中的相变温度非常狭窄, 接近32 ℃; 另一种是基于高临界溶解温度(upper critical solution temperature, UCST)[9], 加热至相变温度时由于水合作用使两亲性链段从不溶状态变成溶解状态, 发生解聚[10], 目前研究较少, 具有很好的研究前景。相比低临界溶解温度的聚合物胶束加热收缩, 高临界溶解温度的胶束稳定性更高, 释药更彻底, 有利于增加目标位置的药物浓度, 从而提高治疗效果, 降低系统毒性[11]。
光热治疗(photothermal therapy, PTT)是近年来发展的一种微创性肿瘤技术, 可以实现定点杀伤, 极大地降低了系统毒性[12]。光热治疗主要利用近红外光激发光敏剂, 使光能转化成热能来达到杀死肿瘤细胞的目的。光热治疗的一个重要因素就是光敏剂, 常见光敏剂包括金纳米材料[13]、碳纳米材料[14]、铜基半导体材料[15]和吲哚菁绿(indocyanine green, ICG)[16]等。ICG是目前唯一被美国FDA批准的近红外染料, 生物相容性较好, 光转化效率高[17]。本研究制备了一种负载DOX的ICG-PAAP两亲性聚合物温敏胶束, 在近红外光的照射下, ICG产生热量, 并促进DOX的释放, 从而实现热疗与化疗的联合应用, 避免了药物在传递过程中释放和毒副作用。
材料与方法试剂 二甲基亚砜(dimethyl sulfoxide, DMSO)、偶氮二异丁腈(国药集团化学试剂有限公司); 单甲氧基聚乙二醇(聚乙二醇单甲醚)琥珀酰亚胺碳酸酯[methoxypoly(ethylene glycol) succinimidyl este, mPEG-SC]、丙烯腈、丙烯酰胺、ICG、尼罗红(阿拉丁试剂有限公司); 盐酸多柔比星(doxorubicin hydrochloride, DOX·HCl, 北京华奉联博科技有限公司); 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT, Sigma-Aldrich公司); DMEM细胞培养基(赛默飞世尔生物化学制品有限公司); 胚胎牛血清(杭州四季青生物科技有限公司); 其他试剂均为分析纯, 所有实验用水均为去离子超纯水。
细胞 人乳腺癌MCF-7细胞(中国科学院上海生化与细胞研究所)。
仪器 紫外可见分光光度计(UV-2450)、荧光分光光度计(RF-5301PC) (日本岛津公司); 核磁共振波谱仪(AC-80, 德国布鲁克公司); 傅立叶红外光谱仪(FTIR-370, Nicolet Avatar, 美国Nicolet Instrument Corporation公司); 透射电子显微镜(Tecnai 12, 荷兰Philips公司); 高分辨粒度分析仪(90 Plus PALS, 美国Brookhaven公司); 高速冷冻离心机(Allegra X-15, 美国Beckmancoulter公司); 红外热成像仪[Testo 875-1i, 德图仪器国际贸易(上海)有限公司]; 可调808 nm光纤耦合激光器(LDD 808-2000G3, 西安赫胥尔镭得激光科技有限公司); 冷冻干燥机(LOC-1m, 德国Christ公司); 酶标仪(Spectra max 190, 美国MD公司)。
两亲性聚合物胶束p(AAm-co-AN)-g-PEG的制备 采用无规共聚法制备两亲性聚合物胶束。预先将丙烯腈、DMSO蒸馏以备使用。精密称取丙烯腈2.65 g、丙烯酰胺10.65 g, 量取DMSO 167 mL, 通N2 1 h, 另取脱气的DMSO 33 mL、偶氮二异丁腈487.79 mg于60 ℃水浴锅中加热5.5 h, 冰浴冷却, 加入10倍量甲醇沉淀、洗涤3次, 最后在70 ℃下真空干燥, 得到p(AAm-co-AN)。取上述产物0.5 g与mPEG-SC 0.375 g共溶于10 mLDMSO溶液中, 50 ℃搅拌8 h后置于透析袋(MWCO: 14 kDa)中透析48 h, 将胶束溶液冷冻干燥(-80 ℃, 0.08~0.1 MPa) 24 h, 最终得到胶束粉末p(AAm-co-AN)-g-PEG (PAAP), 备用。
负载ICG的温敏胶束的制备 采用自组装的方法制备复合胶束。首先称取2 mg ICG溶解于去离子水中, 在超声的条件下逐滴加入PAAP溶液(ICG:PAAP = 1:2)中, 在室温避光条件下搅拌过夜, 自组装成温敏复合胶束。样品通过高速冷冻离心机(10 000 r·min-1)离心40 min后收集沉淀物, 并用水洗涤直至上清液无色, 以除去未结合的ICG, 冷冻干燥(-80 ℃, 0.08~0.1 MPa) 24 h, 最终得到温敏复合载体粉末ICG-PAAP。
PAAP的表征 样品通过2%磷钨酸染色后, 利用透射电镜(TEM)观察PAAP的形貌; 将制备的PAAP分散在水中, 采用高分辨粒度分析仪测定样品的粒径分布; 取少量PAAP样品粉末与适量溴化钾(KBr)研磨压片后在傅里叶红外光谱仪上进行测定; 取适量PAAP的冻干粉末溶于DMSO-d6中, 采用核磁测定聚合物的1H NMR光谱。
ICG-PAAP的表征及临界胶束浓度的测定 配制适宜浓度的ICG、ICG-PAAP溶液在200~1 000 nm波长内进行紫外可见近红外吸收光谱的扫描。利用脂溶性的尼罗红作为标记物, 溶解在丙酮中, 浓度为1×10-5 mol·L-1。然后分别在2 mL不同质量浓度(0.5~500 μg·mL-1)的ICG-PAAP水溶液中加入0.1 mL尼罗红的丙酮溶液, 在室温避光的条件下于摇床中震荡过夜, 以挥发丙酮。最后利用荧光分光光度计测定不同浓度样品的尼罗红荧光强度, 激发波长为485 nm, 发射波长为580 nm。
高临界溶解温度的测定 将ICG-PAAP分散在去离子水中, 采用程序升温的方式从25 ℃升高至50 ℃, 利用高分辨率粒度分析仪在不同温度点测定粒子粒径。当粒径不再发生变化时的值为胶束UCST。每个温度点循环测定3次, 粒径取平均值。使用温度控制器, 以1 ℃·min-1的升温速率从25 ℃升高至50 ℃, 在设置的温度点通过紫外可见分光光度计于617 nm处测定透过率, 当透过率不变时为UCST, 每个温度点循环测定3次, 透过率取平均值。
体外光热性能的评价 将ICG-PAAP配成质量浓度为15、30、60、125、250和500 μg·mL-1溶液, 分别吸取500 μL置于EP管中。用808 nm近红外激光照射8 min (功率为2 W·cm-2), 每隔1 min用红外热成像仪测定温度并记录图像。
DOX的负载和载药量的测定 取DOX 1 mg与ICG-PAAP冻干粉末10 mg溶于去离子水中, 在室温下避光搅拌24 h后通过高速冷冻离心机(10 000 r·min-1)离心40 min收集沉淀物, 并用水洗涤直至上清液无色, 以除去游离DOX, 并收集洗涤上清液。利用紫外-可见分光光度计测定DOX在488 nm处的吸光度, 根据标准曲线计算载药量和包封率。最后冷冻干燥(-80 ℃, 0.08~0.1 MPa) 24 h, 得到载药DOX- ICG-PAAP粉末。
称取DOX-ICG-PAAP冻干粉末分散在去离子水(50 μg·mL-1)中, 与冻干前比较, 观察复溶状态, 主要采用高分辨粒度分析仪测定样品的前后粒径分布。称取适量的DOX、DOX-ICG-PAAP冻干粉末溶解在水中, 在200~1 000 nm波长内进行紫外可见近红外吸收光谱的扫描, 然后将DOX-ICG-PAAP溶液通过高速冷冻离心机离心(10 000 r·min-1, 40 min)收集上清液, 再次进行紫外可见近红外吸收光谱的扫描。
光控药物释放研究 将DOX-ICG-PAAP粉末分散于pH 5.0和7.4磷酸盐缓冲液(PBS)中, 于37 ℃恒温水浴箱中振荡(100 r·min-1)。给予或者不给予2 min的近红外光(808 nm, 2 W·cm-2)照射后, 离心(10 000 r·min-1, 40 min)吸取上清液, 于488 nm测定吸光度并计算累积释放率。
细胞摄取研究 取处于对数生长期的MCF-7细胞, 接种到铺有盖玻片的6孔板内, 每孔约5×104个细胞。培养24 h待细胞贴壁后吸去培养液, 加入含有游离DOX或DOX-ICG-PAAP (以DOX计10 μg·mL-1)的培养液1 mL。需要激光处理的实验组, 用近红外激光照射2 min (808 nm, 2 W·cm-2), 温度控制在43 ℃以下。继续培养0.5或1 h后, 分别用Hoechst 33342 (10 μg·mL-1)和溶酶体绿色荧光探针(1 μmol·L-1)染色15 min, PBS洗涤后, 用激光共聚焦显微镜观察。
体外细胞毒性研究 取对数生长期的MCF-7细胞, 按照每孔5×103个细胞接种至96孔细胞板中, 待肿瘤细胞贴壁后, 将培养液换成含有不同质量浓度(20、50、100、200、500、1 000 μg·mL-1) ICG-PAAP的新鲜培养液; 相同方法加入不同浓度的游离DOX、DOX-ICG-PAAP培养液(质量浓度以DOX计, 分别为0.1、0.2、1、2、10、20 μg·mL-1)。激光组:采用近红外激光(808 nm, 2 W·cm-2)照射3 min, 温度控制在43 ℃以下, 重复照射3次; 对照组不给予照射。细胞继续培养24 h后, 采用MTT法测定细胞存活率。
DOX-ICG-PAAP的体外光热-化疗联合治疗的研究 按照上述方法铺直径35 mm的培养皿, 待24 h细胞贴壁后, 将原培养液换成DOX·HCl或DOX-ICG-PAAP的培养液(浓度以DOX计, 20 μg·mL-1)。激光组利用808 nm近红外激光(2 W·cm-2)在室温下照射2 min, 控制温度不高于43 ℃, 间隔照射3次, 培养3 h后用PBS轻缓洗涤, 加入0.4%台盼蓝染色10 min, 用PBS洗涤后用显微镜观察。
结果与讨论 1 PAAP的合成及表征通过TEM对PAAP进行形貌观察, 利用高分辨率粒径分析仪测定粒径大小。图 1a为PAAP的TEM图, 如图所示胶束呈现类球形, 分散均匀, 平均粒径为45 nm。图 1b为聚合物胶束的粒径分布图, 由图可知粒径呈正态分布, 大小均一, 具有较好的分散性, 粒径约为57 nm, 测定结果较TEM大, 这主要是由于纳米粒表面水化层所致。

|
Figure 1 Transmission electron microscopy and size distributions of p(AAm-co-AN)-g-PEG (PAAP) micelles (a, b); infrared spectrum and 1H NMR spectrum of PAAP micelles (c, d) |
通过红外光谱验证PAAP的构建。如图 1c所示, 1 667 cm-1处为C=O的特征伸缩振动峰; 2 881和2 908 cm-1的吸收峰分别对应≡CH和-CH2基团, 3 422 cm-1的特征吸收峰对应-NH2基团, 这3个峰的形成主要来自于丙烯酰胺; 2 459 cm-1附近的吸收峰归属于丙烯腈的C≡N伸缩振动。
利用核磁共振氢谱1H NMR分析PAAP的结构, 如图 1d所示, 位于δ 3~4的峰是聚合物胶束中mPEG-SC的特征质子共振峰, 而位于δ 7~7.5的峰是丙烯酰胺中-NH2的特征质子共振峰, 说明PAAP已成功合成。
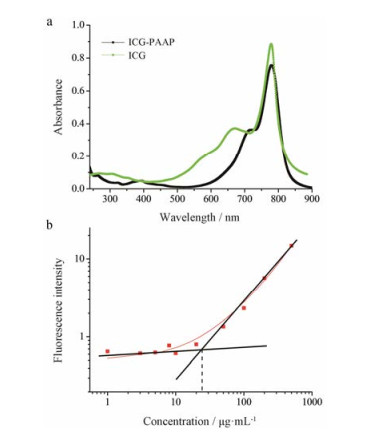
2 ICG-PAAP的表征及临界胶束浓度的测定ICG-PAAP的合成通过紫外可见分光光度计进行观察, 由图 2a可知, 游离ICG的特征吸收峰在780 nm左右, 同样ICG-PAAP聚合物胶束在780 nm也存在吸收峰, 说明ICG已成功负载到PAAP上。
|
Figure 2 UV-vis-NIR absorption spectra of indocyanine green (ICG) and ICG-PAAP (a); critical micelle concentration curve of ICG-PAAP probed by Nile red (b) |
临界胶束浓度(CMC)是形成胶束的最低浓度, 其CMC越低, 形成的胶束越稳定。通过尼罗红标记物的荧光强度来测定CMC, 结果见图 2b。当ICG- PAAP质量浓度低于20 μg·mL-1时, 荧光强度一直较弱, 说明此时未形成胶束; 而高于25 μg·mL-1后, 荧光强度呈线性升高, 说明此时已形成胶束, 该结果显示聚合物胶束的CMC在24 μg·mL-1左右。
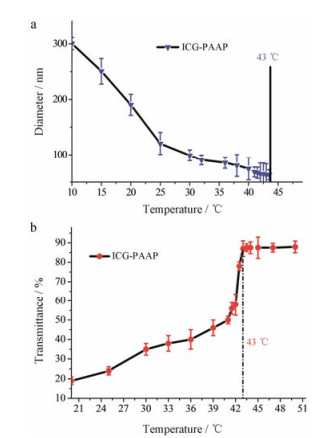
3 高临界溶解温度UCST是评价温敏载体对温度敏感性的关键。通过粒径的变化来观察温敏胶束的UCST。由图 3a可知, 随着温度的升高, 胶束的粒径呈负增长, 当温度为15 ℃时粒径约为250 nm; 37 ℃时粒径约80 nm; 约43 ℃时, 粒径由于太小或太大而不能被检测出, 因此该温度为聚合物胶束的UCST, 载体在低于此温度时可自组装为类球型胶束, 而高于此温度时会发生解聚, 导致粒径变化。图 3b所示, 透过率也是随着温度的升高, 逐渐变大。当在43 ℃左右时, 保持不变。结果表明, 制得的温敏胶束UCST约为43 ℃。
|
Figure 3 Variation of the diameters of ICG-PAAP as a function of temperature (a); transmittance of ICG-PAAP as a function of temperature (b). n = 3, x ± s |
通过近红外激光(808 nm, 2 W·cm-2)研究ICG- PAAP水溶液体外光热性能, 利用近红外成像仪记录温度的变化。图 4a的升温曲线表明溶液温度与照射时间和溶液浓度呈正相关, 照射8 min后, 质量浓度为500 μg·mL-1的样品温度升高至71 ℃, 而对照组升温不明显, 温度仅升高至30 ℃; 随着照射时间的延长, 溶液温度逐渐升高。质量浓度为125 μg·mL-1的样品在照射2 min时温度为42 ℃, 而照射8 min后, 温度升高至58 ℃。因此, 温度的变化与溶液的浓度和照射时间有关。在相同条件下, 载体浓度越高, 照射时间越长, 其温度越高。图 4b为近红外激光照射溶液的光热图像, 结果与升温曲线结果一致, 随着载体浓度的增加和照射时间的延长, 温度逐渐升高, 而对照组水的温度变化不明显。以上结果证明, ICG-PAAP具有较好的光热性能。

|
Figure 4 Photothermal heating curves of pure water and ICG-PAAP at various concentrations as a function of time (a); thermographic images of ICG-PAAP in vitro (b) |
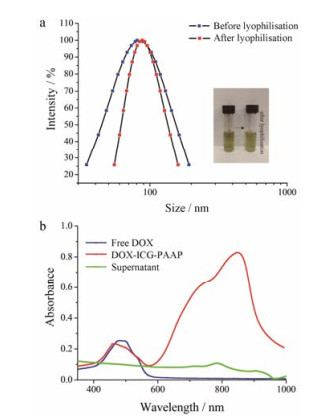
根据DOX浓度-紫外吸光值的标准曲线y = 0.022 2 x + 0.028 (R2 = 0.993), 计算出载药复合胶束的实际载药量为6.8%, 包封率为82.6%。冻干前后DOX- ICG-PAAP的粒径分布见图 5a, 复溶状态良好, 粒径分别约为80和88 nm, 粒径变化不明显, 说明冷冻干燥并不会影响样品性质。其成功负载也可通过紫外可见分光光度计进行表征, 如图 5b所示, 在DOX-ICG-PAAP吸收光谱中, 可明显观察到DOX位于480 nm的吸收峰, 表明DOX已负载到ICG-PAAP上。此外, DOX-ICG-PAAP离心所得上清液并无明显的吸收峰, 说明在冻干过程中无药物泄漏。
|
Figure 5 Size distributions of DOX-ICG-PAAP before or after lyophilisation (a); UV-vis-NIR absorption spectra of DOX, DOX-ICG-PAAP and the supernatant of DOX-ICG-PAAP after centrifugation (b). DOX: Doxorubicin |
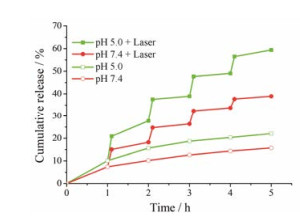
在pH 5.0和7.4介质中药物释放情况见图 6。第1次近红外激光照射后, 相比未照射组DOX释放量明显提高, 累积释放率分别增加了12% (pH 5.0)和7% (pH 7.4), 而当激光关闭后DOX的释放量逐渐减少。在药物释放5 h后激光组释药明显, 累积释放率达59.4% (pH 5.0)和38.9% (pH 7.4), 对照组仅为22%和15.7%。这主要是因为ICG将近红外光能转化为热能, 使温度升高, 达到相变温度时, 胶束发生解聚并释放出药物, 从而达到快速释放的效果; 当激光关闭后, 温度下降, 低于相变温度时, 温敏胶束重新聚合, 药物释放缓慢。从图中还可看出, 药物释放呈明显的pH依赖型, 在pH 5.0时药物释放较快; 在pH 7.4时药物释放较慢。这更加有利于药物在肿瘤内环境中的释放。以上结果表明, 所制备的胶束具有温敏性, 通过控制近红外激光的照射促进药物释放, 且具有pH敏感性。
|
Figure 6 Cumulative release curves of DOX in phosphate buffer saline (PBS) of pH 7.4 and pH 5.0 with or without laser |
通过激光共聚焦显微镜考察MCF-7肿瘤细胞对游离DOX和DOX-ICG-PAAP的摄取情况, 结果见图 7。红色是DOX产生的特征荧光, 蓝色是细胞核染料Hoechst 33342产生的特征荧光, 绿色是溶酶体染料产生的特征荧光。由图可知, DOX-ICG-PAAP在肿瘤细胞摄取0.5 h后, 未进入细胞核, 其红色荧光与溶酶体荧光重叠, 说明DOX-ICG-PAAP纳米粒通过溶酶体途径摄取。当激光照射后细胞核出现红色荧光, 说明DOX已经释放。当摄取1 h时, 可以观察到细胞核内出现少量红色荧光, 主要因为随着摄取时间延长, 细胞摄取DOX-ICG-PAAP的量逐渐增加, 由于细胞内的弱酸性环境影响及载体的pH敏感性, DOX会从载体中少量释放, 并逐渐扩散至细胞核, 引起细胞核内荧光强度增加。游离DOX在培养0.5 h后已被细胞摄取, 并大量扩散至肿瘤细胞核内, 说明游离DOX能快速进入细胞核; 给予游离DOX激光照射后, 与未激光组相比无明显差别, 说明激光对游离DOX无显著影响。以上结果表明, ICG-PAAP可作为DOX药物载体, 能够被细胞摄取, 激光照射后能快速释放药物, 发挥治疗效果。

|
Figure 7 Cellular uptake of DOX-ICG-PAAP and free DOX in MCF-7 cells with or without laser. Red: DOX fluorescence; Blue: Hoechst 33342 staining of nuclei; Green: LysoGreen staining of lysosome (scale bar, 15 μm) |
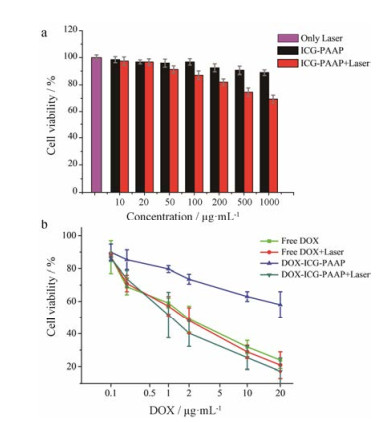
采用MTT法研究ICG-PAAP对MCF-7肿瘤细胞的毒性作用及光热化疗联合的抗肿瘤效果。图 8a结果显示, 载体无明显细胞毒性, 即使质量浓度高达1 000 μg·mL-1时, 细胞存活率仍然高于90%, 说明ICG-PAAP毒性较低, 适合作为药物载体。同时研究了ICG-PAAP载体作为辅助治疗的光热治疗效果。载体经近红外光照射, 将温度控制在43 ℃以下时, 细胞存活率虽然有所下降, 但并不明显。图 8b显示, 近红外光照射后对DOX的治疗效果并无明显影响, 说明近红外光不会增加DOX的细胞毒性。负载DOX后, DOX-ICG-PAAP表现出一定的细胞毒性, 这主要是由于在溶酶体酸性环境下, DOX可以释放。当激光照射后, DOX-ICG-PAAP对MCF-7细胞的抑制率高于游离DOX, 说明在激光照射条件下DOX可以快速释放。以上结果表明, ICG-PAAP载体无明显毒性, 近红外光可促进DOX-ICG-PAAP快速释放药物, 从而达到光热-化疗联合抗肿瘤的效果。
|
Figure 8 Photothermal toxicity of ICG-PAAP in MCF-7 cells incubated with different concentrations for 24 h (a); the anti-tumor curves of DOX and DOX-ICG-PAAP photothermal or chemo-photothermal therapy (b). n = 3, x ± s |
图 9是对DOX-ICG-PAAP光热与化疗联合治疗效果的评价。图 9a为空白对照, 图 9b结果显示单独光照未见明显的细胞死亡, 图 9c显示使用游离DOX出现部分细胞死亡(蓝色), 而图 9d结果表明经近红外光照射的载体使细胞出现大量死亡(蓝色)。以上结果说明, 单独热疗和化疗效果不显著而制备的载体通过光热可以促进化疗药物释放, 增加细胞毒性, 提高杀伤效果, 为联合治疗提供了平台。

|
Figure 9 Microscopic images of MCF-7 cells after treated with control (a), laser (b), DOX (c), DOX-ICG-PAAP + laser (d) (scale bar, 35 μm) |
本文通过无规共聚法构建温敏胶束, 并将光敏剂ICG负载到聚合物胶束上, 制备了光响应胶束。当近红外光照射时, ICG将光能转化为热能, 导致温度升高使胶束解聚, 同时释放出药物, 从而实现光热和化疗联合治疗的效果。制备的DOX-ICG-PAAP粒径大小均一, 分散性较好, UCST为43 ℃, 粒径约为88 nm。载体具有良好的光热性能, 在808 nm激光照射下, 可实现温度快速升高及药物突释。药物释放同时具有pH敏感性, 有利于DOX在肿瘤微酸性环境中释放。细胞实验表明所制备的空白载体无明显毒性, 而载药载体在激光照射下可快速杀伤肿瘤。上述结果表明, 所构建的温敏胶束在激光触发下可实现肿瘤的快速杀伤, 为肿瘤的特异性治疗提供了可能。
| [1] | Noy R, Pollard JW. Tumor-associated macrophages:from mechanisms to therapy[J]. Immunity, 2014, 41: 49–61. DOI:10.1016/j.immuni.2014.06.010 |
| [2] | Liu J, Detrembleur C, Debuigne A, et al. Poly(acrylic acid)-block-poly(vinyl alcohol) anchored maghemite nanoparticles designed for multi-stimuli triggered drug release[J]. Nanoscale, 2013, 5: 11464–11477. DOI:10.1039/c3nr02861e |
| [3] | Li JZ, Yuan ZQ, Yan M, et al. pH-sensitive micelles loaded paclitaxel using carboxymethyl chitosan-palmitic acid mediated by cRGD[J]. Acta Pharm Sin (药学学报), 2016, 51: 642–649. |
| [4] | Yin XL, Zhang B, Liu YJ, et al. Advances in polymer-drug conjugated micelles in the delivery of anticancer drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 710–716. |
| [5] | Guo H, Chen W, Sun X, et al. Theranostic magnetoliposomes coated by carboxymethyl dextran with controlled release by low-frequency alternating magnetic field[J]. Carbohydr Polym, 2015, 118: 209–217. DOI:10.1016/j.carbpol.2014.10.076 |
| [6] | Rapoport N. Ultrasound-mediated micellar drug delivery[J]. Int J Hypertherm, 2012, 28: 374–385. DOI:10.3109/02656736.2012.665567 |
| [7] | Talelli M, Hennink WE. Thermosensitive polymeric micelles for targeted drug delivery[J]. Nanomedicine, 2011, 6: 1245–1255. DOI:10.2217/nnm.11.91 |
| [8] | He S, Tourkakis G, Berezin O, et al. Temperature-dependent shape-responsive fluorescent nanospheres for image-guided drug delivery[J]. J Mater Chem C, 2016, 4: 3028–3035. DOI:10.1039/C6TC00122J |
| [9] | Seuring J, Agarwal S. Polymers with upper critical solution temperature in aqueous solution[J]. Macromol Rapid Commun, 2012, 33: 1898–1920. DOI:10.1002/marc.v33.22 |
| [10] | Huang G, Li H, Feng ST, et al. Self-assembled UCST-type micelles as potential drug carriers for cancer therapeutics[J]. Macromol Chem Phys, 2015, 216: 1014–1023. DOI:10.1002/macp.v216.9 |
| [11] | Li WS, Huang LW, Ying XY, et al. Antitumor drug delivery modulated by a polymeric micelle with an upper critical solution temperature[J]. Angew Chem Int Ed, 2015, 54: 3126–3131. DOI:10.1002/anie.201411524 |
| [12] | Huang DH, Qi XY, Ge YR, et al. Application of magnetic iron oxide nanoparticles in magnetic resonance/photothermal dual-modal imaging[J]. Acta Pharm Sin (药学学报), 2017, 52: 481–487. |
| [13] | Hao YW, Zhang BX, Zheng C, et al. The tumor-targeting core-shell structured DTX-loaded PLGA@Au nano-particles for chemo-photothermal therapy and X-ray imaging[J]. J Control Release, 2015, 220: 545–555. DOI:10.1016/j.jconrel.2015.11.016 |
| [14] | Moon HK, Lee S, Choi HC. In vivo near-infrared mediated tumor destruction by photothermal effect of carbon nanotubes[J]. ACS Nano, 2009, 3: 3707–3713. DOI:10.1021/nn900904h |
| [15] | Zhou M, Song SL, Zhao J, et al. Theranostic CuS nanoparticles targeting folate receptors for PET image-guided photothermal therapy[J]. J Mater Chem B, 2015, 3: 8939–8948. DOI:10.1039/C5TB01866H |
| [16] | Zheng MB, Yue CX, Ma Y, et al. Single-step assembly of DOX/ICG loaded lipid-polymer nanoparticles for highly effective chemo-photothermal combination therapy[J]. ACS Nano, 2013, 7: 2056–2067. DOI:10.1021/nn400334y |
| [17] | Tang JJ, Mei L, Yu QW, et al. Preparation and evaluation of anti-tumor metastasis of self-assembly micelles loaded with indocyanine green in vitro[J]. Acta Pharm Sin (药学学报), 2017, 52: 1933–1941. |
 2018, Vol. 53
2018, Vol. 53


