2. 中国药科大学 药剂学教研室, 江苏 南京 210009
2. Department of Pharmaceutics, China Pharmaceutical University, Nanjing 210009, China
活性成分的低溶解度被认为是当今药物研发与制剂的最大挑战, 据统计超过75%候选药物为水难溶性化合物[1]。一直以来, 寻找和开发有效的方法来改善此类药物的溶解度和溶出度是研究的热点之一。共无定形物是近年来研究的一种新型混合体系的固体形态, 是指将活性药物成分(active pharmaceutical ingredient, API)与其他生理上可接受的小分子物质(药用辅料或另一种API)通过氢键等非共价键、离子键或无相互作用力形成的多组分单相无定形体系[2]。研究发现共无定形可显著提高难溶性药物的水溶性及溶出速率, 如瑞格列奈-糖精共无定形[3]、盐酸鲁拉西酮-糖精共无定形[4]、盐酸鲁拉西酮-瑞格列奈共无定形[5]、吲哚美辛-雷尼替丁共无定形[6]和萘普生-西咪替丁共无定形[7]等。
他达拉非(tadalafil, TD, 图 1左)通过抑制5型磷酸二酯酶(PDE5)使细胞内cGMP水平提高, 引起平滑肌松弛与血管舒张, 临床用于治疗阴茎勃起功能障碍(erectile dysfunction, ED)。然而, 由于TD水溶性极差(约2 μg·mL-1), 溶解度成为其体内吸收的限制因素[8, 9]。达泊西汀(dapoxetine, DP, 图 1右)是目前治疗男性早泄(premature ejaculation, PE)的首选药物。研究发现患有ED的男性伴随PE的比例相当大, 32% PE患者同时被报道患有ED, 44% ED患者伴随PE[10], 两者的联合用药具有较好的临床应用价值。
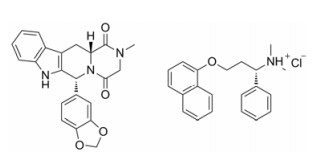
|
Figure 1 Chemical structures of tadalafil (TD, left) and dapoxetine (DP, right) |
一般认为氢键是共无定形形成中最重要的作用力。由图 1可知, TD结构中酰胺上的羰基是氢键的受体官能团, 达泊西汀分子中的N+-H可作为氢键供体。两者有潜在形成共无定形的可能。本研究致力于将TD和DP制成共无定形, 旨在通过该体系提高TD晶体的溶解度及溶出度。
材料与方法试药和试剂 他达拉非(纯度: 99.6%, 济南联成医药科技开发有限公司); 达泊西汀(纯度: 99%, 武汉远成共创科技有限公司); 乙腈(色谱纯, 上海安谱科学仪器公司); 实验用水为Milli-Q水纯化系统(美国Millipore公司)制得; 其余试剂均为分析纯。
主要仪器 D8 Advance X射线衍射仪(德国Burker AXS公司); DSC 204 F1 Phoenix差示扫描热分析仪(德国Netzsch公司); Nicolet Impact 410型红外光谱仪(美国Thermo Fisher Scientific公司); 旋转蒸发仪(RE-501, 郑州华特仪器设备有限公司); 智能溶出仪(RC-806, 天津天大天发科技有限公司); 高效液相色谱仪(Agilent1260, DAD检测器, 美国安捷伦科技公司); Lab Solution CS工作站网络版(日本Shimadzu公司)。
Flory-Huggins相互作用参数(χ) Flory-Huggins理论最初用于预测二元系统中聚合物和小分子的热力学混溶性[11], 近年来, 也被应用于小分子多元系统相容性及相稳定性的预测[12, 13]。作者运用Material Studio软件的Forcite模块对TD和DP进行结构优化, 得到全局最小的构象, 其中力场设置为COMPASS, 精确度设置为ultra-fine。随后, 应用Blends模块计算两组分χ。该理论认为当χ小于或接近0时, 两组分相容性较好, 为单相体系; 反之则易发生相分离。
Hildebrand溶解度参数 Hildebrand溶解度参数是表征分子间相互作用强度特征的重要参数。Hildebrand等[14]将溶解度参数定义为物质内聚能密度的平方根。其公式如下:
| $ \delta = {(E/V)^{0.5}} = {({U_{\text{m}}}/{V_{\text{m}}})^{0.5}} $ |
其中, E代表内聚能(cal·mol-1), V代表体积(cm3·mol-1), 且E和V分别代表构成分子的各基团的能量和体积的累计值; Um代表聚合物的摩尔蒸发能; Vm代表聚合物一个重复单元的摩尔体积。为了能够简单快捷地得到溶解度参数, 采用Small[15]摩尔基团引力常数法, 根据各原子或基团的内聚能和摩尔体积进行加和计算TD与DP的溶解度参数(δ)。研究发现, 当两种物质之间的溶解度参数差值(Δδ) < 7.5时, 两者容易混溶; 当Δδ > 7.5时, 两者部分混溶或完全不混溶。
TD-DP共无定形的制备 称取TD原料约228 mg、DP原料约200 mg (摩尔比为1:1)至100 mL梨形瓶中, 加入丙酮30 mL, 室温搅拌使溶解。置55 ℃水浴中减压旋转蒸发溶剂, 得到白色泡沫状固体产物, 过80目筛, 室温下置P2O5干燥器中干燥, 备用。
实验中采取熔融冷却法、旋转蒸发溶剂法和球磨法等尝试制备TD和DP各自的单独无定形, 结果未能获得。
固态表征
粉末X射线衍射(PXRD) 采用X射线衍射仪, 以Cu-Kα靶为发射源, 波长为0.154 06 nm。将样品置于铝架上, 设置管压50 kV, 管流50 mA, 步长0.02°, 扫描速度2°·min-1, 扫描范围5~45°/2θ。数据用Origin (version 8.0)软件分析。
差示扫描量热分析(DSC) 采用差示扫描热分析仪, 将样品置于铝坩埚内, 升温速率为10 ℃·min-1, 温度范围25~300 ℃。数据用NETZSCH-Proteus热分析软件(version 4.2)处理。
傅里叶变换红外光谱(FTIR) 采用红外光谱仪, 将样品与KBr混合并压成薄片, 扫描范围为4 000~400 cm-1。数据经Nicolet Omnic红外光谱处理软件(version 8.0)处理。
TD和DP的含量测定 采用Agilent 1260 Infinity色谱系统, Ultimate Lp-C8色谱柱(150 mm × 4.6 mm, 5 μm), 柱温30 ℃; 以乙腈: 0.01%三氟乙酸水溶液(50:50)为流动相; 流速1.0 mL·min-1; 进样量10 μL; 检测波长为285 nm。在所用色谱条件下, TD和DP实现基线分离(分离度R > 1.5)。TD质量浓度在0.5~25 μg·mL-1, DP质量浓度在10~200 μg·mL-1内, 相关系数(r)均大于0.999, 线性关系良好。两者最低浓度值的重复性RSD分别为2.12%和3.01%, 最高浓度值的重复性RSD则为0.72%和0.88%。此外, TD和DP的回收率均在98%~102%之间。说明本法重复性良好、准确度高。
过饱和条件下溶出曲线 按照《中国药典》2015年版溶出度与释放度测定法第三法(小杯法)装置, 以水、0.01 mol·L-1 HCl、pH 4.5和pH 6.8磷酸盐缓冲液150 mL为溶出介质, 转速100 r·min-1, 温度37 ℃。取过量样品置于溶出介质中, 分别于2、5、10、15、30、60和180 min取样3 mL, 并及时补充3 mL空白介质, 经微孔滤膜滤过, 取续滤液进样, HPLC测定样品的溶出度。各组实验平行操作3次。
物理稳定性研究
动态吸湿 依照《药物引湿性试验指导原则》, 取数个干燥的具塞玻璃称量瓶, 于实验前一天置于适宜的(25 ± 1) ℃、(80 ± 2) %相对湿度(RH)恒温干燥器中, 24 h后精密称重(m1)。分别称取各样品适量平铺于干燥量瓶内, 精密称重(m2)。将称量瓶依次置于盛有KOH (8% RH)、K2CO3 (43% RH)、NaNO2 (65% RH)、NaCl (75% RH)、KCl (85% RH)和KNO3 (92.5% RH)饱和溶液的干燥器中各24 h。每次改变湿度条件时均精密称重(m3)。每组实验平行做3份。质量变化(mass change, MC)百分比计算如下:
| $ {\text{MC}}\left( \% \right) = \frac{{\left( {{m_3} - {m_2}} \right)}}{{\left( {{m_2} - {m_1}} \right)}} \times 100\% $ |
稳定性 将新鲜制备的TD-DP共无定形过80目筛后置于60 ℃烘箱10天; 同时放置于25 ℃/60% RH和40 ℃/75% RH恒温恒湿箱中, 分别于30和90天后取出, 通过PXRD和DSC分析测定样品的物理稳定性。
结果与讨论 1 共无定形相互作用力的预测Material Studio软件模拟计算得到TD与DP之间χ为-15.27, 远小于0, 说明为放热混合。与单独组分间相比, 两者存在更强的相互作用[12], 氢键模拟结果如图 2所示。根据基团贡献法, TD和DP化学结构中各原子或基团的内聚能和摩尔体积如表 1、2所示[16]。经计算TD与DP的Δδ为0.54, 远小于7.5。表明二者互溶效果好, 旋蒸过程中在分子水平上能够充分均匀混合。这也是两种组分之间能够产生分子间作用力的前提条件。
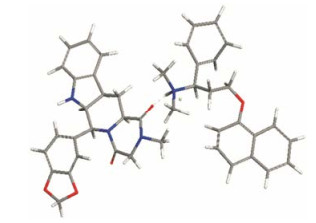
|
Figure 2 Hydrogen bond interaction of TD and DP |
| Table 1 Calculation of solubility parameter for TD |
| Table 2 Calculation of solubility parameter for DP |
各样品的PXRD结果如图 3所示。TD晶体的特征衍射峰为7.34°、10.68°、12.61°, 13.54°、14.60°、15.63°、18.50°、21.74°、24.24°和25.07°/2θ, 与专利[17]所述一致。DP晶体在2θ为6.55°、14.59°、15.29°、19.12°、22.89°和25.53°处具有特征衍射峰。晶体物理混合物是二者晶体图谱的简单叠加。而TD和DP的共旋蒸产物仅观察到一个较大的衍射环, 衍射图谱呈弥散状, 表明该旋蒸产物为无定形态。

|
Figure 3 X-ray diffractograms for crystalline TD (a), crystalline DP (b), TD-DP (1:1) physical mixture (c) and coamorphous TD-DP (d) |
各样品的DSC结果如图 4所示。TD晶体和DP晶体分别在302.2 ℃和181.9 ℃具有单一尖锐的吸热熔融峰。晶体物理混合物在167.4 ℃处有1个吸热峰, 推测二者在加热过程中存在相互作用可能形成了共晶或低共熔物。TD-DP共无定形物在103.9 ℃有单一的玻璃化转变温度(Tg), 表明其为单一的无定形态; 此外, TD和DP本身在该条件下不能形成单独的无定形, 因此, 不可能是两者单独无定形的混合物。随后, 共无定形在164.2 ℃左右出现小的放热峰, 这可能是转晶引起。

|
Figure 4 Differential scanning calorimetry (DSC) thermograms for crystalline TD (a), crystalline DP (b), TD-DP (1:1) physical mixture (c) and coamorphous TD-DP (d) |
理论上来说, 一般选取易形成分子间作用力的供氢体与受氢体等官能团来研究共无定形体系中分子间作用力, 如C=O、N-H、O-H等, 故选取3 000~3 500 cm-1 (νN-H, νO-H)及1 600~ 1 800 cm-1 (νC=O)为主要研究对象。如图 5所示, TD晶体中的仲胺νN-H峰位于3 326.8 cm-1, 内酰胺的νC=O和νC=C在1 677.3和1 647.6 cm-1, 表现为尖锐的双峰, 与文献[18]报道一致。DP分子中叔胺N与盐酸解离的氢离子形成N+-H, 其νN+-H峰位于2 447.0和2 543.1 cm-1, 1 576.5 cm-1为苯环骨架的伸缩振动峰。

|
Figure 5 Fourier transform infrared spectroscopy (FTIR) spectra for crystalline TD (a), crystalline DP (b), TD-DP (1:1) physical mixture (c) and coamorphous TD-DP (d) |
物理混合物的红外图谱是单组分晶体谱图的简单叠加, 具有单组分的特征吸收峰, 而共无定形化后红外图谱发生明显变化。首先, DP中νN+-H峰几乎消失, TD的内酰胺νC=O和νC=C由双峰变为单峰同时蓝移至1 661.6 cm-1, 峰形略变钝。表明TD分子中的C=O与DP分子的N+-H可能形成了分子间氢键, 这与图 2结果一致; 其次, TD的仲胺νN-H峰变宽, 在3 398.7 cm-1出现一个小肩峰, 而3 441.7 cm-1处的钝峰, 推测可能为共无定形体系中游离的νN-H峰。这种峰形宽化及峰位移动现象主要是因为晶体药物在形成无定形态的过程中分子重排导致化学环境发生改变的结果。
3 过饱和溶出曲线无定形属于热力学亚稳态体系, 在溶出过程中易发生相转变[19]。因此, 研究其在水性介质中的溶出状态十分必要。
各样品在过饱和状态下的释放量-时间曲线如图 6所示。其中, TD晶体在不同介质中的浓度均随时间的推移而缓慢增加, 且不具有pH依赖性。物理混合物和共无定形在不同介质中均表现出优于晶体的溶出优势, 但却具有不同的溶出行为。在水和0.01 mol·L-1 HCl介质中, 共无定形快速达到过饱和, 分别于5和10 min达到峰值浓度(2.0 mg, 6.7%; 1.8 mg, 4.5%), 随后迅速降低, 最终在3 h后与晶体物理混合物药物水平保持一致, 类似于Guzmán等[20]提出的“弹簧”现象。这是由于无定形短程无序的结构使其具有较高的自由能和表面积, 溶解过程中无需克服晶格能, 从而实现快速溶出[21]。然而, 一旦与水介质接触, 无定形表面迅速转晶, 阻滞内部药物溶出, 导致结晶速率大于溶出速率[22]。与以上两种介质中溶出现象及溶出曲线不同的是, 在pH 4.5和6.8磷酸盐缓冲液中, 共无定形在溶出区间内保持稳定上升的态势, 约在3 h溶出达到最高值(0.85 mg, 2.1%; 1.52 mg, 3.8%), 然后稳步下降至物理混合物水平(此处未显示)。Guzmán等[20]称之为“降落伞”现象, 主要由于该介质中晶体成核和生长过程较缓慢。由此可知, 将TD制成共无定形后显著提高了TD的溶出速率和溶出量。

|
Figure 6 Dissolved-time profiles of TD in crystalline TD (■), physical mixture (△), and coamorphous (▲) in water (a), 0.01mol·L-1 HCl (b), pH 4.5 (c) and pH 6.8 (d) phosphate buffer. n = 3, x ± s |
水分子作为塑化剂, 可显著降低无定形的Tg, 增强分子流动性, 继而增加了无定形转晶的可能性[23]。因此, 研究无定形的动态吸湿曲线以期为贮存条件提供依据。如图 7a所示, 其中TD晶体几乎无引湿性。而DP晶体在中等湿度条件下快速吸湿, 其临界RH为63.1% (图 7b), 这可能是由于其结构中含有极性亲水基团的原因。将两者制成共无定形物后, 临界RH为75.2%, 相应的晶体物理混合物则为76.9% RH, 相差仅为1.7% RH, 说明两者引湿性不具有显著性差异(图 7c)。但当RH大于65%时, 共无定形物的吸湿速率和吸湿量均明显大于晶体物理混合物(图 7d)。由于无定形体系的体积大、密度小和内部疏松多孔, 因此很容易吸附空气中的水分。

|
Figure 7 Dynamic hygroscopic profiles of crystalline TD (a), crystalline DP (b), physical mixture (c), and coamorphous system (d). n = 3, x ± s. RH: Relative humidity |
无定形药物在储藏过程中, 除受到湿度影响外, 还可能受到温度、外力等的影响发生转晶, 甚至导致药物临床药效的改变。因此, 通过研究其贮存期间的稳定性, 从而采取一些措施来避免或减缓转晶的发生是非常必要的。TD-DP共无定形物在稳定性研究期间内的PXRD和DSC图谱如图 8, 9所示。共无定形在25 ℃/60% RH及40 ℃/75% RH条件下分别放置90和30天后PXRD图谱与0天样品无差异, 无明显的衍射峰出现, 样品依然处于无定形态。同时DSC谱图上仅显示Tg的微小差异, 表明体系仍为单相共无定形态, 稳定性较好。随着温度和湿度升高, 转晶速率加快, 在40 ℃/75% RH条件下放置到90天后, 共无定形几乎完全转晶, 其DSC曲线与晶体物理混合物一致。而当温度升高至60 ℃时, 10天后即在不同的2θ处出现强度各异的TD或DP晶体衍射峰, 说明此时共无定形已有部分转晶。由此可知, 在贮存期间, 无定形的稳定性通常是温度、湿度和时间3种因素共同作用的结果。因此, 储存中控制低温和低湿条件可有效保证共无定形的稳定性。
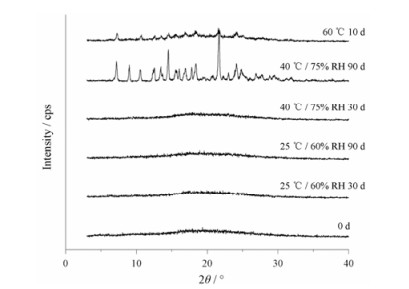
|
Figure 8 Powder X-ray diffraction (PXRD) patterns of coamorphous TD-DP in different storage conditions |

|
Figure 9 DSC thermograms of coamorphous TD-DP in different storage conditions |
本研究采用减压旋转蒸发溶剂法成功制得TD-DP共无定形。与单独TD晶体相比, 共无定形明显提高了其溶解度及溶出度, 同时由于DP晶体的存在使之转晶后仍保持溶出优势, 但对DP晶体无改善。稳定性研究表明, 共无定形在室温条件下, 低湿度储存将有助于提高TD-DP共无定形体系的稳定性。本研究为难溶性药物提高溶解溶出度以及联合用药提供了新思路。
| [1] | Di L, Fish PV, Mano T. Bridging solubility between drug discovery and development[J]. Drug Discov Today, 2012, 17: 486–495. DOI:10.1016/j.drudis.2011.11.007 |
| [2] | Guo HH, Miao NN, Li TF, et al. Pharmaceutical coamorphous-a newly defined single-phase amorphous binary system[J]. Prog Chem (化学进展), 2014, 26: 478–486. |
| [3] | Gao Y, Liao J, Qi X, et al. Coamorphous repaglinide-saccharin with enhanced dissolution[J]. Int J Pharm, 2013, 450: 290–295. DOI:10.1016/j.ijpharm.2013.04.032 |
| [4] | Qian S, Heng WL, Wei YF, et al. Coamorphous lurasidone hydrochloride-saccharin with charge-assisted hydrogen bonding interaction shows improved physical stability and enhanced dissolution with pH-independent solubility behavior[J]. Cryst Growth Des, 2015, 15: 2920–2928. DOI:10.1021/acs.cgd.5b00349 |
| [5] | Qian S, Li Z, Heng WL, et al. Charge-assisted intermolecular hydrogen bond formed in coamorphous system is important to relieve the pH-dependent solubility behavior of lurasidone hydrochloride[J]. RSC Adv, 2016, 6: 106396–106412. DOI:10.1039/C6RA18022A |
| [6] | Chieng N, Aaltonen J, Saville D, et al. Physical characterization and stability of amorphous indomethacin and ranitidine hydrochloride binary systems prepared by mechanical activetion[J]. Eur J Pharm Biopharm, 2009, 71: 47–54. DOI:10.1016/j.ejpb.2008.06.022 |
| [7] | Allesø M, Chieng N, Rehder S, et al. Enhanced dissolution rate and synchronized release of drugs in binary systems through formulation:amorphous naproxen-cimetidine mixtures prepared by mechanical activation[J]. J Control Release, 2009, 136: 45–53. DOI:10.1016/j.jconrel.2009.01.027 |
| [8] | Zalit I, Pal B. Tadalafil solid composites: US, 2008009502A1[P]. 2008-01-10. |
| [9] | Hamishehkar H, Khoshbakht M, Jouyban A, et al. The relationship between solubility and transdermal absorption of tadalafil[J]. Adv Pharm Bull, 2015, 5: 411–417. DOI:10.15171/apb.2015.056 |
| [10] | Dresser MJ, Desai D, Gidwani S, et al. Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors[J]. Int J Impot Res, 2006, 18: 104–110. DOI:10.1038/sj.ijir.3901420 |
| [11] | Marsac PJ, Shamblin SL, Taylor LS. Theoretical and practical approaches for prediction of drug-polymer miscibility and solubility[J]. Pharm Res, 2006, 23: 2417–2426. DOI:10.1007/s11095-006-9063-9 |
| [12] | Pajula K, Taskinen M, Lehto VP, et al. Predicting the formation and stability of amorphous small molecule binary mixtures from computationally determined Flory-Huggins interaction parameter and phase diagram[J]. Mol Pharm, 2010, 7: 795–804. DOI:10.1021/mp900304p |
| [13] | Löbmann K, Laitinen R, Grohganz H, et al. A theoretical and spectroscopic study of co-amorphous naproxen and indomethacin[J]. Int J Pharm, 2013, 453: 80–87. DOI:10.1016/j.ijpharm.2012.05.016 |
| [14] | Hildebrand JH, Scott RL. The Solubility of Non-electrolytes[M]. 3rd ed. New York: Reinhold, 1950. |
| [15] | Small PA. Some factors affecting the solubility of polymers[J]. J Chem Technol Biotechnol, 1953, 3: 71–80. |
| [16] | Fedors RF. A method for estimating both the solubility parameters and molar volumes of liquids[J]. Polym Eng Sci, 1974, 14: 147–154. DOI:10.1002/(ISSN)1548-2634 |
| [17] | Wizel S, Krochmal B, Givant A, et al. Tadalafil crystal forms and processes for preparing them: US, 2006111571A1[P]. 2006-05-25. |
| [18] | Krupa A, Descamps M, Willart JF, et al. High energy ball milling and supercritical carbon dioxide impregnation as co-processing methods to improve dissolution of tadalafil[J]. Eur J Pharm Sci, 2016, 95: 130–137. DOI:10.1016/j.ejps.2016.05.007 |
| [19] | Williams HD, Trevaskis NL, Charman SA, et al. Strategies to address low drug solubility in discovery and development[J]. Pharmacol Rev, 2013, 65: 315–499. DOI:10.1124/pr.112.005660 |
| [20] | Guzmán HR, Tawa M, Zhang Z, et al. Combined use of crystalline salt forms and precipitation inhibitors to improve oral absorption of celecoxib from solid oral formulations[J]. J Pharm Sci, 2007, 96: 2686–2702. DOI:10.1002/jps.20906 |
| [21] | Hao TY, Wei YF, Qian S, et al. Advances in strategies of improving solubility and permeability of taxanes[J]. Acta Pharm Sin (药学学报), 2018, 53: 54–61. |
| [22] | Alonzo DE, Zhang GG, Zhou D, et al. Understanding the behavior of amorphous pharmaceutical systems during dissolution[J]. Pharm Res, 2010, 27: 608–618. DOI:10.1007/s11095-009-0021-1 |
| [23] | Hancock BC, Zografi G. The relationship between the glass-transition temperature and the water-content of amorphous pharmaceutical solids[J]. Pharm Res, 1994, 11: 471–477. DOI:10.1023/A:1018941810744 |
 2018, Vol. 53
2018, Vol. 53


