高脂血症是由多种原因导致的血浆中总胆固醇(TC)、甘油三脂(TG)与低密度脂蛋白胆固醇(LDL-C)过高的脂质代谢紊乱疾病[1], 可增加多种心血管疾病的患病风险[2], 如中风、冠心病、心肌梗死等[3]。IMM-H007 (图 1)是中国医学科学院药物研究所从天然产物虫草素中提取并经过结构改造获得的新型调血脂化合物[4], 药效实验[5]和毒理学研究[6]表明IMM-H007主要通过激活腺苷酸活化蛋白激酶(AMPK)发挥良好的调血脂作用, 且安全性较好, 具有良好的开发前景。
|
Figure 1 The structures of IMM-H007, M1, MP and WS070119 |
在金黄地鼠口服IMM-H007后体内药代动力学研究基础上[7], 本研究以恒河猴为研究对象, 建立了IMM-H007及活性代谢产物M1和MP在恒河猴全血中HPLC-MS/MS定量测定方法, 并应用该方法研究了恒河猴单次口服不同剂量IMM-H007后体内药代动力学特征。
材料与方法药品和试剂 IMM-H007、M1、MP及内标WS070119均由中国医学科学院药物所合成[8, 9] (纯度分别为99.7%、99.5%、97.0%、99.2%), IMM-H007及代谢产物的化学结构如图 1所示。甲酸、甲醇、乙腈均为色谱纯(Merck, USA), 实验用水由Milli-Q制备, 其他化学试剂均为分析纯。
仪器设备 API4000质谱仪(美国AB公司), 包括ESI源、质谱泵及Analysist1.5.2数据处理系统; 岛津LC-30A液相色谱仪, 包括在线自动脱气装置; Thermo高速台式离心机; MVS-1型涡旋混合器(北京北德化学仪器厂)等。
实验动物 健康恒河猴8只, 雌雄各半, 体重5.0~5.5 kg, 许可证号为SCXK (京) 2015-0011, 购自北京协尔鑫生物资源研究所有限责任公司。恒河猴单笼饲养, 自由摄水, 室温18~22 ℃, 日温差3 ℃, 湿度50%~60%, 光照12 h明暗交替, 换气次数为每小时20次, 气流速度0.1~0.2 m·s-1, 空气洁净度为1 000级, 氨浓度≤14 mg·m-3, 噪声≤60分贝, 工作照度为150~300 LX, 动物照度为100~200 LX。猴笼每日清洗2次, 每两周采用过氧乙酸消毒1次。
HPLC-MS/MS条件 色谱条件:色谱柱为Capcell PAK ADME Column (2.1 mm × 100 mm, 3 μm, Shiseido, Japan); 柱温为35 ℃; 进样器温度为15 ℃; 流动相为A (0.1%甲酸水):B (0.1%甲酸甲醇), 梯度洗脱程序: 0~1 min, 76% A; 1~3.5 min, 5% A; 4.5~5.5 min, 60% A; 6.5~7.5 min, 20% A; 8.5~9.5 min, 60% A, 10.5~11.5 min, 20% A; 12.5~13.5 min, 60% A; 14.5~15 min, 20% A; 15.5 min, 60% A, 15.5~19 min, 40% A; 19~24 min, 76% A; 流速为0.25 mL·min-1; 进样量为2 μL。质谱条件:电喷雾离子源(ESI); 喷雾电压为5.5 kV, 碰撞气为10 psi (1 psi ≈ 6.9 kPa), CUR Gas为25 psi, Gas1与Gas2均为50 psi, 离子源温度为550 ℃。反应以阳离子方式检测, 扫描方式选用选择反应离子监测(SRM), 各化合物用于定量分析的选择性反应离子分别为: m/z 486.2→228.1 (IMM-H007, CE: 24 eV), m/z 360.2→228.1 (M1, CE: 25 eV), m/z 440.0→228.1 (MP, CE: 28 eV), m/z 374.0→242.0 (IS, CE: 26 eV)。
标准溶液与质控工作液配制 精密称取IMM-H007、M1及MP对照品适量, 以甲醇溶解定容至1 mg·mL-1作为储备液备用。使用前准确吸取IMM- H007、M1及MP储备液, 用甲醇以梯度稀释法配制标准曲线工作液。IMM-H007标准曲线工作液质量浓度为5 000、2 000、1 000、500、200、100、50、20 ng·mL-1, M1标准曲线工作液质量浓度为10 000、5 000、2 000、1 000、500、200、100、50 ng·mL-1, MP标准曲线工作液质量浓度为50 000、20 000、10 000、5 000、2 000、1 000、250、100 ng·mL-1。以同样方法制备质控标准工作液, IMM-H007质控工作液质量浓度为50、400、4 000 ng·mL-1, M1质控工作液质量浓度为100、800、8 000 ng·mL-1, MP质控工作液质量浓度为200、4 000、40 000 ng·mL-1。
内标溶液配制 精密称取内标WS070119适量, 用甲醇溶解定容至1 mg·mL-1作为内标储备液备用。使用前用乙腈稀释为1 μg·mL-1内标工作液。
全血校正曲线与质控样品制备 取肝素抗凝恒河猴空白全血100 μL, 加入不同浓度IMM-H007、M1及MP标准曲线工作液各10 μL、内标工作液10 μL、乙腈160 μL, 配成IMM-H007、M1及MP全血标准曲线样品。IMM-H007标准曲线终质量浓度为500、200、100、50、20、10、5、2 ng·mL-1, M1标准曲线终质量浓度为1 000、500、200、100、50、20、10、5 ng·mL-1, MP标准曲线终质量浓度为5 000、2 000、1 000、500、200、100、25、10 ng·mL-1。涡旋振荡2 min后, 高速离心(14 000 r·min-1, 5 min)两次, 取上清液2 μL进行HPLC-MS分析。质控样品的制备方法同标准曲线, IMM-H007质控样品终质量浓度为5、40、400 ng·mL-1, M1质控样品终质量浓度为10、80、800 ng·mL-1, MP质控样品终质量浓度为20、400、4 000 ng·mL-1。
全血样品处理 取恒河猴新鲜全血100 μL, 加入乙腈190 μL及内标10 μL, 涡旋振荡2 min后, 高速离心(14 000 r·min-1, 5 min)两次, 取上清液2 μL进行HPLC-MS/MS分析。
药代动力学研究 恒河猴药代动力学实验方案经北京协和建昊医药技术开发有限责任公司动物伦理委员会批准实施。8只健康恒河猴, 雌雄各半, 自由饮水与饮食, 实验前禁食12 h, 分别口服不同剂量IMM-H007 (70、210和630 mg·kg-1)混悬液(0.5%羟丙甲纤维素配制)后5、15、30 min、1、2、3、4、6、8、12、24、36、48、72、96和120 h于前肢取血约0.5 mL, 新鲜全血置于含0.5%肝素钠和200 mmol·L-1 NaF的冰浴化离心管中, 取出全血100 μL按照“全血样品处理”方法操作分析。
数据分析 药代动力学参数由Phoenix WinNonLin软件(version 6.3, Certara Corporation, St. Louis, MO)采用非房室模型计算获得。数据以均值±标准差形式表示。
结果 1 方法学确证 1.1 方法专属性本研究考察了恒河猴不同个体空白全血样品、空白全血样品加IMM-H007、M1、MP和内标(IS)、猴生物全血样品的色谱图, 评估全血样品中生物基质对于IMM-H007、M1及MP测定是否存在干扰。空白全血、空白全血加IMM-H007、M1、MP和内标后样品、恒河猴全血样品色谱图见图 2。结果表明, IMM-H007、M1、MP及内标峰形良好, 定量下限信号噪音比大于20, 全血中未见明显杂质干扰, IMM-H007、M1、MP的保留时间分别为3.72、3.35、3.10、3.28 min。

|
Figure 2 Mass chromatograms of IMM-H007, M1, MP and IS. A: Blank Rhesus monkey blood; B: Blank Rhesus monkey blood spiked with IMM-H007 (2 ng·mL-1), M1 (5 ng·mL-1), MP (10 ng·mL-1) and internal standard (WS070119, 100 ng·mL-1); C: Rhesus monkey blood sample from pharmacokinetics study at 5 min after a single oral administration of IMM-H007 (210 mg·kg-1) |
恒河猴全血中IMM-H007、M1及MP与内标的比值与药物浓度线性关系良好, 线性范围分别为2~500 ng·mL-1、5~1 000 ng·mL-1与10~5 000 ng·mL-1, 各化合物拟合校正曲线相关系数(r2)均大于0.99, 可满足恒河猴样品测定灵敏度要求。结果见表 1。
| Table 1 Regression equation of IMM-H007, M1 and MP |
本研究考察了低、中、高3个浓度的恒河猴全血质控样品测定的批内和批间精密度和准确度。同浓度质控样品同批内连续进样5次考察批内精密度, 分析测定3个不同批次的质控样品考察批间精密度。结果表明, 恒河猴高、中、低浓度全血质控样品中IMM-H007、M1及MP测定的批内、批间精密度RSD在1.25%~10.07%之间, 准确度RE在-2.18%~14.25%内, 提示该方法准确、可靠、重现性好。
1.4 回收率和基质效应将IMM-H007、M1、MP高、中、低3个浓度质控样品中的色谱峰面积与空白全血样品处理后的上清液配制的同浓度样品(基质样品)的色谱峰面积进行比较, 计算回收率; 以空白全血样品处理后的上清液配制的样品色谱峰面积与流动相配制的同浓度样品(标准样品)色谱峰面积进行比较, 计算基质效应。结果表明, 恒河猴全血中IMM-H007、M1及MP高、中、低浓度样品的基质因子(基质样品色谱峰面积/标准样品色谱峰面积)在0.99~1.05之间, 回收率为97%~102%。
1.5 稳定性取全血高、中、低3个浓度质控样品, 每个浓度5个平行样品, 分别在冰上放置2 h、反复冻融3次、室温放置24 h、处理后样品进样仓放置48 h、短期放置(-20 ℃放置7天)或长期放置(-80 ℃放置30天、90天)后, 测定IMM-H007、M1及MP浓度, 考察其在样品处理过程中的稳定性。结果表明, 高、中、低浓度全血质控样品经上述方法处置后稳定性良好, 实测数值与预计值偏差均在±15%以内, 表明IMM-H007、M1和MP在上述样品处理及放置过程中均稳定。
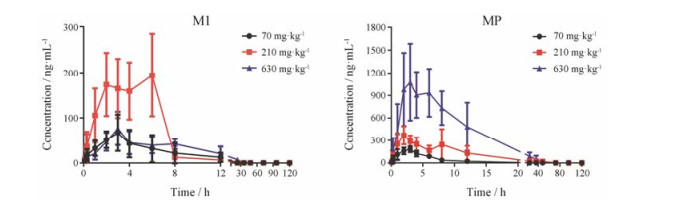
2 恒河猴口服不同剂量IMM-H007后全血药代动力学研究恒河猴口服不同剂量IMM-H007 (70、210、630 mg·kg-1)后各时间点全血药物浓度-时间曲线见图 3, 相关药代动力学参数见表 2、3。结果表明, 恒河猴口服IMM-H007后原形药迅速代谢, 血药浓度低于检测限, 全血中主要以活性代谢产物M1和MP的形式存在。雌性恒河猴口服低、中、高不同剂量IMM-H007后, 代谢产物M1血药浓度-时间曲线下面积AUC0-t分别为286.22 ± 54.9、905.27 ± 274.73、476.59 ± 205.6 h·ng·mL-1, 达峰浓度Cmax分别为49.53 ± 15.54、183.75 ± 61.04、71.65 ± 32.94 ng·mL-1; 代谢产物MP的血药浓度-时间曲线下面积AUC0-t分别为792.89 ± 225.44、3 723.06 ± 1 748.5、13 172.77 ± 5 817.41 h·ng·mL-1, 达峰浓度Cmax分别为164.1 ± 50.05、378 ± 124.49、1 187.25 ± 597.53 ng·mL-1。雄性恒河猴口服低、中、高不同剂量IMM-H007后, 代谢产物M1血药浓度-时间曲线下面积AUC0-t分别为445.64 ± 348.14、1 234.98 ± 553.21、564.72 ± 273.05 h·ng·mL-1, 达峰浓度Cmax分别为93 ± 45.67、262 ± 86.81、86.3 ± 41.74 ng·mL-1; 代谢产物MP的血药浓度-时间曲线下面积AUC0-t分别为1 081.38 ± 399.34、3 656.89 ± 1 822.78、13 632.99 ± 4 641.49 h·ng·mL-1, 达峰浓度Cmax分别为222.25 ± 35.85、504.75 ± 159.04、1 278.75 ± 514.46 ng·mL-1。不同剂量组雌雄动物的药代动力学参数经统计学检验, 未见明显性别差异。MP的体内暴露量明显高于M1, Cmax和AUC与给药剂量呈现一定的比例关系, 基本符合线性动力学特征。
|
Figure 3 Blood concentration-time curves of M1 and MP in rhesus monkeys after a single oral administration of IMM-H007 at 70, 210 and 630 mg·kg-1 |
| Table 2 Mean parameters of M1 in female and male Rhesus monkeys after oral administration of IMM-H007 (70, 210 and 630 mg·kg-1) |
| Table 3 Mean parameters of MP in female and male Rhesus monkeys after oral administration of IMM-H007 (70, 210 and 630 mg·kg-1) |
本研究建立了恒河猴全血样品中同时检测IMM-H007及其代谢产物M1和MP的HPLC-MS/MS测定方法。前期研究表明, IMM-H007的酯键可迅速被全血中的酯酶水解, 生成活性代谢产物M1和MP, 因此在采血管中加入200 mmol·L-1 NaF[10]以抑制样品中IMM-H007的生物转化从而保证浓度测定的准确性。此外, 由于血中生物基质影响, IMM-H007及所测代谢产物用原有金黄地鼠HPLC-MS/MS测定方法分析极易产生残留且峰形较差, 因此本文建立了新的恒河猴生物样品HPLC-MS/MS测定方法。经过实验条件优化与反复尝试, 最终选用Capcell PAK ADME柱改善M1及MP峰形; 用新洗液(含0.5%甲酸甲醇)代替原洗液(甲醇-水, 3:2)可降低MP残留, 结合反复梯度洗脱[11]及高比例有机相长时间冲洗的方法可有效解决MP高残留问题[12, 13]。虽然延长了分析时间, 但是在保证灵敏度的前提下, 各待测物残留量均小于最低定量限峰面积的10%, 满足新药测定方法学要求。
研究发现, IMM-H007在恒河猴体内药代动力学存在较大个体差异, 无明显性别差异。恒河猴口服IMM-H007后体内原形药浓度较低, 体内主要为活性代谢产物M1与MP, 其中MP暴露量明显高于M1。前期药效研究表明MP具有良好药效作用, 提示MP可能是IMM-H007体内发挥药效作用的主要活性形式。MP在恒河猴体内的达峰浓度和暴露量与给药剂量呈现一定的比例关系, 但中剂量组到高剂量组Cmax和AUC的增幅高于低剂量组到中剂量组的增幅。经分析, 出现该结果可能主要有两方面原因:一是随给药量增加, 加大了药物在吸收部位的浓度差, 促进了被动扩散, 从而增加了体内暴露量。二是前期实验证明, IMM-H007、M1与MP均为P-糖蛋白(P-gp)底物, 高剂量给药可能造成药物外排转运的饱和, 从而减少药物外排的比例, 提高体内血药浓度和暴露量。此外, 另一代谢物M1呈现随剂量增加体内暴露量先升高再降低的过程, 低剂量与高剂量体内药物浓度水平相当, 中剂量体内药物浓度最高, 提示M1向MP的转化可能不存在特定比例, 高剂量给药可能影响血液中酶活性与含量水平, 导致M1转化为MP的比例升高, 进一步机制还有待研究。
前期药理研究表明, 恒河猴与金黄地鼠的有效剂量范围存在一定差异。恒河猴给药70 mg·kg-1方可发挥药效, 远远高于依据金黄地鼠药效起始剂量和体表面积折算得到的恒河猴药效起始剂量(17.5 mg·kg-1)。本研究表明, 与啮齿类动物金黄地鼠相比[7], IMM-H007及其代谢产物在恒河猴体内血药浓度和暴露量均较低:恒河猴口服低剂量(70 mg·kg-1) IMM-H007后MP体内暴露量低于金黄地鼠口服低剂量(50 mg·kg-1) IMM-H007后MP暴露量, 而恒河猴口服高剂量(630 mg·kg-1) IMM-H007与金黄地鼠口服中剂量(450 mg·kg-1) IMM-H007后MP暴露量相当, 提示除去不同种属动物病理模型的差异外, IMM-H007及其代谢产物体内暴露量与药效也可能存在一定相关性, 相关机制有待进一步研究。
| [1] | Larsen MK, Nissen PH, Kristensen IB, et al. Sudden cardiac death in young adults:environmental risk factors and genetic aspects of premature atherosclerosis[J]. J Forensic Sci, 2012, 57: 658–662. DOI:10.1111/jfo.2012.57.issue-3 |
| [2] | Wang Z, Wang X, Qu K, et al. Binding of cordycepin monophosphate to AMP-activated protein kinase and its effect on AMP-activated protein kinase activation[J]. Chem Biol Drug Des, 2010, 76: 340–364. DOI:10.1111/j.1747-0285.2010.01019.x |
| [3] | Ma A, Wang J, Yang L, et al. AMPK activation enhances the anti-atherogenic effects of high density lipoproteins in apoE-/- mice[J]. J Lipid Res, 2017, 58: 1536–1547. DOI:10.1194/jlr.M073270 |
| [4] | Huang ZL, Liu R, Bai XY. Protective effects of the novel adenosine derivative WS0701 in a mouse model of posttraumatic stress disorder[J]. Acta Pharmacol Sin, 2014, 35: 24–32. |
| [5] | Lian Z, Li Y, Gao J, et al. A novel AMPK activator, WS070117, improves lipid metabolism discords in hamsters and HepG2 cells[J]. Lipids Health Dis, 2011, 10: 67. DOI:10.1186/1476-511X-10-67 |
| [6] | Guo P, Lian ZQ, Sheng LH, et al. The adenosine derivative 2', 3', 5'-tri-O-acetyl-N6-(3-hydroxylaniline) adenosine activates AMPK and regulates lipid metabolism in vitro and in vivo[J]. Life Sci, 2012, 90: 1–7. DOI:10.1016/j.lfs.2011.09.001 |
| [7] | Jia Y, Wang B, Wu X, et al. Simultaneous quantification of 2', 3', 5'-tri-O-acetyl-N6-(3-hydroxylaniline) adenosine and its principal metabolites in hamster blood by LC-MS/MS and its application in pharmacokinetics study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1022: 46–53. DOI:10.1016/j.jchromb.2016.04.004 |
| [8] | Wen XZ, Hong NW, Bo L, et al. The synthesis of the metabolites of 2', 3', 5'-tri-O-acetyl-N6-(3-hydroxyphenyl) adenosine (WS070117)[J]. Molecules, 2016. DOI:10.3390/molecules21010008 |
| [9] | Zhang WX, Li B, Wu HN, et al. Synthesis of impurities of the novel cholesterol-lowering drug candidate WS070117[J]. Chin J New Drug (中国新药杂志), 2015, 24: 1166–1170. |
| [10] | Liu Y, He J, Abliz Z, et al. In vitro stability and metabolism of O2', O3', O5'-tri-acetyl-N6-(3-hydroxylaniline) adenosine in rat, dog and humanplasma:chemical hydrolysis and role of plasma esterases[J]. Xenobiotica, 2011, 41: 549–560. |
| [11] | Li RS, Li QS, Huang YR, et al. Determination of batifeiban in macaque plasma by LC-MS/MS and its pharmacokinetic study[J]. Chin J New Drug (中国新药杂志), 2012, 21: 1798–1802. |
| [12] | Wu JF, Chen LX, Luo GA, et al. Recent advances in the application of capillary electrophoresis in pharmaceutical analysis[J]. Acta Pharm Sin (药学学报), 2006, 41: 385–389. |
| [13] | Song JK, Zhang W, Zhang WK, et al. Pharmacokinetics of salvianolic acid A after single intravenous administration in Rhesus monkey[J]. Acta Pharm Sin (药学学报), 2015, 50: 1142–1147. |
 2018, Vol. 53
2018, Vol. 53


