2. 南京中医药大学 江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023;
3. 南京中医药大学 中药资源产业化与方剂创新药物国家地方联合工程研究中心, 江苏 南京 210023;
4. 江苏康缘药业股份有限公司, 江苏 连云港 222001
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China;
4. Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China
热毒宁注射液由青蒿、栀子和金银花3味中药组合而成, 主要用于外感风热所致流感、高热不退、咳嗽及上呼吸道感染等症, 临床上退热作用迅速、抗病毒效果显著[1]。研究表明, 其主要有效成分为京尼平苷、京尼平苷酸、断氧化马钱子苷和绿原酸等[2, 3]。虽有京尼平苷、京尼平苷酸及绿原酸体内代谢的文献报道[4, 5], 但这些报道仅限于对单味药提取物或单体成分的代谢研究, 而热毒宁注射液在体内代谢产物研究尚未见报道。
药物化学结构的多样性和体内生物转化途径的复杂性使得药物代谢产物鉴定研究具有挑战性, 且由于生物样品中代谢产物含量低, 将样品收集再经色谱等方法分离得纯品后鉴定结构的方法, 既费时又费力。LC-MS联用技术由于兼有优秀的色谱分离能力和高灵敏度、高专属的质谱检测能力, 近年来在药物体内过程研究中的应用日益广泛, 其中高分辨质谱的应用使得代谢产物结构推测的可靠性得到极大的提高, 已成为药物代谢产物鉴定的主要方法之一[6, 7]。而高分辨率的线性离子阱-静电轨道阱串联质谱(LTQ-Orbitrap-MS)在线性离子阱灵敏、快速的基础上增加了轨道阱技术的高分辨率、高质量准确度的特点, 可短时间内同时实现母、子离子的高分辨采集和多级质谱碎裂, 更适用于中药复杂物质体系中代谢产物的快速鉴定[8]。本文采用UHPLC串联LTQ-Orbitrap-MS技术研究大鼠注射热毒宁注射液后主要化学成分在其体内代谢产物, 共鉴定出36个代谢物, 为进一步探讨热毒宁注射液的体内过程, 阐明其功效物质基础提供依据。
材料与方法仪器与试药 UltiMate 3000型超高效液相色谱、LTQ-Orbitrap Velos Pro质谱仪(美国Thermo公司); Xcalibur 3.0质谱工作站软件、Metworks 1.3及Mass Frontier 7.0分析软件(美国Thermo公司); DZ 30-32高速离心机(上海安亭科学仪器厂); WH-微型涡旋混合仪(上海沪西分析仪器厂有限公司); 电子天平(BT125, 赛多利斯科学仪器有限公司)。
京尼平苷(批号160729)、京尼平(批号160918)、京尼平苷酸(批号160916)、断氧化马钱子苷(批号160720)、绿原酸(批号160903)均购自上海融禾医药科技有限公司, 纯度均大于98%。热毒宁注射液(批号161010, 10 mL/支)由江苏康缘药业股份有限公司提供, 其中京尼平苷、京尼平苷酸、断氧化马钱子苷、绿原酸含量分别为9.95、0.830、1.13和6.33 mg·mL-1。乙腈、甲酸(色谱级, 德国Merck公司)。
实验动物 清洁级雄性SD大鼠, 约8周龄, 体重(250 ± 10) g, 由南京市江宁区青龙山动物繁殖场提供, 合格证号SCXK (苏) 2017-0001。
UHPLC检测条件 色谱柱: Acquity UPLC BEH T3 (100 mm × 2.1 mm, 1.7 μm)柱; 流动相: 0.1%甲酸(A)-乙腈(B), 洗脱梯度(0~3 min, 1% B; 3~9 min, 1%~10% B; 9~12 min, 10%~20% B; 12~13 min, 20%~25% B; 13~15 min, 25% B; 15~18 min, 25%~40% B; 18~20 min, 40%~99% B); 柱温30 ℃; 流速0.4 mL·min-1, 进样量2 μL。
MS检测条件 电喷雾离子源(ESI), 采用正离子检测模式, m/z采集范围为110~1 000, 采集时间为0.8~20.8 min。主要质谱参数:毛细管温度350 ℃, 蒸发器温度350 ℃, 鞘气流40 kPa, 辅助气流15 kPa, 喷雾电压3.5 V, 源电流100 μA; MS2质谱的触发方式为动态数据依赖分析模式, 选取上一级最高峰进行碰撞诱导碎裂解离碎片扫描(CID), 碰撞能量设定为30%, 以离子阱打拿极检测。
对照品溶液的制备 分别精密称取京尼平苷、京尼平、京尼平苷酸、断氧化马钱子苷、绿原酸10 mg, 甲醇溶解并定容至10 mL得1 mg·mL-1的储备液。
动物分组及给药 SD大鼠15只, 随机分为空白组、血浆组、胆汁组、尿液/粪便组, 空白组6只, 其余每组3只。根据临床剂量, 热毒宁注射液给药剂量为2 mL·kg-1。分别连续3天给予热毒宁注射液及空白组的等体积生理盐水。
生物样品的采集与供试液的制备 大鼠第3天给药前禁食不禁水12 h, 取血浆组于30 min眼眶取血置于预先涂有1%肝素钠生理盐水的EP管中, 离心10 min (4 000 r·min-1), 取上清得血浆样品; 取胆汁组10%水合氯醛麻醉, 胆管插入并固定后即刻给大鼠注射给药, 注射给药后开始收集0~30 min胆汁样品; 取尿液/粪便组分别置于代谢笼, 收集0~12 h的尿液和粪便。以上样品置于-20 ℃保存。
大鼠血浆样品供试液的制备 取血浆样品200 μL混合均匀后, 加入3倍乙腈沉淀蛋白, 涡旋混匀30 s, 离心10 min (12 000 r·min-1), 取上清液于37 ℃氮气吹干, 以5%乙腈复溶, 离心5 min (12 000 r·min-1), 取上清液为血浆样品供试液。
大鼠胆汁、尿液样品供试液的制备 取尿液或胆汁1 mL, 加等体积乙腈, 涡旋混匀30 s, 离心10 min (12 000 r·min-1), 取上清液作为胆汁、尿液样品供试液。
大鼠粪便样品供试液的制备 取碾碎混匀的粪便1 g, 加蒸馏水3 mL溶解, 超声10 min, 取出后离心10 min (12 000 r·min-1), 取上清液, 加入等体积乙腈, 涡旋混匀30 s, 离心5 min (12 000 r·min-1), 取上清液作为粪便样品供试液。
数据处理 利用Metworks 1.3分析软件对空白和给药组的一级质谱进行自动比对, 结合待测化合物元素组成, 在误差小于5 ppm的条件下, 寻找符合代谢修饰的代谢产物准分子离子峰, 结合二级质谱分析代谢物结构特征, 并通过Mass Frontier 7.0谱图解析软件作进一步验证。
结果 1 血浆、胆汁、尿液、粪便UHPLC-LTQ-Orbitrap-MS分析给药血浆、胆汁、尿液、粪便样品正离子条件下原形化合物及其代谢产物总提取离子流图如图 1。

|
Figure 1 Combined ion chromatograms of the original compounds and metabolites in rat plasma, bile, urine and feces |
大鼠体内共鉴定出14个京尼平苷代谢产物, 主要鉴定信息见表 1。
| Table 1 Metabolites of geniposide in rats after Reduning injection. GlucA: Glucuronic acid; Cys: Cysteine |
A0为京尼平苷: m/z 411.124 8为其加钠分子离子峰, m/z 249.072 8为糖苷键断裂的碎片, m/z 231.062 1由其进一步脱水形成, 与对照品相符。A1为京尼平苷苷元与葡萄糖醛酸结合产物: m/z 425.107 5为其加钠分子离子峰, m/z 199.021 7为葡萄糖醛酸正离子, 其余碎片与京尼平苷相同。A2为A1开环产物: m/z 427.120 7为其加钠分子离子峰, m/z 233.078 9为脱葡萄糖和水的碎片。A3-1和A3-2皆为A2去甲酸甲酯和羟基产物: m/z 345.153 7为其加氢分子离子峰, m/z 169.121 8为糖苷键断裂的碎片, m/z 151.111 3由其进一步脱水形成。A4-1和A4-2为半胱氨酸与京尼平苷不同碳位结合的同分异构产物[9]: m/z 492.152 0为其加氢分子离子峰, m/z 330.100 4为糖苷键断裂的碎片, m/z 312.090 0由其进一步脱水形成。A5为京尼平苷去甲氧基产物: m/z 381.114 4为其加钠分子离子峰, m/z 219.065 0为糖苷键断裂的碎片, m/z 201.052 1由其进一步脱水生成。
A6为京尼平: m/z 227.090 9为其加氢分子离子峰, m/z 213.076 2为酯键断裂碎片, m/z 209.080 5为其脱水的碎片, m/z 191.070 3由其进一步脱水产生, 与对照品相符。A7为A6酯键水解产物: m/z 213.075 1为其加氢分子离子峰, m/z 195.065 3为其脱水的碎片, m/z 185.080 8为脱羰基碎片, m/z 151.075 2为其脱水并脱羧碎片。A8为A6氧化脱氢产物: m/z 225.075 2为其加氢分子离子峰, m/z 207.065 1为其脱水的碎片, m/z 195.059 4为脱甲氧基的碎片, m/z 151.075 5由进一步脱羧产生。A9-1和A9-2皆为A6不同位羟基脱水的同分异构产物: m/z 209.080 4为其加氢分子离子峰, m/z 191.070 5为其脱水的碎片, m/z 177.054 3由其去甲基后脱水产生。A10为A6脱甲氧基产物: m/z 197.080 2为其加氢分子离子峰, m/z 179.070 3为脱水的碎片, m/z 169.085 8为其脱羰基的碎片, m/z 151.075 3由其进一步脱水产生。A11为A7开环产物, m/z 215.090 7为其加氢分子离子峰, m/z 197.080 8为脱水的碎片, m/z 169.085 9为脱羰基的碎片。综上, 京尼平苷体内代谢途径见图 2a。
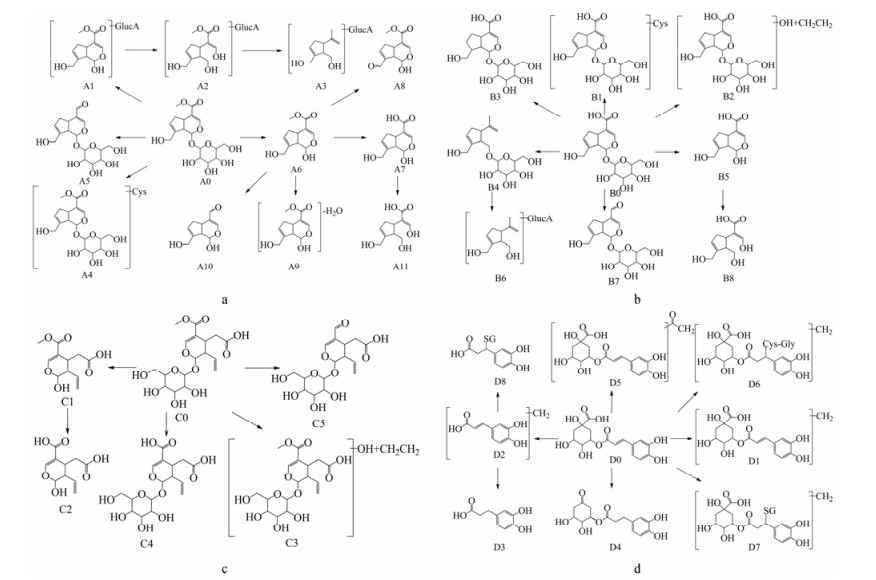
|
Figure 2 The possible metabolic pathways of geniposide (a); geniposidic acid (b); secoxylogain (c); chlorogenic acid (d) in rats |
大鼠体内共鉴定出9个京尼平苷酸代谢产物, 主要鉴定信息见表 2。
| Table 2 Metabolites of geniposidic acid in rats after Reduning injection. The metabolite B5, B6, B7-1, B7-2 and B8 are same with A7, A5, A3-1, A3-2, A11 in the table 1 |
B0为京尼平苷酸: m/z 397.109 0为其加钠分子离子峰, m/z 235.052 6为糖苷键断裂的碎片, m/z 217.047 1由进一步脱水产生, 与对照品相符。B1为半胱氨酸结合产物: m/z 478.136 1为其加氢分子离子峰, m/z 316.076 4为糖苷键断裂的碎片, m/z 298.074 4和m/z 280.063 5由进一步连续脱水产生。B2为羟基化再乙基化产物: m/z 421.168 8为其加氢分子离子峰, m/z 375.125 6为脱乙基和水的碎片, m/z 213.075 7由其进一步脱葡萄糖产生。B3为双键还原产物: m/z 377.144 0为其加氢分子离子峰, m/z 331.138 5为脱羧基的碎片, m/z 215.091 4为糖苷键断裂的碎片, m/z 197.080 8由进一步脱水产生。B4为京尼平苷酸开环后去甲酸甲酯产物: m/z 331.174 1为其加氢分子离子峰, m/z 313.152 6为脱水的碎片, m/z 169.122 3为糖苷键断裂的碎片。B5为B0糖苷键水解产物, B6为B4脱糖与葡萄糖醛酸结合产物, B7-1和B7-2为B0脱羟基产物, B8则为B5开环产物, 产物B5、B6、B7-1、B7-2、B8与京尼平苷产物A7、A5、A3-1、A3-2、A11相同, 仅从结构无法判断基源, 其二级碎片详见表 1。综上, 京尼平苷酸体内代谢途径如图 2b。
2.3 断氧化马钱子苷(C)代谢产物大鼠体内共鉴定出6个断氧化马钱子苷代谢产物, 主要鉴定信息见表 3。
| Table 3 Metabolites of secoxylogain in rats after Reduning injection |
C0为断氧化马钱子苷: m/z 405.138 6为其加氢分子离子峰, m/z 391.119 2为酯键断裂的碎片, m/z 373.121 6由其进一步脱水产生, m/z 243.085 4为糖苷键断裂的碎片, 与对照品相符。C1为断氧化马钱子苷苷元: m/z 243.085 5为其加氢分子离子峰, m/z 225.076 7为脱水的碎片, m/z 207.065 2由其进一步脱水产生。C2为C1酯键水解产物: m/z 229.069 9为其加氢分子离子峰, m/z 211.060 1为脱水的碎片, m/z 201.074 8为脱羰基的碎片。C3-1和C3-2同为不同碳位羟基化再乙基化的同分异构产物: m/z 451.182 3为加氢分子离子峰, m/z 243.086 0为其糖苷断裂后脱水脱羰基的碎片, m/z 225.112 3由其进一步脱水产生。C4为断氧化马钱子苷酯键水解产物: m/z 391.124 2为其加氢分子离子峰, m/z 373.112 6为其脱水的碎片。C5为去甲氧基产物: m/z 375.127 5为其加氢分子离子峰, m/z 357.113 8为脱水的碎片, m/z 195.065 2由进一步脱葡萄糖产生, m/z 347.133 1为脱羰基的碎片。综上, 断氧化马钱子苷的体内代谢途径如图 2c。
2.4 绿原酸(D)代谢产物大鼠体内共鉴定出12个绿原酸代谢产物, 主要鉴定信息见表 4。
| Table 4 Metabolites of chlorogenic acid in rats after Reduning injection. Cys-Gly: Cysteinylglycine; GSH: Glutathione |
D0为绿原酸: m/z 355.101 6为加氢分子离子峰, m/z 181.049 2为酯键断裂的咖啡酸正离子, m/z 163.038 4由其进一步脱水产生, m/z 149.022 8为再去甲基产生, 与对照品相符。D1-1、D1-2和D1-3同为绿原酸不同位羟基甲基化的同分异构产物: m/z 369.116 9为其加氢分子离子峰, m/z 351.107 0为脱水的碎片, m/z 195.065 1为甲基化咖啡酸正离子, m/z 177.054 2由其进一步脱水产生。D2为甲基化咖啡酸: m/z 195.063 9为其加氢分子离子峰, m/z 163.039 0为其脱甲基和水的碎片, m/z 153.054 6为其脱甲基和脱羰基的碎片。D3为二氢咖啡酸: m/z 183.064 8为其加氢分子离子峰, m/z 165.054 6为脱水的碎片, m/z 137.059 2由进一步脱羰基产生。D4为绿原酸脱羧产物: m/z 311.112 0为其加氢分子离子峰, m/z 183.065 0为二氢咖啡酸正离子, m/z 165.054 4由进一步脱水产生。D5为绿原酸乙酰化产物: m/z 397.111 9为其加氢离子峰, m/z 379.102 4为其脱水碎片, m/z 353.086 7为丢失乙酰基的碎片。
D6-1和D6-2皆为绿原酸不同位羟基甲基化的同分异构体与半胱氨酰甘氨酸结合的产物: m/z 547.157 5为其加氢分子离子峰, m/z 369.118 0为甲基化绿原酸正离子, m/z 351.106 9由其进一步脱水产生, m/z 179.047 9为半胱氨酰甘氨酸正离子。D7-1和D7-2同为绿原酸不同位羟基甲基化的同分异构体与谷胱甘肽结合的产物[10]: m/z676.200 3为其加氢分子离子峰, m/z 369.117 8为甲基化绿原酸正离子, m/z 308.091 0为谷胱甘肽正离子, m/z 233.058 9由其进一步脱甘氨酸产生。D8为甲基化咖啡酸与谷胱甘肽结合产物: m/z 502.147 8为其加氢分子离子峰, m/z 195.064 0为甲基化咖啡酸正离子, 其余碎片与D7相同。综上, 绿原酸体内代谢途径如图 2d。
讨论栀子药材中主要活性成分为环烯醚萜类, 代表性成分为含量达3.06%~4.12%的京尼平苷, 而其苷元京尼平的含量却只有0.005%~0.01%[11]。本文的研究结果显示, 热毒宁注射液中京尼平的含量低于检测限, 但在大鼠注射给药热毒宁注射液后的血浆与尿液中却检测到京尼平, 由此可确定此注射液中京尼平苷代谢为其苷元京尼平的这一代谢途径, 并可进行共存成分对这一代谢的影响研究。有文献分别研究京尼平苷在人体和大鼠中的代谢途径, 发现羟基化是人类特有的代谢途径[12, 13], 在本研究同样未在大鼠体内检测到京尼平苷羟基化产物。
大鼠静脉注射绿原酸后, 胆汁中存在大量其与氨基酸、谷胱甘肽结合的产物, 这是由于绿原酸的烯酮双键具有很强的亲电性, 可与谷胱甘肽结合[14, 15]。热毒宁注射液中的绿原酸在静脉注射给药后亦有如此的代谢途径。但口服给药却未检测到其与氨基酸、谷胱甘肽结合产物的报道, 推测其原因可能是绿原酸口服给药后, 由于肠道菌的代谢作用[16], 使其原形进入体内的实际量减少, 以致代谢产物量偏少而无法检测出。
本文研究结果显示, 热毒宁注射液经静脉给药后, 其主要成分在大鼠体内发生以下代谢反应: Ⅰ相代谢主要包括氧化、水解和脱羟基等; Ⅱ相代谢可直接共价结合; 亦可在Ⅰ相代谢基础上进一步生成甲基化、乙酰化、葡萄糖醛酸化、氨基酸或谷胱甘肽结合物等。
| [1] | Li HB, Yu Y, Wang ZZ, et al. Research on antiviral constituents in Re-Du-Ning Injection (Ⅰ)[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 1682–1688. |
| [2] | Wang Y, Wen J, Zheng W, et al. Simultaneous determination of neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid and geniposide in rat plasma by UPLC-MS/MS and its application to a pharmacokinetic study after administration of Reduning injection[J]. Biomed Chromatogr, 2015, 29: 68–74. DOI:10.1002/bmc.v29.1 |
| [3] | Du WJ, Liu XS, Tao LY, et al. Multi-indicators rapid determination in alcohol precipitation of Lonicerae Japonicae Flos and Artemisiae Annuae Herba in Reduning Injection by near-infrared spectroscopy[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 61–65. |
| [4] | Zhu H, Bi K, Han F, et al. Identification of the absorbed components and metabolites of Zhi-Zi-Da-Huang decoction in rat plasma by ultra-high performance liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry[J]. J Pharm Biomed Anal, 2015, 111: 277–287. DOI:10.1016/j.jpba.2015.03.043 |
| [5] | Karine R, Candice SM, Philippe G, et al. Identification of novel circulating coffee metabolites in human plasma by liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2011, 1218: 4678–4688. DOI:10.1016/j.chroma.2011.05.050 |
| [6] | Lu LL, Shu Y, Qian DW, et al. Identification of the metabolites of Sinisan extract in rat plasma, urine, feces and bile after intragastric administration[J]. Acta Pharm Sin (药学学报), 2011, 46: 1374–1379. |
| [7] | Chen YX, Chen LM, Wang ZM, et al. Analysis of major bioactive components and their metabolites in rats' plasma, urine and feces after oral administration of the aqueous extract of Euodiae Fructus by UHPLC-QTOF-MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 1157–1164. |
| [8] | Li L, Chen XY, Zhong DF. Application of liquid chromatography-mass spectrometry in drug metabolite identification[J]. J Chin Mass Spectrom Soc (质谱学报), 2017, 38: 375–378. |
| [9] | Li Y, Cai W, Cai Q, et al. Comprehensive characterization of the in vitro and in vivo metabolites of geniposide in rats using ultra-high-performance liquid chromatography coupled with linear ion trap-Orbitrap mass spectrometer[J]. Xenobiotica, 2016, 46: 357–369. DOI:10.3109/00498254.2015.1079746 |
| [10] | Chen XY, Zhong DF, Chen XY. Metabolites of injected chlorogenic acid in rats[J]. Acta Pharm Sin (药学学报), 2011, 46: 88–95. |
| [11] | Kitano A. Genipin suppression of fibrogenic behaviors of the alpha-TN4 lens epithelial cell line[J]. J Cataract Refract Surg, 2006, 32: 1727–1735. DOI:10.1016/j.jcrs.2006.05.015 |
| [12] | Wang GW, Bao B, Han ZQ, et al. Metabolic profile of Fructus Gardeniae in human plasma and urine using ultra high-performance liquid chromatography coupled with high-resolution LTQ-orbitrap mass spectrometry[J]. Xenobiotica, 2016, 46: 901–913. DOI:10.3109/00498254.2015.1132793 |
| [13] | Han H, Yang L, Xu Y, et al. Identification of metabolites of geniposide in rat urine using ultra-performance liquid chromatography combined with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2011, 25: 3339–3350. DOI:10.1002/rcm.5216 |
| [14] | Kang J, Liu Y, Xie MX, et al. Interactions of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochim Biophys Acta, 2004, 1674: 205–214. DOI:10.1016/j.bbagen.2004.06.021 |
| [15] | Rawel HM, Rohn S, Kruse HP, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chem, 2002, 78: 443–455. DOI:10.1016/S0308-8146(02)00155-3 |
| [16] | Lardeau A, Poquet L. Phenolic acid metabolites derived from coffee consumption are unlikely to cross the blood-brain barrier[J]. Pharm Biomed, 2013, 76: 134–138. DOI:10.1016/j.jpba.2012.12.016 |
 2018, Vol. 53
2018, Vol. 53


