2. 解放军第302医院全军中医药研究所, 北京 100039;
3. 湖南中医药大学药学院, 湖南 长沙 410208;
4. 国家药品不良反应监测中心, 北京 100020
2. China Military Institute of Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China;
4. National Center for Adverse Drug Reaction Monitoring, Beijing 100020, China
近年来, 随着中草药在全球范围内的广泛传播和应用、国家药品不良反应监测体系的不断完善以及民众对药品不良反应关注度的大幅提高, 中药相关不良反应/事件的报道呈升高趋势, 特别是一些传统不认为有毒的中药也发生了不良反应, 对中药的临床安全用药造成了一定的负面影响。其中临床常用的含蒽醌类成分中药如大黄、何首乌、芦荟、番泻叶等被报道有临床肝损害问题, 引起国内外药监部门普遍关注和重视[1-4]。2001年美国NIH组织发现蒽醌类成分之一大黄素具有肝肾毒性[5]; 2006年MHRA (Medicines and Healthcare Products Regulatory Agency)发布含何首乌制剂的肝损害警告信息[6]; 2009年中国CFDA发布《含蒽醌类保健食品注册管理有关规定》, 限制含蒽醌类中药的日剂量和使用人群, 并要求标示蒽醌含量范围。然而, 传统“无毒”中药肝毒性的发生机制尚不完全明确[7, 8], 尤其是能否通过辨证用药减(避)毒, 提高含蒽醌中药的临床安全性, 是当前迫切需要解决的现实问题[9]。
大黄是临床常用中药, 为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim. ex Balf.或药用大黄Rheum officinale Baill的根及根茎, 因其疗效确切、功效众多被列为“药中四维”, 是典型的多功效中药。传统对大黄多功效的认识如《神农本草经》曰: “下瘀血, 血闭, 寒热, 破症瘕积聚, 留饮宿食, 荡涤肠胃, 推陈致新, 通利水谷, 调中化食, 安和五脏”[10, 11]。现代临床应用大黄, 主要用于便秘、慢性肝炎、肝纤维化、黄疸、慢性肾衰、上消化道出血, 也有用于糖尿病、高血脂、脂肪肝等多种代谢性疾病[12-14]。最近含大黄蒽醌类成分的中成药在减肥、排毒养颜等保健领域应用越来越普遍。然而国内外报道大黄所含蒽醌类成分存在肝肾毒性和潜在的致癌的风险[15, 16]。这种药性与毒性的“双向”作用致使我国大黄及相关中成药的安全性一度受到社会大众的质疑。
针对上述中药大黄存在的问题, 本课题前期研究结果证实[17, 18]:大黄一方面对正常动物有肝肾毒性, 另一方面却可用于肝肾疾病的治疗, 含蒽醌中药大黄存在典型的“有故无殒”现象, 这看似一个悖论, 如何客观、辨证地看待大黄的肝毒性?临床上很多治疗慢性肝病的中成药也含有此类成分, 但未见肝毒性问题, 提示该类药物存在通过辨证用药减(避)毒提高临床安全性的可能。
为此, 本研究拟在前期研究基础上建立基于病理毒理学的大黄安全性评价模式和方法, 即不仅采用正常动物, 而且疾病动物(肝纤维化模型)对比研究的方式, 综合比较大黄提取物对不同机体状态动物模型的干预作用和规律, 通过采用代谢组学方法表征大黄在不同动物模型干预后大鼠血清内源性代谢物的变化差异, 正交偏最小二乘法-判别分析(OPLS-DA)筛选大黄“有故无殒”现象的潜在生物标志物, 并结合代谢通路数据库, 探讨可能的代谢通路和作用机制。本研究为大黄的临床合理用药提供建议, 为诠释中医辨证(病)用药减毒的科学性和可行性提供理论依据。
材料与方法仪器和试剂 Waters Acquity超高效液相色谱仪, 二极光阵列检测器(PDA), Empower 2色谱工作站, Waters Xevo G2-XS QTOF/MS质谱仪(美国Waters公司); 微量分析天平(Mettler Toledo AL204瑞士), 低温离心机(美国Thermo Fisher Scientific Sigma公司); Leica EG1150组织包埋机, Leica 2016石蜡切片机(上海莱卡仪器有限公司); Synergy H2全功能微孔板检测仪(美国BioTek公司), Nikon E200光学显微镜(日本Nikon公司)等。
甲醇(色谱纯, 美国Fisher公司); 纯净水(娃哈哈集团有限公司); 磷酸(分析纯, 天津市化学试剂六厂); 甲醇(分析纯, 北京北化精细化学品有限公司); 橄榄油(分析纯, Lot: 20160615)、四氯化碳(分析纯, Lot: 20160820) (国药集团化学试剂有限公司); GPT/ALT试剂盒(Lot: 20170515), GOT/AST试剂盒(Lot: 20170515, 南京建成生物工程研究所)。
药物制备 基于本课题组前期研究[15-17], 同时结合目前大黄药材主流品种、主产地和历史道地产区。采用甘肃陇南地区掌叶大黄(Rheum palmatum L.)药材(购于北京绿野药业有限公司), 经解放军第302医院肖小河研究员鉴定为蓼科植物掌叶大黄的干燥块根。为了更好地研究含蒽醌中药大黄的可能肝毒性, 本研究采用醇提加水提的方式制备药材总提物, 尽可能多提取可能的毒性成分。药材粉碎成粗粉, 加10倍量90%乙醇浸泡30 min, 不时搅拌, 回流提取1 h, 收集醇提液; 药渣加10倍量去离子水, 回流提取1 h, 与醇提液合并, 减压浓缩至适当体积, 密封备用。
动物分组和给药 健康雄性SD大鼠, 6周, SPF级, 体重180 ± 20 g, 40只, 购于军事医学科学院实验动物中心[合格证号SCXK-(军) 2012-0004]。分笼饲养于解放军第302医院实验动物中心, 自由饮水及进食。饲养环境保持安静, 通风良好, 并定期消毒, 温度(25 ± 2) ℃, 湿度50%~60%, 人工光照约12 h/12 h明暗周期。
SD大鼠在动物中心适应性喂养1周后, 随机分为4组:正常对照组(normal)、正常给药组(NR)、模型对照组(model)、模型给药组(MR)。肝纤维模型参考本课题组前期研究和文献报道使用经典的四氯化碳诱导模型。方法:四氯化碳(CCl4)-橄榄油(40%:60%)比例浓度, 0.2 mL·100 g-1的剂量腹腔注射, 每周2次, 共造模8周。模型造模结束后, 各给药组参考课题组前期研究按大黄生药14.7 g·kg-1剂量灌胃给药, 空白组给予相同体积蒸馏水, 每天1次, 连续给药4周。
样本收集 实验结束后, 用采血针下腔静脉取血后, 4 ℃、3 500 r·min-1离心10 min, 分离血浆, -80 ℃保存; 取大鼠左侧肝叶部分于4%中性多聚甲醛溶液中固定保存。
肝功能指标检测和肝脏病理学检查 采集大鼠血浆, 按试剂盒说明书测定并计算血浆ALT和AST的活力。取大鼠肝组织1.5 cm × 1 cm, 用4%中性多聚甲醛溶液固定24 h后, 常规病理切片, HE和TUNEL染色后显微镜下观察。
代谢组学血浆样品处理 将存放于-80 ℃冰箱中的大鼠血浆样品于4 ℃复融, 精密吸取200 μL置于EP管中, 加入3倍量预冷的甲醇(色谱级)稀释, 涡旋混匀, 再放入4 ℃离心机中, 以12 000 r·min-1离心10 min, 用1 mL一次性注射器吸取上清液, 过0.22 μm微孔滤膜, 即为备用样品。质控样品(QC)是从每个待检测样本取10 μL混匀制备所得。
代谢组学色谱条件 色谱柱: Agilent ZORBAX 300 SB-C18柱(2.1 mm × 100 mm, 1.8 μm)。检测波长:全波长扫描190~400 nm; 柱温: 30 ℃; 样品温度: 4 ℃; 流动相A:乙腈(0.1%甲酸), 流动相B:水(0.1%甲酸+ 5%乙腈), 流速: 0.30 mL·min-1; 进样量: 4 μL。色谱梯度洗脱条件: 0~1 min, 5% A; 1~9 min, 5%~40% A; 9~19 min, 40%~90% A; 19~21 min, 90%~100% A; 21~25 min, 100% A。
代谢组学质谱条件 采用电喷雾电离(ESI)离子源, 在负离子模式下数据采集范围m/z: 50~1 200, 采集模式: ESI Continuum模式。毛细管电压2.2 kV (正离子2.5 kV), 锥孔电压40 V, 源温130 ℃, 脱溶剂气温度: 350 ℃, 锥孔气流量50 L·h-1, 脱溶剂气流量800 L·h-1, 质量数校正:亮氨酸脑啡肽(正离子模式下m/z 121.050 9和922.009 8;负离子模式下m/z 112.985 6和1 033.988 1), 质量浓度100 pg·mL-1, 流速10 mL·min-1, 采样频率每次10 s。质量轴校正:甲酸钠溶液(质量精度误差 < 5 ppm); 正离子条件同负离子。
数据处理及统计学分析 代谢组学采用美国Waters公司QI工作站进行色谱峰识别、提取, 并进行分级和校正。然后将化合物的色谱峰的峰面积导入MetaboAnalyst 3.0软件进行标准化处理, 筛选出具有显著性差异的化合物(P < 0.05且倍数变化 > 1.5)。将上述差异化合物导入SIMCA-P-13软件进行主成分分析(PCA)和正交校正偏最小二乘法-判别分析(OPLS-DA)。使用MetaboAnalyst 3.0 (http://www.metaboanalyst.ca/)、Mass Hunter PCDL Manager (MHPM)软件、KEGG (www.genome.jp/kegg/)等生物学数据库进行生物标志物的鉴定和代谢通路的分析。
实验数据以均值±标准差(x ± s)表示, 采用SPSS 17.0进行统计分析, 采用单因素方差分析(one-way ANOVA)进行组间比较, 以双侧P < 0.05或者P < 0.01有统计学意义。
结果 1 大鼠血浆生化指标由图 1可见, 与正常对照组比较, 正常给药组血浆生化指标ALT、AST值都显著性升高(P < 0.01);提示大黄对正常大鼠造成肝损伤。与模型对照组比较, 模型给药组血浆生化指标都显著性的降低(P < 0.01)。结果提示, 大黄对肝纤维化大鼠模型具有保护作用。
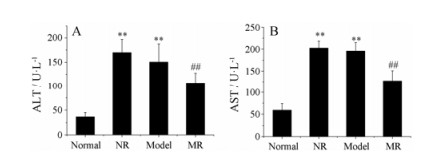
|
Figure 1 The results of plasma biochemical indexes in rats. A: Alanine aminotransferase (ALT); B: Aspartate aminotransferase (AST). Normal: Normal control group; NR: Normal group treated with rhubarb; Model: Model group; MR: Model group treated with rhubarb. n = 10, x ± s. **P < 0.01 vs normal; ##P < 0.01 vs model |
正常对照组大鼠肝组织结构肝小叶清晰, 肝细胞大小均匀, 细胞核清晰可见, 无炎症细胞浸润, 没有观察到明显的组织学病变。与正常对照组比较, 正常给药组肝组织肝细胞肿大, 在肝小叶之间大量炎症细胞侵润, 肝窦明显扩张, 肝细胞局部坏死; 模型对照组大鼠肝组织均出现肝索排列紊乱, 门管区及肝小叶内可见明显的炎症细胞浸润, 间质细胞大量弥漫性胶原增生, 形成细胞纤维间隔, 或纤维细胞间隔, 分隔包绕肝细胞, 胶原沉积; 与模型对照组比较, 模型给药组肝组织肝小叶之间胶原纤维条索明显减少, 炎症细胞显著性减少。见图 2。
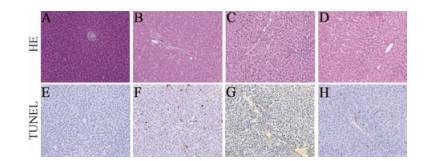
|
Figure 2 Effects of rhubarb on histopathologic change of liver tissues in rats. Normal control group (A, E), normal group treated with rhubarb (B, F), model group (C, G), model group treated with rhubarb (D, H). HE and TUNEL staining (×200) |
与正常对照组比较, 正常给药组有大量凋亡阳性细胞表达, 提示:大黄对正常大鼠造成肝损伤; 与模型对照组比较, 模型给药组凋亡阳性细胞显著减少, 提示:大黄对肝纤维模型大鼠有肝保护作用。见图 2。
3 代谢组学的多元统计分析分析大黄对正常和模型动物“双向”作用的代谢标志物差异。通过采用UPLC-MS代谢组学分析技术平台, 对正、负离子模式下的生物体内重要代谢产物进行PCA和OPLS-DA识别分析研究。PCA分析(图 3)所示, 在正、负离子共同模式下, QC样本聚集在得分矩阵投影图中间附近位置, 显示整个分析过程中LC-MS系统是稳定的。另外, 可观察到在正负两种离子模式下, 正常对照组、正常给药组、模型组和模型给药组间能较好区分, 表明给药后大鼠体内的生理代谢环境发生改变。在正离子模式下样本符合模型判别R2X = 0.892, 模型预测能力为Q2Y = 0.608;在负离子模式下, R2X = 0.803, Q2Y = 0.552, 表明拟合模型的准确度和预测度均良好。另外, 观察到正常给药组偏离正常对照组, 结果提示大黄对正常大鼠造成肝损伤后, 生理代谢环境出现紊乱; 模型给药组靠近正常对照组, 提示大黄对模型大鼠具有肝保护作用, 生理代谢环境恢复稳定。

|
Figure 3 Principal component analysis (PCA) score plots of different groups of rhubarb by UPLC-QTOF/MS in positive (A) and negative (B) electrospray ionization source (ESI) mode |
为了进一步区分大黄各给药组与对照组代谢物的差异, 通过使用有监督的模式识别方法OPLS-DA进行分析, 该分析方法可筛选得到由两组间代谢差异形成的潜在标志物。如得分矩阵投影图(图 4)所示, 在正离子模式下, 正常组和模型组、正常对照组和正常给药组、模型对照组和模型给药组之间可明显区分, 分别位于纵坐标两侧, 提示大黄对不同生理状态大鼠代谢环境的影响有显著差异, 表明拟合模型的准确度和预测度均良好, 并且正常组和模型组: R2Y = 0.943, Q2Y = 0.714;正常组和正常给药组: R2Y = 0.946, Q2Y = 0.689;模型组和模型给药组: R2Y = 0.979, Q2Y = 0.786, 表明该模型具有良好的预测能力。
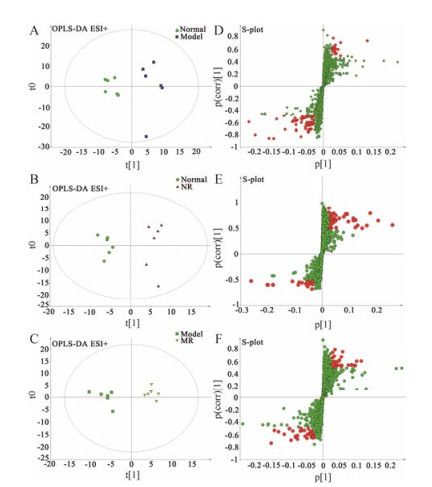
|
Figure 4 Orthogonal partial least squares-discriminant analysis (OPLS-DA) analysis of the data generated from the ESI+ mode (A, B, C). Score plots constructed from the supervised OPLS analysis of plasma (D, E, F), the axes that are plotted in the S-plot from the predictive component are p 1 vs p(corr) 1, representing the magnitude and reliability, respectively. Metabolite ions with variable importance for the projection (VIP) value > 1 and |p(corr)| > 0.5 were marked with a red square. A, D: Displays the result of OPLS-DA model using the data from the Normal and Model groups in ESI+ mode; B, E: As well as Normal and NR group; and C, F: Model and MR group |
在建立OPLS-DA模型基础上, 通过S-plot分析指标分别筛选出正常组和模型组、正常对照组和正常给药组、模型对照组和模型给药组3组间的差异性变量, 在S-plot图中, 选择VIP > 1或|p(corr)|≥0.5差异变量作为大黄对不同生理状态动物模型“双向作用”潜在候选标志物(图 4)。采用MetaboAnalyst 3.0软件对3组对照组进行单变量分析, 包括ANOVA及Fold change分析(P < 0.05且倍数变化 > 1.5 or < 0.5), 分别筛选出肝纤维模型, 大黄肝损伤、大黄肝保护作用具有显著性差异的代谢物作为潜在生物标志物。然后将VIP、ANOVA及Fold change分析分别筛选的差异代谢标志物取交集, 得到大黄“双向”作用共有的潜在生物标志物。最后将上述潜在的生物标志物借助Mass Hunter PCDL Manager数据库中的准确质荷比进行结构解析, 真实Mass tolerance质量误差限定为10 ppm, 最后鉴定出符合条件的共有生物标志物共7个(表 1), 包括:精氨酸、缬氨酸、肌(氨)酸、前列腺素PGF2α、粪甾烷酸、视黄基酯和牛磺酸。选取其中精氨酸、缬氨酸、肌(氨)酸和牛磺酸的4个化合物的对照品进行二级质谱验证。鉴定结果(图 5), 通过对比二级特征峰碎片离子图谱, 保留时间和质荷比与对照品基本一致, 二级质谱鉴定4个化合物与一级质谱鉴定出化合物一致。基于上述二级质谱鉴定结果, 推断一级质谱鉴定出7个化合物真实可信。
| Table 1 Identification and trends of change for potential biomarkers. VIP: Variable importance for the projection |
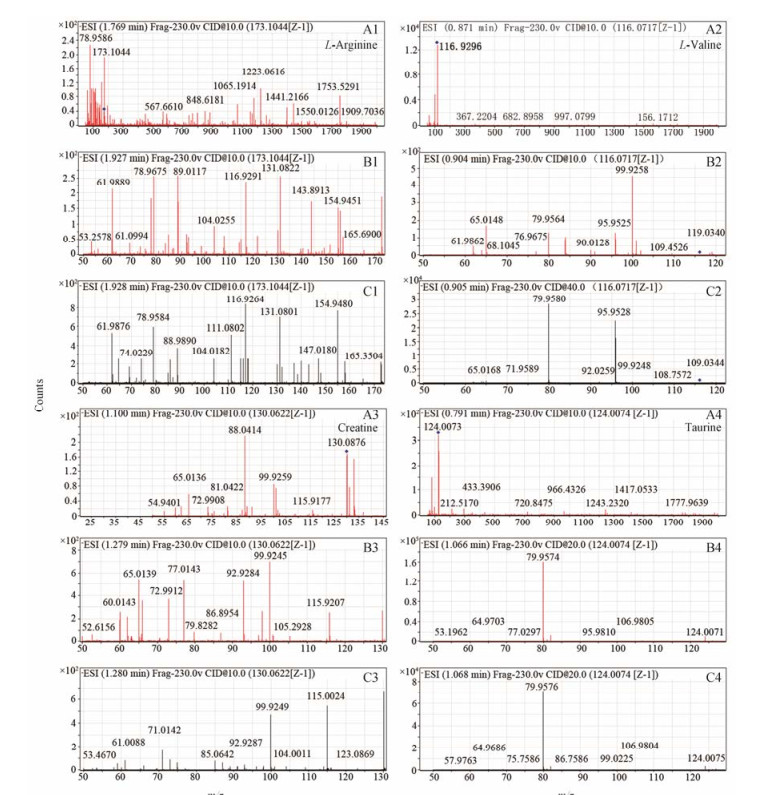
|
Figure 5 The standard mass spectrum of L-arginine, L-valine, creatine and taurine (A1−A4), MS/MS spectrum of 4 standard components (B1−B4) and MS/MS spectrum of 4 components in rat's serum (C1−C4) |
此外, 通过比较筛选出的共有生物标志物在不同生理状态下大鼠体内的含量变化趋势(图 6), 与正常对照组比较, NR组前列腺素PGF2α含量显著性升高, 其他6个标志物含量显著降低, 7个标志物的含量差异变化趋向模型对照组, 提示大黄在NR组有肝损伤作用; 与模型对照组比较, MR组前列腺素PGF2α含量显著性降低, 其他6个标志物含量显著升高, MR组7个标志物的含量变化趋向正常对照组, 提示大黄在MR组有肝保护作用。

|
Figure 6 Peak intensity weighted PCA score plot for each special screened metabolites. A: Score plot for screened L-arginine metabolites weight by normalized peak intensity; B: L-Valine; C: Retinyl ester; D: Creatine; E: Taurine; F: 3α, 7α, 12α-Trihydroxy-5β-cholestanoic acid; G: Prostaglandin F2α |
为了进一步分析大黄双向作用的共同生物标志物间的关系, 将筛选出的7个生物标志物导入MetaboAnalyst 3.0软件进行代谢通路富集分析, 结果显示给予大黄后正常和模型大鼠体内有6条代谢通路受到影响, 包括:精氨酸和脯氨酸代谢、初级胆酸生物合成、牛磺酸和亚牛磺酸代谢、缬氨酸, 亮氨酸和异亮氨酸生物合成、视黄醇新陈代谢和花生四烯酸代谢。同时从生物标志物的路径分析看出, 中药大黄对大鼠体内的初级胆酸生物合成、牛磺酸和亚牛磺酸代谢、精氨酸和脯氨酸代谢影响较大(图 7)。

|
Figure 7 Summary of pathway analysis with MetaboAnalyst 3.0. a: Arginine and proline metabolism; b: Primary bile acid biosynthesis; c: Taurine and hypotaurine metabolism; d: Valine; leucine and isoleucine biosynthesis; e: Retinol metabolism; f: Arachidonic acid metabolism |
本研究在课题组前期研究基础上, 采用代谢组学的方法探讨大黄对正常、肝纤维化模型动物的肝损伤/保护的“双向”作用客观真实性。大鼠血浆生化指标、肝组织病理学检查结果表明, 大黄引起正常动物肝脏损伤, 同时, 大黄对肝纤维化大鼠有肝保护作用。进一步验证了大黄存在典型“有故无殒”现象, 即大黄对正常生理状态和病理状态的动物对肝毒性的应答是不同的。课题组前期多次报道实验结果显示, 肝损伤模型动物对大黄的耐受性显著提高, 为正常动物的2~4倍; 在正常动物出现肝毒性的剂量, 反而对肝炎或肝纤维化模型动物即对病(证)用药时表现出保护和治疗作用, 而非进一步损伤[15]。大黄在肾损伤动物也可看到典型的“有故无殒”现象[17]。上述发现印证了清代张锡纯《医学衷中参西录》所载“大黄之大黄力虽猛, 然有病则病当之, 恒有多用不妨者”, 也证实了《内经》“有故无殒”现象的客观真实性, 提示大黄正确用于“有故”机体, 能够达到“无殒”的目的。
“有故无殒”思想在对指导中药毒性评价与合理用药, 具有重要性的理论和实际价值, 是中药传统毒性理论的重要内容, 也是最能反映中医辨证用药思想的理论认识之一[19]。许多研究证实中药“有故无殒”的现象是客观存在的, 如附子[20]、雷公藤[21]等。最近国外文献[22]报道, 肝纤维化病理状态下的小鼠对肝毒性物质如脂多糖、对乙酰氨基酚等均表现为很强的耐受性。所以, “有故无殒”思想实为对中药药效与毒性的整体认识, 强调的是辨证用药, 即中药的药效/毒性作用不仅与药物本身密切相关, 还与其应用的机体状态有关。
“有故无殒”是一种外在的、宏观表象, 从微观来看, 这一表象之下是机体在病理状态与正常生理状态代谢微环境的显著差异, 而代谢微环境的差异可能显著影响机体对药物毒性反应的应答, 进而在宏观上形成“有故无殒”现象。作者从代谢组学角度分析大黄在不同动物模型干预后大鼠血浆内源性代谢物的变化差异。为了进一步研究这些发生异常改变的小分子代谢物, 本文通过建立OPLS-DA分析方法从中筛选最具显著性差异的变量, 利用MHPM数据库进行鉴定, 本研究筛选出7个潜在的生物标志物, 包括:牛磺酸、精氨酸、缬氨酸、肌(氨)酸、PGF2α、粪甾烷酸和视黄基酯。牛磺酸主要参与初级胆汁酸合成和牛磺酸与亚牛磺酸代谢。精氨酸和肌(氨)酸主要参与精氨酸和脯氨酸代谢; 缬氨酸主要参与缬氨酸, 亮氨酸和异亮氨酸生物合成; PGF2α主要参与花生四烯酸代谢; 粪甾烷酸主要参与初级胆汁酸合成; 视黄基酯主要参与视黄醇的新陈代谢。
肝脏在药物的代谢中起着十分重要的作用, 大多数药物和毒物在肝内经生物转化作用而排出体外。从图 7代谢通路分析发现牛磺胆酸主要参与初级胆汁酸合成和牛磺酸与亚牛磺酸代谢是大黄引起肝损伤最重要的代谢通路之一, 大黄引起正常大鼠胆汁酸的合成发生紊乱, 导致肝脏的脂质代谢紊乱。牛磺酸在细胞中改善糖脂代谢、免疫调节、抗炎、抗氧化等多种生理功能[23]。有研究表明, 牛磺酸可以保护对乙酰氨基酚所致的大鼠肝损伤; 同时研究表明牛磺酸可以改善四氯化碳所致小鼠肝纤维化模型中多项肝功能指标, 通过其改善血清转氨酶和胆红素的水平和抗氧化作用实现对纤维化肝脏的保护[24, 25]。本实验中, 与正常对照组比较, 正常给药组中牛磺酸、粪甾烷酸浓度显著降低, 提示肝损伤与初级胆汁酸合成和牛磺酸与亚牛磺酸代谢紊乱有关联; 模型给药组中牛磺酸、粪甾烷酸浓度显著升高, 提示大黄改善上述代谢通路起到肝保护作用。此外, 视黄基酯浓度降低和PGF2α浓度升高引起视黄醇和花生四烯酸代谢紊乱也是大黄导致正常大鼠肝损伤原因之一。食物中的维生素A主要以视黄基酯的形式存在, 肝脏中的维生素A主要以酯的形式存在于实质细胞和星状细胞中, 研究表明, 维生素A能保护肝脏, 阻止和抑制肝脏中癌细胞的增生; 花生四烯酸在正常生理状态下主要以磷脂的形式存在于细胞膜上, 当细胞膜受到刺激时, 转化的花生四烯酸经环氧合酶转化生成大量的PGF2α, 进一步激活扩大炎症反应导致更严重肝损伤[26, 27]。
另外, 精氨酸参与的精氨酸和脯氨酸代谢可能是大黄肝保护作用最重要的代谢通路之一。精氨酸是一种半必需氨基酸, 但在某些病理状态下则为必需氨基酸。其代谢产物为多胺、一氧化氮(NO)和氧化氮等[28]。研究表明: NO具有广泛的生物化学性质, 可消除活性氧自由基, 改善肝脏微循环; 通过精氨酸酶-1将精氨酸分解成聚胺, 参与合成和稳定细胞外基质; 通过精氨酸酶-1转化为鸟氨酸后, 转化生成门冬氨酸鸟氨酸, 门冬氨酸鸟氨酸具有保护肝细胞膜、增加促进肝细胞代谢的物质、提高干细胞的各种代谢功能、参与肝细胞的修复等作用[29, 30]。因此推测大黄通过促进模型给药组的精氨酸浓度增加, 改善肝纤维化起到肝保护作用。
大黄对正常、肝纤维化模型动物的肝损伤/保护的“双向”作用机制可能影响胆酸生物合成、牛磺酸和亚牛磺酸代谢、精氨酸和脯氨酸代谢等代谢通路紊乱共同作用的结果。本文尽管已经筛选得到大黄“有故无殒”现象的候选生物标志物, 但是仍需要进一步通过动物实验和临床验证。此外, 大黄的双向作用的物质基础和生物学机制也需要进一步研究。
| [1] | Yamate Y, Hiramoto K, Yokoyama S, et al. Immunological changes in the intestines and skin after senna administration[J]. Pharm Biol, 2015, 53: 913–920. DOI:10.3109/13880209.2014.948636 |
| [2] | Kefeli A, Yeniova A, Basyigit S, et al. Melanosis coli caused by herbal tea in an elderly patient[J]. Eur Geriatr Med, 2015, 6: 613–614. DOI:10.1016/j.eurger.2015.09.001 |
| [3] | Abendroth A, Klein R, Schlaak J, et al. Impressive picture of a melanosis coli after chronic anthraquinone laxative use-is there an increased risk for colorectal cancer?[J]. Z Gastroenterol, 2009, 47: 579–582. DOI:10.1055/s-0028-1109056 |
| [4] | Mazzanti G, Battinelli L, Daniele C, et al. New case of acute hepatitis following the consumption of Shou Wu Pian, a Chinese herbal product derived from Polygonum multiflorum[J]. Ann Intern Med, 2004, 140: W30. DOI:10.7326/0003-4819-140-7-200404060-00042-w3 |
| [5] | Program NT. NTP toxicology and carcinogenesis studies of emodin (CAS No. 518-82-1) feed studies in F344/N rats and B6C3F1 mice[J]. Natl Toxicol Program Tech Rep Ser, 2001, 493: 1–278. |
| [6] | Center for Drug Evaluation CFDA. MHRA warning adverse effects of liver damage in Polygonum multiforum[J]. Chin J Pharmacov (中国药物警戒), 2006, 3: 313–314. |
| [7] | Wang JB, Li CY, Zhu Y, et al. Integrated evidence chain-based identification of Chinese herbal medicine-induced hepatotoxicity and rational usage:exemplification by Polygonum multiflorum (He shou wu)[J]. Chin Sci Bull (中国科学通报), 2016, 61: 971–980. |
| [8] | Wang JB, Cui HR, Bai ZF, et al. Precision medicine-oriented safety assessment strategy for traditional Chinese medicines:disease-syndrome-based toxicology[J]. Acta Pharm Sin (药学学报), 2016, 51: 1681–1688. |
| [9] | Tao MB, Zhang L, Liu F, et al. Contains anthraquinones constituents of traditional Chinese medicine security research progress[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2016, 32: 238–243. |
| [10] | Lin YJ, Lin XW, Ni SY, et al. Analysis on the traditional usage and modern pharmacological characteristics of rhubarb[J]. Chin Med Pharm (中国医药科学), 2014, 13: 89–91. |
| [11] | Gao LL. Studies on the Chemical Constituents and Biological Activity of Rheum tanguticum Maxim. ex Balf., Rheum officinale Baill. and Rheum palmatum L (唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究)[D]. Beijing: Peking Union Medical College, 2012. https://www.sciencedirect.com/science/article/pii/S1878535214002779 |
| [12] | Cheng XY, Li EQ, Shen Q, et al. Dahuang Zhechong pill inhibits secondary hepatic fibrosis in patients with hepatitis B[J]. Chin J Pathophysiol (中国病理生理杂志), 2005, 21: 1018–1019. |
| [13] | Li F, Li G, Yin SQ. Clinical observation of combined oxymatrine and Daihuangzhechong pill in treatment of chronic hepatitis B fibrosis[J]. Chongqing Med (重庆医学), 2006, 35: 1293–1294. |
| [14] | Cai HB, Sun XG, Liu ZF, et al. Effects of Dahuangzhechong pills on cytokines and mitogen activated protein kinase activation in rats with hepatic fibrosis[J]. J Ethnopharmacol, 2010, 132: 157–164. DOI:10.1016/j.jep.2010.08.019 |
| [15] | Wang JB, Zhao HP, Zhao YL, et al. Hepatotoxicity or hepatoprotection? Pattern recognition for the paradoxical effect of the Chinese herb Rheum palmatum L. in treating rat liver injury[J]. PLoS One, 2011, 6: e24498. DOI:10.1371/journal.pone.0024498 |
| [16] | Wang JB, Kong WJ, Wang HJ, et al. Toxic effects caused by rhubarb (Rheum palmatum L.) are reversed on immature and aged rats[J]. J Ethnopharmacol, 2011, 134: 216–220. DOI:10.1016/j.jep.2010.12.008 |
| [17] | Zeng LN, Ma ZJ, Zhao YL, et al. The protective and toxic effects of rhubarb tannins and anthraquinones in treating hexavalent chromium-injured rats:the Yin/Yang actions of rhubarb[J]. J Hazard Mater, 2013, 246-247: 1–9. DOI:10.1016/j.jhazmat.2012.12.004 |
| [18] | Fang F, Wang JB, Zhao YL, et al. A comparative study on the tissue distributions of rhubarb anthraquinones in normal and CCl4-injured rats orally administered rhubarb extract[J]. J Ethnopharmacol, 2011, 137: 1492–1497. DOI:10.1016/j.jep.2011.08.028 |
| [19] | Zhao YL. The Study of Relationship among the "Syndrome Pattern-Toxicity-Curative Effect" of Chinese Medicine Guided from the Theory "You Gu Wu Yun" in "Huang Di Nei Jing" (《黄帝内经》"有故无殒"理论指导下中药的"证-毒-效"关系研究)[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2011. |
| [20] | Wang XJ, Tang Y, Zhao HY, et al. Influence of white prepared lateral root of aconite on cardiac enzymes in normal and kidney-yang insufficiency rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2009, 15: 52–55. |
| [21] | Lv YH, Lv C, Tang Y, et al. Effect of Tripterygium wilfordii ployglycosidium on blood biochemical indexes in adjuvant-induced arthritic rats[J]. Chin J Basic Med Tradit Chin Med (中国中医基础医学杂志), 2009, 15: 212–214. |
| [22] | Bourbonnais E, Raymond VA, Ethier C, et al. Liver fibrosis protects mice from acute hepatocellular injury[J]. Gastroenterology, 2012, 142: 130–139. DOI:10.1053/j.gastro.2011.09.033 |
| [23] | Maia AR, Batista TM, Victorio JA, et al. Taurine supplementation reduces blood pressure and prevents endothelial dysfunction and oxidative stress in post-weaning protein-restricted rats[J]. PLoS One, 2014, 9: e105851. DOI:10.1371/journal.pone.0105851 |
| [24] | Ashkani-Esfahani S, Zarifi F, Asgari Q, et al. Taurine improves the wound healing process in cutaneous leishmaniasis in mice model, based on stereological parameters[J]. Adv Biomed Res, 2014, 3: 204. DOI:10.4103/2277-9175.142314 |
| [25] | Miao J, Zhang J, Ma Z, et al. The role of NADPH oxidase in taurine attenuation of Streptococcus uberis-induced mastitis in rats[J]. Int Immunopharmacol, 2013, 16: 429–435. DOI:10.1016/j.intimp.2013.05.007 |
| [26] | Phillips RJ, Fortier MA, Lopez Bernal A. Prostaglandin pathway gene expression in human placenta, amnion and choriodecidua is differentially affected by preterm and term labour and by uterine inflammation[J]. BMC Pregnancy Childbirth, 2014, 14: 241. DOI:10.1186/1471-2393-14-241 |
| [27] | Hoxha M. A systematic review on the role of eicosanoid pathways in rheumatoid arthritis[J]. Adv Med Sci, 2017, 63: 22–29. |
| [28] | Adawi D, Molin G, Jeppsson B. Inhibition of nitric oxide production and the effects of arginine and Lactobacillus administration in an acute liver injury model[J]. Ann Surg, 1998, 228: 748–755. DOI:10.1097/00000658-199812000-00005 |
| [29] | Preiser JC, Berre PJ, Van Gossum A, et al. Metabolic effects of arginine addition to the enteral feeding of critically ill patients[J]. JPEN J Parenter Enteral Nutr, 2001, 25: 182–187. DOI:10.1177/0148607101025004182 |
| [30] | Abu-Serie MM, El-Gamal BA, El-Kersh MA, et al. Investigation into the antioxidant role of arginine in the treatment and the protection for intralipid-induced non-alcoholic steatohepatitis[J]. Lipids Health Dis, 2015, 14: 128. DOI:10.1186/s12944-015-0124-0 |
 2018, Vol. 53
2018, Vol. 53


