脓毒症是由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 2016年拯救严重脓毒症运动(SSC)指南将脓毒症修订为“机体对感染反应失调所致的危及生命的器官功能障碍”[1], 其发病率和死亡率居高不下, 是医学界面临的突出难题。脓毒症发病机制复杂且尚不明确, 涉及复杂的炎症反应、免疫功能及凝血功能紊乱等多器官病理生理的改变。近年来, 多重耐药菌的出现更是为脓毒症的治疗带来了挑战。
代谢组学是继基因组学、转录组学和蛋白质组学之后新发展起来的一门组学技术, 是对生物或者细胞在特定生理时期内所有低分子量的代谢产物进行定性和定量的分析[2]。小分子代谢物作为基因表达后最终产物, 可以直接并且准确的反映机体的病理生理状态。因此, 代谢组学分析在生物标志物的发现、疾病的诊断方面应用广泛, 并为疾病机制的研究提供了新的思路。
近年来, 与脓毒症相关的代谢组学研究也在不断增多, 结合脓毒症发病机制发现了一些与早期脓毒症相关的标志物, 但高敏感和特异性的生物标志物仍未被发现[3, 4]。此外, 对脓毒症发病机制认识的局限性以及临床检测的滞后性也严重妨碍了对临床患者病理生理状态的准确评估, 无法对患者进行及时有效的治疗。因此, 急需寻找到新的生物标志物以实现脓毒症的早期诊断, 准确推测脓毒症患者生理病理状态, 有效改善脓毒症患者的预后, 降低死亡率。
材料与方法实验材料 Agilent 1290 UHPLC超高效液相(美国Agilent公司); AB Triple TOF 6600高分辨质谱(美国AB Sciex公司); ACQUITY UPLC BEH Amide色谱柱(100 mm × 2.1 mm, 1.7 μm, 美国Waters公司); ABX PENTRA60血液分析仪(美国PerkinElmer公司)。色谱级甲醇(Merck公司); 色谱级乙腈(Merck公司); L-2-氯苯丙氨酸(CAS#: 103616-89-3, ≥98%)为内标(上海恒柏生物科技有限公司); 小鼠降钙素原(PCT)酶联免疫吸附测试试剂盒(Elabscience公司, 产品编号: E-EL-M2419c); 小鼠C反应蛋白(CRP)酶联免疫吸附测定试剂盒(Elabscience公司, 产品编号: E-EL-M0053c)。菌株为K. pneumoniae ATCC® BAA 2146 (购自美国模式菌种收集中心)。BALB/c雄性小鼠, 体重(19 ± 1) g, SPF级, 购自北京维通利华实验动物技术有限公司, 许可证号SCXK (京) 2016-0006。饲养于医药生物技术研究所感染动物房。
细菌培养与造模方法 细菌于MH琼脂平板上划线37 ℃培养过夜, 挑取4或5个单菌落接种到MH液体培养基10 mL中, 静置培养6 h后1:50转接, 继续培养18 h。菌液5 000 r·min-1离心10 min, 弃去上清, 生理盐水重悬用于感染小鼠。75只小鼠随机分为5组, 每组15只, 分别为对照组、感染后2、4、8和12 h组, 对照组尾静脉注射生理盐水, 0.2 mL/只, 实验组尾静脉注射菌液5×108 CFU/只。其中每组5个样本用于白细胞、降钙素原和C反应蛋白的测定, 10个样本用于代谢组学检测。
样品采集与处理 分别于感染后2、4、8和12 h采集小鼠全血于肝素及EDTA真空采血管中。肝素管中的样本于4 ℃、3 000 r·min-1离心10 min制得血浆, 每个样本分别取血浆100 μL加入提取液(甲醇-乙睛-水=2:2:1) 900 μL以及L-2-氯苯丙氨酸20 μL, 涡旋混匀30 s, 4 ℃条件下12 000 r·min-1离心15 min, 取上清0.7 mL真空浓缩干燥, 再加入提取液(乙睛-水=1:1) 200 μL复溶, 涡旋30 s, 4 ℃条件下12 000 r·min-1离心15 min, 取上清进行代谢组分析。QC (quality control)样本为每个样本各取10 μL混合而成[5]。
EDTA管中的样品取100 μL, 使用血液分析仪进行白细胞计数, 剩余样品于1 000×g离心15 min取上清, 使用小鼠降钙素原(PCT)酶联免疫吸附测试试剂盒以及小鼠C反应蛋白(CRP)酶联免疫吸附测定试剂盒对血浆样本进行检测。
色谱条件 Waters的UPLC BEH Amide色谱柱(100 mm × 2.1 mm, 1.7 μm); 流速0.5 mL·min-1; 流动相A: 25 mmol·L-1醋酸铵-25 mmol·L-1氨水-水, 流动相B:乙腈; 流动相梯度洗脱: 0~0.5 min, 95% B; 0.5~7 min, 95%~65% B; 7~8 min, 65%~40% B; 8~9 min, 40% B; 9~9.1 min, 40%~95% B; 9.1~12 min, 95% B。
质谱条件 AB 6600 Triple TOF质谱仪基于IDA功能进行一级、二级质谱数据采集。在每个数据采集循环中, 筛选出强度最强且大于100的分子离子采集对应的二级质谱数据。轰击能量: 35 eV, 15张二级谱图每50 ms。ESI离子源参数设置如下:雾化气压(GS1): 60 Pa, 辅助气压: 60 Pa, 气帘气压: 30 Pa, 温度: 550 ℃, 喷雾电压: 5.5 kV (正离子模式)或-4.5 kV (负离子模式)。
数据处理 原始数据进行峰匹配、峰对齐、峰提取和归一化处理, 然后使用SIMCA软件(V14.1, MKS Data Analytics Solutions, Umea, Sweden)进行主成分分析(principal component analysis, PCA), 观察各组分分离趋势[6]。为获取更加可靠的代谢物的组间差异与实验组的相关程度信息, 采用正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis, OPLS-DA)的统计方法对结果进行分析, 通过置换检验(permutation test), 对模型有效性做进一步的检验[7]。使用学生t检验(Student’s t-test)的P值(P-value)小于0.05, 同时OPLS-DA模型第一主成分的变量投影重要度(variable Importance in the Projection, VIP)大于1的标准筛选差异性代谢物, 并通过京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)数据库寻找差异代谢物映射的代谢通路。
结果 1 小鼠生化指标变化为了成功建立脓毒症模型并检测疾病发展情况, 在每个时间点测量血液中白细胞数量、降钙素原和C反应蛋白的水平。结果如表 1所示, 在感染后2 h白细胞数量出现明显下降, 并随感染时间延长不断降低; 在感染后2 h和4 h降钙素原水平约为对照组的2倍, 而感染后8 h和12 h约为对照组的5~6倍; C反应蛋白含量在感染后2 h与对照组差别不大, 而感染后4 h明显升高, 约为对照组的1.5倍, 此后8 h和12 h有所回落, 但仍高于对照组。结果表明, K. pneumoniae ATCC® BAA 2146感染的小鼠脓毒症模型制备成功。
| Table 1 White blood cell count, procalcitonin and C-reactive protein in blood obtained from infected mice compared to controls. n = 5, x ± s. Measurement data were compared with one-way ANOVA. *P < 0.05, **P < 0.01 vs control |
采用ESI+和ESI-两种模式对5组样本进行检测, 其中正离子模式的原始数据经过处理后, 1 637个峰被保留, 负离子模式的原始数据经处理后, 1 270个峰被保留。
使用SIMCA软件对预处理后的数据进行PCA分析和OPLS-DA分析。图 1为全部样本在正离子模式和负离子模式下检测的PCA得分散点图。可见QC样本集中, 说明仪器在检测分析中稳定, 感染后不同时间点的样本具有明显差异, 且样本全部处于95%置信区间内。
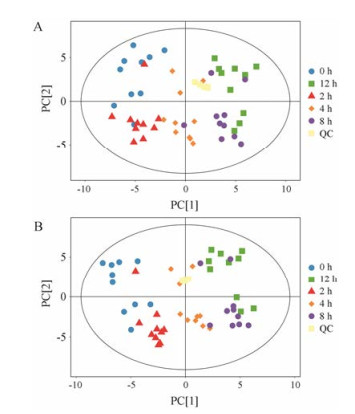
|
Figure 1 PCA scores plot in positive (A) and negative (B) mode |
为获取更加可靠的代谢物组间差异与实验组的相关程度信息, 使用SIMCA软件对第一主成分进行OPLS-DA建模分析, 其判别能力优于PCA, 通过7折交叉验证得到的R2Y和Q2对模型有效性进行评判, 最后通过置换检验对模型的有效性进一步检验。一般R2值、Q2值大于0.5, 表明该模型良好。其后进行置换检验, 通过随机改变分类变量Y的排列顺序, 多次(次数n = 200)建立对应的OPLS-DA模型以获取随机模型的R2和Q2值, 对模型的过拟合以及模型的统计显著性进行评估, Q2值等于或小于0则表明模型有效。总的来说, 原模型可以很好的解释两组样本之间的差异, 模型不存在过拟合现象, 稳健性良好(图 2)。可以做后续的差异成分寻找及分析。
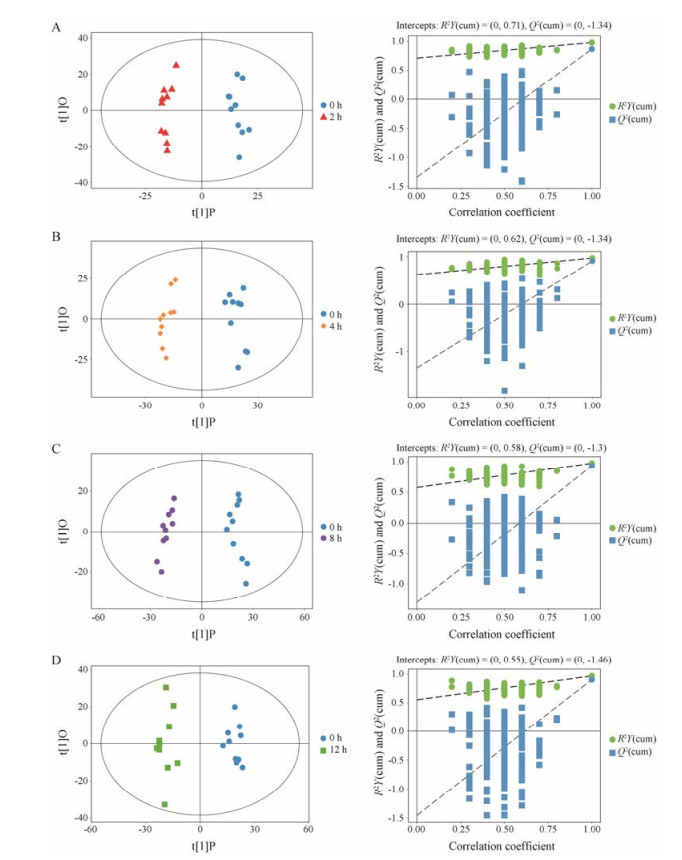
|
Figure 2 OPLS-DA model and permutation test summary for pair-wise comparison. A: 2 h vs 0 h; B: 4 h vs 0 h; C: 8 h vs 0 h; D: 12 h vs 0 h |
使用基于XCMS开发的xcms4dda和xcms4lipid程序及自建库对物质进行鉴定及匹配, 通过VIP值(> 1)和t-test的P值(< 0.05)以及HMDB等代谢组学相关数据库进行了差异代谢物筛选, 共得到58种差异代谢物, 并分析了差异代谢物在感染后不同时间点相对含量的动态变化。L-蛋氨酸(L-methionine)、N-甲酰蛋氨酸(N-formylmethionine)、脱氧胞苷(deoxycytidine)、别嘌呤醇核苷(allopurinol riboside)、二十六烷酸(hexacosanoic acid)、降植烷酸(pristanic acid)、甘油磷酰胆碱(glycerophosphocholine)、马尿酸(hippuric acid)、3-甲基己二酸(3-methyladipic acid)、5'-磷酸吡哆醛(pyridoxal 5'-phosphate)、3-甲基组胺(3-methylhistamine)和吲哚丙烯酸(indoleacrylic acid)共12种代谢物在小鼠感染后4个检测时间点均低于对照组, 并且最低值均比对照组降低至少50%。5-羟甲尿嘧啶(5-hydroxymethyluracil)和5-羟基己酸(5-hydroxyhexanoic acid)在感染后2 h含量与对照组相近, 而后降低, 3个时间点的含量检测值为对照组的40%~70%。肌苷(inosine)、脱氧肌苷(deoxyinosine)、别嘌呤二醇(oxypurinol)含量在感染2、4和12 h时与对照组接近或较小幅度升高, 感染8 h时呈现最大幅度升高, 为对照组的4.4~11.5倍。黄嘌呤(xanthine)和次黄嘌呤(hypoxanthine)在感染后呈现先降低后升高而后回落至接近正常水平的趋势, 2 h、4 h低于对照组, 8 h明显升高达到峰值(对照组的5.75和11.30倍)后, 12 h降到接近正常水平。4-吡哆酸(4-pyridoxic acid)在感染后2 h先降低, 而后逐步上升, 在12 h上升至对照组的2倍左右; 烟酰胺(nicotinamide)感染后2 h接近对照组, 4 h达到最大值, 之后降低, 12 h时至对照组的0.58倍。吲哚酚硫酸盐(indoxyl sulfate)在2 h升至最高(对照组的3倍), 而后逐步降至正常水平附近。其余36种代谢物含量除部分代谢物在感染后2 h有小幅度降低外, 整体呈明显升高趋势, 其中胞嘧啶(cytosine)、L-棕榈酰基肉碱(L-palmitoylcarnitine)、硬脂酰肉毒碱(stearoylcarnitine)、20-羟-二十烷四烯酸(20-hydroxyeicosatetraenoic acid)、牛磺胆酸盐(taurocholate)、牛磺脱氧胆酸(taurodeoxycholic acid)、牛磺熊去氧胆酸(tauroursodeoxycholic acid)、别胱硫醚(allocystathionine)和二氨基庚二酸(diaminopimelic acid)的含量在感染后8~12 h甚至达到对照组的5倍以上(表 2)。
| Table 2 Differentially expressed metabolites of K. pneumoniae infected mice in comparison to the controls. aFold change was calculated by ratio of mean values of group 2 h to control, 4 h to control, 8 h to control and 12 h to control. Fold change with a value greater than 1 indicates a relatively higher concentration present in infected mice, while a value less than 1 means a relatively lower concentration |
生物体中的复杂代谢反应及其调控并不单独进行, 往往由不同基因和蛋白质形成复杂的通路和网络, 它们的相互影响和相互调控最终导致代谢组发生系统性改变。首先将检测出的差异代谢物进行KEGG分析, 整理出差异代谢物对对应物种小鼠(Mus musculus)的通路映射的所有代谢通路, 然后通过MetaboAnalyst对差异代谢物所在通路进行综合分析, 获得在感染后不同时间脓毒症相关潜在靶标路径[8], 其拓扑分析及富集分析结果以气泡图表示(图 3)。通过对代谢通路进一步筛选发现有8个代谢通路在疾病发展过程中受到较大干扰, 涉及检测到的18种差异代谢物, 其中有代谢物涉及多条代谢通路。为直观展示潜在靶标路径所对应的差异代谢物在小鼠感染后动态变化过程, 对其相对含量Fold change取以2为底的对数做折线图。图 4可以看出烟酸和烟酰胺代谢所涉及的代谢物整体呈先上升后下降的趋势, 其中烟酰胺含量降至正常水平以下; 嘧啶代谢、牛磺酸和亚牛磺酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸和脯氨酸代谢与D-谷氨酰胺和D-谷氨酸代谢中所涉及差异代谢物整体呈随时间逐步升高的趋势; 维生素B6代谢和甘油磷脂代谢整体呈下降趋势, 其中4-吡哆酸在2 h后开始回升并逐步高于正常水平。
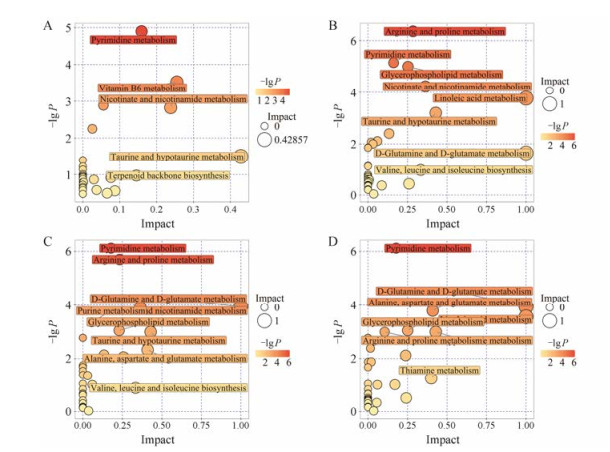
|
Figure 3 Bubble plot of pathway analysis. A: 2 h vs 0 h; B: 4 h vs 0 h; C: 8 h vs 0 h; D: 12 h vs 0 h |
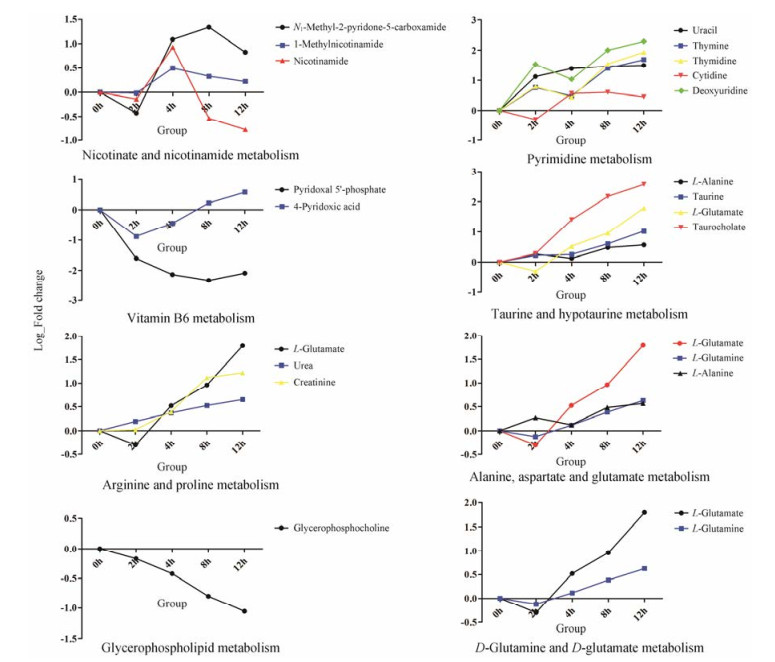
|
Figure 4 Metabolite concentration changes relative to corresponding controls at different time points after K. pneumoniae infection |
现今临床上常用于检测脓毒症的生物标志物具有一定的局限性, 例如C反应蛋白缺乏特异性, 降钙素原虽然灵敏度和特异性更高但无法确定感染的病原菌的种类、受体内因素影响较多且监测费用较高[4]。早期确诊脓毒症并评估疾病严重程度仍是临床上面临的重大问题。面对脓毒症复杂发病机制, 代谢组学具有精确、灵敏度高、技术更通用等优势, 改变了单一标志物检验的传统思想, 对患者体内各物质的变化进行全方位的监测, 以一组代谢物群体作为标志物来诊断疾病[9]。
本研究成功建立了肺炎克雷伯杆菌ATCC BAA 2146感染小鼠脓毒症模型以及UHPLC-QTOF-MS非靶向代谢组学分析方法, 方法稳定可行。通过OPLS-DA方法建立的模型表明脓毒症小鼠与健康小鼠的代谢存在明显差异。研究筛选到58种潜在标志物并对其在感染早期的含量变化进行了跟踪, 发现在疾病发展过程中涉及18种代谢物的8条代谢通路受到较大干扰, 涉及到氨基酸和脂类代谢紊乱、氧化应激及炎症反应, 与脓毒症的病理生理变化密切相关。
脓毒症时机体处于高耗能、氧供需失衡等状态[10], 检测结果显示血浆中多种氨基酸含量升高, 推测原因为主要供能物质糖类不能正常通过三羧酸循环途径进行有氧氧化, 外周组织蛋白质的分解增加为机体提供能量, 也反映了机体在维持能量代谢稳态的代偿机制。20-羟-二十烷四烯酸可激活内皮细胞烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶系统和核因子-κB (nuclear factor-κB, NF-κB)通路发挥氧化应激和促炎作用[11], 牛磺酸、烟酰胺和谷氨酰胺等物质具有一定的抗炎、抗氧化作用[12, 13], 其含量的升高可能与机体组织的代谢紊乱和氧化应激作用相关。病原菌的入侵激发了机体的氧化应激反应、产生了氧化活性物质, 牛磺酸、烟酰胺以及谷氨酰胺等物质含量的升高可以降低过强的氧化作用对宿主机体的损伤。维生素B6作为氨基酸和神经递质等物质合成的辅酶, 在促进机体正常酶代谢方面起到十分重要的作用。在小鼠感染脓毒症后, 作为维生素B6活性形式的5'-磷酸吡哆醛含量明显下降。而与此结果一致的是, 有研究表明高剂量的5'-磷酸吡哆醛可以通过抑制胱硫醚-γ-裂合酶(cystathionine gamma-lyase enzyme, CSE)的活性降低血管内皮硫化氢的生成, 从而保护脓毒症相关的血管功能障碍并降低死亡率[14]。
脓毒症会导致多功能器官的损害, 胆酸、脱氧胆酸、牛磺胆酸盐、牛黄脱氧胆酸以及牛磺熊去氧胆酸含量的明显升高, 其可能与脓毒症引起的肝功能异常有关, 胆汁酸的合成、代谢和转运异常引起严重的胆汁淤积, 导致血浆中胆汁酸含量升高[15]。肌酐的含量与肾的正常功能密切相关, 其含量的波动升高可能由脓毒症引起的急性肾损伤导致。
文献[16]报道肠道微生物的改变可以引起马尿酸和吲哚酚硫酸盐含量的变化, 本研究中马尿酸含量的下降和吲哚酚硫酸盐含量的上下波动可能与脓毒症引起的肠道微生物的紊乱有关[17]。在小鼠感染后甘油磷酰胆碱含量的不断降低, 此前有关于大鼠脓毒症代谢组学的研究发现在感染大鼠血浆中的甘油磷酰胆碱明显低于对照组[17], 高胆碱饮食可以提高内毒素休克大鼠的存活率[18]。也有研究发现与SIRS患者相比, 脓毒症患者体内甘油磷酰胆碱含量较低, 且在脓毒症死亡患者体内呈现更低的水平[19]。此外, 检测到二氨基庚二酸含量在小鼠感染4 h后不断上升, 其为一种中性氨基酸, 除金葡菌和乳酸杆菌外, 几乎存在于所有细菌的细胞壁中。感染后的小鼠血浆中的二氨基庚二酸含量的升高, 可能与细菌在血液中的增殖和裂解有关, 或许可以通过该物质指示血液中的细菌水平。
总之, 本研究从整体水平反映了细菌感染脓毒症内源性小分子的代谢变化, 有助于深入研究脓毒症发病机制, 发现可能的生物标志物, 为细菌感染脓毒症早期诊断和疗效评价提供参考和借鉴, 进一步的靶向代谢组学研究正在进行中。
| [1] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of clinical criteria for sepsis:for the third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315: 775–787. DOI:10.1001/jama.2016.0289 |
| [2] | Nicholson JK, Lindon JC, Holmes E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29: 1181–1189. DOI:10.1080/004982599238047 |
| [3] | Pierrakos C, Vincent JL. Sepsis biomarkers:a review[J]. Critical Care, 2010, 14: R15. DOI:10.1186/cc8872 |
| [4] | Xu C, Xu YH. The research progress of early warning biomarker for sepsis[J]. Lab Med (检验医学), 2015, 30: 533–536. |
| [5] | Dunn WB, Broadhurst D, Begley P, et al. Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry[J]. Nat Protoc, 2011, 6: 1060–1083. DOI:10.1038/nprot.2011.335 |
| [6] | Abdi H, Williams LJ. Principal component analysis[J]. WIREs Comp Stat, 2010, 2: 433–459. DOI:10.1002/wics.101 |
| [7] | Trygg J, Wold S. Orthogonal projections to latent structures (O-PLS)[J]. J Chemom, 2002, 16: 119–128. DOI:10.1002/(ISSN)1099-128X |
| [8] | Xia J, Sinelnikov IV, Han B, et al. MetaboAnalyst 3.0——making metabolomics more meaningful[J]. Nucleic Acids Res, 2015, 43: W251. DOI:10.1093/nar/gkv380 |
| [9] | Pham-Tuan H, Kaskavelis L, Daykin CA, et al. Method development in high-performance liquid chromatography for high-throughput profiling and metabonomic studies of biofluid samples[J]. J Chromatogr B, 2003, 789: 283–301. DOI:10.1016/S1570-0232(03)00077-1 |
| [10] | Duranbedolla J, Ma OS, Saldañanavor V, et al. Sepsis, mitochondrial failure and multiple organ dysfunction[J]. Clin Investig Med, 2014, 37: E58–E69. DOI:10.25011/cim.v37i2.21087 |
| [11] | Li H, Zhu Y. Progress of studies in 20-hydroxyeicosatetraenoic acid on vascular endothelium[J]. Prog Physiol Sci (生理科学进展), 2013, 44: 1–5. |
| [12] | Huxtable RJ. Physiological action of taurine[J]. Physiol Rev, 1992, 72: 101–163. DOI:10.1152/physrev.1992.72.1.101 |
| [13] | Cao JR, Luo B, Wang HY, et al. A study on protective effect of glutamine on oxidative stress injury in mice with sepsis[J]. Chin J Integr Tradit Western Med Intensive Crit Care (中国中西医结合急救杂志), 2015, 22: 374–377. |
| [14] | Park JT. The effects of pyridoxal 5-phosphate (PLP) pretreatment in cecal ligation and puncture induced sepsis in mice[J]. J Crit Care, 2015, 30: 830–830. |
| [15] | Recknagel P, Gonnert FA, Westermann M, et al. Liver dysfunction and phosphatidylinositol-3-kinase signalling in early sepsis:experimental studies in rodent models of peritonitis[J]. PLoS Med, 2012, 9: e1001338. DOI:10.1371/journal.pmed.1001338 |
| [16] | Swann JR, Tuohy KM, Lindfors P, et al. Variation in antibiotic-induced microbial recolonization impacts on the host metabolic phenotypes of rats[J]. J Proteome Res, 2011, 10: 3590–3603. DOI:10.1021/pr200243t |
| [17] | Dong F, Wang B, Zhang L, et al. Metabolic response to Klebsiella pneumoniae infection in an experimental rat model[J]. PLoS One, 2012, 7: e51060. DOI:10.1371/journal.pone.0051060 |
| [18] | Rivera CA, Wheeler MD, Enomoto N, et al. A choline-rich diet improves survival in a rat model of endotoxin shock[J]. Am J Physiol, 1998, 275: G862–G867. |
| [19] | Langley RJ, Tsalik EL, van Velkinburgh JC, et al. An integrated clinico-metabolomic model improves prediction of death in sepsis[J]. Sci Transl Med, 2013, 5: 195ra95. |
 2018, Vol. 53
2018, Vol. 53


