2. 中国人民解放军第四军医大学药学院, 陕西 西安 710032;
3. 中国人民解放军第四军医大学西京医院, 陕西 西安 710032
2. School of Pharmacy, the Fourth Military Medical University, Xi'an 710032, China;
3. Xijing Hospital, the Fourth Military Medical University, Xi'an 710032, China
失眠是指患者对睡眠时间和(或)质量不满足并影响日间社会功能的一种主观体验。根据失眠症国际诊断标准以及流行病学研究, 全世界至少有6%的人遭受失眠和睡眠紊乱[1]。目前临床治疗失眠的药物[2]主要包括苯二氮䓬类受体(γ-氨基丁酸A受体, GABAA receptor)激动剂(如地西泮等)、非苯二氮䓬类镇静剂(如唑吡坦等)、褪黑素受体激动剂(如阿戈美拉汀等)和具有催眠效果的抗抑郁药物(如米氮平等), 但其中大多数药物的主要用途不是治疗失眠, 而是起镇静作用。2014年8月13日, 美国FDA批准默克公司研发的苏沃雷生(suvorexant, 商品名Belsomra)用于治疗失眠症[3], 使其成为第一个上市的食欲素受体拮抗剂(orexin receptor antagonist, ORA)。苏沃雷生临床使用的重要意义在于它是一种专门用于治疗失眠的药物, 该类药物有着全新的靶点和作用机制[4-7]。
1 食欲素体系的发现和基本功能早在1998年, Sakurai等[8]和de Lecea等[9]分别独立发现了食欲素体系(orexin system), 该体系能显著调节受试对象的进食行为, 影响食欲。该体系包括两个G-蛋白偶联受体:食欲素-1受体(orexin-1 receptor, OX1R)和食欲素-2受体(orexin-2 receptor, OX2R), 以及两个神经递质肽激动剂:食欲素-A (orexin A, OX-A)和食欲素-B (orexin B, OX-B)。作为神经递质肽激动剂的OX-A和OX-B产生于下丘脑部位, OX-A是具有33个氨基酸序列的多肽, 能够以同样强度激活OX1R和OX2R; 而OX-B是具有28个氨基酸序列的多肽, 只能以中等程度选择性地激活OX2R, 这两种食欲素受体在整个中枢神经系统(central nervous system, CNS)均有广泛表达。Lin等[10]证实, OX2R功能的丧失与嗜睡症之间有着必然联系, 使人们对失眠的认识由睡眠紊乱过渡到病症层次, 即失眠也是一种疾病。此后的多项研究表明, 食欲素体系的影响力遍及睡眠、成瘾、食欲、压力、焦虑、疼痛以及奖赏等多个方面[4-7], 食欲素体系广泛存在于哺乳动物体内, 其结构和功能上的共性使得以该体系作为靶点研制药物成为可能。食欲素可使人保持清醒, 如果有一种小分子药物, 能够竞争性地阻断食欲素和食欲素受体的结合, 就可以使人尽快进入睡眠状态, 可用于治疗失眠和睡眠紊乱。食欲素受体拮抗剂(ORA)应运而生, 苏沃雷生就是其中的优秀代表[11-13]。
2 食欲素受体拮抗剂研究进展由于食欲素OX-A和OX-B分别对应食欲素受体OX1R和OX2R, 因此有关食欲素受体拮抗剂的研究从一开始就分为两大类:一类为选择性食欲素受体拮抗剂(即SORAs)[14], 该类拮抗剂对食欲素受体OX1R和OX2R亲和力具有显著差异; 另一类称为双重食欲素受体拮抗剂(即DORAs)[4-7], 这类拮抗剂对食欲素受体OX1R和OX2R有着类似的亲和力, 不具有选择性。
选择性的界定来源于化合物或候选药物的生物活性测试, 这种测试使用高通量筛选(high-throughput screening, HTS)技术, 通过荧光成像来测定中国地鼠卵巢细胞表达的食欲素受体对食欲素诱导的细胞内钙离子释放的抑制作用[15, 16]。一般用IC50、KB或pKB表示测试药物对食欲素受体的亲和力(当采用放射配基结合分析时, 用Ki或pKi表示该药物的亲和力), 当一种药物对其中一类食欲素受体的亲和力大于另一类食欲素受体的亲和力20倍以上时[14, 17], 这种受测药物就称为选择性食欲素受体拮抗剂; 反之为双重食欲素受体拮抗剂。
2.1 选择性食欲素受体拮抗剂(SORAs)研究进展 2.1.1 选择性食欲素-1受体拮抗剂(1-SORAs)1-SORAs的化学母核结构主要包括喹啉脲类(图 1, 1~5)和四氢异喹啉类(图 1, 9~12)。
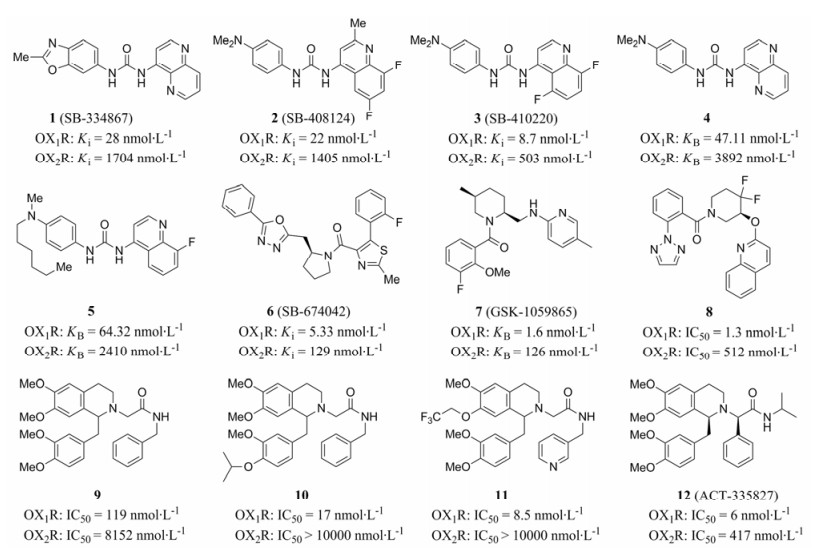
|
Figure 1 Chemical structures of selective orexin receptor-1 antagonists (1-SORAs) |
葛兰素-史克公司(GSK)的Smart和Porter等[15]率先发现喹啉脲类化合物可作为1-SORAs, 尤其是化合物1 (SB-334867, 被认为是第一个1-SORAs), 可通过血脑屏障, 对OX1R的亲和力强(Ki = 28 nmol·L-1, 对OX2R的Ki = 1 704 nmol·L-1), 遗憾的是1缺乏口服生物利用度, 对两种5-羟基色胺受体(5-HT)亚型(5-HT2B和5-HT2C)也具有较强的亲和力(pKi分别为8.6和7.6), 且与OX1R的结合具有可逆性, 在实验中导致大鼠的修饰行为, 没有明显的镇静催眠作用, 导致1缺乏成药性, 但1在食欲素药理学研究中功不可没, 迄今已有超过200篇论著用1作为参照化合物。Porter等[16]合成的化合物2 (SB-408124)和3 (SB-410220)具有良好的口服生物利用度, 对OX1R有很强的亲和力(Ki值分别达到22和8.7 nmol·L-1)。Perrey等[17]合成了化合物1的一系列类似物, 构效关系研究表明, 当使用2, 4-二取代苯胺基替换1中的2-甲基苯并噁唑基时, 可获得与1类似的生理活性。Langmead等[18]首次报道了基于手性吡咯烷骨架的化合物6 (SB-674042), 对OX1R有很强的亲和力(Ki = 5.33 nmol·L-1), 其在食欲素药理学上占有非常重要的地位, 这是因为6的氚化物在大鼠实验中首次提供了放射配基结合OX1R的强力证据, 此后有关食欲素受体拮抗剂放射配基的研究均参照该项实验。默克(Merck)公司Kuduk等[19]合成了260多个4, 4-二氟代哌啶酰胺化合物, 从中筛选出的8与OX1R有很强的亲和性, 其对OX1R的IC50低至1.3 nmol·L-1 (对OX2R的IC50 = 512 nmol·L-1), 有望进入临床研究。默克公司Koberstein等[20]发现, 具有四氢异喹啉主体结构的化合物是一类优秀的选择性食欲素-1受体(OX1R)拮抗剂, 先导化合物9对OX1R的IC50 = 119 nmol·L-1, 对OX2R的IC50 = 8 152 nmol·L-1, 选择性的差异不够明显, 但化合物10对OX1R的IC50低至17 nmol·L-1, 而对OX2R的IC50大于10 000 nmol·L-1, 是一个非常优秀的1-SORA。艾可泰隆(Actelion)公司Steiner等[21]在上述研究的基础上研制了口服药物12 (ACT-335827), 通过对大鼠的药理研究证实, 12可以选择性地和OX1R结合(对OX1R的IC50 = 6 nmol·L-1, 对OX2R的IC50 = 417 nmol·L-1), 但12并不具有催眠作用, 而是有助于缓解大鼠的恐惧压力和焦虑症状, 是一种非常有潜力的抗焦虑药物。
直到目前为止, 还没有选择性食欲素-1受体拮抗剂药物问世。
2.1.2 选择性食欲素-2受体拮抗剂(2-SORAs)相对1-SORAs而言, 2-SORAs的研究比较热, 强生(J & J)、默克和艾克泰隆等制药公司在本世纪初竞相展开2-SORAs的研究。
日本Banyu制药有限公司Hirose等[22]通过高通量筛选技术, 发现了第一个选择性食欲素-2受体拮抗剂13。13具有四氢异喹啉骨架, 对OX2R的亲和力是OX1R的250倍。艾克泰隆公司Aissaoui等[23]发现甘氨酸磺酰胺衍生物14对OX2R的IC50 = 2 nmol·L-1, 而对OX1R的IC50 > 10 000 nmol·L-1, 表明14是一种强效2-SORA。2004年, 强生公司McAtee等[24]合成了一系列1, 3-二取代脲类化合物, 从中筛选出化合物15 (JNJ-1037049), 对OX2R的亲和力是OX1R的600倍, 是优秀的2-SORAs。日本Takeda公司Fujimoto等[25]通过高通量筛选获得化合物17, 并以Hammet σp值为电子效应参数, 以Hansch π值为溶解度效应参数, 对其7-位进行修饰, 引入各种基团, 合成了一系列苯并氧氮杂䓬类化合物, 经过筛选发现化合物18表现优秀, 对OX2R的结合选择性是OX1R的100多倍, 体外和体内实验研究证实18具有很好水溶性、代谢稳定性和口服利用度, 显示了引入-CHF2的优越性。Merck公司Wager等[26]首次将螺环结构引入2-SORA的设计合成中, 获得化合物螺哌啶衍生物19, 化合物19具有低分子量、适度的亲水亲油性, 最重要的是具有相对刚性的螺环结构, 其对OX2R的结合选择性明显高于OX1R; 受Wager等研究工作启发, Fujimoto等[27]也合成了一系列基于螺哌啶结构的衍生物, 并从中筛选获得化合物20, 对OX2R的结合选择性是OX1R的450倍。
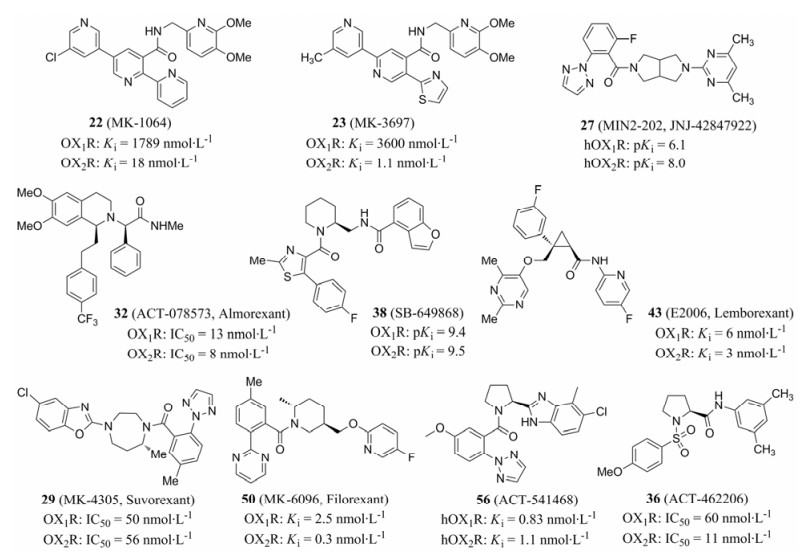
Merck公司研究人员Mercer等[28]合成了一系列2, 5-二芳基尼古丁酰胺类化合物, 并深入研究了该类化合物作为2-SORAs的构效关系, 化合物21脱颖而出, 仅需要0.07 nmol·L-1就可以拮抗OX2R, 对OX2R的选择性是OX1R的1 378倍; 体内实验表明, 21具有低到中等程度的体内清除率和较短的半衰期(对犬的半衰期为2.1 h, 大鼠为0.9 h)以及中等的口服生物利用率(对犬的口服生物利用率为37%, 大鼠为55%); 大鼠睡眠模型研究证实, 口服化合物21能显著改善大鼠的睡眠结构, 降低浅度睡眠时间。Roecker和Mercer等相继获得尼古丁酰胺类化合物22 (MK- 1064)[29]和23 (MK-3697)[30]。化合物22具有较好的口服生物利用率, 能强效拮抗OX2R, 但对酸不稳定且中等程度抑制细胞色素P450-3A4酶(CYP3A4)。Raheem等[31]合成了多取代手性哌啶醚类化合物24 (PE-6), 对OX2R的亲和浓度低至0.6 nmol·L-1, 是OX1R的1 600倍, 药代动力学研究显示口服一定剂量(30 mg·kg-1) 24, 起效快速, 血药浓度在半小时内可达到最大值, 可显著降低大鼠睡眠期的清醒时间, 增加非快速眼动(NREM)和快速眼动(REM)睡眠时间。
强生公司Bonaventure等[32, 33]合成了具有双环吡咯啉结构的化合物27 (JNJ-42847922), 是一种强效2-SORA。大鼠口服一定剂量的(30 mg·kg-1) 27, 能迅速通过血脑屏障, 在1 h时血药浓度达到最高, 并在4 h时迅速下降, 24 h完全清除出大脑, 可显著延长NREM睡眠时间, 对REM影响甚小, 具有临床研究潜力。图 2列举出2-SORAs的化学结构。
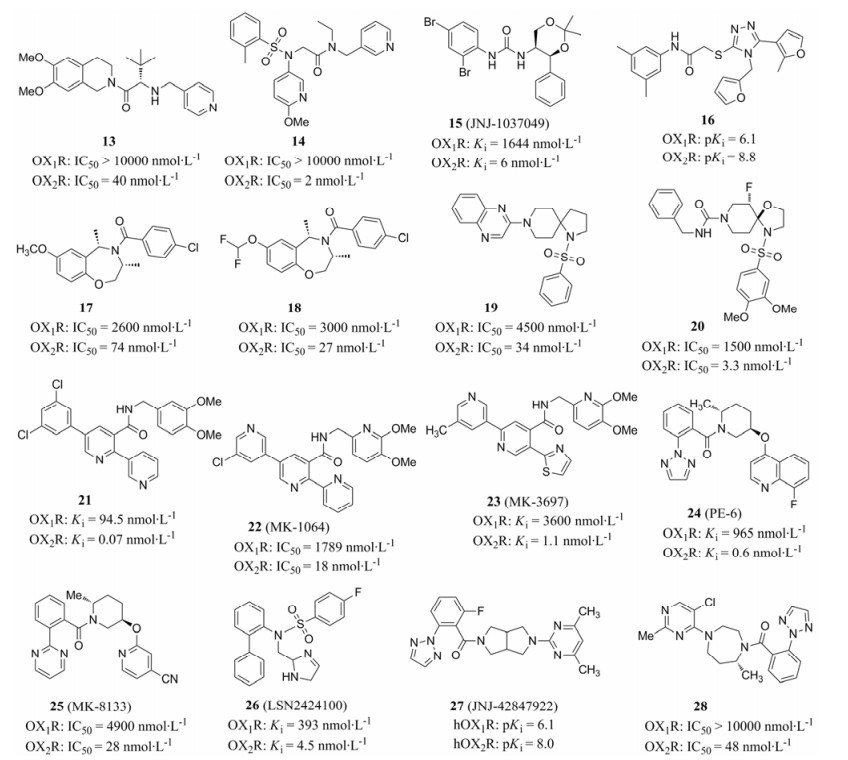
|
Figure 2 Chemical structures of selective orexin receptor-2 antagonists (2-SORAs) |
和1-SORAs一样, 到目前为止, 还没有2-SORAs药物问世。
2.2 双重食欲素受体拮抗剂(DORAs)研究进展从食欲素受体拮抗剂研究伊始, 选择性食欲素受体拮抗剂(SORAs)和双重食欲素受体拮抗剂(DORAs)之争就从未停息, 很多制药巨头同时开展了SORAs和DORAs研究。2014年8月, 美国FDA批准了Merck公司研发的苏沃雷生(29, MK-4305, suvorexant)[3, 34]上市, 成为第一个用于治疗失眠症的食欲素受体拮抗剂。苏沃雷生在药理作用上属于DORAs, 随着高分辨率(2.5 Å )人食欲素-2受体(hOX2R)与苏沃雷生结合的蛋白晶体结构解析[35], 人类第一次清晰观测到二者的结合点及最优构象, 使DORAs的研究进入黄金时期。
2.2.1 DORAs研究简况早在2001年, 艾克泰隆药业公司已经开始研究食欲素受体拮抗剂药物, 先后发现脲类化合物30[36]和甘氨酸磺酰胺化合物31[37]可作为DORAs, 显著改善大鼠睡眠结构。2007年, 该公司工作人员通过高通量筛选技术和构效关系研究获得四氢异喹啉类化合物32 (ACT-078573, 奥默雷生, almorexant)[38], 是一种十分优秀的DORA, 对OX1R和OX2R几乎具有同等程度的拮抗效能, 对大鼠和比格犬的生物实验研究表明, 32能减少从清醒进入有效睡眠的时间并显著增加REM和NREM睡眠的持续时间。基于以上动物实验结果, 32被用于失眠症志愿者, 进入临床Ⅰ期研究, 这是人类历史上第一个进入临床研究的DORA, 6名男性志愿者口服200 mg 32, 相继检测到47个与32相关的代谢产物, 口服生物利用率仅为11%, 且某些代谢产物具有较强的肝毒性, 临床研究被迫中断。Sifferlen等[39]对化合物32进行结构修饰, 分别引入吡唑环和咪唑环, 获得化合物33和34, 经初步生理实验表明, 33和34均属于强效DORAs, 能改善大鼠睡眠结构。该研究小组也合成了基于吡咯啉-2-酮骨架的化合物35[40], 体外研究证实35是一种强效DORAs, 对OX1R和OX2R的IC50降至10 nmol·L-1以下。该公司William等[41]合成了化合物37, 大鼠睡眠模型研究证实, 和苏沃雷生相比, 37具有相当短的半衰期(对OX1R为1.1 min, OX2R为5.4 min), 在100 mg·kg-1口服剂量下, 37能显著增加NREM和REM睡眠时间, 其效能与苏沃雷生相当。
葛兰素-史克公司报道了基于手性哌啶酰胺骨架的化合物38[42] (SB-649868)。大鼠药理实验表明, 38具有很强的蛋白结合性能和中等的浸润大脑能力, 半衰期短(0.6 h), 口服生物利用率高, 在10 mg·kg-1剂量下, 能显著增加大鼠NREM和REM睡眠时间, 这些优势使得38进入临床研究。一组失眠志愿者的实验中, 38在人体内的代谢产物共有8种, 其中一个代谢产物的半衰期长达39 h, 远远高于母药38在人体内的半衰期(5 h), 且另一种中间代谢产物具有较强毒性, 其临床研究被迫中断。化合物38和32的命运极其相似, 这说明药代动力学研究在新药研发中占有重要地位。
日本Eisai公司Yoshida等[43]合成了一系列基于1, 2-顺式取代环丙烷骨架的化合物, 经过筛选发现41和42可作为DORAs, 其中41对OX1R和OX2R的Ki均为7.2 nmol·L-1, 酰胺基可能通过氢键作用增强与食欲素受体的结合能力; 42是手性化合物, 在30和100 mg·kg-1口服剂量下, 42能显著增加大鼠的NREM睡眠时间, 但对REM睡眠无显著影响。通过构效关系研究, Yoshida等[44]对42进一步优化, 引入嘧啶环和-F原子, 获得化合物43 (E2006)。和42相比, 43具有更为优秀的药代动力学指标, 大鼠睡眠实验研究表明, 在30和100 mg·kg-1口服剂量下, 43能显著增加NREM和REM睡眠时间, 对大鼠睡眠结构的改善更加合理, 目前43已进入临床试验阶段。Taisho药业公司Suzuki等[45]合成了化合物44 (TASP0428980), 药代动力学研究显示, 44口服生物利用率好, 大脑浸润能力强, 起效迅速, 半衰期短(1.2~1.4 h), 在3 mg·kg-1口服剂量下, 能同时改善NREM和REM睡眠时间, 是一个非常优秀的双重食欲素受体拮抗剂(DORA), 有望进入临床研究。图 3列举出DORAs的化学结构。

|
Figure 3 Chemical structures of dual orexin receptor antagonists (DORAs) |
默克公司从2005年介入DORAs研究, 苏沃雷生(29, MK-4305, suvorexant)的上市成为DORAs研究领域的成功典范。默克研发团队利用高通量筛选(HTS)技术获得哌啶醚类化合物46[46], 46能强效拮抗OX1R和OX2R, 但其物理化学性质不佳, 不适合进行后续研究。开环二胺47被用于大鼠睡眠研究[47], 由于其药代动力学性质不符合成药性要求, 研发人员再次回归到环状结构, 以减少由单键自由旋转所造成的代谢毒性, 经过多次实验, 获得了具有1, 4-二氮环庚烷结构的化合物48, 在100 mg·kg-1口服剂量下, 48能显著增加大鼠NREM和REM睡眠时间[48], 但还是因为药代动力学指标达不到临床研究而中断。通过48的X-ray单晶衍射结构发现, 其结构中的两个芳香基团之间存在π-π堆积作用, 使得48采取了U-型构象, 计算化学表明该构象是48的优势构象(能量最低的构象), 据此推测48和食欲素受体结合时极有可能也采取U-型构象[49], 2014年药物研发科学家获得了人食欲素受体与苏沃雷生29结合的晶体结构[35], 使这一推测得到证实, 这是食欲素受体拮抗剂研究领域的重大发现, 给该类药物的开发带来深远影响。对48药代动力学研究发现, 其在体内代谢的氧化产物主要来源于母体结构中的甲苯基团、喹唑啉基团和1, 4-二氮环庚烷。去除苯环上的甲基, 在喹唑啉环上引入-F原子, 在1, 4-二氮环庚烷上引入甲基, 获得化合物49, 49的口服剂量降至10 mg·kg-1, 可产生与46相当的生理效能, 这些改进并未使药代动力学性质得以改善, 反而具有较高的代谢毒性。研发人员再次对49结构中的杂环基团进行多次调整, 发现将氟代喹唑啉基团换成氯代苯并噁唑基团, 得到化合物29[3, 34, 50, 51], 对大鼠和狗的代谢毒性大大降低, 29最终通过临床研究成为第一个双重食欲素受体拮抗剂药物, 用于治疗睡眠紊乱, 并冠以苏沃雷生上市。默克公司随后对手性哌啶醚类化合物46进行再次改造, 获得双重食欲素受体强效拮抗剂50 (MK-6096, 费罗雷生, filorexant)[52, 53]。图 4给出suvorexant的研发历程。
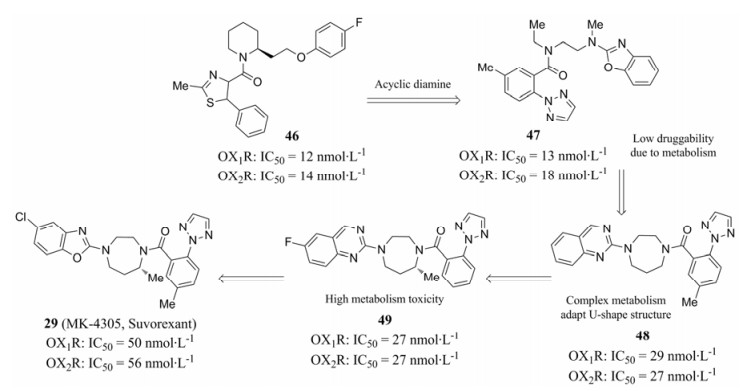
|
Figure 4 The development of suvorexant |
食欲素受体拮抗剂药物研究领域的一个特殊现象就是药理转换(pharmacology switching)[4], 这一现象指对具有同一母体化学结构的食欲素受体拮抗剂的化学基团(或取代基)进行微小变动, 就可获得药物效能的转换, 即含有相同主体结构的1-SORAs、2-SORAs和DORAs之间可进行转换。
例如具有四氢异喹啉主体结构的食欲素受体拮抗剂之间的药理转换, 涉及优秀的DORA——奥默雷生32的发现(图 5)。
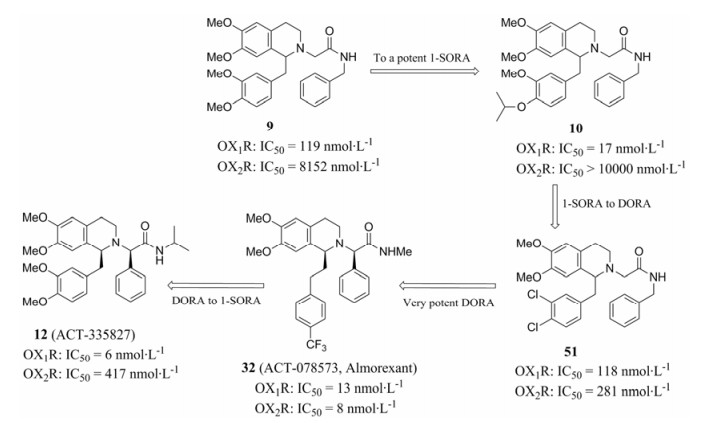
|
Figure 5 Examples of pharmacology switching between 1-SORAs and DORAs |
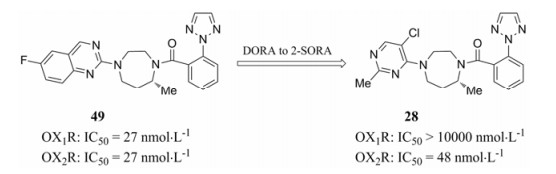
具有手性1, 4-二氮杂䓬主体结构的DORA (化合物49)只需改变芳香取代基, 就可获得性能优异的2-SORA (化合物28, 图 6)。
|
Figure 6 Example of pharmacology switching DORA to 2-SORA |
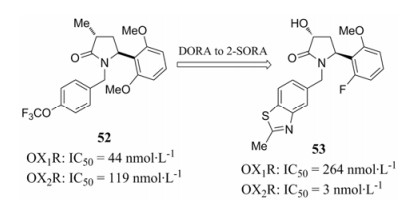
图 7给出多取代吡咯烷-2-酮主体结构食欲素受体拮抗剂的药理转换。
|
Figure 7 Another example of pharmacology switching DORA to 2-SORA |
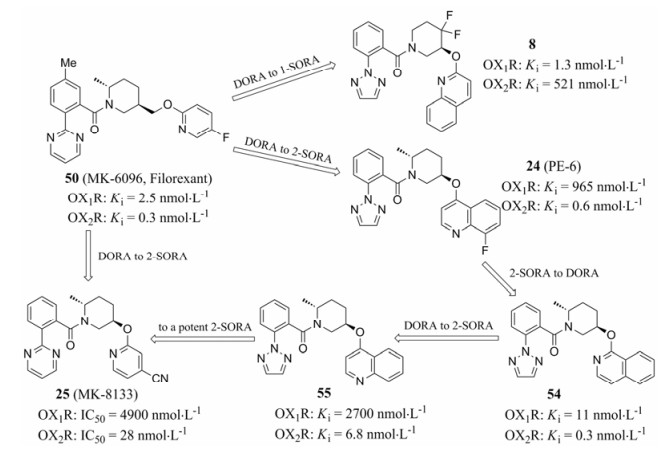
具有2, 5—二取代哌啶主体结构的食欲素受体拮抗剂之间的药理转换, 例如24 (PE-6)到54的转换, 仅有细微差别, 就从2-SORA转变成DORA (图 8)。
|
Figure 8 Examples of pharmacology switching DORAs to SORAs |
药理转换这一特性使得人们在研究一类食欲素受体药物的同时, 可以开发出具有同一主体结构的其他种类的药物。
2.4 进入临床研究的食欲素受体拮抗剂文献报道的食欲素受体拮抗剂种类繁多, 涉及的化合物有数百种, 但绝大多数仅限于临床前研究, 能进入临床研究的寥寥无几。
截至目前, 共有10个化合物进入临床研究, 包括6个DORAs和4个2-SORAs, 其中奥默雷生、费罗雷生以及SB-649868的临床研究已经中断。令人欣慰的是Eisai公司的莱博雷生(E2006, lemborexant)[54]于2016年进入临床Ⅲ期研究。Janssen公司2-SORAs的研究进展顺利, 有1个药物(MIN-202, 即JNJ- 42847922)于2015年12月进入临床Ⅱ期研究[55]。2017年, Idorsia公司的化合物56 (ACT-541468)已进入临床Ⅱ期研究。
表 1和图 9列举了进入临床研究的食欲素受体拮抗剂药物的情况。
| Table 1 Orexin receptor antagonists (ORAs) entered human clinical trials |
|
Figure 9 Chemical structures of orexin receptor antagonists (ORAs) entered human clinical trials |
食欲素体系的发现(1998年)至今近20年, 针对这一靶点的药物研究也有十多年(2001年)的历史, 第一个食欲素受体拮抗剂药物苏沃雷生的上市是在2014年, 很多制药公司和研究人员做出了不懈努力, 但其中奥秘仍未全部解开, 还有不少领域亟待开发[56, 57]。首先, 食欲素体系是一个十分复杂的生理体系, 它的影响遍及全身, 与食欲、情绪、睡眠、成瘾、奖赏等人类生理活动关系密切, 目前药物研究仅针对睡眠紊乱, 因此还有很大空间需要开发[5, 11], 例如以食欲素体系为靶点, 可以研制出治疗肥胖症或精神疾病的良药; 其次, 苏沃雷生是双重食欲素受体拮抗剂(DORAs), DORAs和选择性食欲素受体拮抗剂(SORAs)对失眠症治疗效果之争一直存在, 近期有研究显示2-SORAs在治疗失眠症方面优于DORAs, 但这仍有待于实践和患者检验; 最后, 目前还没有1-SORAs进入临床研究, 动物实验显示1-SORAs在治疗强迫症和成瘾性方面表现优秀, 希望在不久的将来, 有1-SORAs进入临床研究。
| [1] | Coleman PJ, Gotter AL, Herring WJ, et al. The discovery of Suvorexant, the first orexin receptor drug for insomnia[J]. Ann Rev Pharmacol Toxicol, 2017, 57: 509–533. DOI:10.1146/annurev-pharmtox-010716-104837 |
| [2] | Zisapel N. Current Phase Ⅱ investigational therapies for insomnia[J]. Expert Opin Investig Drugs, 2014, 24: 1–11. |
| [3] | US FDA. FDA approves new type of sleep drug, Belsomra[EB/OL]. 2014-08-13. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm409950.htm. |
| [4] | Roecker AJ, Cox CD, Coleman PJ. Orexin receptor antagonists:new therapeutic agents for the treatment of insomnia[J]. J Med Chem, 2016, 59: 504–530. DOI:10.1021/acs.jmedchem.5b00832 |
| [5] | Roch BC. Recent trends in orexin research-2010 to 2015[J]. Bioorg Med Chem Lett, 2015, 25: 2875–2887. DOI:10.1016/j.bmcl.2015.05.012 |
| [6] | Christopher JA. Small-molecule antagonists of the orexin receptors[J]. Pharm Pat Anal, 2014, 3: 625–638. DOI:10.4155/ppa.14.46 |
| [7] | Kumar A, Chanana P, Choudhary S. Emerging role of orexin antagonists in insomnia therapeutics:an update on SORAs and DORAs[J]. Pharmacol Rep, 2016, 68: 231–242. DOI:10.1016/j.pharep.2015.09.002 |
| [8] | Sakurai T, Amemiya A, Ishii M, et al. Orexins and orexin receptors:a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92: 573–585. DOI:10.1016/S0092-8674(00)80949-6 |
| [9] | de Lecea L, Kilduff TS, Peyron C, et al. The hypocretins:hypothalamus-specific peptides with neuroexcitatory activity[J]. Proc Natl Acad Sci USA, 1998, 95: 322–327. DOI:10.1073/pnas.95.1.322 |
| [10] | Lin L, Faraco J, Li R, et al. The sleep disorder canine narcolepsy is caused by a mutation in the hypocrein (orexin) receptor 2 gene[J]. Cell, 1999, 98: 365–376. DOI:10.1016/S0092-8674(00)81965-0 |
| [11] | Guo ZR. Suvorexant-the first drug to be developed by the pharmaceutical chemical method[J]. Acta Pharm Sin (药学学报), 2016, 51: 1934–1938. |
| [12] | Arch JRS, Williams G, Wilson S. Orexins and obesity[J]. Neurosci News, 1999, 2: 37–42. |
| [13] | Scammell TE, Winrow CJ. Orexin receptors:pharmacology and therapeutic opportunities[J]. Annu Rev Pharmacol Toxicol, 2011, 51: 243–266. DOI:10.1146/annurev-pharmtox-010510-100528 |
| [14] | Lebold TP, Bonaventure P, Shireman BT. Selective orexin receptor antagonists[J]. Bioorg Med Chem Lett, 2013, 23: 4761–4769. DOI:10.1016/j.bmcl.2013.06.057 |
| [15] | Porter RA, Chan WN, Coulton S, et al. 1, 3-Biarylureas as selective non-peptide antagonists of the orexin-1 receptor[J]. Bioorg Med Chem Lett, 2001, 11: 1907–1910. DOI:10.1016/S0960-894X(01)00343-2 |
| [16] | Smart D, Sabido-David C, Brough SJ, et al. SB-334867:the first selective orexin-1 receptor antagonist[J]. Br J Pharmacol, 2001, 132: 1179–1182. DOI:10.1038/sj.bjp.0703953 |
| [17] | Perrey DA, Gilmour BP, Runyon SP, et al. Diaryl urea analogues of SB-334867 as orexin-1 receptor antagonists[J]. Bioorg Med Chem Lett, 2011, 21: 2980–2985. DOI:10.1016/j.bmcl.2011.03.048 |
| [18] | Langmead CJ, Jerman JC, Brough SJ, et al. Characterization of the binding of[3H]-SB-674042, a novel nonpeptide antagonist, to the human orexin-1 receptor[J]. Br J Pharmacol, 2004, 141: 340–346. DOI:10.1038/sj.bjp.0705610 |
| [19] | Kuduk S, Cooke A. Stump C, et al. 4-Fluoropiperidine orexin receptor antagonists: WO, 113303A1[P]. 2014-01-13. |
| [20] | Koberstein R, Aissaoui H, Bur D, et al. Tetrahydroisoquinolines as orexin receptor antagonists:strategies for lead optimization by solution-phase chemistry[J]. Chimia, 2003, 57: 270–275. DOI:10.2533/000942903777679361 |
| [21] | Steiner MA, Gatfield J, Brisbare-Roch C, et al. Discovery and characterization of ACT-335827, an orally available, brain penetrant orexin receptor type 1 selective antagonist[J]. ChemMedChem, 2013, 8: 898–903. DOI:10.1002/cmdc.201300003 |
| [22] | Hirose M, Egashira SI, Goto Y, et al. N-acyl 6, 7-dimethoxy-1, 2, 3, 4-tetrahydroisoquinoline:the first orexin-2 receptor selective non-peptidic antagonist[J]. Bioorg Med Chem Lett, 2003, 13: 4497–4499. DOI:10.1016/j.bmcl.2003.08.038 |
| [23] | Aissaoui H, Clozel M, Weller T, et al. Sulfonylamino-acetic acid derivatives: US, WO 2004033418[P]. 2004-04-22. |
| [24] | McAtee LC, Sutton SW, Rudolph DA, et al. Novel substituted 4-phenyl-[1, 3] dioxanes:potent and selective orexin receptor 2(OX2R) antagonists[J]. Bioorg Med Chem Lett, 2004, 14: 4225–4229. DOI:10.1016/j.bmcl.2004.06.032 |
| [25] | Fujimoto T, Kunitomo J, Tomata Y, et al. Discovery of potent, selective, orally active benzoxazepine-based orexin-2 receptor antagonists[J]. Bioorg Med Chem Lett, 2011, 21: 6414–6416. DOI:10.1016/j.bmcl.2011.08.093 |
| [26] | Wager TY, Chandrasekaran RY, Hou X, et al. Defining desirable central nervous system drug space through the alignment of molecular properties, in vitro ADME, and safety attributes[J]. ACS Chem Neurosci, 2010, 1: 420–434. DOI:10.1021/cn100007x |
| [27] | Fujimoto T, Tomata Y, Kunitomo J, et al. Discovery of spiropiperidine-based potent and selective orexin-2 receptor antagonists[J]. Bioorg Med Chem Lett, 2011, 21: 6409–6413. DOI:10.1016/j.bmcl.2011.08.094 |
| [28] | Mercer SP, Roecker AJ, Ganson S, et al. Discovery of 2, 5-diarylnicotinamides as selective orexin-2 receptor antagonists (2-SORAs)[J]. Bioorg Med Chem Lett, 2013, 23: 6620–6624. DOI:10.1016/j.bmcl.2013.10.045 |
| [29] | Roecker AJ, Mercer SP, Schreier JD, et al. Discovery of 5''-chloro-N-[(5, 6-dimethoxypyridin-2-yl)methyl]-2, 2':5', 3''-terpyridine-3'-carboxamide (MK-1064):a selective orexin-2 receptor antagonist (2-SORA) for the treatment ofinsomnia[J]. ChemMedChem, 2014, 9: 311–322. DOI:10.1002/cmdc.v9.2 |
| [30] | Roecker AJ, Reger TS, Mattern MC, et al. Discovery of MK-3697:a selective orexin 2 receptor antagonist (2-SORA) for the treatment of insomnia[J]. Bioorg Med Chem Lett, 2014, 24: 4884–4890. DOI:10.1016/j.bmcl.2014.08.041 |
| [31] | Raheem IT, Breslin MJ, Bruno J, et al. Discovery of piperidine ethers as selective orexin receptor antagonists (SORAs) inspired by Filorexant[J]. Bioorg Med Chem Lett, 2015, 25: 444–450. DOI:10.1016/j.bmcl.2014.12.056 |
| [32] | Bonaventure P, Shelton J, Yun SJ, et al. Characterization of JNJ-42847922, a selective orexin-2 receptor antagonist, as a clinical candidate for the treatment of insomnia[J]. J Pharmacol Exp Ther, 2015, 354: 471–482. DOI:10.1124/jpet.115.225466 |
| [33] | Letavic MA, Bonaventure P, Carruthers NI, et al. Novel octahydropyrrolo[3, 4-c]pyrroles are selective orexin-2 antagonists:SAR leading to a clinical candidate[J]. J Med Chem, 2015, 58: 5620–5636. DOI:10.1021/acs.jmedchem.5b00742 |
| [34] | Cox CD, Breslin MJ, Whitman DB, et al. Discovery of the dual orexin receptor antagonist[(7R)-4-(5-chloro-1, 3-benzoxazol-2-yl)-7-methyl-1, 4-diazepan-1-yl][5-methyl-2-(2H-1, 2, 3-triazol-2-yl)phenyl]methanone (MK-4305) for the treatment of insomnia[J]. J Med Chem, 2010, 53: 5320–5332. DOI:10.1021/jm100541c |
| [35] | Yin J, Mobarec JC, Kolb P, et al. Crystal structure of the human OX2 orexin receptor bound to the insomnia drug Suvorexant[J]. Nature, 2015, 519: 247–250. DOI:10.1038/nature14035 |
| [36] | Aissaoui H, Clozel M, Fischli W, et al. 7, 8, 9, 10-Tetrahydro-6H-azepino, 6, 7, 8, 9-tetrahydro-pyrido and 2, 3-dihydro-2H-pyrrolo[2, 1-B]-quinazolinone derivatives: WO, 004733[P]. 2004-01-15. |
| [37] | Aissaoui H, Koberstein R, Zumbrunn C, et al. N-Glycine-sulfonamides as potent dual orexin 1/orexin 2 receptor antagonists[J]. Bioorg Med Chem Lett, 2008, 18: 5729–5733. DOI:10.1016/j.bmcl.2008.09.079 |
| [38] | Brisbare-Roch C, Dingemanse J, Koberstein R, et al. Promotion of sleep by targeting the orexin system in rats, dogs, and humans[J]. Nat Med, 2007, 13: 150–155. DOI:10.1038/nm1544 |
| [39] | Sifferlen T, Koberstein R, Cottreel E, et al. Synthesis, structure-activity relationship studies, and identification of novel 5, 6, 7, 8-tetrahydroimidazo[1, 5-a]pyrazine derivatives as dualorexin receptor antagonists.Part 1[J]. Bioorg Med Chem Lett, 2013, 23: 2212–2216. DOI:10.1016/j.bmcl.2013.01.088 |
| [40] | Sifferlen T, Boller A, Chardonneau A, et al. Discovery of substituted lactams as novel dual orexin receptor antagonists:synthesis, preliminary structure-activity relationship studies and efforts towards improved metabolic stability and pharmacokinetic properties, Part 1[J]. Bioorg Med Chem Lett, 2014, 24: 1201–1208. DOI:10.1016/j.bmcl.2013.12.092 |
| [41] | Williams JT, Gatfield J, Roch C. Discovery and optimisation of 1-acyl-2-benzylpyrrolidines as potent dual orexin receptor antagonists[J]. Med Chem Commun, 2015, 6: 1054–1064. DOI:10.1039/C5MD00074B |
| [42] | Di Fabio R, Pellacani A, Faedo S, et al. Discovery process and pharmacological characterization of a novel dual orexin1 and orexin 2 receptor antagonist useful for treatment of sleep disorders[J]. Bioorg Med Chem Lett, 2011, 21: 5562–5567. DOI:10.1016/j.bmcl.2011.06.086 |
| [43] | Yoshida Y, Terauchi T, Naoe Y, et al. Design, synthesis, and structure-activity relationships of a seriesof novel N-aryl-2-phenylcyclopropanecarboxamide that are potent and orally active orexin receptor antagonists[J]. Bioorg Med Chem, 2014, 22: 6071–6088. DOI:10.1016/j.bmc.2014.08.034 |
| [44] | Yoshida Y, Naoe Y, Terauchi T, et al. Discovery of (1R, 2S)-2-{[(2, 4-dimethylpyrimidin-5-yl)oxy]methyl}-2-(3-fluorophenyl)-N-(5-fluoropyridin-2-yl)cyclopropanecarboxamide (E2006):a potent and efficacious oral orexin receptor antagonist[J]. J Med Chem, 2015, 58: 4648–4664. DOI:10.1021/acs.jmedchem.5b00217 |
| [45] | Suzuki R, Nozawa D, Futamura A, et al. Discovery and in vitro and in vivo profiles of N-ethyl-N-[2-[3-(5-fluoro-2-pyridinyl)-1H-pyrazol-1-yl]ethyl]-2-(2H-1, 2, 3-triazol-2-yl)-benzamide as a novel class of dual orexin receptor antagonist[J]. Bioorg Med Chem, 2015, 23: 1260–1275. DOI:10.1016/j.bmc.2015.01.044 |
| [46] | Coleman PJ, Cox CD, Roecker AJ. Discovery of dual orexin receptor antagonists (DORAs) for the treatment of insomnia[J]. Curr Top Med Chem, 2011, 11: 696–725. DOI:10.2174/1568026611109060696 |
| [47] | Whitman DB, Cox CD, Breslin MJ, et al. Discovery of a potent, CNS penetrant orexin receptor antagonist based on an N, N-disubstituted-1, 4-diazepane scaffold that promotes sleep in rats[J]. ChemMedChem, 2009, 4: 1069–1074. DOI:10.1002/cmdc.v4:7 |
| [48] | Cox CD, McGaughey GB, Bogusky M J, et al. Conformation alanalysis of N, N-disubstituted-1, 4-diazepane orexin receptor antagonists and implications for receptor binding[J]. Bioorg Med Chem Lett, 2009, 19: 2997–3001. DOI:10.1016/j.bmcl.2009.04.026 |
| [49] | Winrow CJ, Gotter AL, Cox CD, et al. Promotion of sleep by suvorexant-a novel dual orexin receptor antagonist[J]. J Neurogenet, 2011, 25: 52–61. DOI:10.3109/01677063.2011.566953 |
| [50] | McGaughey GB, Bayly CI, Cox CD, et al. Shaping suvorexant:application of experimental and theoretical methods for driving synthetic designs[J]. J Comput-Aided Mol Des, 2014, 28: 5–12. DOI:10.1007/s10822-014-9710-x |
| [51] | Winrow CJ, Gotter AL, Cox CD, et al. Pharmacological characterization of MK-6096:a dual orexin receptor antagonist for insomnia[J]. Neuropharmacology, 2012, 62: 978–987. DOI:10.1016/j.neuropharm.2011.10.003 |
| [52] | Coleman PJ, Schreier JD, Cox CD, et al. Discovery of[2R, 5R)-5-{{(5-fluoropyridin-2-yl)oxy]methyl}-2-methylpiperidin-1-yl][5-methyl-2-(pyrimidin-2-yl)phenyl]methanone (MK-6096):a dual orexin receptor antagonists with potent sleep-promoting properties[J]. ChemMedChem, 2012, 7: 415–424. DOI:10.1002/cmdc.201200025 |
| [53] | Connor KM, Mahoney E, Jackson S, et al. A phase Ⅱ dose-ranging study evaluating the efficacy and safety of the orexin receptor antagonist filorexant (MK-6096) in patients with primary insomnia[J]. Int J Neuropsychopharmacol, 2016, 19: pyw022. DOI:10.1093/ijnp/pyw022 |
| [54] | Murphy PJ, Yasuda S, Nakai K. Concentration-response modeling of ECG data from early-phase clinical studies as an alternative clinical and regulatory approach to assessing QT risk-experience from the development program of Lemborexant[J]. J Clin Pharm, 2017, 57: 96v104. |
| [55] | Bonaventure P, Shelton J, Yun SJ, et al. Characterization of JNJ-42847922, a selective orexin-2 receptor antagonist, as a clinical candidate for the treatment of insomnia[J]. J Pharmacol Exp Ther, 2015, 354: 471–482. DOI:10.1124/jpet.115.225466 |
| [56] | Skudlarek JW, DiMarco CN, Babaoglu K, et al. Investigation of orexin-2 selective receptor antagonists:structural modifications resulting in dual orexin receptor antagonists[J]. Bioorg Med Chem Lett, 2017, 27: 1364–1370. DOI:10.1016/j.bmcl.2017.02.012 |
| [57] | Razavi BM, Hosseinzadeh H. A review of the role of orexin system in pain modulation[J]. Biomed Pharmacother, 2017, 90: 187–193. DOI:10.1016/j.biopha.2017.03.053 |
 2018, Vol. 53
2018, Vol. 53


