2. 中国医学科学院药物研究所, 北京 100050;
3. 广西壮族自治区中医药研究院, 广西 南宁 530022
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Guangxi Institute of Chinese Medicine and Pharmaceutical Sciences, Nanning 530022, China
抑郁症是一种主要的人类精神疾病, 其致残问题比其他任何疾病都更为严重。据世界卫生组织报道, 在世界范围内, 大约3亿5千万人正遭受着抑郁症的折磨。抑郁症在心脏病、中风和艾滋病等致死、致残疾病中排名第9位。在中国, 抑郁症的发病率约为3.02%, 但这并不是实际的发病率, 由于病耻感、缺乏有效的治疗方法及缺乏足够的心理健康资源等原因, 抑郁症并不能得到广泛的诊断及治疗[1]。目前抗抑郁药物主要是增加突触单胺类神经递质的水平。尽管单胺水平变化很快, 但药物通常需要很长时间才能发挥作用, 在临床上抗抑郁药物的治疗效果并不尽如人意, 抑郁患者在服药期间往往伴有不良反应, 故亟待开发更为安全有效的药物[2]。
拟黑多刺蚁(Polyrhachis vicina Roger), 分类上属于膜翅目, 蚁科, 蚁亚科, 蚁属, 主要产于广西、贵州和云南等省。《周礼·天宫》和《礼记·内则》, 曰: “蚳醢以供天子馈食”; 《本草纲目》记载, 拟黑多刺蚁“扶正祛邪、补肾强身、活血化瘀、延年益寿。食之益气力、泽颜色”, 其药用价值及营养价值记录由来已久。中医临床上主要将其用于治疗风湿与类风湿性关节炎。现代科学研究证明, 拟黑多刺蚁除了抗痛风和镇痛作用外[3], 还可缓解疲劳、抗氧化、抗肿瘤[4, 5]等。现代学者对拟黑多刺蚁活性成分进行了深入研究, Zhao等[6]将拟黑多刺蚁提取物分成石油醚层、乙酸乙酯层、正丁醇层及水层4个部位, 石油醚层主要成分为十八碳烯酸等不饱和脂肪酸, 具有抗痛风性炎症和镇痛等作用。本课题组在前期预实验中发现, 石油醚层可缓解利血平引发的抑郁表现, 提升啮齿类动物血清中超氧化物歧化酶水平, 显著改善利血平引发的单胺类神经递质减少的症状, 故本文将在前期研究基础上, 对拟黑多刺蚁石油醚部位抗抑郁作用机制进行进一步研究。
材料与方法药物 拟黑多刺蚁石油醚部位(EPPR)自制。
动物 SD大鼠, 雄性, 体重200~220 g, SPF级, 购自斯贝福实验动物科技有限公司, 质量合格证号: SCXK (京) 2011-0004。动物饲养于明暗交替(12 h:12 h)的清洁级动物房中, 环境温度为20~22 ℃, 相对湿度为50%。
试剂 盐酸度洛西汀购自北京同仁堂, 批号: H20150287; NF-κBp65抗体购自美国Santa Cruz公司; Polyclonal Rabbit Anti-Glial Fibrillary Acidic Protein (GFAP)抗体购自丹麦Dako公司; IBAL-1抗体购自日本Wako公司; FITC-羊抗兔IgG荧光二抗、TRITC羊抗鼠IgG荧光二抗购自Sigma公司。Trizol试剂购自赛默飞世尔公司, 反转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix)和实时定量PCR试剂盒(TransStart Tip Green qPCR SuperMix)购自北京全式金生物技术有限公司; PCR基因特异性引物由北京擎科新业生物技术有限公司合成; 胞核胞浆蛋白制备试剂盒和BCA法蛋白定量试剂盒购自北京普利莱基因技术有限公司。实验用水均为双蒸水或三蒸水。
仪器 蛋白电泳系统电源(北京六一仪器厂); PCR仪(ABI公司); 激光共聚焦显微镜(卡尔·蔡司公司); 正置荧光显微镜(日本奥林巴斯公司)。
药物提取 将干燥的拟黑多刺蚁, 按固液比1:6 (g·mL -1), 加入食用酒精(95%乙醇)回流提取3次, 每次1 h, 合并滤液浓缩至0.9~1.2 mg·mL-1, 冷却, 用石油醚(60~90 ℃)萃取, 收集上层液, 浓缩至膏状, 即可。使用时, 用Tween 80乳化, 配成所需的浓度, 其中Tween 80含量为0.3 %。
动物分组及给药 动物随机分为6组, 即空白对照组、模型组、盐酸度洛西汀阳性对照组(3 mg·kg-1)和EPPR给药组(80、160和320 mg·kg-1)。实验前动物预适应1周, 自由饮食饮水。除空白对照组外, 其余动物进行慢性温和不可预见性刺激造模[7]。每日随机给予动物两种刺激, 这些刺激有:冰水游泳6 min、噪音2 h、通宵照明、昼夜颠倒、倾斜45° 12 h、夹尾2 min、禁食24 h、禁水2 h、湿垫料12 h、孤笼饲养48 h或拥挤12 h。造模同时进行灌胃给药, 给药组动物按照10 mL·kg-1体积灌胃给予不同剂量的EPPR和盐酸度洛西汀。连续给药4周后, 动物进行行为学检测。待行为学检测结束后, 所有动物禁食不禁水12 h, 处死动物, 一部分动物冰上快速取脑, 于-80 ℃冰箱保存, 用于生化指标检测; 另一部分用4%多聚甲醛溶液灌流固定后, 取脑, 石蜡包埋切片后进行组织化学检验。
糖水偏好实验 用大小相同的水瓶, 分别装有1%蔗糖水和饮用水, 同时给予大鼠, 预适应48 h。撤去水瓶。大鼠禁食禁水12 h后, 测定大鼠1 h内1%蔗糖水消耗量与饮用水的消耗量。计算蔗糖水消耗百分比。
蔗糖摄入百分比=糖水消耗量/ (糖水消耗量+饮用水消耗量) × 100%
强迫游泳实验 将大鼠置于直径50 cm, 水深30 cm, 水温(25 ± 2) ℃的透明圆桶中, 观察6 min, 记录大鼠在后4 min的不动时间, 不动状态:大鼠在水中停止挣扎, 或呈漂浮状态, 仅有细小肢体动作保持头部浮在水面。
H&E染色 取固定后的脑组织, 石蜡包埋, 切片(4 μm)。常规脱蜡, 水化。Harris苏木精5 min染色, 用自来水迅速洗去浮色, 双蒸水稍洗, 75%盐酸乙醇分化, 自来水冲洗切片返蓝, 双蒸水稍洗。封片。
免疫荧光染色 取固定后的脑组织, 石蜡包埋, 切片(4 μm)。脱蜡, 水化, PBS洗净, 枸橼酸盐缓冲液中高温抗原修复10 min, 室温冷却, 洗净, 0.5% Triton-100透化10 min, 洗净, 5% BSA封闭1 h, 滴加一抗(GFAP 1:200、Iba-1 1:200), 4 ℃过夜。次日复温30 min, 用PBST缓冲液冲洗干净, 避光, 滴加荧光二抗, 室温孵育2 h, 洗净, Hoechst 33342室温孵育15 min, 滴加90%甘油, 封片。激光共聚焦显微镜下观察图像。
qRT-PCR检测EPPR对抑郁大鼠炎症因子基因表达的影响 称取大鼠前额组织50 mg, 按照Trizol试剂盒说明书提取组织总RNA。在260和280 nm处测定吸光度值(OD), 计算RNA浓度。RNA样品浓度(μg·μL-1) = OD260×稀释倍数×40/1000。根据cDNA合成试剂盒说明书合成cDNA, 然后根据TransStart Tip Green qPCR SuperMix试剂盒说明书扩增反应。引物根据Genbank发表的基因序列, 利用Primer 6.0软件设计IL-1β、IL-6、TNF-α及IDO的基因PCR扩增引物, 并同时设计内参GAPDH基因扩增引物进行检测。序列见表 1。PCR反应体系: 20 μL; PCR反应条件: 94 ℃预变性30 s, 然后按94 ℃ 5 s、53 ℃ 15 s、72 ℃ 10 s共40个循环, 最后72 ℃延伸7 min。
| Table 1 Primer sequence |
免疫印迹实验 称量组织样品, 按照普利莱胞浆胞核提取试剂盒说明书制备胞浆胞核蛋白。按照BCA试剂盒计算各样品的吸光度值, 计算蛋白浓度。在处理的样品中加入4X SDS-Loading buffer, 混匀, 置于95 ℃水浴锅上加热15 min, 使蛋白质充分变性。制备的样品用于电泳, 转膜, 封闭2 h, 加一抗(NF-κB p65, 1:500), 4 ℃过夜。洗膜, 加二抗室温孵育2 h, 曝光。
统计学方法 数据统计采用Graphpad Prism 5软件进行分析, 对各组数据进行正态性检验和方差齐性检验, 在各组数据均正态分布且方差齐性的条件下用one-way ANOVA进行方差分析及t检验进行组间比较。实验结果用x± s表示, 统计学分析检验水准为0.05。
结果 1 拟黑多刺蚁石油醚部位可显著改善慢性应激诱导的大鼠抑郁样行为糖水偏好与强迫游泳实验显示, 与正常对照组比较, 模型组大鼠糖水偏好显著下降, 强迫游泳不动时间显著增长(P < 0.001), 造模成功。连续灌胃给药4周后, 盐酸度洛西汀组及EPPR高、中、低给药组, 均能显著增加抑郁大鼠糖水偏好, 缩短抑郁大鼠强迫游泳不动时间, 其中以中剂量组最为显著(P < 0.001), 见表 2。说明拟黑多刺蚁石油醚部位可改善大鼠抑郁样行为。
| Table 2 Extratable petroleum ether of Polyrhachis vicina Roger (EPPR) improved the depression-like behaviours of depressed rats. n = 15, x± s. ###P < 0.001 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs model |
HE染色结果表明, 与正常大鼠比较, 抑郁大鼠前额皮层细胞排列紊乱, 细胞间隙疏松增大, 部分细胞核固缩; 与抑郁模型组大鼠比较, 阳性对照组及EPPR给药组均可显著改善抑郁大鼠组织病理学改变。见图 1。

|
Figure 1 Protective effect of EPPR on histopathologic change in rat were evaluated in section stained by H & E (x200) |
实验结果表明, 与正常大鼠比较, 抑郁大鼠大脑前额皮层GFAP、Iba-1表达显著增多, 星形胶质细胞及小胶质细胞激活增多; 与模型组比较, EPPR给药组及阳性对照组GFAP和Iba-1表达下调, 星形胶质细胞及小胶质细胞激活减少。见图 2, 3。
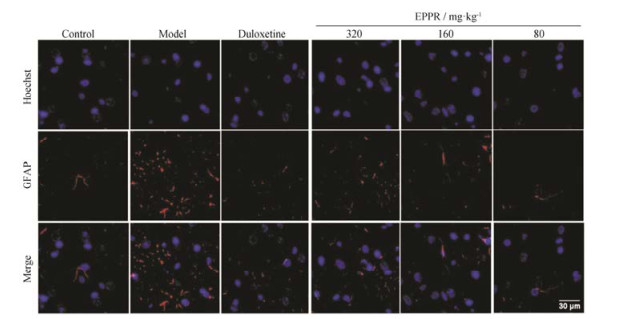
|
Figure 2 Stress induced astrocyte activation. EPPR treatment inhibits astrocyte activation. Astrocytes are labeled using immunofluorescence with anti-glial fibrillary acidic protein (GFAP) |
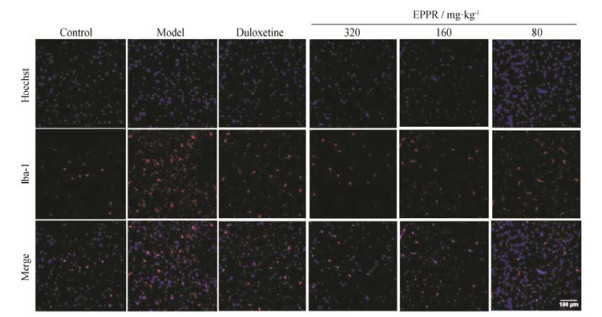
|
Figure 3 Stress induced microglia activation. EPPR treatment inhibits microglia activation. Microglia are labeled using immunofluorescence with anti-Iba1 |
实验结果表明, 模型组大鼠促炎细胞因子IL-1β, TNF-αRNA水平显著上升(P < 0.001, P < 0.01), IDO RNA水平也显著上升(P < 0.01)。EPPR给药干预后, 促炎细胞因子IL-1β表达下降, 以80 mg·kg-1剂量组下降最为显著(P < 0.001); TNF表达水平下降, 以160 mg·kg-1剂量组下降最为显著(P < 0.05); IDO表达水平下调, 以160 mg·kg-1剂量组最佳(P < 0.05)。见表 3。
| Table 3 EPPR treatment blocked the cytokine increase. n = 3, x± s. ##P < 0.01, ###P < 0.001 vs control; *P < 0.05, ***P < 0.001 vs model. IDO: Indoleamine 2, 3-dioxygenase |
EPPR可介导NF-κB信号通路。结果表明, EPPR给药组可降低前额皮层促炎细胞因子水平。有学者研究表明, 在应激状态下, NF-κB转录入核, 启动下游信号通路, 释放大量炎症因子[8-10]。为研究NF-κB信号通路, 作者制备胞浆胞核蛋白, 观察NF-κB核转位情况, 结果证明, 模型组核转位增强, 而不同剂量给药组可显著抑制NF-κB转录入核, 改善炎性状态(P < 0.05, P < 0.01), 见图 4。

|
Figure 4 EPPR treatment suppressed NF-κB p65 nuclear translocation. Nuclear and cytoplasmic proteins were prepared and analyzed for NF-κB. n = 3, x± s. #P < 0.05 vs control; *P < 0.05, **P < 0.01 vs model |
有研究表明重度抑郁症患者表现出炎症反应所有基本特征, 如急性反应期促炎细胞因子及其受体水平的上升, 外周血及脑脊液中可溶性黏附分子水平上升等[11, 12]。本实验研究结果表明, 慢性温和不可预见性刺激4周后, 大鼠出现抑郁样行为, 表现为糖水偏好值下降, 强迫游泳不动时间增长, 这表明兴趣缺失, 求生欲望下降; 抑郁模型大鼠促炎因子IL-1β、TNF-α释放增加, 大脑前额皮层小胶质细胞和星形胶质细胞激活增多, 这些都反映了抑郁大鼠体内发生持续炎症反应。在生理应激下, 应激诱导的损伤相关分子模式及病原相关分子模式激活炎症相关通路, 诱导一系列炎症反应。在静息状态下, NF-κB (p50/ p65)二聚体与其内源抑制蛋白IκB结合形成三聚体。在应激状态下, IκB蛋白N末端两个保守丝氨酸残基被IκB磷酸化激酶复合物特异性磷酸化, NF-κB激活进入细胞核与靶基因启动子区域特定序列结合, 启动下游信号表达, 释放大量炎性细胞因子[13]。而细胞因子可作用于星形胶质细胞及小胶质细胞, 使得星形胶质细胞与小胶质细胞激活, 星形胶质细胞与小胶质细胞构成细胞因子网络, 合成并表达细胞因子, 进而放大细胞因子信号, 影响神经递质系统, 如激活吲哚胺2, 3-双加氧酶通路, 色氨酸-犬尿氨酸代谢通路的紊乱, 催化色氨酸向犬尿氨酸代谢转化, 进而造成谷氨酸兴奋性毒性, 影响神经营养物质的合成, 使得炎性反应持续恶化[14-16]。
拟黑多刺蚁石油醚部位给药干预可显著改善大鼠抑郁样行为, 其作用机制可能是通过抑制NF-κB转录入核, 进而降低炎症细胞因子的表达, 炎性因子的降低使得小胶质细胞和星形胶质细胞激活下降, 进而小胶质细胞及星形胶质细胞释放促炎因子下降, 抑制了IDO相关通路。这可能使得神经递质表达上升, 谷氨酸兴奋性毒性下降, 神经营养素水平升高。本课题组前期研究通过气质联用对拟黑多刺蚁石油醚部位脂溶性成分进行成分分析及含量测定, 共鉴定出13种脂肪酸, 主要包括9种饱和脂肪酸及其酯和3种不饱和脂肪酸, 不饱和脂肪酸占总含量的71.36%, 其中单不饱和脂肪酸占60.7%, 多不饱和脂肪酸占1.06%[3]。多不饱和脂肪酸可通过改善氧化应激, 调控神经炎症及凋亡通路, 改变细胞膜功能来改善抑郁症状[17], 而单不饱和脂肪酸在抗抑郁机制中的作用仍不明确, 拟黑多刺蚁石油醚部位抗抑郁作用的机制未完全被阐明, 需要进一步的研究探索, 为抗抑郁药物的开发提供更多的资料。
| [1] | Smith K. Mental health:a world of depression[J]. Nature, 2014, 515: 181. |
| [2] | Monteggia LM, Malenka RC, Deisseroth K. Depression:the best way forward[J]. Nature, 2014, 515: 200–201. DOI:10.1038/515200a |
| [3] | Wei GN, Su QB, Zeng XB, et al. The study on the efficacy of the petroleum ether fraction of ethanol extracts of Polyrhachis vicina Roger in the treatment of gout and the major constituents[J]. Pharm Clin Chin Mater Med (中药药理与临床), 2013, 29: 99–103. |
| [4] | Gao L, Liu TX. Physical-chemical and antioxidant properties of the alcohol extracts of Polyrhachis vicina Roger[J]. Mod Food Sci Technol (现代食品科技), 2013, 29: 741–744. |
| [5] | Chen J, Song WG, Zhang XG. Experimental research of tumor-inhibiting effect of Polyrhachis vicina Roger in vitro[J]. J Beihua Univ (Nat Sci) (北华大学学报自然科学版), 2000, 1: 396–398, 401. |
| [6] | Zhao KJ. Study on the Effective Hemostatic Components and Quality Assessment of Polyrhachis vicina Roger (拟黑多刺蚁的有效部位及质量研究)[D]. Yanji: Yanbian University, 2006. |
| [7] | Katz RJ, Roth KA, Carroll BJ. Acute and chronic stress effects on open field activity in the rat:implications for a model of depression[J]. Neurosci Biobehav Rev, 1981, 5: 247–251. DOI:10.1016/0149-7634(81)90005-1 |
| [8] | Bierhaus A, Wolf J, Andrassy M, et al. A mechanism converting psychosocial stress into mononuclear cell activation[J]. Proc Natl Acad Sci U S A, 2003, 100: 1920–1925. DOI:10.1073/pnas.0438019100 |
| [9] | Pace TW, Mletzko TC, Alagbe O, et al. Increased stress-induced inflammatory responses in male patients with major depression and increased early life stress[J]. Am J Psychiatry, 2006, 163: 1630–1633. DOI:10.1176/ajp.2006.163.9.1630 |
| [10] | Koo JW, Russo SJ, Ferguson D, et al. Nuclear factor-κB is a critical mediator of stress-impaired neurogenesis and depressive behavior[J]. Proc Natl Acad Sci U S A, 2010, 107: 2669–2674. DOI:10.1073/pnas.0910658107 |
| [11] | Miller AH, Maletic V, Raison CL. Inflammation and its discontents:the role of cytokines in the pathophysiology of major depression[J]. Biol Psychiatry, 2009, 65: 732–741. DOI:10.1016/j.biopsych.2008.11.029 |
| [12] | Maes M. Major depression and activation of the inflammatory response system[J]. Adv Exp Med Biol, 1999, 461: 25–46. DOI:10.1007/b102345 |
| [13] | De Bosscher K, Berghe WV, Haegeman G. The interplay between the glucocorticoid receptor and nuclear factor-κB or activator protein-1:molecular mechanisms for gene repression[J]. Endocr Rev, 2003, 24: 488–522. DOI:10.1210/er.2002-0006 |
| [14] | Miller AH, Raison CL. The role of inflammation in depression:from evolutionary imperative to modern treatment target[J]. Nat Rev Immunol, 2016, 16: 22–34. DOI:10.1038/nri.2015.5 |
| [15] | Wohleb ES, Franklin T, Iwata M, et al. Integrating neuroimmune systems in the neurobiology of depression[J]. Nat Rev Neurosci, 2016, 17: 497–511. DOI:10.1038/nrn.2016.69 |
| [16] | Zheng X, Wang GJ, Hao HP. Update on immune and metabolic dysregulation in major depressive disorder and the implications for drug intervention[J]. Acta Pharm Sin (药学学报), 2017, 52: 19–25. |
| [17] | Song C, Shieh CH, Wu YS, et al. The role of omega-3 polyunsaturated fatty acids eicosapentaenoic and docosahexaenoic acids in the treatment of major depression and Alzheimer's disease:acting separately or synergistically?[J]. Prog Lipid Res, 2016, 62: 41–54. DOI:10.1016/j.plipres.2015.12.003 |
 2018, Vol. 53
2018, Vol. 53


