2. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
阿尔茨海默病(AD)是发病率最高的神经退行性疾病, 在临床上主要表现为渐进性认知功能障碍、记忆障碍、语言障碍和人格改变等, 患者的语言交流能力、学习记忆能力和抽象思维能力会持续下降。据世界卫生组织统计, 截至2016年, 全世界AD患者约4 750万, 医疗消耗超过6 000亿美元, 据预测[1], 我国的阿尔茨海默病患者数量从2001年到2040年将会增长3倍, AD已成为严重威胁老年人工作、生活与社交的疾病, 并且给家庭和社会都会带来沉重负担。现有的AD治疗药物包括乙酰胆碱酯酶(AChE)抑制剂与N-甲基-D-天冬氨酸(NMDA)受体拮抗剂, 但是, 两者均无法延迟或阻断AD的病理进程。近年来兴起的以清除脑内β-淀粉样蛋白(Aβ)沉积为主的免疫疗法大量应用于临床试验, 而连续的试验失败更加深刻地认识到抗AD药物研究任重道远。
1 AD的发病假说AD最早由德国医生Alois Alzheimer于1906年首次报道[2], 他在患者的脑内发现有大量的老年斑存在, 这也是AD最早的病理学变化—Aβ沉积, Aβ级联假说被认为是AD发病机制假说之一。该假说认为Aβ对神经细胞有毒性作用, 进而诱发神经炎症反应, 最终导致神经细胞死亡。淀粉样前体蛋白(amyloid precursor protein, APP)是Aβ的前体物质, APP经蛋白激酶裂解后产生具有毒性的Aβ, 而Aβ反过来又可以加速APP的聚集, 经过一系列反应, 最终引发神经细胞凋亡, 因此Aβ异常分泌和产生过多会导致AD病理变化。APP和早老蛋白(presenilin, PS)相关基因突变导致产生过多的Aβ, 致使体内Aβ失衡, 从而使得Aβ过多的聚集或高集聚能力的Aβ1-42在脑组织内沉积和斑块的沉积, 这些均与AD的病理有关[3]。
除Aβ级联假说外, 神经纤维缠结假说也被认为是AD发病机制假说之一。tau蛋白是一种微管相关蛋白, 微管是细胞骨架的重要组成部分, 因此tau蛋白具有结合细胞骨架和稳定细胞骨架神经元的作用[4]。研究发现, tau蛋白在AD患者脑内出现异常过度磷酸化, 从而与微管蛋白的结合力降低, 失去了促进微管形成和维持微管稳定的作用, 最终形成了神经纤维缠结(neurofibril tangles, NFTs)。有研究表明[5], 在AD的病理中Aβ是tau蛋白的上游, 会诱发tau蛋白从正常形式转换成毒性形式, 当然也有证据表明毒性形式的tau蛋白反过来也会通过反馈增大Aβ的毒性。因此, 与正常老人相比, AD患者脑内NFT数目更多、分布更广, 可能与AD患者脑内tau蛋白总量及异常磷酸化数目增多有关, 且随着临床痴呆的程度发展而增多[6]。
此外, AD的发病假说还包括氧化应激假说、兴奋性氨基酸毒性假说、细胞凋亡假说[7]、神经炎症反应假说[8]和钙超载等。
2 免疫调控在AD发病中的作用神经系统内免疫系统的激活通常被认为是神经炎症反应。在AD中, 这些炎症反应主要来源于中枢神经系统固有的免疫细胞, 如小胶质细胞、星形胶质细胞及血管周围粒细胞的活化。早期研究认为, 神经炎症仅是发生于AD晚期的一种并发症, 因为在AD患者脑内, 小胶质细胞和星型胶质细胞高度活化多发生于Aβ沉积的斑块周围, 激活的主要原因是清除Aβ斑块。此外, 活化的小胶质细胞和星形胶质细胞会产生大量与老年斑产生和发展密切相关的细胞因子, 如白细胞介素-1 (IL-1)、白细胞介素-6 (IL-6)和肿瘤坏死因子(TNF-α)等[9]。上述研究均表明神经炎症的产生是Aβ病变的伴随现象。但是, 在2013年, 新英格兰医学杂志在同期发表两篇文章[10, 11]显示, 髓系细胞2中表达触发受体(TREM2)可显著增加散发性AD的发病风险。同年, Bradshaw等[12]研究显示, 粒细胞表面抗原CD33表达异常与Aβ病理学变化密切相关, 这是首次发现免疫系统变化与AD发生的相关性, 也提示免疫系统的激活不仅参与AD的后期病变, 而且也与AD的发生密切相关。随着神经系统内免疫调控机制研究的深入, 临床前研究、遗传学研究及生物信息学研究的数据均表明, 免疫系统的激活伴随着AD的发生发展过程, 虽然单纯的免疫系统激活不是导致AD发生的直接原因, 但却参与了AD的发生、发展和恶化阶段。见图 1。
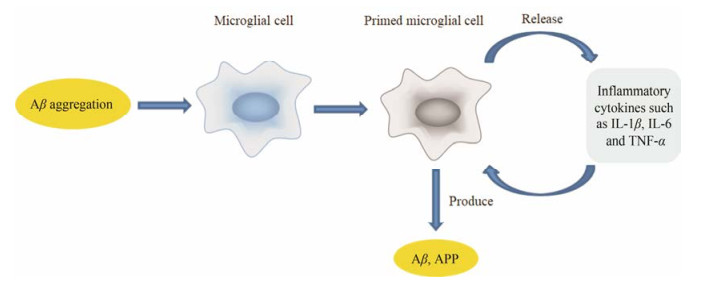
|
Figure 1 Mechanism of inflammation in Alzheimer's disease (AD). APP: Amyloid precursor protein |
基于免疫反应致病假说, 人们对于AD的免疫治疗主要通过两方面进行[13]:一方面是通过注射Aβ疫苗, 刺激宿主发生免疫反应, 产生抗Aβ抗体或直接引入Aβ单克隆抗体, 有效清除沉积的斑块, 改善AD症状; 另一方面则是从炎症反应入手, 用抗炎药物来改善和延缓AD的病理进程。但抗炎药物如非甾体类环加氧酶2 (COX-2)抑制剂等对改善认知功能障碍无明显作用[14], 且在3期临床试验中宣告失败; 小胶质细胞调节剂CHF5074目前尚在研发阶段, 暂无成熟有效的抗AD抗炎药物[15], 而中药通过抗炎改善AD症状已经有了很大研究进展, 值得进一步研究开发。
3 中药免疫治疗AD的研究进展 3.1 人参人参为五加科多年生草本植物, 根部入药, 是一味效果显著的补气药。人参皂苷是人参发挥药理作用的重要活性成分之一。据报道[16], 人参皂苷Rg1通过增强海马的抗炎和抗氧化能力, 能改善AD大鼠认知功能障碍。Rg1通过提高转录因子SOX-2表达保护神经干细胞和神经元前体细胞, 通过降低星形细胞上调基因1 (Aeg-1)的水平抑制星形胶质细胞激活, 增强抗氧化酶如谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的活性, 降低促炎细胞因子IL-l、IL-6和TNF-α的表达水平, 增加端粒长度和端粒酶活性, 促进海马神经发生[17]。人参皂苷Rg1可以改善AD大鼠的学习记忆能力, 且其药理作用机制可能与降低神经系统炎性因子水平、抑制炎症反应发生有关。同人参一样, 三七总皂苷Rg1也可减轻海马神经元的损伤, 减弱小胶质细胞的激活, 减少IL-1β的释放。Rg1的药理作用机制十分广泛, 如可通过抗Aβ毒性、抗神经炎症、抗氧化应激、抗细胞凋亡和调节神经递质等作用抗AD及其他中枢神经系统疾病, 多层次、多靶点作用于疾病, 具有很好的应用前景。
3.2 天麻天麻是兰科天麻属多年生草本植物, 以根茎入药, 是名贵中药, 功效为息风止痉、平抑肝阳、祛风通络。有增强体力、智力和抗衰老作用, 还有显著的抗炎作用。天麻素是天麻发挥药理作用的重要活性成分之一, 天麻素具有较好的镇静和安眠作用, 同时也有健脑补脑, 延缓衰老的功效。研究表明[18], 天麻素可以显著改善记忆障碍, 减少Aβ沉积和减弱脑内神经胶质细胞的激活, 这些实验还表明, 天麻素是通过其抗炎和抗Aβ作用在AD转基因小鼠中发挥显著神经保护作用的。天麻素的抗炎作用主要表现在减少核转录因子NF-κB (p65)的表达并调节促炎因子IL-1β和TNF-α的合成。
3.3 黄芪黄芪是豆科多年生草本植物, 根部入药, 其药用迄今已有2 000多年的历史, 具有增强机体免疫功能、保肝、抗衰老、抗应激、降压和较广泛的抗菌作用[19], 黄芪能增加组织的胶原合成, 延长细胞寿命, 还能增强脑部功能, 加强学习记忆能力。黄芪甲苷是黄芪中含量最高且研究最多的活性成分, 它具有抗炎、抗氧化、保护心血管和免疫系统的功能。研究表明[20], 黄芪甲苷可减少NF-kB的活性, 改善全身促炎性细胞因子的产生, 能逆转Aβ(25-35)在小鼠海马体和大脑皮质中引起的神经萎缩和记忆丧失, 提示黄芪甲苷可通过抗炎作用在AD小鼠中发挥神经保护作用。
3.4 枸杞枸杞为茄科植物, 以其干燥成熟果实入药, 主要药用种类是宁夏枸杞, 具有滋补肝肾、益精明目之功效。枸杞子具有抗氧化、抗衰老、神经保护、抗AD和保肝等药理活性。枸杞多糖是枸杞子中的主要活性成分, 有调节免疫、延缓衰老的作用。研究表明[21], 枸杞多糖可以提高AD小鼠的学习记忆能力, 可减少其海马内Aβ(1-42)的含量, 这种改善学习记忆行为可能是通过枸杞多糖在中枢神经系统中的抗炎作用来实现的。枸杞多糖可以下调中枢神经系统内促炎因子的循环, 这可能是枸杞发挥抗炎作用的主要机制。
3.5 石菖蒲石菖蒲是天南星科多年生草本植物, 是中医临床使用频率较高的治疗AD的中药[22]。其干燥根茎入药, 具有化湿开胃、开窍豁痰和醒神益智之功效, 用于脘痞不饥、噤口下痢、神昏癫痫、健忘耳聋等。其主要活性成分β-细辛醚, 可以穿透血脑屏障, 在脑中广泛分布, 且在多方面都表现出神经保护作用。据报道[23], β-细辛醚可作用于与AD相关的多个靶点, 包括对神经元的保护作用、促进脑源性神经营养因子(BDNF)合成分泌的作用、抑制Aβ聚集、减少Aβ斑块形成、促进神经元再生和抑制炎症反应等作用。有研究表明[24], β-细辛醚可以减少TNF-α、IL-1β和IL-6等炎性细胞因子的产生, 还可以显著降低自噬基因Beclin-1和自噬相关蛋白LC3β的表达, 同时增加抑凋亡蛋白Bcl-2水平, 说明β-细辛醚通过Bcl-2/ Beclin-1通路减轻Aβ诱导的炎症反应和自噬反应并认为β-细辛醚可能是一个潜在的AD预防性药物。此外, β-细辛醚还通过NF-κB信号通路和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路抑制促炎介质的产生和小胶质细胞的活化来发挥抗炎作用[25]。
3.6 黄芩黄芩是唇形科多年生草本植物, 以根入药, 具有清热燥湿、泻火解毒、止血和安胎等功效。其临床抗菌性较好, 而且不易产生抗药性。黄芩苷是黄芩发挥抗炎和神经保护作用的主要生物活性物质之一, 黄芩苷对于出现病理改变和行为障碍的AD小鼠的神经保护作用已通过实验得到验证[26]:在给予黄芩苷后, 可显著改善学习记忆障碍, 也会减弱小胶质细胞和星形胶质细胞的激活, 降低TNF-α、IL-6的表达。黄芩苷通过抑制JAK2/STAT3信号通路[27]发挥抗神经炎症功能, 从而起到改善Aβ相关病理和认知功能障碍的作用, 并且可能成为AD的潜在治疗药物。除黄芩苷外, 黄芩素也是从黄芩中提取的具有显著神经保护作用的有效物质, 黄芩素可以通过干扰丝裂原活化蛋白激酶(MAPK)等信号通路, 抑制NF-κB的活性及炎症因子的分泌及释放来发挥抗炎的作用, 还可以抑制巨噬淋巴细胞的浸润, 降低炎症因子TNF-α、IL-1β的表达, 发挥抗炎和神经保护作用[28]。
3.7 姜黄姜黄是姜科多年生草本植物, 以根茎入药, 能行气破瘀、通经止痛。主治胸腹胀痛、肩臂痹痛、心痛难忍、月经不调和跌打损伤等。姜黄素是从姜黄根茎中提取的一类有神经保护作用的生物活性物质, 姜黄素在神经系统具有抗炎、抗氧化、清除自由基的免疫相关作用, 还可以抑制Aβ的形成和聚集[29], 在临床上, 对于AD预防与治疗发挥了一定作用。研究表明[30], 姜黄素可以抑制脂多糖(LPS)诱导的小胶质细胞的激活和MAPK的活性, 姜黄素显著抑制Aβ42诱导的CD68的表达。姜黄素可以显著地抑制Aβ诱导的IL-1β、IL-6和TNF-α的生成并且降低小胶质细胞中的蛋白水平, 同时, 还可以对Aβ42激活的小胶质细胞中的细胞外调节蛋白激酶(ERK1/2)和p38产生抑制效应。进一步研究发现, 抑制ERK1/2和p38信号通路可以减少小胶质细胞中的炎症因子的产生, 说明姜黄素通过抑制ERK1/2和p38信号通路减弱炎症反应, 对AD的治疗起到一定作用。
3.8 银杏银杏是银杏科多年生落叶乔木, 银杏果、银杏叶、银杏外种皮和银杏根均可入药, 可以益心敛肺、化湿止泻。其中, 银杏叶在我国已有多年的入药历史, 国际标准银杏叶提取物是金纳多, 又称EGb761, 具有多种药理作用如抗氧化、抗凋亡、保护线粒体功能和抗炎等神经保护作用, 可以改善AD的认知功能障碍、神经精神症状和功能[31]。因此, EGb761在临床上被广泛用于轻、中度AD的治疗与预防[32]。研究发现, EGb761的抗炎作用机制可能与抑制血小板活性因子(PAF)的活性有关[33], PAF可以调节炎症细胞因子的表达, 如刺激促炎细胞因子白三烯C4的产生, PAF在脑内过多的聚集可能是AD的致病原因之一。银杏叶提取物EGb761的抗炎作用还包括:减少小胶质细胞的数目并抑制其激活, 降低TNF-α和趋化因子CCL-2等炎症相关细胞因子的表达, 并且在海马区促炎基因和抗炎基因包括TNF-α、IL-1β、CCL-2和IL-10等转录均明显降低, 以及改善AD模型小鼠的认知功能障碍和减少其突触结构蛋白如PSD-95、Munc18-1和SNAP25的丢失, 还可以通过增加Beclin1和p62的表达激活小胶质细胞的自噬, 从而降低Aβ诱导的小胶质细胞分泌的TNF-α、IL-1β及caspase-1的活化, 减少炎症小体NLRP3的聚集, 另外, 长期的EGb761治疗可以通过抑制脑内β-分泌酶活性和Aβ聚集来改善Aβ病理损伤[34]。
3.9 吴茱萸吴茱萸为芸香科小乔木或灌木, 以近成熟果实入药, 有散寒止痛、降逆止呕和助阳止泻的功效。吴茱萸碱是从吴茱萸中提取的主要生物活性物质之一, 具有抗炎、镇痛、免疫调节、降血糖和减肥等多种药理作用。研究发现[35], 吴茱萸碱可以降低炎性细胞因子, 如TNF-α、IL-1β、IL-6和COX-2在AD模型小鼠脑中的表达, 还会增加其脑部组织对葡萄糖的摄取, 然而对Aβ的沉积无明显作用, 说明吴茱萸碱通过抗炎作用改善AD症状。
3.10 雷公藤雷公藤是卫矛科灌木, 以根入药, 性凉、味辛、苦, 有大毒, 具有祛风湿、解毒杀虫和通络止痛的功效。雷公藤甲素是从雷公藤提取的非甾体类抗炎药, 近年来研究报道[36], 雷公藤甲素可以抑制神经胶质细胞激活, 抑制tau蛋白磷酸化, 减少Aβ沉积, 还可以提高AD模型小鼠空间学习能力, 抑制了Aβ蛋白的产生及βAPP裂解酶(BACE1)表达, 显著减少细胞周期素依赖蛋白激酶5 (Cdk5)和激动因子P25的表达, 从而发挥抗炎、抗氧化作用, 改善AD小鼠的认知能力。
3.11 灵芝灵芝是多孔菌科真菌灵芝的子实体, 具有补气安神、止咳平喘和延年益寿的功效, 历年来被视为滋补强壮、扶正固本的珍品。灵芝多糖是灵芝次级代谢产物, 具有抗肿瘤、降血糖血脂、抗血栓、抗氧化、清除自由基、抗衰老、抗辐射和调节免疫等药理作用。有研究表明[37], 灵芝多糖可以抑制LPS诱导的BV2细胞中促炎因子的表达, 如与AD密切相关的炎症介质IL-1β和IL-6的表达以及可以促进小胶质细胞激活的iNOS的表达。此结果同样在Aβ诱导的原代小胶质细胞上得到验证, 且抑制效果更佳。另外, 灵芝多糖在以上两种细胞模型中均可以增加抗炎因子转化生长因子TGFβ的表达。这些结果提示, 灵芝多糖可能通过其抗炎作用成为防治早期AD的潜在治疗靶点。
3.12 川芎川芎是伞形科植物, 以根茎入药, 具有活血化瘀、祛风止痛和开郁燥湿等功效。川芎嗪是从川芎中提取的生物碱单体, 具有扩张血管, 预防血栓的形成, 清除自由基, 抗脂质过氧化, 改善学习记忆力, 保护神经和抗癌等药理作用。研究表明[38], 川芎嗪在AD大鼠脑内亦可发挥显著的神经保护作用。川芎嗪可以下调AD大鼠脑内炎症因子IL-1β、IL-6和TNF-α的表达, 同时还可抑制AD大鼠脑内高级糖化终产物受体(RAGE)的表达, RAGE是Aβ的配体之一, 在神经元和小胶质细胞中有较多的表达, 可以促使NF-κB转录IL-1β、IL-6、TNF-α和RAGE等靶基因, 从而上调炎症反应[39]。
中药免疫治疗AD的研究进展见表 1。
| Table 1 Advances in immunotherapy by traditional Chinese medicine for Alzheimer's disease (AD) |
综上所述, 免疫反应已成为阿尔茨海默病的主要发病机制, 越来越引起研究人员的重视, 抗神经炎症也逐渐成为治疗AD新的切入点。目前西药抗炎抗AD效果并不是很理想, 而在中药方面的研究已初具成效, 且现有研究已经寻找到新的免疫治疗靶点(CD33、TREM2), 提供了新的研究方向。因此, 深入研究免疫反应在阿尔茨海默病发生、发展中的作用机制, 以及中药抗炎作用的机制, 寻找更有效的中药抗炎药物, 将成为人们探索免疫治疗AD的新方法。在今后的研究中应更深入地探索AD抗炎反应机制, 寻找更贴近的AD病理模型, 为找到新型有效的抗AD药物提供新的策略。
| [1] | Lee JH, Kahn A, Cheng R, et al. Disease-related mutations among Caribbean Hispanics with familial dementia[J]. Mol Genet Genomic Med, 2014, 2: 430–437. DOI:10.1002/mgg3.2014.2.issue-5 |
| [2] | Tanzi RE. Twenty years of the Alzheimer's disease amyloid hypothesis:a genetic perspective[J]. Cell, 2005, 120: 545–555. DOI:10.1016/j.cell.2005.02.008 |
| [3] | Rossi G, Giaccone G, Maletta R, et al. A family with Alzheimer disease and strokes associated with A713T mutation of the APP gene[J]. Neurology, 2004, 63: 910–912. DOI:10.1212/01.WNL.0000137048.80666.86 |
| [4] | Kvetnoĭ IM, Kvetnaia TV, Ⅱu R, et al. Expression of beta-amyloid and tau-protein in mastocytes in Alzheimer disease[J]. Arkh Patol, 2003, 65: 36–39. |
| [5] | Bloom GS. Amyloid-β and tau:the trigger and bullet in Alzheimer disease pathogenesis[J]. JAMA Neurol, 2014, 71: 505–508. DOI:10.1001/jamaneurol.2013.5847 |
| [6] | Joshi P, Benussi L, Furlan R, et al. Extracellular vesicles in Alzheimer's disease:friends or foes? Focus on Aβ-vesicle interaction[J]. Int J Mol Sci, 2015, 16: 4800–4813. DOI:10.3390/ijms16034800 |
| [7] | Dong XX, Wang Y, Qin ZH. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases[J]. Acta Pharmacol Sin, 2009, 30: 379–387. DOI:10.1038/aps.2009.24 |
| [8] | Heppner FL, Ransohoff RM, Becher B. Immune attack:the role of inflammation in Alzheimer disease[J]. Nat Rev Neurosci, 2015, 16: 358–372. DOI:10.1038/nrn3880 |
| [9] | Gyoneva S, Swanger SA, Zhang J, et al. Altered motility of plaque-associated microglia in a model of Alzheimer's disease[J]. Neuroscience, 2016, 330: 410–420. DOI:10.1016/j.neuroscience.2016.05.061 |
| [10] | Guerreiro R, Wojtas A, Bras J, et al. TREM2 variants in Alzheimer's disease[J]. N Engl J Med, 2013, 368: 117–127. DOI:10.1056/NEJMoa1211851 |
| [11] | Jonsson T, Stefansson H, Steinberg S, et al. Variant of TREM2 associated with the risk of Alzheimer's disease[J]. N Engl J Med, 2013, 368: 107–116. DOI:10.1056/NEJMoa1211103 |
| [12] | Bradshaw EM, Chibnik LB, Keenan BT, et al. CD33 Alzheimer's disease locus:altered monocyte function and amyloid biology[J]. Nat Neurosci, 2013, 16: 848–850. DOI:10.1038/nn.3435 |
| [13] | Wisniewski T, Goñi F. Immunotherapy for Alzheimer's disease[J]. Biochem Pharmacol, 2014, 88: 499–507. DOI:10.1016/j.bcp.2013.12.020 |
| [14] | Lv MN. Advance in immunotherapy for Alzheimer's disease[J]. J Chin Pract Diagn Ther (中华实用诊断与治疗杂志), 2014, 28: 1047–1049. |
| [15] | Peng Y, Li PP, Li L, et al. Progress of clinical trials in Alzheimer's disease drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 1185–1195. |
| [16] | Wang Y, Kan H, Yin Y, et al. Protective effects of ginsenoside Rg1 on chronic restraint stress induced learning and memory impairments in male mice[J]. Pharmacol Biochem Behav, 2014, 120: 73–81. DOI:10.1016/j.pbb.2014.02.012 |
| [17] | Zhu J, Mu X, Zeng J, et al. Ginsenoside Rg1 prevents cognitive impairment and hippocampus senescence in a rat model of D-galactose-induced aging[J]. PLoS One, 2014, 9: e101291. DOI:10.1371/journal.pone.0101291 |
| [18] | Hu Y, Li C, Shen W. Gastrodin alleviates memory deficits and reduces neuropathology in a mouse model of Alzheimer's disease[J]. Neuropathology, 2014, 34: 370–377. |
| [19] | Chen GH, Huang WF. Progress in pharmacological effects of compositions of Astragalus membranaceus[J]. Chin J New Drugs (中国新药杂志), 2008, 17: 1482–1485. |
| [20] | Tohda C, Tamura T, Matsuyama S, et al. Promotion of axonal maturation and prevention of memory loss in mice by extracts of Astragalus mongholicus[J]. Br J Pharmacol, 2006, 149: 532–541. DOI:10.1038/sj.bjp.0706865 |
| [21] | Zhang Q, Du XP, Xu YP, et al. The effects of Gouqi extracts on Morris maze learning in the APP/PS1 double transgenic mouse model of Alzheimer's disease[J]. Exp Ther Med, 2013, 5: 1528–1530. DOI:10.3892/etm.2013.1006 |
| [22] | Mao J, Huang S, Liu S, et al. A herbal medicine for Alzheimer's disease and its active constituents promote neural progenitor proliferation[J]. Aging Cell, 2015, 14: 784–796. DOI:10.1111/acel.12356 |
| [23] | Zhang MX. The Studies on Anti-Alzheimer's Disease Fraction of Acorus tatarinowii and Its Preliminary Material Basis (石菖蒲抗老年痴呆活性部位的确定及其初步物质基础研究)[D]. Shanghai: China Stata Institute of Pharmaceutical Industry, 2016. |
| [24] | Chang WG, Teng JF. β-Asarone prevents Aβ25-35-induced inflammatory responses and autophagy in SH-SY5Y cells:down expression Beclin-1, LC3B and up expression Bcl-2[J]. Int J Clin Exp Med, 2015, 8: 20658–20663. |
| [25] | Lim HW, Kumar H, Kim BW, et al. β-Asarone (cis-2, 4, 5-trimethoxy-1-allyl phenyl), attenuates pro-inflammatory mediators by inhibiting NF-κB signaling and the JNK pathway in LPS activated BV-2 microglia cells[J]. Food Chem Toxicol, 2014, 72: 265–272. DOI:10.1016/j.fct.2014.07.018 |
| [26] | Chen C, Li X, Gao P, et al. Baicalin attenuates Alzheimer-like pathological changes and memory deficits induced by amyloid β1-42, protein[J]. Metab Brain Dis, 2015, 30: 537–544. DOI:10.1007/s11011-014-9601-9 |
| [27] | Xiong J, Wang C, Chen H, et al. Aβ-induced microglial cell activation is inhibited by baicalin through the JAK2/STAT3 signaling pathway[J]. Int J Neurosci, 2014, 124: 609–620. DOI:10.3109/00207454.2013.865027 |
| [28] | Wang W, Zhou PH, Xu CG, et al. Baicalein attenuates renal fibrosis by inhibiting inflammation via down-regulating NF-κB and MAPK signal pathways[J]. J Mol Histol, 2015, 46: 283–290. DOI:10.1007/s10735-015-9621-8 |
| [29] | Wang ZY, Liu JG, Li H, et al. Pharmacological effects of active components of Chinese herbal medicine in the treatment of Alzheimer's disease:a review[J]. Am J Chin Med, 2016, 44: 1525–1541. DOI:10.1142/S0192415X16500853 |
| [30] | Shi X, Zheng Z, Li J, et al. Curcumin inhibits Aβ-induced microglial inflammatory responses in vitro:involvement of ERK1/2 and p38 signaling pathways[J]. Neurosci Lett, 2015, 594: 105–110. DOI:10.1016/j.neulet.2015.03.045 |
| [31] | Ihl R, Tribanek M, Bachinskaya N. Efficacy and tolerability of a once daily formulation of Ginkgo biloba extract EGb 761® in Alzheimer's disease and vascular dementia:results from a randomised controlled trial[J]. Pharmacopsychiatry, 2012, 45: 41–46. DOI:10.1055/s-0031-1291217 |
| [32] | Yang M, Xu DD, Zhang Y, et al. A systematic review on natural medicines for the prevention and treatment of Alzheimer's disease with meta-analyses of intervention effect of ginkgo[J]. Am J Chin Med, 2014, 42: 505–521. DOI:10.1142/S0192415X14500335 |
| [33] | Shi C, Liu J, Wu F, et al. Ginkgo biloba extract in Alzheimer's disease:from action mechanisms to medical practice[J]. Int J Mol Sci, 2010, 11: 107–123. DOI:10.3390/ijms11010107 |
| [34] | Liu X, Hao W, Qin Y, et al. Long-term treatment with Ginkgo biloba extract EGb 761 improves symptoms and pathology in a transgenic mouse model of Alzheimer's disease[J]. Brain Behav Immun, 2015, 46: 121–131. DOI:10.1016/j.bbi.2015.01.011 |
| [35] | Yuan S, Gao K, Wang D, et al. Evodiamine improves cognitive abilities in SAMP8 and APPswe/PS1△E9 transgenic mouse models of Alzheimer's disease[J]. Acta Pharmacol Sin, 2011, 32: 295–302. DOI:10.1038/aps.2010.230 |
| [36] | Wang Q, Xiao B, Cui S, et al. Triptolide treatment reduces Alzheimer's disease (AD)-like pathology through inhibition of BACE1 in a transgenic mouse model of AD[J]. Dis Model Mech, 2014, 7: 1385–1395. DOI:10.1242/dmm.018218 |
| [37] | Cai Q, Li Y, Pei G. Polysaccharides from Ganoderma lucidumattenuate microglia-mediated neuroinflammation and modulate microglial phagocytosis and behavioural response[J]. J Neuroinflamm, 2017, 14: 63. DOI:10.1186/s12974-017-0839-0 |
| [38] | Lu F, Li X, Li W, et al. Tetramethylpyrazine reverses intracerebroventricular streptozotocin-induced memory deficits by inhibiting GSK-3β[J]. Acta Biochim Biophy Sin, 2017, 49: 722–728. DOI:10.1093/abbs/gmx059 |
| [39] | Liu CA, Zhu J, Cai B, et al. Tetramethylpyrazine protect rats against the inflammation and Aβ(25-35) induced ROS by targeting the RAGE-ERK1/2-p38-NFκB pathway[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1126–1132. |
 2018, Vol. 53
2018, Vol. 53


