2. 中国药科大学 中药制剂教研室, 江苏 南京 210009
2. Department of Traditional Chinese Pharmaceutics, China Pharmaceutical University, Nanjing 210009, China
共晶是两种或两种以上的分子, 通过非共价键(如氢键、离子键等)结合在同一晶格中形成的晶体[1, 2]。而药物共晶则是特指组成共晶的成分中包含了一种或多种活性药物成分[2]。对药物进行共晶修饰可以改变药物的溶解度和溶出速率, 影响药物的临床疗效[3], 同时还可获得专利保护[4]。因此, 近年来共晶技术已成为固体药物开发的一种新途径[5]。
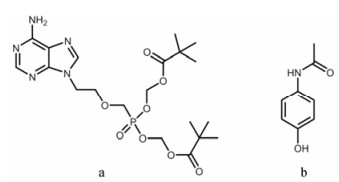
阿德福韦酯(adefovir dipivoxil, AD, 图 1a)属于生物药剂学分类系统Ⅲ类低渗透性药物[6], 其为腺嘌呤磷酸酯化合物阿德福韦的前药, 口服后可迅速水解为活性母体药物阿德福韦[7], 阿德福韦可以通过抑制乙肝病毒脱氧核糖核酸聚合酶的活性来抑制乙肝病毒的复制与繁殖[8]。由于AD是P-糖蛋白转运体(P-glyprotein, P-gp)的底物[9-12], 故AD易被肠道的P-gp外排而导致其渗透性低, 口服生物利用度差。此外, 临床研究表明, 长期服用AD会引起肾毒性, 主要表现为血清肌酐的升高和血磷的下降[13], 这主要是由于AD活性代谢物阿德福韦经有机阴离子转运体1 (human organic anion transporter 1, hOAT1)转运而蓄积于肾小管导致的[14]。
|
Figure 1 Chemical structures of adefovir dipivoxil (AD, a) and acetaminophen (AP, b) |
非甾体抗炎药具有抗炎、抗风湿、止痛和退热等作用, 在临床上广泛用于骨关节炎、类风湿性关节炎、多种发热和各种疼痛症状的缓解[15]。研究表明, 非甾体抗炎药对乙酰氨基酚(acetaminophen, AP, 图 1b)还可通过抑制肠道P-gp的转运活性而抑制P-gp底物的外排, 故AP可促进AD (P-gp底物)转运进入肠细胞而促进其肠吸收[16, 17]。此外, 一些非甾体类抗炎药(如对乙酰氨基酚、吲哚美辛和萘普生等)可抑制hOAT1的活性, 从而降低阿德福韦蓄积产生的肾毒性[14, 18, 19]。故本研究选择AP (美国食品药品管理局公认的安全物质[20])作为共晶形成物, 与AD制备形成共晶, 旨在通过共晶技术提高AD溶出并利用P-gp抑制剂促进AD肠吸收。
材料与方法药品与试剂 阿德福韦酯(AD, 晶型Ⅰ, 江西乐平市赛复乐医药化工有限公司, 纯度99.75%); 对乙酰氨基酚(AP, 杭州海阳医药化工有限公司, 纯度99.40%); 乌拉坦(国药集团化学试剂有限公司, 纯度98%); 自制Krebs-Ringer缓冲液(即K氏液, 分别取NaCl 7.80 g、KCl 0.35 g、CaCl2 0.37 g、MgCl2 0.22 g、NaH2PO4 0.22 g、葡萄糖3.00 g和NaHCO3 1.37 g, 用水溶解并稀释至1 L); 甲醇、乙腈(色谱纯, 上海安谱科学仪器公司); 实验用水采用Milli-Q水纯化系统(美国Millipore公司)制得; 其余试剂均为分析纯。
主要仪器 RY-1熔点仪(天津分析仪器厂); NETZSCH DSC 204 F1 Phoenix差示扫描量热分析仪(德国NETZSCH公司); X'TRA粉末X射线衍射仪(瑞士ARL公司); Nicolet Impact 410型红外光谱仪(美国赛默飞世尔科技公司); RC-806溶出仪(天津市天大天发科技有限公司); Shimadzu高效液相色谱仪(日本Shimadzu公司, LC-10AD泵, SPD-10A检测器)。
动物 清洁级SD大鼠, 体重(220 ± 20) g, 青龙山实验动物中心提供, 动物合格证号: SCXK (浙) 20080033。
阿德福韦酯-对乙酰氨基酚(AD-AP)共晶的制备 称取AD 752.0 mg与AP 226.7 mg (摩尔比为1:1)于烧杯中, 加入乙腈15 mL, 搅拌使药物溶解完全后, 转移至玻璃培养皿中, 于通风橱中在室温条件下缓慢挥发除去溶剂。最后将上述产物在25 ℃真空干燥箱中减压干燥, 即得AD-AP共晶, 置无水氯化钙干燥器中备用。
差示扫描量热法(differential scanning calorimetry, DSC) 分别将AD晶体、AP晶体、AD晶体与AP晶体摩尔比为1:1的物理混合物(AD+AP)及AD-AP共晶过100目筛, 取上述样品置于铝坩埚中进行热扫描。升温速率为10 ℃·min-1, 升温范围为25~250 ℃。数据用NETZSCH Proteus热分析软件(Version 4.2)处理。
粉末X-射线衍射法(powder X-ray diffraction, PXRD) 分别将AD晶体、AP晶体、AD+AP及AD- AP共晶过200目筛。实验采用Cu-Kα靶, 设定波长为1.540 562 Å, 管压为40 kV, 管流为40 mA, 步长为0.02°, 扫描速度为2°·min-1, 扫描范围为5~45° 2θ。数据用Materials Studio模拟软件(version 5.0)进行分析。
傅里叶红外光谱法(Fourier transform infrared spectroscopy, FTIR) 分别将AD晶体、AP晶体、AD+AP及AD-AP共晶与溴化钾压成薄片, 在4 000~400 cm-1内进行红外扫描, 数据用Nicolet Omnic红外光谱处理软件(version 8.0)处理。
共晶分子结构模拟 运用分子模拟软件Materials Studio (version 5.0)的Reflex模块对共晶的PXRD谱图进行指标化, 确定样品所属晶系及空间群; 再对PXRD数据进行Pawley精修、Powder Solve解析和Rietveld精修来模拟其晶体结构。
平衡溶解度的测定 量取纯化水5 mL于西林瓶中, 分别加入过量的AD晶体、AD+AP及AD-AP共晶, 密封后置于25 ℃恒温振荡器中, 振摇24 h以达到平衡, 后移取上清液用甲醇适当稀释, 采用HPLC法测定溶解度, 所有样品平行测定3次。
HPLC系统采用Shim-pack VP-ODS色谱柱(150 mm × 4.6 mm, 5 μm), 设定柱温为30 ℃; 以甲醇- pH 6.0磷酸盐缓冲液(50:50)为流动相, 流速为1.0 mL·min-1; 检测波长为260 nm; 进样体积为20 μL。在该色谱条件下, AD与AP分离度(R)良好(R > 1.5)且不受溶剂峰干扰; AD线性方程为C = 0.000 298A + 0.546 (r = 0.999 8), 线性范围为5.0~250.5 μg·mL-1; AP线性方程为C = 0.000 139A - 0.701 (r = 0.999 5), 线性范围为1.5~72.5 μg·mL-1; 平行测量数值的相对标准偏差均小于2%, 且AD与AP回收率均在98%~102%, 表明该方法重复性好且准确度高。
溶出度测定 将AD晶体、AP晶体、AD+AP及AD-AP共晶过100目筛(149 μm), 使样品粉末粒径范围均一。溶出实验依照2015版《中华人民共和国药典》溶出度与释放度测定法第二法(桨法)的要求进行, 分别量取500 mL的0.01 mol·L-1盐酸介质(漏槽条件)置各溶出杯中, 设定搅拌桨转速为50 r·min-1, 待溶出介质温度恒定在37 ℃后, 称取过筛的AD晶体、AP晶体、AD+AP及AD-AP共晶(相当于AD 50 mg、AP 15 mg)加入溶出介质中, 开始计时。后于5、10、15、20、30和45 min取样3 mL, 同时及时补充相同体积、温度为37 ℃的空白溶出介质, 立即用0.22 μm微孔滤膜过滤, 取续滤液, 采用上述HPLC法测定AD、AP的浓度, 计算溶出量。
特性溶出速率的测定 分别称取约200 mg AD晶体、AD+AP及AD-AP共晶, 用液压机压制成直径为13 mm的致密规整药片。将药片的底面和侧面用蜂蜡包裹, 使其只有一面(表面积约为1.327 3 cm2)与溶出介质接触。
溶出实验依照2015版《中华人民共和国药典》溶出度与释放度测定法第二法(桨法)的要求进行, 分别量取纯化水500 mL置各溶出杯中, 设定搅拌桨转速为50 r·min-1, 待溶出介质温度恒定在37 ℃后, 取蜂蜡包裹的药片6片, 分别投入6个溶出杯内, 开始计时。在3 h内, 每隔30 min吸取溶出样品3 mL, 同时及时补充相同体积、温度为37 ℃的空白介质, 立即用0.22 μm微孔滤膜过滤, 取续滤液, 采用上述HPLC法测定AD的浓度, 计算溶出量。
用单位表面积累积溶出量与时间绘制回归曲线, 其斜率即为特性溶出速率[21], 计算公式为:
| $ {\rm{IDR}} = \frac{{{d_{\rm{w}}}}}{{{d_{\rm{t}}}S}} = \frac{{D{C_{\rm{S}}}}}{h} $ | (1) |
其中, IDR为特性溶出速率(mg·min-1·cm-2), dw为药物溶出的变化量(mg), dt为时间的变化量(min), S为药片的表面积(cm2), D为扩散系数(cm2·min-1), Cs为物质的饱和溶解度(mg·mL-1), h为扩散层的厚度(cm)。
共晶在体肠吸收的研究——大鼠在体单向肠灌流实验 取禁食24 h (可自由饮水)的大鼠, 腹腔注射20%乌拉坦麻醉(1.0 g·kg-1), 置于红外灯下维持体温。沿腹中线打开腹腔(约2~3 cm), 分离出待考察肠段, 取约10 cm肠段于两端切口, 于切口处插管后用灭菌的手术线结扎, 伤口处用浸有生理盐水的脱脂棉覆盖保湿, 红外灯下保温[22]。先用预热至37 ℃的等渗生理盐水将肠段冲洗干净, 再用K氏液灌流10 min。取供试液250 mL, 先以1.0 mL·min-1流速灌流10 min使其平衡, 再将流速调为0.2 mL·min-1, 开始计时。进口处用已知质量的装有供试液的小瓶以一定流速进行灌流, 在出口处用另一已知质量的小瓶收集, 每隔15 min迅速更换1次供试液小瓶和收集液小瓶, 并称重, 持续105 min[23]。收集液小瓶内加入一定体积的冰甲醇, 以终止流出的灌流液中酶的活性。实验结束后处死大鼠, 剪下被考察的肠段, 测量其长度和内径。
将所取样品于冷冻离心机中离心5 min (转速为10 000 r·min-1)后, 精密量取上清液20 μL, HPLC测定AD的浓度。根据灌流前后药量之差, 计算AD的吸收速率常数(Ka)、表观渗透系数(Peff)及吸收量(Fa)。
AD浓度对其肠吸收的影响 分别配制含30、100、180 μg·mL-1 AD的肠灌流液, 于十二指肠进行单向灌流实验。
AP对AD肠吸收的影响 配制100 μg·mL-1 AD肠灌流液, 分别加入不同量的AP, 使各灌流液中AP的浓度分别为10、33.3和60 μg·mL-1, 分别于十二指肠进行单向灌流实验。
AD在大鼠各肠段的吸收情况 分别配制AD、AD+AP及AD-AP共晶肠灌流液(相当于AD浓度100 μg·mL-1), 分别于十二指肠、空肠、回肠和结肠4个肠段进行单向灌流实验。
数据分析 采用质量法, 按下式(2)、(3)、(4)分别计算Ka、Peff及Fa[23]:
| $ {K_{\rm{a}}} = \left( {1 - \frac{{{C_{{\rm{out}}}}}}{{{C_{{\rm{in}}}}}} \cdot \frac{{{Q_{{\rm{out}}}}}}{{{Q_{{\rm{in}}}}}}} \right)\frac{Q}{V} $ | (2) |
| $ {P_{{\rm{eff}}}} = \frac{{ - Q{\rm{ln}}\left( {\frac{{{C_{{\rm{out}}}}}}{{{C_{{\rm{in}}}}}} \cdot \frac{{{Q_{{\rm{out}}}}}}{{{Q_{{\rm{in}}}}}}} \right)}}{{2\pi rl}} $ | (3) |
| $ {F_{\rm{a}}} = \frac{{{c_0}{V_0} - {c_{\rm{t}}}{V_{\rm{t}}}}}{{lt}} $ | (4) |
其中, Cin和Cout分别为肠道进、出口灌流液中药物的浓度(μg·mL-1); Qin和Qout分别为肠道进、出口灌流液的体积(mL, 假定进、出口灌流液密度为1.0 g·mL-1); Q为灌流速度(0.2 mL·min-1); V为灌流肠段的体积(mL); l和r分别为被灌流肠段的长度(cm)和横截面半径(cm); c0和ct分别表示药物初始浓度和终浓度(μg·mL-1); V0和Vt分别表示初始体积和终体积(mL); t为灌流时间(h)。
统计学分析 以上数据分析均采用单因素方差分析(SPSS 17.0), P < 0.05表明差异有统计学意义。
结果与讨论 1 共晶的表征 1.1 差示扫描量热法由DSC谱图(图 2)可知, AD晶体在98.9 ℃附近有明显的吸热峰, 与文献[24]报道AD晶型Ⅰ的吸热峰的位置一致。AP晶体在169.1 ℃附近出现尖锐的晶体吸热峰, 与文献[25]报道一致。AD+AP在91.7 ℃附近有1个较宽的吸热峰, 这可能是因为AD+AP在DSC加热过程中形成了低共熔物; 与之不同的是, AD-AP共晶在62.2 ℃左右具有单一尖锐的吸热峰。这表明形成了具有更低熔点的AD-AP共晶, 明显区别于其物理混合物。

|
Figure 2 Differential scanning calorimetry thermograms for AD, AP, physical mixture of adefovir dipivoxil and acetaminophen (AD+AP) and adefovir dipivoxil-acetaminophen (AD-AP) cocrystal |
为了进一步确证AD+AP在DSC加热过程中形成了低共熔物, 本研究还考察了AD晶体与AP晶体不同摩尔比物理混合物(摩尔比分别为1:1、2:1、3:1、1:2、1:3)的熔点。熔点测定依照2015版《中华人民共和国药典》熔点测定法第一法的要求进行, 调节升温速率为1.0 ℃·min-1。熔点测定结果表明, 不同比例物理混合物的熔点相近(约为90 ℃), 且均低于AD晶体(100 ℃)和AP晶体(170 ℃) (图 3), 这表明物理混合物在DSC加热过程中形成了低共熔物[26]。

|
Figure 3 Binary phase diagram of AD and AP physical mixtures exhibits a typical pattern characteristic of eutectics |
药物共晶由于引入了配体而改变了原料药晶体的分子排列和堆积方式, 故共晶的熔点与原料药晶体相比会发生变化[3]。研究表明, 低熔点晶体比具有类似结构的高熔点晶体更易溶解[27]。与AD原料药相比, AD-AP共晶熔点显著降低, 因此可以推测, 与AP形成共晶可能会提高AD的溶解度和溶出速率。
1.2 粉末X-射线衍射法由PXRD谱图(图 4)可知, AD的PXRD谱图与文献[24]所述晶型Ⅰ一致, 2θ特征峰位于7.20°、17.40°、20.94°和21.64°。AP的2θ特征峰位于15.54°、18.20°、23.46°和26.52°, 与文献[25]报道一致。AD+AP的PXRD谱图为两种单体药物谱图的叠加。与AD+AP不同, AD-AP共晶在11.22°、16.40°、17.60°、19.76°和24.48°有新的强衍射峰出现, 这表明AD-AP共晶是不同于物理混合物的新物质。
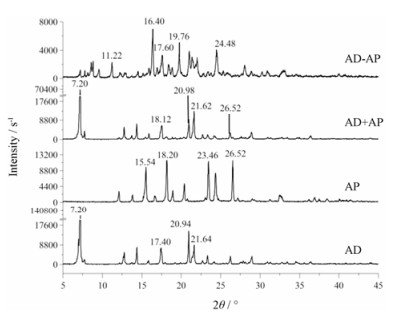
|
Figure 4 X-Ray powder diffraction patterns for AD, AP, physical mixture of AD+AP and AD-AP cocrystal |
由FTIR谱图(图 5)可知, AD的磷酯基νP=O峰位于1 293 cm-1, 酯基νC=O峰位于1 751 cm-1, 伯胺基团νN-H峰位于3 275和3 124 cm-1, 咪唑环上的νC=N峰位于1 681 cm-1, 与文献[24]报道的晶型Ⅰ吻合。AP在3 233和3 159 cm-1分别有亚酰胺的νN-H峰和酚羟基的νO-H峰, 而1 653 cm-1对应其νC=O峰。AD+AP的FTIR谱图为两种单体药物谱图的叠加。形成AD-AP共晶后, AD的νP=O峰由1 293 cm-1红移到1 282 cm-1, νN-H峰由3 275和3 124 cm-1分别蓝移到3 459和3 278 cm-1, νC=N峰由1 681 cm-1红移到1 671 cm-1; AP的νN-H峰由3 233 cm-1蓝移到3 344 cm-1, νC=O峰由1 653 cm-1红移到1 610 cm-1。由上述结果可知, AD的νP=O峰、νN-H峰、νC=N峰和AP的νN-H峰、νC=O峰均发生明显位移, 这表明AD-AP共晶中AD与AP间可能通过氢键连接而形成新物质, 形成氢键的具体位点可通过共晶结构模拟进一步确证。

|
Figure 5 FTIR spectra for AD, AP, physical mixture of AD+AP and AD-AP cocrystal |
Materials Studio (version 5.0)分子模拟结果表明, AD-AP共晶属三斜晶系, P1空间群, 共晶中AD与AP通过氢键连接, 与FTIR结果相符; 共晶晶体结构如图 6a, 分子间的氢键连接方式如图 6b。从图 6b中可以看出, 共晶的不对称结构单元中含有1分子AD和1分子AP, 其中AD的P=O基团与AP的N-H基团形成氢键; 而两个结构单元间, AD的C=N基团与另一个AD的-NH2基团形成氢键。该氢键连接方式也与FTIR结果中AD-AP共晶的红外特征峰位移相符。
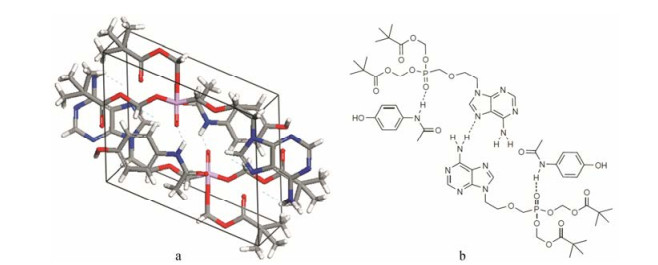
|
Figure 6 Crystal structure (a) and hydrogen bonds (b) in AD-AP cocrystal |
对结构模拟所得AD-AP共晶的晶体结构进行Rietveld结构精修后可得PXRD模拟谱图, 将PXRD模拟谱图与上述PXRD实验所得谱图进行对比(图 7)可验证上述分子模拟结果。由图 7可知, PXRD模拟谱图与实验谱图基本一致, 计算得到的峰强度与实验数据相符性均较好, 这表明结构模拟所得的晶体结构可信度较高。
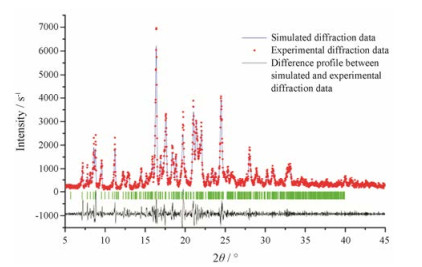
|
Figure 7 Rietveld refinement results of AD-AP cocrystal |
由平衡溶解度实验结果可知, AD晶体、AD+AP及AD-AP共晶中AD在水中的溶解度分别为(0.30 ± 0.05)、(0.39 ± 0.03)和(0.61 ± 0.03) mg·mL-1。AD+AP及AD-AP共晶中AD在水中的溶解度相比于AD原料药均有显著增加(P < 0.05)。与AD+AP相比, AD-AP共晶仍有显著的溶解度优势(P < 0.05)。由于晶体药物的溶解需要经历药物脱离晶格和脱离晶格的药物溶剂化这两个独立的过程, 故晶体药物的溶解需要克服晶格能(ΔGlattice)和溶剂化能(ΔGsolvation)[28, 29]。形成共晶可改变原料药晶体的排列方式而改变其ΔGlattice和ΔGsolvation[28], 进而影响药物的溶解。
在理想溶液中, 物质的溶解度仅取决于其熔点及熔融焓, 而物质的ΔGlattice与其熔点及熔融焓相关[30], 故仅考虑ΔGlattice时(即理想溶液中), 物质的溶解度公式可表示如下[28, 31, 32]:
| $ {\rm{ln}}{X_{{\rm{ideal}}}} = - \frac{{\Delta {H_{\rm{m}}}}}{{\rm{R}}}\left( {\frac{{{T_{\rm{m}}} - T}}{{T{T_{\rm{m}}}}}} \right) $ | (5) |
其中, Xideal为药物理想溶解度, Tm为药物熔点, ΔHm为药物熔化焓, R为常数, T为溶液温度。晶体药物的Tm、ΔHm可由药物的DSC谱图获取。
然而实际的溶解过程中, 还经历了溶质的溶剂化过程, 而在溶剂化过程中药物与溶剂会发生相互作用, 故药物的实测溶解度与药物的理想溶解度之间必然存在差异。此时药物的实测溶解度可以用下式表示[28, 29]:
| $ {\rm{ln}}X = {\rm{ln}}{X_{{\rm{ideal}}}} - {\rm{ln}}\gamma $ | (6) |
其中, X为药物实测溶解度, Xideal为药物理想溶解度, γ为药物在溶剂中的活度系数。
在式(6)中ln Xideal与ΔGlattice有关, -ln γ与ΔGsolvation有关[28, 29]。利用Pinal等提出的方法计算ln Xideal与-ln γ, 将计算所得ln Xideal与-ln γ叠加可得药物的实际溶解度ln X (图 8)[29]。

|
Figure 8 Lattice strength (black bar) and solvation (white bar) contribute to the solubilities of crystalline AD, AP and AD-AP cocrystal |
由图 8可知, AD与AD-AP共晶的-ln γ相近, 但ln Xideal存在明显差异, 故ΔGlattice (与ln Xideal有关)对AD溶解的影响明显大于ΔGsolvation (与-ln γ有关)。因此, 结合DSC结果可知, 与AP形成共晶后, AD溶解度显著提高可能是由于形成共晶可显著降低体系的Tm而使ln Xideal升高、ΔGlattice降低所致。
4 溶出度测定AD晶体、AD+AP及AD-AP共晶中AD在0.01 mol·L-1盐酸介质中的溶出曲线如图 9a所示, AP晶体、AD+AP及AD-AP共晶中的AP在0.01 mol·L-1盐酸介质中的溶出曲线如图 9b所示。由图 9a可知, AD-AP共晶中AD的溶出速率和溶出度均明显高于AD原料药及AD+AP。此外, AD-AP共晶的溶出行为与AD原料药及AD+AP有明显区别, AD-AP共晶中AD在15 min时已基本溶出完全, 但AD原料药及AD+AP中的AD在45 min时仍未溶出完全。故由溶出结果可知, 与AP形成AD-AP共晶可显著提高AD的溶出速率和溶出度。由图 9b可知, 与AP原料药及AD+AP相比, 形成AD-AP共晶后AP溶出速度明显提高, 故与AD形成共晶可促进AP的溶出。
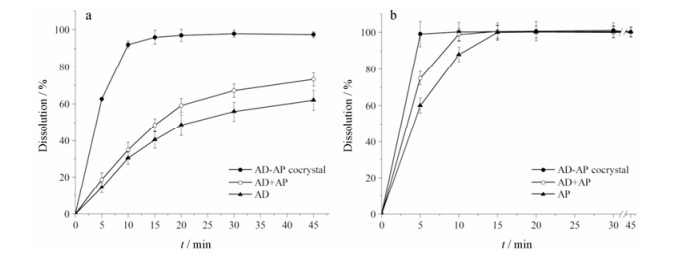
|
Figure 9 Dissolution of AD (a) and AP (b) in crystalline state, physical mixture of AD+AP and AD-AP cocrystal in 0.01 mol·L-1 HCl(n = 6) |
在特性溶出实验中, AD晶体、AD+AP及AD-AP共晶中AD在水中不同时间点的单位表面积溶出量如图 10所示。由图可知, AD晶体、AD+AP及AD-AP共晶中AD在水中的特性溶出速率分别为0.020 7、0.028 7和0.043 3 mg·mL-2·min-1。与AD原料药相比, AD+AP与AD-AP共晶中AD的特性溶出速率均明显提高, 而AD-AP共晶中AD的特性溶出速率又明显高于AD+AP 1.5倍。
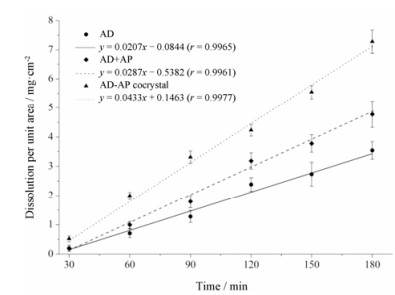
|
Figure 10 Dissolution amount per unit area of AD in crystalline state, physical mixture of AD+AP and AD-AP cocrystal in distilled water (n = 6) |
由表 1可知, 在30~180 μg·mL-1内, AD在十二指肠中Fa随灌流浓度的增大而线性增大, 而Ka与Peff无显著性差异(P > 0.05), 不存在浓度依赖性, 符合Ficks扩散原理。这表明AD主要以被动扩散的机制被十二指肠吸收, 其吸收动力学为一级速率过程。
| Table 1 Absorption rate constant (Ka), apparent absorption coefficient (Peff) and absorption amount (Fa) of AD crossing duodenum. n = 3, x± s |
与单独肠灌流100 μg·mL-1 AD溶液相比, 加入AP一起灌流后, AD在十二指肠中Ka和Peff均显著升高, 且在10~60 μg·mL-1 AP内, AD在十二指肠中Ka和Peff值与AP浓度呈正相关(表 2)。
| Table 2 Ka and Peff of AD crossing duodenum after the addition of AP. n = 3, x± s. *P < 0.05 vs AD 100 (control group); ▲P < 0.05 vs AD 100 + AP 10 |
在肠道中, P-gp广泛分布于肠成熟上皮细胞的顶端, 可主动外排细胞内P-gp底物, 从而减少由肠腔进入血液循环的P-gp底物量[33-36]。研究表明, AP可抑制肠道的P-gp转运活性[16, 17]。由于AD是P-gp的底物[9-12], 故AP可抑制P-gp对AD的外排作用而使AD进入肠细胞的量增加。因此, 加入AP灌流后AD肠吸收速率增加。
6.3 AD、AD+AP及AD-AP共晶在不同肠段的吸收以100 μg·mL-1 AD肠灌流液对大鼠各肠段进行灌流, 计算Peff, 比较不同肠段AD的吸收情况。结果表明, AD在不同肠段的Peff大小顺序为:十二指肠 > 空肠 > 回肠 > 结肠(图 11)。其中AD在结肠段的吸收显著低于其他肠段, AD的主要吸收部位为十二指肠和空肠, 且以十二指肠的吸收能力最强。
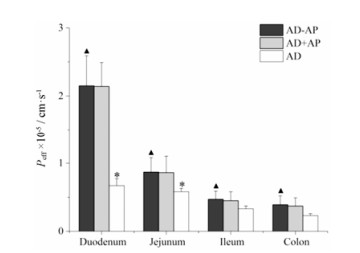
|
Figure 11 Peff of AD in crystalline state, physical mixture of AD+AP and AD-AP cocrystal in different segments of intestines. n = 3, x± s. *P < 0.05 vs AD in colon; ▲P < 0.05 vs AD in different segments of intestines |
以AD+AP、AD-AP共晶配制的肠灌流液(相当于AD浓度100 μg·mL-1)对大鼠各肠段进行灌流。结果表明(图 11), 与AD原料药灌流相比, 以AD-AP共晶灌流时AD在4个肠段Peff均显著增加(P < 0.05), 以十二指肠为例, AD-AP共晶中AD Peff约为AD原料药的3倍。虽然在各肠道中AD+AP、AD-AP共晶中AD的肠渗透性无显著差异(P > 0.05), 但AD-AP共晶较AD+AP仍有显著的溶解、溶出优势, 这将有助于AD的体内吸收。
对于被动扩散的药物, 其体内吸收往往与Peff具有良好的正相关[37]。不同浓度AD灌流实验已表明AD为被动扩散的药物; AD、AP同时灌流实验表明AP可抑制AD外排而促进AD的肠吸收。另外, 与AD原料药相比, 形成AD-AP共晶后AD的溶解度、溶出速率和肠渗透性均有显著提升。故形成AD-AP共晶有利于AD的口服吸收。
结论本研究采用溶剂挥发法制备得到AD-AP共晶。与AD晶体相比, 共晶中AD的溶解度和溶出速率均得到显著提高。在体肠吸收实验结果表明, AD以被动扩散的机制被肠道吸收; 形成共晶后, AD的肠渗透性相对于AD晶体显著提高, 这有利于提高AD的口服生物利用度。本研究选用P-gp转运蛋白抑制剂AP作为共晶配体与AD形成共晶, 在改善了AD溶解、溶出的同时, 提高了AD的肠渗透性, 这为低溶解性或/和低渗透性药物的开发提供了新的思路。
| [1] | Lara-Ochoa F, Espinosa-PÉRez G. Cocrystals definitions[J]. Supramol Chem, 2007, 19: 553–557. DOI:10.1080/10610270701501652 |
| [2] | Shan N, Zaworotko MJ. The role of cocrystals in pharma-ceutical science[J]. Drug Discov Today, 2008, 13: 440–446. DOI:10.1016/j.drudis.2008.03.004 |
| [3] | Schultheiss N, Newman A. Pharmaceutical cocrystals and their physicochemical properties[J]. Cryst Growth Des, 2009, 9: 2950–2967. DOI:10.1021/cg900129f |
| [4] | Chen XW, Song J, Tang HY, et al. Progress in screening methods and physicochemical properties of pharmaceutical co-crystals[J]. Chin J Pharm (中国医药工业杂志), 2012, 43: 703–708. |
| [5] | Trask AV. An overview of pharmaceutical cocrystals as intellectual property[J]. Mol Pharm, 2007, 4: 301–309. DOI:10.1021/mp070001z |
| [6] | Cundy KC, Sue IL, Visor GC, et al. Oral formulations of adefovir dipivoxil: in vitro dissolution and in vivo bioavailability in dogs[J]. J Pharm Sci, 1997, 86: 1334–1338. DOI:10.1021/js970264s |
| [7] | Dallas S, Schlichter L, Bendayan R. Multidrug resistance protein (MRP) 4- and MRP 5-mediated efflux of 9-(2-phos-phonylmethoxyethyl) adenine by microglia[J]. J Pharmacol Exp Ther, 2004, 309: 1221–1229. DOI:10.1124/jpet.103.063966 |
| [8] | Heijtink RA, De Wilde GA, Kruining J, et al. Inhibitory effect of 9-(2-phosphonylmethoxyethyl)-adenine (PMEA) on human and duck hepatitis B virus infection[J]. Antiviral Res, 1993, 21: 141–153. DOI:10.1016/0166-3542(93)90050-S |
| [9] | Annaert P, Van Gelder J, Naesens L, et al. Carrier mechanisms involved in the transepithelial transport of bis(POM)-PMEA and its metabolites across Caco-2 monolayers[J]. Pharm Res, 1998, 15: 1168–1173. DOI:10.1023/A:1011923420719 |
| [10] | Maeng HJ, Chapy H, Zaman S, et al. Effects of 1α, 25- dihydroxyvitamin D3 on transport and metabolism of adefovir dipivoxil and its metabolites in Caco-2 cells[J]. Eur J Pharm Sci, 2012, 46: 149–166. DOI:10.1016/j.ejps.2012.02.018 |
| [11] | Yoon IS, Son JH, Kim SB, et al. Effects of 1α, 25- dihydroxyvitamin D3 on intestinal absorption and disposition of adefovir dipivoxil and its metabolite, adefovir, in rats[J]. Biol Pharm Bull, 2015, 38: 1732–1737. DOI:10.1248/bpb.b15-00356 |
| [12] | Annaert P, Tukker JJ, Van Gelder J, et al. In vitro, ex vivo, and in situ intestinal absorption characteristics of the antiviral ester prodrug adefovir dipivoxil[J]. J Pharm Sci, 2000, 89: 1054–1062. DOI:10.1002/1520-6017(200008)89:8<1054::AID-JPS10>3.0.CO;2-5 |
| [13] | Ji X, Wang J, Zhang L, et al. Application of phosphates and phosphonates prodrugs in drug research and development[J]. Acta Pharm Sin (药学学报), 2013, 48: 621–634. |
| [14] | Mulato AS, Ho ES, Cihlar T. Nonsteroidal anti-inflammatory drugs efficiently reduce the transport and cytotoxicity of adefovir mediated by the human renal organic anion transporter 1[J]. J Pharmacol Exp Ther, 2000, 295: 10–15. |
| [15] | Fu DX, Yang B. Adverse reactions of non-steroidal anti- inflammatory drugs and its prevention[J]. Chin Pharm J (中国药学杂志), 1999, 34: 129–130. |
| [16] | Novak A, Carpini GD, Ruiz ML, et al. Acetaminophen inhibits intestinal P-glycoprotein transport activity[J]. J Pharm Sci, 2013, 102: 3830–3837. DOI:10.1002/jps.23673 |
| [17] | Novak A, Carpini GD, Ruiz ML, et al. Acetaminophen (AP) inhibits intestinal P-glycoprotein (P-gp) activity in vitro and in vivo[J]. FASEB J, 2013, 27: S8914. |
| [18] | Khamdang S, Takeda M, Noshiro R, et al. Interactions of human organic anion transporters and human organic cation transporters with nonsteroidal anti-inflammatory drugs[J]. J Pharmacol Exp Ther, 2002, 303: 534–539. DOI:10.1124/jpet.102.037580 |
| [19] | Apiwattanakul N, Sekine T, Chairoungdua A, et al. Transport properties of nonsteroidal anti-inflammatory drugs by organic anion transporter 1 expressed in xenopus laevis oocytes[J]. Mol Pharmacol, 1999, 55: 847–854. |
| [20] | Mkim JM Jr. In vitro toxicity screening in early drug discovery: importance of metabolism and reactive metabolites[M]//Lyubimov AV. Encyclopedia of Drug Metabolism and Interactions. 2nd ed. Hoboken: John Wiley & Sons, Inc., 2012: 1-28. |
| [21] | Wood JH, Syarto JE, Letterman H. Improved holder for intrinsic dissolution rate studies[J]. J Pharm Sci, 1965, 54: 1068. DOI:10.1002/jps.2600540730 |
| [22] | Chen X, Gao Y, Zhou H, et al. Gastrointestinal absorption kinetics of methylcantharidimide in rats[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2011, 30: 343–349. |
| [23] | Nie SF, Pan WS, Yang XG, et al. Evaluation of gravimetry in the rat single-pass intestinal perfusion technique[J]. Chin J New Drugs (中国新药杂志), 2005, 14: 1176–1179. |
| [24] | Arimilli MN, Kelly DE, Lee TTK, et al. Nucleotide analog compositions: US, 6451340[P]. 2002-09-17. |
| [25] | Zimmermann B, Baranović G. Thermal analysis of paracetamol polymorphs by FT-IR spectroscopies[J]. J Pharm Biomed Anal, 2011, 54: 295–302. DOI:10.1016/j.jpba.2010.08.023 |
| [26] | Cherukuvada S, Row TNG. Comprehending the formation of eutectics and cocrystals in terms of design and their structural interrelationships[J]. Cryst Growth Des, 2014, 14: 4187–4198. DOI:10.1021/cg500790q |
| [27] | Yalkowsky SH, Valvani SC, Roseman TJ. Solubility and partitioning Ⅵ: octanol solubility and octanol-water partition coefficients[J]. J Pharm Sci, 1983, 72: 866–870. DOI:10.1002/jps.2600720808 |
| [28] | Alhalaweh A, Roy L, Rodríguez-Hornedo N, et al. pH-dependent solubility of indomethacin-saccharin and carbamazepine- saccharin cocrystals in aqueous media[J]. Mol Pharm, 2012, 9: 2605–2612. DOI:10.1021/mp300189b |
| [29] | Miyako Y, Tai H, Ikeda K, et al. Solubility screening on a series of structurally related compounds: cosolvent-induced changes on the activity coefficient of hydrophobic solutes[J]. Drug Dev Ind Pharm, 2008, 34: 499–505. DOI:10.1080/03639040701744020 |
| [30] | Jayasankar A, Good DJ, Rodríguez-Hornedo N. Mechanisms by which moisture generates cocrystals[J]. Mol Pharm, 2007, 4: 360–372. DOI:10.1021/mp0700099 |
| [31] | Good DJ, Rodríguez-Hornedo N. Solubility advantage of pharmaceutical cocrystals[J]. Cryst Growth Des, 2009, 9: 2252–2264. DOI:10.1021/cg801039j |
| [32] | Liang SJ, Zhou SY, Yang ST, et al. Thermodynamic studies of naringenin-isonicotinamide cocrystals[J]. Acta Pharm Sin (药学学报), 2017, 52: 625–633. |
| [33] | Thiebaut F, Tsuruo T, Hamada H, et al. Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues[J]. Proc Natl Acad Sci U S A, 1987, 84: 7735–7738. DOI:10.1073/pnas.84.21.7735 |
| [34] | Van De Water FM, Boleij JM, Peters JGP, et al. Characterization of P-glycoprotein and multidrug resistance proteins in rat kidney and intestinal cell lines[J]. Eur J Pharm Sci, 2007, 30: 36–44. DOI:10.1016/j.ejps.2006.09.008 |
| [35] | Amo EMD, Heikkinen AT, Mönkkönen J. In vitro-in vivo correlation in P-glycoprotein mediated transport in intestinal absorption[J]. Eur J Pharm Sci, 2009, 36: 200–211. DOI:10.1016/j.ejps.2008.11.005 |
| [36] | The International Transporter Consortium. Membrane transporters in drug development[J]. Nat Rev Drug Discov, 2010, 9: 215–236. DOI:10.1038/nrd3028 |
| [37] | Artursson P, Karlsson J. Correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial (Caco-2) cells[J]. Biochem Biophys Res Commun, 1991, 175: 880–885. DOI:10.1016/0006-291X(91)91647-U |
 2018, Vol. 53
2018, Vol. 53


