2型糖尿病是一种严重威胁人类健康的慢性疾病, 患者常伴随有糖尿病肾病、心脑血管疾病、视网膜病变等多种并发症, 严重影响患者的生活质量。随着糖尿病病情的发展、病程的延长, 可能引起机体多个组织和器官发生病变, 与药代动力学过程相关的酶、转运体的表达与活性也会发生相应的变化[1], 导致药物在糖尿病病理状态下的药动学过程与正常状态下的情况出现差异[2, 3]。
厚朴(Magnoliae officinalis Cortex)是一味传统中药, 味辛、性温, 具有行气化湿、温中止痛之功效。现代药理学研究表明, 厚朴具有抗氧化[4]、抗肿瘤[5]等多种药理活性, 且和厚朴酚是厚朴的主要活性成分之一[6]。和厚朴酚在正常大鼠、小鼠、犬体内的药动学已有文献报道[7-10], 而和厚朴酚及其代谢产物在糖尿病病理状态下的药动学研究却未见报道。虽然大多数的药动学研究都是在正常动物上进行的, 但是病理状态机体的机能和正常状态相比会有很大的差别, 一些代谢酶的活性和转运体的功能会受到影响, 必然导致药物在患病机体中的药动学发生改变, 从而影响药效甚至产生毒副作用。而药物的作用对象是患者, 因此对药物在病理状态下的药动学过程进行研究与临床更相关。作者前期的研究[11]表明和厚朴酚对2型糖尿病大鼠有抗氧化、降糖降脂、抑制肝脏CYP2E1酶活性等作用, 具有较明显的抗糖尿病疗效。因此, 本文对比研究了和厚朴酚及其主要代谢物在正常及糖尿病模型大鼠体内的药动学与组织分布, 以期为今后基于和厚朴酚的新药研究提供实验依据。
材料与方法药品与试剂 和厚朴酚对照品(纯度≥99%)及内标厚朴酚对照品(纯度≥99%)均购自中国药品生物制品检定所; 和厚朴酚原料药(纯度≥98%)购自武汉泰凯塞科技有限公司; 甲醇(色谱纯), 购自美国Tidea公司; 乙酸铵(质谱纯), 购自美国Sigma公司; 羧甲基纤维素钠, 购自中国常州国宇科技有限公司; 屈臣氏蒸馏水, 购自中国屈臣氏公司。
实验动物 SPF级雄性SD大鼠70只, 150~180 g, 购于湖北省武汉市疾病预防控制中心, 合格证号SCXK (鄂) 2008-0005, 动物福利和实验过程遵循湖北大学动物伦理委员会的规定。
实验仪器 LCMS-8040液-质联用仪系统(Shimadzu公司, 日本): LC-20A泵、DGU-20A3R脱气机、SIL-20AHT自动进样器、CTO-20A柱温箱; VP-ODS色谱柱(2.0 mm × 150 mm, 4.6 μm)、Shim- pack Column Holder保护柱(2 mm × 5 mm, 4.6 μm) (Shimadzu公司, 日本); 2K15C台式高速离心机(Sigma公司, 美国); Ecospin 3180C真空冷冻干燥机(BioTron公司, 韩国)。
2型糖尿病大鼠模型的建立 70只雄性SD大鼠经基础饲料适应性喂养一周后随机分为两组: 46只用于造模(喂饲高脂饲料, 包含10%猪油、10%白糖、5%蛋黄粉、1%胆固醇和74%基础饲料)、24只为正常对照(喂饲基础饲料), 分别用相应饲料喂养6周。此阶段平均每3天清理鼠笼一次。6周后, 隔夜禁食12 h, 模型组大鼠按照30 mg·kg-1剂量一次性腹腔注射链脲佐菌素柠檬酸钠缓冲溶液(pH 4.5), 正常对照组则注射等体积的柠檬酸钠缓冲溶液(pH 4.5)。于注射7天后取尾静脉血测血糖值, 随机血糖值≥16.7 mmol·L-1, 且伴有明显多饮、多尿、多食、体质量下降的大鼠, 确定为糖尿病造模成功, 血糖值< 16.7 mmol·L-1的大鼠弃之。此后, 所有大鼠均予以基础饲料喂养。
大鼠灌胃和厚朴酚的药动学研究 分别选取造模成功的2型糖尿病大鼠及正常大鼠各6只, 灌胃给予50 mg·kg-1和厚朴酚, 并于给药后5、10、15、30、45、60、120、240、480和720 min眼眶静脉丛取血0.3~0.4 mL, 肝素抗凝, 冰上静置0.5 h后3 000 ×g、4 ℃离心10 min, 取血浆, -80 ℃保存备用。
大鼠灌胃和厚朴酚的组织分布研究 选取2型糖尿病模型大鼠18只, 随机分为3组(n = 6);选取正常大鼠18只, 随机分成3组(n = 6), 灌胃给予50 mg·kg-1和厚朴酚, 分别于给药后5、15和240 min断头处死, 快速取出肝、肾和脑组织, 用冰冷的生理盐水仔细洗去表面血液, 再用滤纸仔细吸干表面水分后精密称重, 在冰上用剪刀尽量的剪碎, 按照1:3 (m/v, 肝脏), 1:2 (m/v, 肾脏)、1:2 (m/v, 脑)的比例加入生理盐水, 自动匀浆仪匀浆, 将匀浆液保存在-80 ℃冰箱备用。
样品处理 精密量取大鼠血浆100 μL或组织匀浆400 μL, 加入2倍体积的含有内标(在血浆及组织匀浆中终质量浓度为500 ng·mL-1)的甲醇沉淀蛋白, 涡旋混合3 min后, 12 000 ×g、4 ℃离心10 min, 取上清液200 μL或600 μL, 真空冷冻浓缩挥干, 流动相100 μL复溶, HPLC-MS/MS法鉴定代谢产物, HPLC法检测血浆中和厚朴酚及其代谢产物的浓度。
液相条件 以5 mmol·L-1乙酸铵水溶液(A)和甲醇(B)为流动相进行线性梯度洗脱, 洗脱程序为: 0~10 min, 20%~40% B; 10~23 min, 40%~80% B; 23~29 min, 80% B; 29~29.01 min, 80%~20% B; 29.01~34 min, 20% B。流速为0.2 mL·min-1, 柱温40 ℃, 检测波长为294 nm, 进样量20 μL。由于没有和厚朴酚代谢产物的对照品, 因此假设代谢产物与和厚朴酚有相似的摩尔吸光系数, 利用和厚朴酚的标准曲线对代谢产物进行相对定量。
数据处理 实验结果以Mean ± SD方式表示。采用非房室模型并应用DAS3.0药动学软件对待测物平均药时曲线数据进行拟合, 计算药动学参数。应用t检验和方差分析, 对糖尿病模型组和正常对照组大鼠药动学参数进行统计学分析, P < 0.05, 表示有显著性差异。
结果 1 方法学考察 1.1 专属性在大鼠肝匀浆中检测到两种代谢产物, M1 (羟基化的和厚朴酚葡萄糖醛酸化和磺基化产物)和M2 (和厚朴酚单葡萄糖醛酸化产物), 血浆及肾匀浆中只检测到代谢产物M2, 脑匀浆中没有检测到代谢产物, 鉴定方法参考前期研究[12]。应用本文建立的HPLC方法, 和厚朴酚及其代谢产物在血浆、肝匀浆、肾匀浆、脑匀浆中专属性良好, 无明显干扰峰。以肝匀浆为例, 各物质的典型色谱图见图 1, 由图可知和厚朴酚保留时间为27.0 min, M1保留时间为16.1 min, M2保留时间为22.1 min, 内标厚朴酚保留时间为28.2 min。
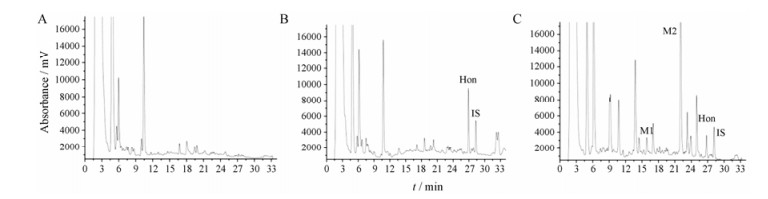
|
Figure 1 Representative LC chromatograms. A: Blank liver homogenate; B: Blank liver homogenate spiked with honokiol (500 ng·mL-1) and the IS (500 ng·mL-1); C: A rat liver homogenate sample collected at 15 min after oral administration of honokiol. M1: Hydroxylated honokiol conjugated with glucuronic and sulfuric acid; M2: HK monoglucuronide; Hon: Honokiol; IS: Magnolol |
和厚朴酚在大鼠血浆、肝匀浆、肾匀浆、脑匀浆的线性回归方程分别为: y = 0.003 8 x + 0.008 2 (50~3 200 ng·mL-1, r2 = 0.999); y = 0.002 6 x + 0.006 5 (50~7 200 ng·mL-1, r2 = 0.999); y = 0.002 3 x + 0.008 7 (50~3 200 ng·mL-1, r2 = 0.994); y = 0.009 4 x + 0.001 5 (25~1 600 ng·mL-1, r2 = 0.998)。由结果可见, 和厚朴酚在血浆和组织匀浆中的各自范围内线性良好。
1.3 日内、日间精密度与准确度日内、日间精密度与准确度结果表明和厚朴酚的质控样在大鼠血浆及各组织匀浆中的日内、日间精密度RSD值均小于15%, 准确度在85%~115%, 定量下限的日内、日间精密度RSD值均小于20%, 准确度在80%~120%, 满足生物样品定量分析要求。
1.4 稳定性和厚朴酚质控样-80 ℃放置1个月、反复冻融3次以及处理后的质控样在4 ℃进样盘放置4 h的稳定性结果表明, 和厚朴酚在上述条件下均较稳定, 相对误差在± 15%以内。
2 大鼠灌胃和厚朴酚的药动学正常组大鼠和模型组大鼠分别灌胃50 mg·kg-1和厚朴酚后, 在血浆中检测到了和厚朴酚、代谢产物M2, 未检测到代谢产物M1, 提示血浆中的主要代谢产物为M2。和厚朴酚及其代谢产物M2的血浆药物浓度-时间曲线见图 2, 药动学参数见表 1。由表 1可知, 和厚朴酚在大鼠体内的药动学过程与许多其他多酚类物质类似[13-15], 也是一个快吸收(tmax为0.31~0.35 h)、较慢消除过程(t1/2z为3.8~4.8 h)。与正常对照组相比, 糖尿病模型组和厚朴酚的药时曲线下面积(AUC)、达峰浓度(Cmax)显著减小(P < 0.05), 平均驻留时间(MRT)和消除半衰期(t1/2z)虽有缩短, 但与正常组相比无统计学差异。同时, 糖尿病模型组代谢产物M2的AUC和Cmax都大于正常对照组, 且模型组M2的Cmax与正常组相比有显著性差异(P < 0.05), 但两组间的tmax无明显差异。此外, 正常对照及模型组血浆中M2的浓度均远大于原药和厚朴酚的浓度。
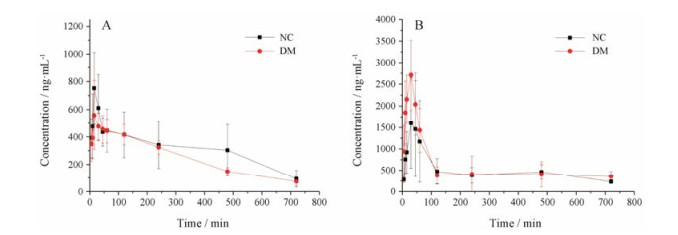
|
Figure 2 Mean plasma concentration-time curves of honokiol (A) and M2 (B) after oral administration of a single dose of honokiol (50 mg·kg-1). NC: Normal control group; DM: Diabetic model group |
| Table 1 The pharmacokinetic parameters of honokiol and M2 in rat plasma after oral administration. n = 6, x± s. -: Not available; *P < 0.05, **P < 0.01 vs NC |
大鼠单次灌胃50 mg·kg-1和厚朴酚后, 无论是正常组还是糖尿病模型组, 大鼠脑组织中均只检测到了和厚朴酚, 肝组织中检测到了和厚朴酚、代谢产物M1和M2, 肾组织中检测到了和厚朴酚和代谢产物M2。表 2显示了和厚朴酚灌胃给药后, 和厚朴酚及其代谢产物在大鼠肝、肾、脑组织中的分布程度。结果显示和厚朴酚在肝脏中暴露量最高, 然后是肾脏和脑。糖尿病模型组大鼠肝脏、肾脏、脑中和厚朴酚的暴露量均高于正常对照组。仅在肝组织中检测到了M1, 而且M1在糖尿病模型组大鼠中的暴露量高于正常对照组大鼠; 在肝脏和肾脏中均检测到了M2, 且糖尿病模型组大鼠肝脏和肾脏中M2的暴露量均高于正常对照组。此外, 结果还表明肝脏和肾脏中代谢产物M2的暴露量均高于和厚朴酚, 且肝脏中和厚朴酚的暴露量高于M1的暴露量。
| Table 2 The AUC0-4 h of honokiol, M1 and M2 in tissues in normal and diabetic rats (n = 6). -: Not available |
作为中药厚朴的主要活性成分之一, 已有报道和厚朴酚的药理活性及其药动学性质。本文对比研究了和厚朴酚及其代谢产物M1、M2在正常大鼠和糖尿病模型大鼠体内的药动学及肝、肾、脑组织的分布情况。在脑组织中只检测到了原药和厚朴酚, 未检测到其代谢产物, 说明和厚朴酚能够透过血脑屏障发挥药理活性, 与文献[16]报道情况一致, 而其代谢产物M1、M2不能透过血脑屏障。在血浆、肝脏和肾脏中, 无论是正常组大鼠还是模型组大鼠, 和厚朴酚代谢产物的量都远大于原药, 说明和厚朴酚在大鼠体内主要以Ⅱ相代谢物即葡萄糖醛酸及硫酸轭合物形式存在。虽然葡萄糖醛酸及硫酸轭合代谢物一向被认为没有药理活性, 但近年来越来越多的研究发现事实并非如此。吗啡的6-葡萄糖醛酸轭合物能够增强吗啡的镇痛效果; 槲皮素在人体内的代谢产物槲皮素葡萄糖醛酸轭合物也保留了槲皮素的部分功能, 能够抑制黄嘌呤氧化酶和脂氧合酶的活性[17, 18]。因此, 本文结果提示和厚朴酚的一些药理作用可能是基于其代谢产物, 而非完全源于和厚朴酚自身。
2型糖尿病的发生发展对肝脏、肾脏、神经、血管等诸多方面的功能都有一定程度的影响。如糖尿病状态下肝、肾一些重要的药物代谢酶与转运体的表达与活性会发生改变, 从而影响药物的体内药动学过程与疗效[1-3, 19]。本研究发现, 在糖尿病病理状态下和厚朴酚及其代谢产物在大鼠体内的药动学过程发生了明显改变。与正常对照组相比, 糖尿病模型组和厚朴酚的t1/2z、AUC和Cmax明显减小, 而代谢产物M2的AUC和Cmax显著增加, 说明在糖尿病状态下原药和厚朴酚在体内的量减少了, 而代谢产物的量增多了。文献[20]报道和厚朴酚的体内清除40%以上由肝脏代谢引起, 只有很少一部分原药(约3%)由尿液排泄, 提示原药和厚朴酚的减少及代谢产物浓度的增加可能与糖尿病状态下肝脏代谢功能的改变有关。Sato等[21]发现在糖尿病状态下机体可能通过释放激肽增加肝脏的血流量, 而血流量的增加会导致肝提取率的增加, 这可能是糖尿病模型组体内原药和厚朴酚含量减小、代谢产物量增加的原因之一。此外, 和厚朴酚在大鼠体内的血浆蛋白结合率约为53.8%[20], 是一个中等蛋白结合的药物。而糖尿病往往伴随肾脏病变, 肾功能不全会导致血浆蛋白含量减少, 这也有可能导致与血浆蛋白结合的和厚朴酚减少, 进入肝细胞并被肝脏清除的和厚朴酚增加, 最终使得在血浆中的和厚朴酚量减少、代谢产物量增加。更为重要的是, 参与和厚朴酚代谢的Ⅰ相、Ⅱ相代谢酶活性的改变能直接影响药物在肝脏的清除, 从而影响其药动学过程。本实验室此前的研究发现, 大鼠肝微粒体中的CYP1A2及CYP3A参与了和厚朴酚的Ⅰ相体外代谢, 而前期研究[12]发现在大鼠体内和厚朴酚主要发生葡萄糖醛酸化和硫酸化Ⅱ相代谢, 与和厚朴酚在大鼠在体肝脏中的代谢产物一致[22]。因此, 糖尿病病理状态下大鼠肝脏葡萄糖醛酸转移酶、磺酸转移酶及CYP1A2及CYP3A活性的上调, 应是糖尿病模型大鼠血浆中和厚朴酚量的减少及代谢产物量的增多的一个主要原因。
药物的组织分布与血液循环、血管的通透性、药物蛋白结合等因素有关。肝、肾和脑都是血液循环快速的器官, 因此灌胃和厚朴酚后在这些组织中都很快检测到了和厚朴酚及其代谢产物(脑中没有检测到代谢物)。文献[23]报道, 糖尿病会导致血浆蛋白含量减少或阻止血浆蛋白结合的物质会增多, 因此游离药物浓度会增加, 使得更多的药物进入组织; 此外, 在病理状态下血管的通透性可能发生改变, 也可能使得药物更容易透过毛细血管进入组织。本文也得到了类似结果, 即糖尿病模型组大鼠肝、肾组织中和厚朴酚及其代谢产物的暴露量均较正常对照组有不同程度的增加, 脑组织中和厚朴酚的暴露量也高于正常对照组, 这可能与病理状态下脑细胞膜通透性变大、和厚朴酚更容易透过血脑屏障有关。此外, 本研究只选择了肝、肾、脑组织进行组织分布研究, 这是因为肝、肾、脑是和厚朴酚的主要靶器官。文献[24, 25]表明和厚朴酚对肝脏具有保护作用, 能逆转酒精性脂肪肝、CCl4引起的肝损伤, 阻止丙型肝炎病毒(HCV)细胞的侵入和复制; 而且和厚朴酚对人肾系膜炎症有抑制作用, 还能抑制小鼠足细胞的凋亡[26]; 此外, 和厚朴酚能够透过血脑屏障, 诱导脑部神经母细胞瘤的凋亡, 抑制脑胶质瘤的生长[16]。
综上, 在糖尿病病理状态下和厚朴酚及其代谢产物的药动学和组织分布发生了一定改变, 提示和厚朴酚如用于糖尿病患者的临床治疗, 在用药剂量上应有所调整。
| [1] | Kudo T, Shimada T, Toda T, et al. Altered expression of CYP in TSOD mice: a model of type 2 diabetes and obesity[J]. Xenobiotica, 2009, 9: 889–902. |
| [2] | Gawrońska-Szklarz B, Musiał DH, Pawlik A, et al. Effect of experimental diabetes on pharmacokinetic parameters of lidocaine and MEGX in rats[J]. Pol J Pharmacol, 2003, 55: 619–624. |
| [3] | Bae SK, Kim JY, Yang SH, et al. Pharmacokinetics of oltipraz in rat models of diabetes mellitus induced by alloxan or streptozotocin[J]. Life Sci, 2006, 78: 2287–2294. DOI:10.1016/j.lfs.2005.09.031 |
| [4] | Wang JJ, Zhao R, Liang JC, et al. The antidiabetic and hepatoprotective effects of magnolol in diabetic rats induced by high-fat diet and streptozotocin[J]. Acta Pharm Sin (药学学报), 2014, 49: 476–481. |
| [5] | Bai X, Cerimele F, Ushio-Fukai M, et al. Honokiol, a small molecular weight natural product, inhibits angiogenesis in vitro and tumor growth in vivo[J]. J Biol Chem, 2003, 278: 35501–35507. DOI:10.1074/jbc.M302967200 |
| [6] | Ren JR, Yu F, Zhang SB, et al. Research progress on active constituents of Magnolia officinalis[J]. Mod Agric Sci Technol (现代农业科技), 2011, 21: 127–128. |
| [7] | Ma SS, Shao YF, Wu XM, et al. The pharmacokinetics of manolol and honokiol in rats by LC-MS/MS[J]. J Chin Mass Spectrom Soc (质谱学报), 2013, 34: 23–28. |
| [8] | Wang LH, Gai YM, Yuan C, et al. Pharmacokinetics profile of magnolol and honokiol: an experimental study in Wistar rats[J]. J Pract Med (实用医药杂志), 2004, 21: 137–139. |
| [9] | Liang Y, Cui G, Wang XX, et al. Pharmacokinetics of honokiol after intravenous guttae in Beagle dogs assessed using ultra performance liquid chromatography-tandem mass spectrometry[J]. Biomed Chromatogr, 2014, 28: 1378–1383. DOI:10.1002/bmc.v28.10 |
| [10] | Wang XH, Cai LL, Zhang XY, et al. Improved solubility and pharmacokinetics of PEGylated liposomal honokiol and human plasma protein binding ability of honokiol[J]. Int J Pharm, 2011, 410: 169–174. DOI:10.1016/j.ijpharm.2011.03.003 |
| [11] | Wang JJ, Zhao R, Liang JC, et al. Antidiabetic and anti- oxidative effects of honokiol on diabetic rats induced by high-fat diet and streptozotocin[J]. Chin Herb Med, 2014, 6: 42–47. DOI:10.1016/S1674-6384(14)60005-8 |
| [12] | Wang JJ, Miao X, Chen JY, et al. The pharmacokinetics and tissue distribution of honokiol and its metabolites in rats[J]. Eur J Drug Metab Pharmacokinet, 2016, 41: 587–594. DOI:10.1007/s13318-015-0281-6 |
| [13] | Lin YR, Chen HH, Ko CH, et al. Effects of honokiol and magnolol on acute and inflammatory pain models in mice[J]. Life Sci, 2007, 81: 1071–1078. DOI:10.1016/j.lfs.2007.08.014 |
| [14] | Ritter JK. Roles of glucuronidation and UDP-glucuronosyltransferases in xenobiotic bioactivation reactions[J]. Chem Biol Interact, 2000, 129: 171–193. DOI:10.1016/S0009-2797(00)00198-8 |
| [15] | Yu HE, Oh SJ, Ryu JK, et al. Pharmacokinetics and metabolism of 4-O-methylhonokiol in rats[J]. Phytother Res, 2014, 28: 568–578. DOI:10.1002/ptr.v28.4 |
| [16] | Wang X, Duan X, Yang G, et al. Honokiol crosses BBB and BCSFB, and inhibits brain tumor growth in rat 9L intracerebral gliosarcoma model and human U251 xenograft glioma model[J]. PLoS One, 2011, 6: e18490. DOI:10.1371/journal.pone.0018490 |
| [17] | Murthy BR, Pollack GM, Brouwer KL. Contribution of morphine-6-glucuronide to antinociception following intravenous administration of morphine to healthy volunteers[J]. J Clin Pharmacol, 2002, 42: 569–576. DOI:10.1177/00912700222011508 |
| [18] | Day AJ, Bao Y, Morgan MR, et al. Conjugation position of quercetin glucuronides and effect on biological activity[J]. Free Radic Biol Med, 2000, 29: 1234–1243. DOI:10.1016/S0891-5849(00)00416-0 |
| [19] | Thomas MC, Tikellis C, Kantharids P, et al. The role of advanced glycation in reduced organic cation transport associated with experimental diabetes[J]. J Pharmacol Exp Ther, 2004, 311: 456–466. DOI:10.1124/jpet.104.070672 |
| [20] | Yuan C, Liang AJ, Zeng L, et al. Pharmacokinetics profile of magnolol and honokiol in Wistar rats[J]. Pharm J Chin PLA (解放军药学学报), 2002, 19: 258–261. |
| [21] | Sato H, Terasaki T, Okumura K, et al. Effect of receptor up-regulation on insulin pharmacokinetics in streptozotocin- treated diabetic rats[J]. Pharm Res, 1991, 8: 563–569. DOI:10.1023/A:1015888203572 |
| [22] | Böhmdorfer M, Maier-Salamon A, Taferner B, et al. In vitro metabolism and disposition of honokiol in rat and human livers[J]. J Pharm Sci, 2011, 100: 3506–3516. DOI:10.1002/jps.22536 |
| [23] | Rick AF, Belpaire FM, Dello C, et al. Influence of enhanced alpha-1-acid glycoprotein concentration on protein binding pharmacokinetics and antiarrhythmic effect of lidocaine in the dog[J]. J Pharmacol Exp Ther, 1987, 241: 289–293. |
| [24] | Lan KH, Wang YW, Lee WP, et al. Multiple effects of honokiol on the life cycle of hepatitis C virus[J]. Liver Int, 2012, 32: 989–997. DOI:10.1111/liv.2012.32.issue-6 |
| [25] | Cao AH, Vo LT, King RG. Honokiol protects against carbon tetrachloride induced liver damage in the rat[J]. Phytother Res, 2005, 19: 932–937. DOI:10.1002/(ISSN)1099-1573 |
| [26] | Wu F. The Effect of Honokiol in Renal Cell Protection and its Mechanism (和厚朴酚保护肾组织细胞的作用与机制研究)[D]. Hangzhou: Zhejiang University, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2119395 |
 2018, Vol. 53
2018, Vol. 53


