2. 呼吸疾病诊疗与新药研发河南省协同创新中心, 河南 郑州 450046
2. Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment and Chinese Medicine Development of Henan Province, Zhengzhou 450046, China
光皮木瓜为[Chaenomeles sinensis (Thouin) Koehne]为蔷薇科植物, 又名榠栌、木李、海棠等, 广泛分布于陕西、山东、河南、湖北、安徽等地。光皮木瓜成熟果实又称为榠楂, 果皮干燥后仍光滑, 不皱缩, 故有光皮木瓜之称[1]。光皮木瓜的记载始于《本草经集注》, 其果实味酸、涩, 性平, 具有和胃舒筋、祛风湿、消痰止渴的功效[2]。目前, 从光皮木瓜中分离得到的化合物主要为三萜类、黄酮类、木脂素类等化合物。现代药理研究表明, 光皮木瓜具有抗氧化、抗炎、抗菌、降血糖、抗癌、抗老年痴呆等药理活性[3]。为了进一步明确光皮木瓜中的化学成分, 本实验采用Diaion HP-20、Toyopearl HW-40、ODS、Sephadex LH-20、硅胶及半制备高效液相等多种色谱方法从光皮木瓜50%含水丙酮提取物中分离得到3个吲哚类生物碱, 利用MS、IR、UV、1D和2D NMR等波谱技术对其结构进行鉴定, 分别为木瓜新碱A (1)、ginsenine (2)和(1S, 3S)-1-甲基-1, 2, 3, 4-四氢-β-咔啉-3-羧酸(3)。其中化合物1为新化合物, 化合物2和3为首次从光皮木瓜中分离得到, 结构见图 1。采用MTT法检测化合物1~3对β淀粉样蛋白25-35 (Aβ25-35)诱导大鼠嗜铬细胞瘤细胞(PC-12)细胞损伤的保护作用, 结果显示化合物2和3对PC-12细胞具有显著的保护作用。

|
Figure 1 Structures of compounds 1-3 |
化合物1 白色粉末(甲醇)。
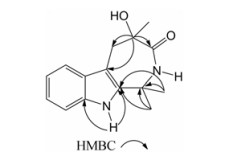
|
Figure 2 Key HMBC of compound 1 |

|
Figure 3 Key NOESY of compound 1 |
| Table 1 1H NMR (500 MHz in DMSO-d6) and 13C NMR (125 MHz in DMSO-d6) spectral data of compound 1 |
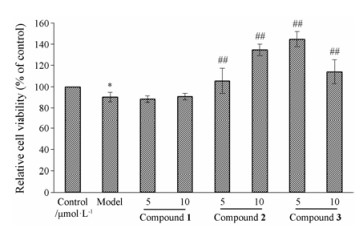
采用MTT法检测化合物1~3对Aβ25-35诱导PC-12细胞损伤的保护作用。结果显示化合物2、3在浓度5和10 μmol·L-1时, 可显著提高Aβ25-35诱导PC-12损伤的细胞活力, 说明化合物2和3对PC-12细胞具有显著的保护作用(图 4)。
|
Figure 4 The effect of compounds 1-3 on the viability of PC-12 cells exposed to Aβ25-35. n = 4, x± s. *P < 0.05 vs control group; ##P < 0.01 vs model group |
Bruker AVANCE Ⅲ 500核磁共振仪, TMS为内标; LC50型高压制备液相色谱仪[赛谱锐思(北京)科技有限公司, 紫外检测器为(UV200), 色谱柱为(YMC-Pack ODS-A, 250 mm × 10 mm. D. S-5 μm, 12 μm)]; Bruker maxis HD型飞行时间质谱仪(德国); 柱色谱所用硅胶H (160~200目)为青岛海洋化工厂生产, 所用分析纯和色谱纯试剂为天津市恒兴化学试剂制造有限公司和天津市四友精细化学品有限公司生产, 柱色谱填充剂所用Diaion HP-20、MCI Gel CHP-20、Toyopearl HW-40为日本三菱化学公司生产, Sephadex LH-20为Parmacia Biotech公司生产。
本实验所用的光皮木瓜, 采自河南南阳方城县, 经河南中医药大学董诚明教授鉴定为蔷薇科植物光皮木瓜[Chaenomeles sinensis (Thouin) Koehne]的新鲜成熟果实。
1 提取与分离光皮木瓜鲜品30 kg, 用50%含水丙酮组织破碎提取3次, 提取液减压浓缩得总浸膏2.67 kg, 后用80%乙醇进行醇沉, 得到上层澄清溶液, 减压浓缩, 得浸膏1.26 kg。将其水溶离心、过滤, 上大孔吸附树脂Diaion HP-20, 依次用水、10%乙醇、20%乙醇、30%乙醇、50%乙醇、70%乙醇、95%乙醇洗脱, 得到的各个部位。其中10% (37.68 g)乙醇洗脱部位通过Toyopearl HW-40柱色谱, 梯度洗脱[甲醇-水(0:100→10:90→20:80→30:70→100:0, v/v)], 共得到5个组分(Fr.1~Fr.5)。Fr. 1通过Toyopearl HW-40和Sephadex LH-20柱色谱, 等度洗脱[甲醇-水(50:50, v/v)], 得到Fr.1-1~Fr.1-3。Fr.1-2通过ODS柱色谱进行甲醇-水(0:100→10:90→20:80 →30:70→40:60→100:0, v/v)梯度洗脱, 得到Fr.1-2-1~Fr.1-2-6。Fr.1-2-3 (0.53 g)经半制备液相[甲醇-水(23:77, v/v)]分离纯化得到化合物1 (6.93 mg)、2 (3.61 mg)和3 (8.15 mg)。
2 结构鉴定化合物1 白色粉末(甲醇)。
化合物2 白色粉末(甲醇)。ESI-MS m/z: 267.110 9 [M+Na]+。1H NMR (DMSO-d6, 500 MHz) δ: 11.03 (1H, s, -NH), 7.43 (1H, d, J = 7.8 Hz, H-10), 7.32 (1H, d, J = 8.1 Hz, H-13), 7.08 (1H, t, J = 7.7 Hz, H-12), 7.00 (1H, t, J = 7.3 Hz, H-11), 4.47 (1H, d, J = 6.4 Hz, H-3), 3.58 (1H, dd, J= 11.8, 4.6 Hz, H-7a), 3.13 (1H, dd, J = 16.0, 4.1 Hz, H-7b), 2.75 (1H, m, H-6), 1.58 (3H, s, H-15); 13C NMR (DMSO-d6, 125 MHz) δ: 169.6 (C-5), 136.3 (C-14), 132.5 (C-2), 126.2 (C-9), 121.2 (C-12), 118.8 (C-11), 117.9 (C-10), 111.2 (C-13), 106.8 (C-8), 57.6 (C-6), 48.9 (C-3), 23.4 (C-7), 17.1 (C-15)。以上数据与文献[8]报道的ginsenine基本一致。
化合物3 白色粉末(甲醇)。ESI-MS m/z: 255.110 9 [M+Na]+。1H NMR (CD3OD-d4, 500 MHz) δ: 7.47 (1H, d, J = 7.9 Hz, H-9), 7.33 (1H, d, J = 8.1 Hz, H-12), 7.12 (1H, t, J = 8.0 Hz, H-10), 7.03 (1H, t, J = 7.8 Hz, H-11), 4.69 (1H, d, J = 6.2 Hz, H-3), 3.94 (1H, dd, J = 11.5, 4.5 Hz, H-5), 3.43 (1H, dd, J = 16.3, 4.4 Hz, H-6a), 3.02 (1H, t, J = 13.1 Hz, H-6b), 1.73 (3H, s, H-14); 13C NMR (CD3OD-d4, 125 MHz) δ: 173.1 (-COOH), 138.6 (C-13), 131.5 (C-2), 127.5 (C-8), 123.3 (C-9), 120.5 (C-12), 119.2 (C-10), 112.3 (C-11), 107.9 (C-7), 59.8 (C-5), 51.1 (C-3), 24.4 (C-6), 17.2 (-CH3)。以上数据与文献[9]报道的(1S, 3S)-1-甲基-1, 2, 3, 4-四氢-β-咔啉-3-羧酸基本一致。
3 化合物1~3对Aβ25-35诱导PC-12细胞损伤的保护作用将处于对数生长期PC-12细胞按每孔4×104个细胞、每孔200 μL接种于96孔培养板内, 24 h后, 分为正常组、模型组(20 μmol·L-1 Aβ25-35)及化合物不同浓度(20 μmol·L-1 Aβ25-35 + 5、10 μmol·L-1化合物)给药组。继续培养24 h, MTT法检测细胞活力[10]。
| [1] | Flora of China Editorial Committee of Chinese Academy of Sciences. The Flora of China (中国植物志)[M]. Beijing: Science Press, 1974: 350. |
| [2] | Zhang DS, Gao HY, Wu LJ. Advances in the study of Chaenomeles sinensis[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2007, 24: 721–725. |
| [3] | Yin ZH, Zhao C, Zhang JJ, et al. Research progress on chemical constituents and pharmacological activities of Chaenomeles sinensis[J]. Chin J Exp Tradit Med Form (中国实验方剂学), 2017, 23: 234–242. |
| [4] | Huang L, Yu DQ. Application of Ultraviolet Spectrum in Organic Chemistry (紫外光谱在有机化学中的应用) [M]. Part Ⅱ. Beijing: Science Press, 1998: 132-137. |
| [5] | Zhang HC, Zhang TT, Du B, et al. Chemical constituents of Celosia cristata L[J]. Chin Tradit Pat Med (中成药), 2014, 36: 122–125. |
| [6] | Wei W, Fan CL, Wang GY, et al. Chemical constituents from Ficus pumila[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 615–621. |
| [7] | Wang TY, Zhao JP, Li XR, et al. New alkaloids from green vegetable soybeans and their inhibitory activities on the proliferation of concanavalin A-activated lymphocytes[J]. J Agric Food Chem, 2016, 64: 1649–1656. DOI:10.1021/acs.jafc.5b06107 |
| [8] | Wang JY, Li XG, Yang XW. Ginsenine, a new alkaloid from the berry of Panax ginseng C. A. Meyer[J]. J Asian Nat Prod Res, 2006, 8: 605–608. DOI:10.1080/10286020500208444 |
| [9] | Yang BY, Song DD, Han H, et al. Chemical constituents from roots of Sambucus williamsii (Ⅰ)[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 1367–1372. |
| [10] | Wang YL, Song TY, Lu M, et al. Setting up Alzheimer disease cell apoptosis model with PC-12 cell induced by Aβ25-35[J]. J Xi'an Med Univ (西安医科大学学报), 2002, 23: 129–132. |
 2018, Vol. 53
2018, Vol. 53


