2. 湖南中医药大学药学院, 湖南 长沙 410208
2. College of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
糖尿病是严重威胁人类健康的代谢性疾病, 其中超过一半的患者死于心血管并发症[1]。与非糖尿病患者相比, 糖尿病患者卒中发病率为非糖尿病患者的2~4倍, 且预后更差[2]。
人参皂苷Rg1是临床脑卒中治疗药物的共有成分, 如金森胶囊、血塞通注射液等[3-5]。Xie等[6]对人参治疗脑卒中研究的926篇报告进行了严格筛选, 精选11篇进行了荟萃分析, 统计结果显示Rg1可显著改善卒中后运动功能障碍, 缩小卒中后的梗死体积。
Rg1具有降低2型糖尿病大鼠血糖含量和胰岛素含量[7]、增强1型糖尿病胰岛素分泌量的功效, Rg1也可促进脂肪细胞对葡萄糖的摄取能力, 改善糖尿病心肌病患者心肌细胞凋亡状态, 提高心肌细胞抗氧化损伤能力[8, 9], 促进糖尿病患者肢体远端血管再生, 改善患者微循环[10], 改善高血糖引发的视网膜损伤、肾脏损伤和肝脏损伤[11, 12]。上述研究提示Rg1对于糖尿病并发症具有良好治疗潜能。但是, Rg1对糖尿病患者脑卒中的药理学作用尚未见报道。
本研究采用高糖高脂饮食联合链脲佐霉素制备2型糖尿病大鼠模型, 在此基础上, 通过大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)制作糖尿病脑卒中复合模型, 采用静脉注射Rg1的方式评价其对糖尿病脑卒中的治疗作用, 同时观察高迁移率族蛋白1 (high mobility group box1, HMGB1)对其治疗作用的影响。
材料与方法动物 雄性SD大鼠(5周龄), 购自北京维通利华实验动物技术有限公司(清洁级, 合格证号: SCXK (京) 2016-0011), 饲养于中国医学科学院药物研究所动物房, 室温24 ± 1 ℃, 相对湿度(55 ± 5) %, 12 h/12 h明暗循环, 自由饮食, 饮水。
药品与试剂 脂肪供能比为60%高脂纯化饲料(H10060), 购自北京华阜康生物科技股份有限公司。链脲佐霉素(STZ, 美国Sigma公司); 血糖试纸(三诺生物传感股份有限公司); 异氟烷(深圳瑞沃德实验技术公司); Iba-1抗体、HMGB1抗体(Abcam公司); Iba-1 (日本WaKo公司), Alexa 488-二抗、Hoechst 33342 (Life Technology公司); ECL发光液(北京普利莱生物技术有限公司)。
2型糖尿病大鼠模型的建立 经适应性饲养7天后, 给予大鼠高脂饲料喂养4周。4周后, 经禁食12 h, 单次STZ溶液(枸橼酸缓冲液配制, pH 4.4)注射, 剂量为35 mg·kg-1, 120 h后检测空腹血糖值, 大鼠空腹血糖高于11.1 mol·L-1为糖尿病模型成功标准。
动物分组及脑缺血再灌注模型的建立 选取成功诱导2型糖尿病大鼠, 按照血糖值随机分为假手术组; 模型组; Rg1低、中、高剂量组(10、20和40 mg·kg-1); 阳性药丁苯酞组(NBP) (80 mg·kg-1)。除假手术组外, 所有大鼠进行大脑中动脉结扎再灌注模型, 操作步骤如下, 大鼠经异氟烷麻醉后, 仰卧固定在手术台上。颈部消毒, 颈前正中做一2 cm切口, 钝性分离皮下软组织、肌肉, 暴露分离颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。用0号手术线结扎ECA及其分支, 在CCA分叉前及ICA近颅端置动脉夹, 在ECA距离CCA分叉3~4 mm处做微切口。松开ICA的动脉夹, 插入特制尼龙线(长40 mm, 直径0.26 mm), 沿ICA推进至大脑中动脉(MCA)起始部, 约18.5 ± 0.5 mm, 遇阻力而停止, 造成MCA起始端阻塞, 用1号手术线固定尼龙线, 伤口覆盖生理盐水化的棉球, 将大鼠放在电热毯上保温, 90 min后将尼龙线抽出而再灌, 缝合伤口。假手术组不插入尼龙线, 其余操作同脑缺血模型组。在实验过程中, 大鼠置于温控毯上, 采用温控仪控制大鼠肛温维持在36.5~37 ℃内。
行为学评分 术后24 h进行动物行为学评分观察, 参照Longa方法, 提鼠尾离开地面约1尺, 观察两前肢状况; 将大鼠置于水平地面, 推动其双肩, 观察两侧抵抗力有无差异; 大鼠置于地面, 观察其行走情况。采用5分法(0~4分)对各组进行行为学评分, 分数越高, 说明其神经行为损伤越严重。①行为完全正常者, 记0分; ②提起鼠尾离开地面, 手术对侧前肢内旋者, 记1分; ③大鼠至地面, 手挤压两侧检查抵抗力, 抵抗力下降者, 记2分; ④大鼠至地面, 观察其行走, 围绕手术对侧转圈者, 记3分; ⑤损伤极其严重, 已无法自主活动者, 记4分。
大鼠脑梗死率(infract area percent, IAP)和水肿系数(edema factor, EF)的测定 脑组织称湿重后迅速置于-20 ℃冰箱中, 30 min后置室温, 将大鼠脑置于切片模具中, 切除嗅球、小脑和低位脑干后, 间隔2 mm冠状切片, 共计6片。然后迅速将脑片置于5 mL含1% 2, 3, 5-氯化三苯基四氮唑(TTC)的磷酸盐缓冲液(PBS)中, 37 ℃恒温避光孵育30 min, 期间每隔5 min将脑片翻动1次。经TTC染色后, 正常组织呈玫瑰红色, 梗死组织未被染色而呈白色。取出脑片放入10%福尔马林中固定。将每组脑片排列整齐, 拍照保存。应用Imagepro Plus图像分析软件处理并作统计, 计算每张脑片的梗死面积, 假定每张脑片的梗死面积为A, 患侧脑片的面积为B, 健侧的面积为C。IAP = (A1+A2+A3+A4+A5+A6)/(B1+B2+B3+B4+ B5+B6+C1+C2+C3+C4+C5+C6)×100%。EF = (B1+B2+B3+ B4+B5+B6)/(C1+C2+C3+C4+C5+C6)。
免疫细胞的检测 术后24 h进行水合氯醛麻醉(350 mg·kg-1), 待动物麻醉至无痛觉, 将四肢固定于手术板上, 经心脏进行PBS和多聚甲醛灌流固定48 h后, 进行石蜡切片。检测受损脑区内小胶质细胞(Iba-1阳性细胞)数量的变化, 具体操作:石蜡切片经脱蜡、抗原修复和封闭等处理后, 将Iba-1抗体溶液[3%牛血清白蛋白(BSA) + PBS]滴加于切片上, 4 ℃孵育过夜, PBS洗5 min×3次, 二抗避光孵育1 h, 激光共聚焦显微镜下观察Iba-1阳性细胞数量的变化。中性粒细胞检测同小胶质细胞检测, 识别抗体为髓过氧化物酶(myeloperoxidase, MPO)。
炎症因子的检测 采用qPCR方法进行检测, 具体操作:大鼠断头处死, 冰上分离受损侧大脑皮层组织, 采用Trizol提取总RNA, 经反转录后进行实时荧光定量PCR检测, 检测指标包括肿瘤坏死因子-α (TNF-α)、白介素1β (IL-1β)和诱导性一氧化氮合成酶(iNOS)。
HMGB1蛋白水平的检测 大鼠断头处死, 冰上分离受损侧皮层, 采用RIPA裂解液超声破碎, BCA法测定蛋白浓度, 加入1/4体积5×loading buffer后95 ℃处理10 min, 样品于-40 ℃保存。蛋白上样量70 μg, 分离胶浓度12%, 将蛋白转印至PVDF膜后以5% BSA封闭1 h, HMGB1抗体4 ℃孵育过夜, PBS洗5 min×3次, 二抗室温孵育2 h, PBS洗5 min×3次, 加入ECL发光液显影。使用Quality one 4.6.2凝胶分析软件对蛋白条带进行灰度分析。
侧脑室注射HMGB1抗体或HMGB1蛋白 侧脑室定位依据脑定位图谱:前囟点向后0.8 mm, 向右1.5 mm, 进针深度为3.5 mm, 给药速度为1 μL·min-1, 注射后留针3 min。缺血60 min后, 再灌同时侧脑室给予HMGB1抗体(1 μg)或1 μg兔源IgG, 体积均为5 μL, 分别命名为anti-HMGB1组和anti-control组。将anti-HMGB1组动物与anti-control组动物分别随机分为control组和Rg1 (40 mg·kg-1)治疗组, 在此基础上, 观察HMGB1对Rg1治疗糖尿病大鼠脑卒中的影响, 检测指标同上。HMGB1蛋白注射部位同上, 每只动物注射剂量为1 μg, 检测指标同HMGB1抗体注射组。
统计学分析 实验数据用x± s表示, 采用Graphpad Prism 6统计分析软件进行统计分析。数据组间比较采用单因素方差分析(one-way ANOVA)结合Tukey检验, 以P < 0.05表示具有显著性差异。
结果 1 单次给予Rg1对糖尿病大鼠血糖相关基础体征的影响如图 1a所示, 单次静脉给予40 mg·kg-1 Rg1 24 h后, 无论是在健康大鼠还是糖尿病大鼠, 均未对血糖值产生显著影响(P > 0.05)。图 1b显示, 10、20和40 mg·kg-1 Rg1也未对糖尿病大鼠卒中后血糖值产生显著影响。同时, Rg1对糖尿病大鼠卒中后血中胰岛素水平(图 1c)和体重降低(图 1d)亦无显著影响, 表明单次给予Rg1对卒中引发的糖尿病大鼠代谢异常无显著影响。

|
Figure 1 Effect of single administration of Rg1 on basal diabetes symptoms. a: Effect of Rg1 on fasting blood glucose in normal rats and diabetic rats; b: Effect of Rg1 on blood glucose after stroke in diabetic rats; c: Effect of Rg1 on blood insulin after stroke in diabetic rats; d: Effects of Rg1 on weight changes after stroke in diabetic rats. NBP: dl-3-n-Butylphthalidle |
本研究选取神经行为学评分, 采用脑梗死率及脑水肿系数进行综合评价。如图 2所示, 与模型组相比, 20和40 mg·kg-1 Rg1组可显著降低卒中后大鼠的行为学评分(P < 0.05, P < 0.01), 与阳性药丁苯酞相比, 无显著差异; 梗死率分析显示, 与模型组相比, 20和40 mg·kg-1 Rg1组可显著降低动物的梗死率, 40 mg·kg-1 Rg1组与阳性药相比无显著差异; 卒中后脑水肿是导致其病情恶化的重要原因, 与模型组相比, 20和40 mg·kg-1 Rg1组可显著降低动物的水肿系数(P < 0.01), Rg1与阳性药相比无显著差异。
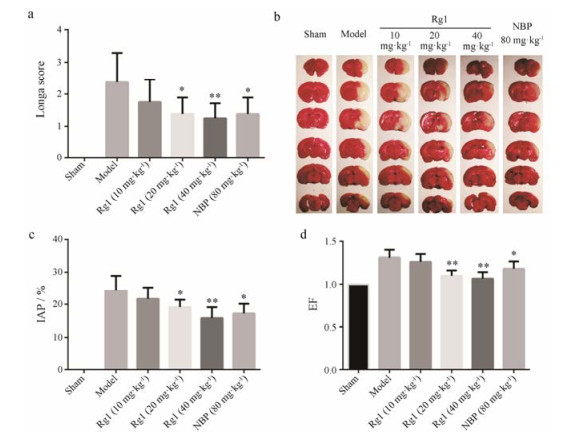
|
Figure 2 Improvement of Rg1 on ischemic stroke in diabetic rats. a: Quantitative analysis of neurological score by Longa test; b: Representative TTC staining results of MCAO rats treated with Rg1 or NBP; c: Quantitative analysis of cerebral infarct area percent (IAP); d: Quantitative analysis of edema factor (EF). n = 8-10, x± s. *P < 0.05, **P < 0.01 vs model group. TTC: 2, 3, 5-Triphenyltetrazolium chloride; MCAO: Middle cerebral artery occlusion |
本研究结果显示, Rg1可显著缓解卒中后炎症反应, 表现为: ① Rg1可显著减少受损脑区中性粒细胞浸润。如图 3a所示, 与空白组相比, 模型组受损脑区内髓过氧化物酶(MPO)阳性细胞显著增加, 40 mg·kg-1 Rg1治疗可显著减少MPO阳性细胞数; ② Rg1可抑制小胶质细胞的激活。如图 3b所示, 与空白组相比, 模型组受损脑区内Iba-1阳性细胞显著增加, 40 mg·kg-1 Rg1治疗可显著减少Iba-1阳性细胞数。在此基础上, 采用qPCR方法, 对受损脑区IL-1β、TNF-α和iNOS mRNA水平进行了检测, 结果显示, 与空白组相比, 模型组受损脑区内三者含量显著升高, 40 mg·kg-1 Rg1治疗可显著降低受损脑区内上述炎症因子的含量(图 3c~e)。结果表明Rg1可抑制糖尿病大鼠脑卒中后炎症反应。

|
Figure 3 Attenuation of neuro-inflammation induced by Rg1 in diabetic rats. a: Representative myeloperoxidase (MPO) staining results of MCAO rats treated with Rg1 (40 mg·kg-1); b: Representative Iba-1 staining results of MCAO rats treated with Rg1 (40 mg·kg-1); c-e: Quantitative analysis of pro-inflammation cytokines, including IL-1β (c), TNF-α (d) and iNOS (e) by qPCR. n = 6, x± s. ###P < 0.001 vs sham group; **P < 0.01 vs model group |
HMGB1作为神经损伤的关键因子之一, 在糖尿病大鼠模型和糖尿病患者中的表达增加[13, 14]。本研究显示, 糖尿病大鼠卒中后HMGB1表达显著升高, 40 mg·kg-1 Rg1治疗可显著降低HMGB1的蛋白水平, 表明HMGB1可能参与了Rg1缓解糖尿病大鼠脑卒中的炎症反应(图 4)。
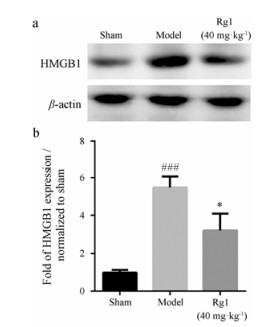
|
Figure 4 Inhibitory effect of Rg1 on high mobility group box1 (HMGB1) level determined by Western blot in diabetic rat. n = 6, x± s. ###P < 0.001 vs sham group; *P < 0.05 vs model group |
为观察HMGB1在Rg1改善糖尿病脑卒中中的生物学意义, 本实验通过侧脑室注射技术, 分别采用HMGB1中和抗体和外源性补充HMGB1蛋白的方法, 增强或阻断HMGB1活性, 结果如图 5所示, 在anti- control注射组, 与对照组相比, 40 mg·kg-1 Rg1可显著降低卒中导致的行为学障碍, 减小梗死率, 降低水肿系数, 与图 2结果一致。在anti-HMGB1注射组, 阻断HMGB1活性可显著减小大鼠MCAO术后的梗死率, 降低行为学评分, 减轻脑水肿程度, 表现出与Rg1具有相似的治疗作用, 但HMGB1与Rg1联合应用并未显示出协同效应或叠加效应。HMGB1蛋白注射可使大鼠梗死率显著扩大, 神经行为学评分显著升高, 脑水肿程度加重阻断Rg1的神经保护作用, 上述结果表明HMGB1在Rg1治疗糖尿病脑卒中具有重要的作用。
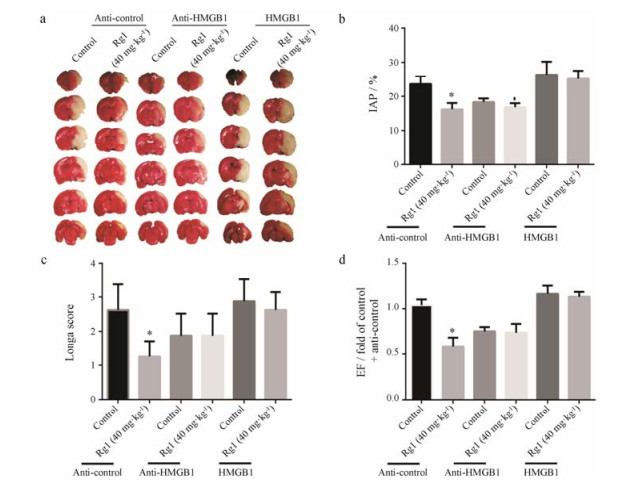
|
Figure 5 HMGB1 is involved into the anti-stroke effect of Rg1 in diabetic rat. a: Representative TTC staining results of MCAO rats treated with Rg1 (40 mg·kg-1) infected by anti-HMGB1 or anti-control treatment; b: Quantitative analysis of cerebral IAP; c: Quantitative analysis of neurological score by Longa test; d: Quantitative analysis of EF. n = 8-10, x± s. *P < 0.05 vs control group |
如图 6显示, 在anti-control注射组, 40 mg·kg-1 Rg1可显著抑制小胶质细胞增殖, 抑制IL-1β、TNF-α和iNOS的表达, 抑制炎症反应, 与图 3结果一致; 在anti-HMGB1注射组, 阻断HMGB1活性可发挥与Rg1相似的治疗作用, 但Rg1与HMGB1抗体联合应用并未产生协同或叠加效应; 在HMGB1注射组, 增强HMGB1活性可抑制Rg1的抗炎作用, 表现为与对照组相比, Rg1不能显著减少小胶质细胞数量、降低炎症因子水平。上述结果表明, HMGB1在Rg1缓解糖尿病脑卒中的炎症反应中具有重要的作用。
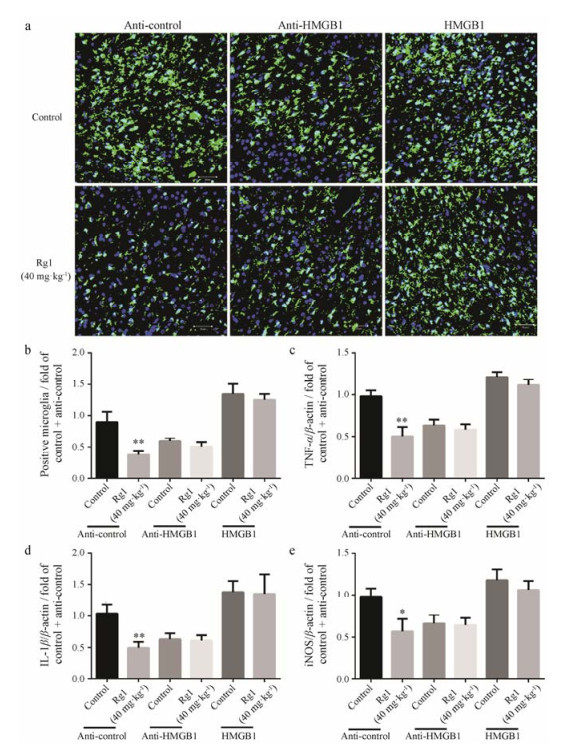
|
Figure 6 HMGB1 is involved into the attenuation of neuro-inflammation induced by Rg1 in diabetic rats. a: Representative Iba-1 staining results of MCAO rats treated with Rg1 (40 mg·kg-1) infected by anti-HMGB1 or anti-control treatment; b: Quantitative analysis of Iba-1 positive microglia; c-e: Quantitative analysis of pro-inflammation cytokines, including TNF-α (c), IL-1β (d) and iNOS (e) by qPCR. n = 6, x± s. *P < 0.05, **P < 0.01 vs control group |
本研究通过高脂饲料联合STZ制备2型糖尿病大鼠模型, 在此基础上, 采用MCAO模拟糖尿病缺血性脑卒中复合模型, 发现Rg1可在不影响血糖的情况下显著降低卒中后大鼠的神经行为学评分, 降低大脑梗死率, 减轻脑水肿程度, 缓解神经炎症反应。进一步研究发现, Rg1可显著抑制缺血再灌注引发的HMGB1蛋白水平的升高。阻断HMGB1活性可发挥与Rg1相似的治疗作用, 增强HMGB1活性可抑制Rg1对糖尿病大鼠脑卒中的神经保护作用, 上述结果表明HMGB1可能参与Rg1治疗糖尿病脑卒中作用。
前期研究表明, Rg1可显著降低糖尿病模型血糖水平, 但给药方式均为长期口服, 单次静脉给予Rg1对糖尿病模型血糖的影响尚未见报道。本研究首先观察了静脉单次注射Rg1对糖尿病大鼠血糖的影响, 发现单次给予Rg1并不能有效降低血糖水平。缺血再灌注损伤会引发机体血糖值应激性的升高, Rg1对卒中后血糖、胰岛素水平亦无显著影响, 上述研究表明Rg1对糖尿病大鼠卒中后的影响与血糖调控无关。
行为学障碍是卒中后临床症状的核心表现, 本研究采用Longa法观察了Rg1对糖尿病大鼠卒中后行为学的影响, 结果显示Rg1可显著降低Longa评分。TTC染色显示, Rg1可显著降低卒中后梗死率, 抑制水肿系数。上述结果表明, Rg1可显著改善糖尿病大鼠卒中后神经损伤。在本研究中, 40 mg·kg-1剂量组无论在梗死率、行为学评分还是脑水肿系数方面, 均优于其他剂量组, 是Rg1治疗糖尿病脑卒中的最佳治疗剂量。Rg1治疗缺血性脑卒中的有效剂量10~100 mg·kg-1均有报道[6]。因此, 本研究采用40 mg·kg-1作为代表性有效剂量观察了Rg1对神经炎症及HMGB1信号分子的研究。
神经炎症是加重卒中后神经损伤的核心机制之一, 主要表现为小胶质细胞的激活, 外周免疫细胞浸润, 以及炎性细胞因子表达增加[15]。本研究发现卒中后模型组大鼠小胶质细胞数量显著增多, Rg1治疗可显著减少小胶质细胞数量。中性粒细胞是体内对缺血性脑卒中响应最早的免疫细胞[16]。本研究发现卒中后大鼠受损脑区中性粒细胞数量显著增加, Rg1可显著减少中性粒细胞数量, 降低受损脑区炎性因子的表达, 表明Rg1具有缓解卒中后神经炎症的功效。
HMGB1是一种高度保守的非组蛋白DNA结合核蛋白, 在真核细胞中普遍表达并调节转录[17]。本研究发现Rg1可显著抑制HMGB1的蛋白水平, 提示HMGB1可能参与Rg1抑制卒中后炎症反应的功效。HMGB1可通过诱导IL-1β、IL-6和炎症相关酶iNOS的表达来促进炎性损伤, 在脑卒中发展中起关键角色[18]。并且, 在糖尿病卒中后显著升高, 抑制HMGB1可显著降低卒中后炎症反应[19], 与本研究结果一致。
为观察HMGB1含量降低在Rg1治疗糖尿病大鼠脑卒中的作用, 本研究采用HMGB1抗体来阻断HMGB1活性, 用来模拟Rg1抑制HMGB1蛋白水平造成的HMGB1活性降低的药理学特征, 结果显示, 阻断HMGB1可模拟Rg1的神经保护作用, 缓解神经炎症反应, HMGB1抗体组与Rg1治疗组无显著差异。同时, 本研究发现HMGB1抗体与Rg1联合应用并未发挥协同或叠加效应, 其原因可能为HMGB1抗体已对HMGB1活性发挥有效抑制作用, 掩盖了Rg1对HMGB1蛋白的抑制功效, 从而造成了Rg1神经保护作用被抵消。
在上述基础上, 本研究采用外源性补充HMGB1蛋白的方法增强HMGB1活性, 结果显示, 补充HMGB1蛋白可显著加重卒中后神经损伤, 抑制Rg1的抗脑卒中作用, 神经炎症检测结果显示, 增强HMGB1活性可阻断Rg1的抗神经炎症作用。结果表明HMGB1参与Rg1抗缺血性脑卒中作用。
综上所述, Rg1在发挥抗脑卒中功效同时, HMGB1信号分子也发生了变化, HMGB1参与Rg1的抗糖尿病性脑卒中作用, 为Rg1及含有Rg1的脑卒中治疗药物应用于糖尿病脑卒中的治疗提供了理论基础和科学依据。
| [1] | Bhupathiraju SN, Hu FB. Epidemiology of obesity and diabetes and their cardiovascular complications[J]. Circ Res, 2016, 118: 1723–1735. DOI:10.1161/CIRCRESAHA.115.306825 |
| [2] | O'Donnell MJ, Chin SL, Rangarajan S, et al. Global and regional effects of potentially modifiable risk factors associated with acute stroke in 32 countries (INTERSTROKE):a case- control study[J]. Lancet, 2016, 388: 761–775. DOI:10.1016/S0140-6736(16)30506-2 |
| [3] | Huang YL. Study on the Basis and Mechanism of Anti- cerebral Ischemia Active Material of Sanqi Tongshu Capsule (三七通舒胶囊抗脑缺血活性物质的基础和机制研究)[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10633-1015543373.htm |
| [4] | Ming L. The Basic Research on the Pharmacodynamics of Xueshuan Xinmaining Tablets (血栓心宁片药效学的基础研究)[D]. Changchun: Jilin University, 2012. |
| [5] | Yang PF, Song XY, Chen NH. Advances in pharmacological research on Panax notoginseng saponins against cerebral ischemia reperfusion injury[J]. Acta Pharm Sin (药学学报), 2016, 51: 1039–1046. |
| [6] | Xie CL, Wang WW, Xue XD, et al. A systematic review and meta-analysis of ginsenoside-Rg1(G-Rg1) in experimental ischemic stroke[J]. Sci Rep, 2015, 5: 7790. DOI:10.1038/srep07790 |
| [7] | Zheng YR, Liu CF, Wang B, et al. Ginsenoside Rg1 on blood glucose regulation in type 2 diabetic rat model[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药), 2016, 25: 18–19. |
| [8] | Yu HT, Zhen J, Pang B, et al. Ginsenoside Rg1 ameliorates oxidative stress and myocardial apoptosis in streptozotocin- induced diabetic rats[J]. J Zhejiang Univ-Sci B, 2015, 16: 344–354. DOI:10.1631/jzus.B1400204 |
| [9] | Yu HT, Zhen J, Pang B, et al. Effects of ginsenoside Rg1 on myocardial oxidative stress and apoptosis in diabetic rats[J]. Biomed Biotechnol, 2015, 16: 344–354. |
| [10] | Yang NQ. Ginsenoside Rg1 Promotes Angiogenesis in Ischemic Limbs of Diabetic Mice (人参皂苷Rg1促进糖尿病小鼠肢体缺血血管再生)[D]. Nanjing: Nanjing Medical University, 2013. |
| [11] | Jia JC. Research on the protective effect of ginsenoside Rg1 on pathological liver injury in type 2 diabetic rats[J]. Clin J Chin Med (中医临床研究), 2016, 8: 13–14. |
| [12] | Zhang XK, Zhao ZJ, Cui XM, et al. Renal protective effects of Rg1 and Rb1 on diabetic nephropathy in rats and its effect on renal tissue MCP-1 mRNA and protein expression[J]. Chin J Integr Tradit West Med Nephrol (中国中西医结合肾病杂志), 2008, 9: 578–581. |
| [13] | Wang C, Jiang J, Zhang X, et al. Inhibiting HMGB1 reduces cerebral ischemia reperfusion injury in diabetic mice[J]. Inflammation, 2016, 39: 1862–1870. DOI:10.1007/s10753-016-0418-z |
| [14] | Ye X, Chopp M, Liu X, et al. Niaspan reduces high-mobility group box 1/receptor for advanced glycation endproducts after stroke in type-1 diabetic rats[J]. Neuroscience, 2011, 190: 339–345. DOI:10.1016/j.neuroscience.2011.06.004 |
| [15] | Xiong XY, Liu L, Yang QW. Functions and mechanisms of microglia/macrophages in neuroinflammation and neurogenesis after stroke[J]. Prog Neurobiol, 2016, 142: 23–44. DOI:10.1016/j.pneurobio.2016.05.001 |
| [16] | Brifault C, Gras M, Liot D, et al. Delayed pituitary adenylate cyclase-activating polypeptide delivery after brain stroke improves functional recovery by inducing M2 microglia/ macrophage polarization[J]. Stroke, 2015, 46: 520–528. DOI:10.1161/STROKEAHA.114.006864 |
| [17] | Singh V, Roth S, Veltkamp R, et al. HMGB1 as a key mediator of immune mechanisms in ischemic stroke[J]. Antioxid Redox Signal, 2016, 24: 635–651. DOI:10.1089/ars.2015.6397 |
| [18] | Tian X, Liu C, Shu Z, et al. Review:therapeutic targeting of HMGB1 in stroke[J]. Curr Drug Deliv, 2017, 14: 785–790. |
| [19] | Hu J, Liu B, Zhao Q, et al. Bone marrow stromal cells inhibits HMGB1-mediated inflammation after stroke in type 2 diabetic rats[J]. Neuroscience, 2016, 324: 11–19. DOI:10.1016/j.neuroscience.2016.02.058 |
 2018, Vol. 53
2018, Vol. 53


