多聚(ADP-核糖)聚合酶(PARP)是一种蛋白修饰酶家族, 其催化NAD+分子中的ADP-核糖转移到蛋白分子氨基酸残基上, 从而对蛋白进行修饰, 调节蛋白的功能[1]。PARP已发现有17个成员, 目前研究较为深入的是PARP1/2, 它们催化蛋白的多聚ADP-核糖化修饰, 主要参与调节DNA损伤修复、细胞死亡和转录, 进而在肿瘤疾病和多种非肿瘤急慢性疾病病程中发挥重要作用。PARP1/2通过DNA损伤修复机制在维持基因的稳定性中起着关键的作用[2]。在肿瘤细胞中, PARP1/2一般处于高表达状态, 导致肿瘤对于治疗产生耐受或耐药。因此, 抑制PARP能够减少肿瘤产生耐受, PARP1/2已成为肿瘤治疗的一个新靶点。一方面, PARP1/2抑制剂可以通过合成致死的原理, 单独用药治疗存在同源重组(homologous recombination, HR)修复基因缺陷(如BRCA1/2突变、PTEN缺陷)的肿瘤细胞; 另一方面PARP1/2抑制剂又可以与化疗药物、分子靶向药物联合使用, 增强这些药物的杀伤肿瘤作用, 克服其耐药[1, 3, 4]。目前国际上各大制药公司均在竞相开发该靶点药物, 从2014年以来, 已有3个PARP1/2抑制剂olaparib、rucaparib和niraparib获批上市用于卵巢癌的治疗[5-7], 而在国内尚无PARP1/2抑制剂上市, 因此研发新型的PARP1/2抑制剂对于提高我国药物的可及性具有重要的意义。
本研究利用已经建立的PARP抑制剂筛选方法[8-10], 获得了高活性的PARP1/2抑制剂YHP-743, 并针对该化合物进行了体内外抗肿瘤作用评价。
材料与方法细胞 MCF-7、MDA-MB-231、MDA-MB-468、MDA-MB-453购自中国医学科学院基础医学研究所细胞中心, MX-1由实验室保存。
试剂与药物 Veliparib、多柔比星(doxorubicin, Dox)、拓扑替康(topotecan, TPT)购自Selleck公司; 替莫唑胺(temozolomide, TMZ)购自百灵威公司; 顺铂(cisplatin, CisPt)购自齐鲁制药; 紫杉醇(taxol)由北京协和药厂提供; 抗PAR抗体购自美国Trevegen公司; 抗γH2AX抗体购自美国Cell Signaling Tech nology公司; 抗β-actin抗体购自美国圣克鲁斯生物技术; 组蛋白、DNA和MTT购自Sigma-Aldrich公司。
仪器与设备 Biotek全波长酶标仪(美国), GE ImageQuant LAS 4000 mini凝胶成像仪(美国)。
细胞培养 MX-1、MDA-MB-231和MCF-7细胞培养于含10% FBS和抗生素的DMEM培养基中, MDA-MB-468和MDA-MB-453细胞培养于含10% FBS和抗生素的RMPI 1640培养基中。
PARP1/2抑制剂酶学抑制活性检测 利用实验室建立的PARP1/2抑制剂筛选方法进行检测[8]。用50 μg·mL-1组蛋白于4 ℃包被96孔板过夜, 用含0.1% Triton X-100的PBS和PBS各洗板2次。设置空白对照孔、加酶对照孔、化合物YHP-743测定孔, 空白对照孔加入测定缓冲液(50 mmol·L-1 Tris、2 mmol·L-1 MgCl2, pH 8.0)配制的NAD+ (5 pmol) 30 μL, 纯化缓冲液(0.1 mol·L-1 NaCl、50 mmol·L-1 Tris、2 mmol·L-1 MgCl2, pH 8.0) 10 μL、DNA (1 μg·mL-1) 5 μL; 加酶对照孔加NAD+ (5 pmol) 30 μL、PARP1或PARP2 (0.005 U) 10 μL、DNA (1 μg·mL-1) 5 μL; 化合物对照孔加入NAD+ (5 pmol) 30 μL、veliparib或YHP-743稀释液5 μL、PARP1或PARP2 (0.005 U) 10 μL、DNA (1 μg·mL-1) 5 μL, 然后各孔补齐50 μL体积, 室温反应1 h。利用含0.1% Triton X-100的PBS和PBS各洗板2次。再加入用PBS 1:500稀释的抗PAR抗体50 μL, 室温孵育1 h, 含0.1% Triton X-100的PBS和PBS各洗板2次。加入PBS 1:4 000稀释的山羊抗鼠二抗50 μL, 室温孵育30 min, 用含0.1% Triton X-100的PBS和PBS各洗板2次。再加入TMB反应液50 μL, 室温避光反应15 min, 用1 mol·L-1硫酸50μL终止反应。450 nm测定吸收值。计算化合物YHP-743对PARP1或PARP2的抑制率。
MTT检测 将对数生长期的肿瘤细胞用胰酶消化后配制成浓度为每毫升2×104个细胞的细胞液, 每孔100 μL (2 000个细胞)接种于96孔板。次日每孔加入不同浓度YHP-743或veliparib及相应溶剂对照的新鲜培养基100 μL (DMSO终浓度 < 0.5%), 每组设3个平行孔, 于37 ℃继续培养72 h后, 弃上清, 每孔加50 μg·mL-1 MTT, 37 ℃孵育4 h后弃上清, 加入DMSO后, 振荡混匀后, 用酶标仪在570 nm波长下测定光吸收值(A)。
增敏作用检测 参照上述方法, 每孔加入不同浓度的化疗药物和固定浓度的YHP-743或veliparib及相应溶剂对照的新鲜培养基100 μL (DMSO终浓度 < 0.5%), 于37 ℃继续培养72 h后, 按照“MTT检测”方法测定吸收值(A)。
蛋白免疫印迹 收集YHP-743处理的细胞, 蛋白定量后, 电泳转膜, 用含5%脱脂奶粉的TBS-T缓冲液室温封闭非特异性结合位点1 h后, 用TBS-T缓冲液洗膜3次, 每次10 min, 加入1:1 000稀释比例的一抗, 4 ℃孵育过夜。次日, TBS-T缓冲液洗膜3次后, 加1:3 000稀释的HRP标记的二抗, 室温孵育1 h后加入TBS-T缓冲液洗膜3次, 加入ECL化学发光底物反应液后进行凝胶成像检测。
体内动物实验 无菌条件下收集人乳腺癌MX-1细胞, 用灭菌生理盐水调整至每毫升1×107个细胞, 取0.2 mL接种于雌性BALB/c裸鼠腋背部皮下, 待肿瘤生长至直径1 cm大小, 无菌条件下取出, 匀浆后均匀接种于裸鼠腋背部皮下(2×106个细胞)。7日后待肿瘤生长至100~300 mm3后, 将动物随机分组, 开始给药(记为第0天)。口服给药, 替莫唑胺连续口服给药5天; 单药YHP-743组连续给药13天; 联合给药组替莫唑胺和待测化合物均连续口服给药5天(两种药物给药间隔时间为1 h)。所有化合物均混悬于0.5%羧甲基纤维素钠溶液中。每周3次称量体重并用游标卡尺测量肿瘤的长度和宽度, 给药第13天后将裸鼠脱臼处死, 剥离肿瘤组织, 称重并拍照。最后计算肿瘤抑制率, 以肿瘤抑制率评价YHP-743抗肿瘤作用强度。
数据处理 体外实验重复3次, 数据以平均值±标准差(x± s)表示, 使用Graphpad Prism进行数据统计和计算。
| $ \begin{array}{l} 酶学抑制率\% = \left[ {{A_{{\rm{enzyme}}}} - {A_{{\rm{test}}}}} \right]/\left[ {{A_{{\rm{enzyme}}}} - {A_{{\rm{con}}}}} \right] \times 100\% \\ 细胞抑制率\% = \left[ {1 - {A_{{\rm{test}}}}/\left. {{A_{{\rm{con}}}}} \right)} \right] \times 100\% \end{array} $ |
其中, test为待测化合物, con为空白对照组, enzyme为加酶对照组。
肿瘤体积(TV): V = 1/2×a×b2, a和b分别表示瘤体长和宽。
抑瘤率TGI (%) = (1-T/C)×100, T为YHP-743组肿瘤重量, C为阴性对照组或替莫唑胺组肿瘤重量。
结果 1 YHP-743的体外抗肿瘤活性YHP-743是一个具有新型结构的PARP1/2抑制剂, 结构如图 1所示。在多种乳腺癌细胞上通过MTT方法检测YHP-743杀伤肿瘤细胞的作用。由表 1可见, YHP-743对于存在同源重组修复缺陷的乳腺癌细胞具有较强的杀伤作用, 而对于不存在同源重组修复缺陷的乳腺癌细胞的杀伤作用较弱。体外酶学水平检测化合物YHP-743对PARP1和PARP2抑制活性表明, 其半数抑制浓度(IC50)值分别为2.3和1.5 nmol·L-1, 与阳性化合物veliparib相当(表 2)。
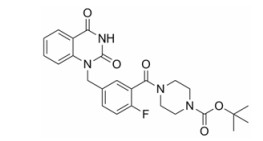
|
Figure 1 Chemical structure of YHP-743 |
| Table 1 Cytotoxicity of YHP-743 on breast cancer cells. Cells were treated with various concentrations of YHP-743 or veliparib for 72 h and the cytotoxicity was detected via MTT method. BRCA 1/2: Breast cancer susceptibility gene 1/2; PTEN: Phosphatase and tensin homolog |
| Table 2 The enzymatic inhibitory activities of YHP-743 on PARP1 and PARP2 |
为了进一步评价YHP-743在细胞上对PARP1/2的抑制作用, 采用蛋白免疫印迹法检测反映细胞内PARP1/2酶活性的PAR水平和细胞DNA损伤的γH2AX水平。由图 2可见, YHP-743处理MX-1细胞24 h后, 细胞内PAR水平降低, 而γH2AX水平升高, 均具有剂量依赖性。提示YHP-743可抑制肿瘤细胞中的PARP1/2活性, 进而阻断细胞内DNA损伤修复, 最终引起肿瘤细胞死亡。

|
Figure 2 The inhibhitory activity of YHP-743 in MX-1 breast cancer cell. The protein levels of PAR and γH2AX were detected via immunoblotting in MX-1 cells exposure to various concentrations of YHP-743 for 24 h |
在确证YHP-743单药可杀伤肿瘤细胞的基础上, 考察了YHP-743对化疗药物的增敏作用。首先, 在不同类型的乳腺癌细胞上检测YHP-743与生物烷化剂TMZ联用杀伤肿瘤细胞的作用。从图 3可见, 无论乳腺癌细胞是否存在同源重组修复缺陷, YHP-743均可增强TMZ杀伤肿瘤的作用, 具有良好的增敏效应。
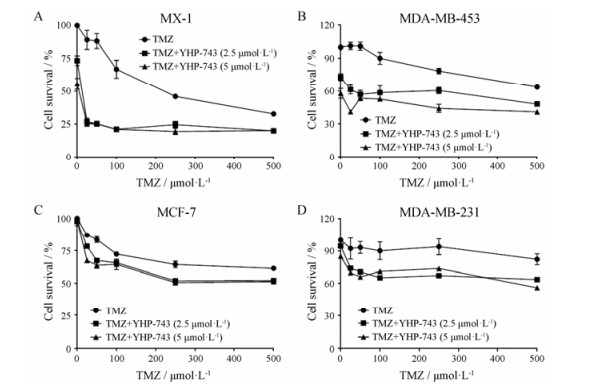
|
Figure 3 The potentiation effect of YHP-743 on temozolomide (TMZ) in various breast cancer cells. MX-1 (A), MDA-MB-453 (B), MCF-7 (C) and MDA-MB-231 (D) cells were treated with indicated concentrations of TMZ combined with fixed concentrations of YHP-743 for 72 h, respectively. The cell survival was calculated and shown as cell survival curve |
本文利用MX-1细胞进一步评价了YHP-743与其他化疗药物联用的增敏作用。由图 4结果可见, YHP- 743不仅对生物烷化剂TPT和CisPt具有增敏作用, 而且亦可增强其他化疗药物taxol和Dox杀伤肿瘤细胞的作用。表明YHP-743与化疗药物联用, 可增强这些药物的作用。

|
Figure 4 The potentiation effect of YHP-743 on different chemotherapy agents in MX-1 breast cancer cell. MX-1 cells were treated with indicated concentrations of topotecan (TPT, A), cisplatin (CisPt, B), taxol (C) or doxorubicin (Dox, D) combined with fixed concen tration of YHP-743 or veliparib for 72 h respectively. The cell survival was calculated and shown as cell survival curve |
在体外细胞水平, YHP-743单独给药不仅可以杀伤同源重组修复缺陷的肿瘤细胞, 而且对于不同的化疗药物具有增敏作用。在人乳腺癌MX-1裸鼠异体移植瘤模型上, 考察了YHP-743单药以及联合用药对体内肿瘤生长的抑制作用。由图 5可见, 联合给药组YHP-743和TMZ连续口服给药5天后停药, 结果显示YHP-743和TMZ联合给药组可显著抑制肿瘤的生长。YHP-743在12.5和25 mg·kg-1剂量下与TMZ合用, 相对于溶剂组的抑瘤率分别为88%和91%, 而相对于TMZ组的抑瘤率分别为63%和74% (表 3)。但YHP-743和veliparib单药组未见明显的抑制肿瘤生长的作用。在实验过程中, YHP-743单独用药组与溶剂组相比未出现明显体重变化, 而YHP-743联合用药组与TMZ组相比, 体重没有出现明显降低。

|
Figure 5 Antitumor activity of YHP-743 in breast cancer MX-1 xenograft mice model. MX-1 bearing mice were orally administrated with YHP-743 or veliparib of 25 mg·kg-1 for 13 days or TMZ of 50 mg·kg-1 for 5 days. For combination group, mice were orally administrated with YHP-743 (12.5 or 25 mg·kg-1) or veliparib (25 mg·kg-1) in combination with TMZ (50 mg·kg-1) for 5 days. A:Tumor growth curve; B: Tumor issue; C: Tumor weight; D: Body weight curve. n = 7, x± s. ***P < 0.001 vs vehicle group |
| Table 3 Antitumor activity of YHP-743 in breast cancer MX-1 xenograft mice model. n = 7, x± s. ***P < 0.001 vs vehicle group. TGI: Tumor growth inhibition; T/Cveh: Mean tumor volume of treated group/mean tumor volume of vehicle group |
乳腺癌是女性最常见的恶性肿瘤, 其发病率逐年提高, 特别是晚期乳腺癌, 仍是不可治愈的疾病, BRCA突变是其发生、发展的重要因素。目前的治疗只能减轻症状, 改善生活质量和延长生存[11, 12]。在临床上, 经典的治疗模式是维持治疗, 维持治疗的药物都是化疗药物。由于化疗药物毒性较大、维持治疗的给药周期较长, 患者的耐受性较差、不良反应较多, 且容易产生耐药。因此, 理想的维持治疗方案选择的药物应具有低毒、有效、使用方便等特点。这就要求能够开发出低毒、易于耐受的靶向药物。近年研究发现, 三阴乳腺癌和BRCA突变乳腺癌对PARP1/2抑制剂更为敏感[13-16], 这提示PARP1/2抑制剂有可能成为治疗乳腺癌的新型靶向药物。
本研究在酶学、细胞水平和动物水平对具有新型结构的PARP1/2抑制剂YHP-743进行了体内外活性评价。YHP-743可显著地抑制PARP1和PARP2的酶学活性, 在细胞上表现为可以抑制PAR水平, 增加γH2AX水平。在存在同源重组基因缺陷细胞(如MX-1存在BRCA1/2缺陷)上, YHP-743单独使用可通过合成致死原理有效抑制乳腺癌细胞的增殖, 也可以与化疗药物联用增强这些药物杀伤肿瘤细胞的作用。在体内, YHP-743与TMZ联用具有显著的抑制肿瘤生长作用, 但是YHP-743和阳性药veliparib单药未见明显抑制肿瘤生长的作用。这可能与该肿瘤模型有关, 在该模型的其他实验中, PARP1/2抑制剂olaparib每天口服给药200 mg·kg-1, 连续13天, 也未见明显的抑制肿瘤生长的作用, 该结果与文献报道类似[13]。因此, 需要其他的肿瘤模型如MDA-MB- 436来评价YHP-743单独用药的抑瘤作用[3]。此外, 在实验过程中, YHP-743与TMZ联合给药组与TMZ组相比, 体重没有出现明显下降, 提示YHP-743具有较好的安全性, 不会增加TMZ的毒性。
YHP-743是本研究发现的一个具有较好体内外活性的PARP1/2抑制剂, 与目前在研和上市的PARP1/2抑制剂类似[1], 该化合物也具有PARP1/2抑制剂的共同活性结构基团, 但YHP-743具有全新的化学结构。然而, 体内外研究结果显示YHP-743量效关系欠佳, 提示其透膜性和药代特性可能不理想, 因此, 仍需对YHP-743化合物进行结构修饰和改造, 提高其体内外活性并改善药代特性。
综上所述, 本研究证明YHP-743对PARP1/2活性具有较强的抑制作用, 不仅单药可以杀伤肿瘤细胞, 与化疗药物联合用药更可增强药物的疗效。本研究为进一步开发治疗乳腺癌的新型PARP1/2抑制剂提供了实验基础。
| [1] | Gibson BA, Kraus WL. New insights into the molecular and cellular functions of poly(ADP-ribose) and PARPs[J]. Nat Rev Mol Cell Biol, 2012, 13: 411–424. DOI:10.1038/nrm3376 |
| [2] | Beck C, Robert I, Reina-San-Martin B, et al. Poly(ADP-ribose) polymerases in double-strand break repair:focus on PARP1, PARP2 and PARP3[J]. Exp Cell Res, 2014, 329: 18–25. DOI:10.1016/j.yexcr.2014.07.003 |
| [3] | Zhou Q, Ji M, Zhou J, et al. Poly (ADP-ribose) polymerases inhibitor, Zj6413, as a potential therapeutic agent against breast cancer[J]. Biochem Pharmacol, 2016, 107: 29–40. DOI:10.1016/j.bcp.2016.02.015 |
| [4] | Lai FF, Li J, Ji M, et al. Olaparib potentiates the antitumor effect of taxol on 4T1 breast cancer[J]. Acta Pharm Sin (药学学报), 2016, 51: 907–912. |
| [5] | Kim G, Ison G, McKee AE, et al. FDA approval summary:olaparib monotherapy in patients with deleterious germline BRCA-mutated advanced ovarian cancer treated with three or more lines of chemotherapy[J]. Clin Cancer Res, 2015, 21: 4257–4261. DOI:10.1158/1078-0432.CCR-15-0887 |
| [6] | Scott LJ. Niraparib:first global approval[J]. Drugs, 2017, 77: 1029–1034. DOI:10.1007/s40265-017-0752-y |
| [7] | Syed YY. Rucaparib:first global approval[J]. Drugs, 2017, 77: 585–592. DOI:10.1007/s40265-017-0716-2 |
| [8] | Zhu Z, Jin J, Xue N, et al. Development and validation of high- throughput screening assays for poly(ADP-ribose) polymerase-2 inhibitors[J]. Anal Biochem, 2014, 449: 188–194. DOI:10.1016/j.ab.2013.12.028 |
| [9] | Yao H, Ji M, Zhu Z, et al. Discovery of 1-substituted benzyl- quinazoline-2, 4(1H, 3H)-dione derivatives as novel poly(ADP- ribose)polymerase-1 inhibitors[J]. Bioorg Med Chem, 2015, 23: 681–693. DOI:10.1016/j.bmc.2014.12.071 |
| [10] | Zhou J, Ji M, Zhu Z, et al. Discovery of 2-substituted 1H- benzo[d]immidazole-4-carboxamide derivatives as novel poly (ADP-ribose)polymerase-1 inhibitors with in vivo anti-tumor activity[J]. Eur J Med Chem, 2017, 132: 26-41. |
| [11] | Akiyama F, Horii R. Therapeutic strategies for breast cancer based on histological type[J]. Breast Cancer, 2009, 16: 168–172. DOI:10.1007/s12282-009-0126-8 |
| [12] | Akiyama F, Iwase H. Triple negative breast cancer:clinicopathological characteristics and treatment strategies[J]. Breast Cancer, 2009, 16: 252–253. DOI:10.1007/s12282-009-0140-x |
| [13] | Shen Y, Rehman FL, Feng Y, et al. BMN 673, a novel and highly potent PARP1/2 inhibitor for the treatment of human cancers with DNA repair deficiency[J]. Clin Cancer Res, 2013, 19: 5003–5015. DOI:10.1158/1078-0432.CCR-13-1391 |
| [14] | Wang L, Mason KA, Ang KK, et al. MK-4827, a PARP-1/-2 inhibitor, strongly enhances response of human lung and breast cancer xenografts to radiation[J]. Invest New Drugs, 2012, 30: 2113–2120. DOI:10.1007/s10637-011-9770-x |
| [15] | Robson M, Im SA, Senkus E, et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation[J]. N Engl J Med, 2017, 377: 523–533. DOI:10.1056/NEJMoa1706450 |
| [16] | Romero D. Breast cancer:olaparib improves PFS[J]. Nat Rev Clin Oncol, 2017, 14: 460. |
 2018, Vol. 53
2018, Vol. 53


