在2010年, 癌症已成为我国疾病死因之首, 并且其发病率与死亡率还在逐年上升[1], 据统计, 在2015年, 我国新增肿瘤约429.2万例, 约281.4万人因癌症去世[2]。目前, 临床上最常用的肿瘤检测方法是通过穿刺等方式获得患者细胞, 再进行病理学观察, 这种方法给患者造成不小的痛苦。磁共振成像、CT成像和PET成像等非侵袭性成像方法在临床诊断中越来越受到重视, 但是这些技术无法应用于手术过程中的肿瘤病灶的精确定位和切除。因此, 发展新型非侵袭性的肿瘤检测方法, 为肿瘤手术过程提供指导, 提高手术的准确性并尽量保留更多的正常组织功能, 具有重要的意义。
纳米药物递送系统兴起于上世纪60年代[3]。1964年, 脂质体的结构被确立以来, 纳米药物递送系统已经走过了50多年的历史[4]。利用纳米技术进行药物的递送, 能增加药物的血液循环时间, 减少药物的毒性, 从而解决药物代谢快、不良反应大等问题; 还可以对纳米载体表面进行修饰, 来进行特异性靶向[5], 对肿瘤进行特异性杀伤。研究中常用刺激响应型纳米体系进行药物递送, 如pH敏感体系[6, 7]、酶敏感体系等, 这种体系能够响应肿瘤偏酸性的微环境[8]或高表达的酶, 从而大幅提高药物的递送效率。
纳米粒的生物学过程受到多方面因素的影响, 包括形状[9]、粒径[10]、电荷[11]、柔性[12]、弹性、亲疏水性、粒子结构和靶头修饰等。因此, 在设计纳米粒时, 通过改变这些性质, 能够对粒子的生物学功能进行操控, 包括血浆稳定性、长循环时间、组织分布、组织渗透性、肿瘤靶向性和刺激响应性等[13]。
对于同一种聚合物分子而言, 形状对其功能极为重要, 有文献提出, 形状特点会对纳米载体的行为和最终的递送效果产生重要影响, 如体内循环和分布、细胞黏附和摄取等[14]。因此, 将同样的聚合物分子制备成不同的形状进行比较研究, 有助于最大化地发挥这种体系的生物学功能。
在本研究中, 作者合成了一种pH超敏感两嵌段聚合物——聚乙二醇-聚二异丙基氨基甲基丙烯酸乙酯(PEG5k-iPDPA20), 通过改变制备方法, 将其制备成两种不同的形状, 即球形胶束(spherical micelles, SMs)和蠕虫形胶束(wormlike micelles, WMs), 并研究了这两种形状的制剂的体内外生物学性质差异。
材料与方法材料和试剂 聚乙二醇5000 (PEG5k-OH)、2-溴异丁酰溴、纤维素膜透析袋、2-(二异丙基氨基)甲基丙烯酸乙酯(iDPA-MA)、溴化亚酮(CuBr)、五甲基二亚乙基三胺(PMDETA)、N, N-二甲基甲酰胺(DMF) (美国Sigma-Aldrich公司); 三乙胺(日本TCI公司); 异丙醇、二氯甲烷(CH2Cl2)、4-二甲氨基吡啶(DMAP) (北京百灵威科技有限公司); 甲基丙烯酸-2-氨基乙基酯盐酸盐(AMA·HCl) (美国Polyscience公司); 四甲基罗丹明(tetramethyl rhodamine, TMR, 美国Pierce公司); BODIPY-FL (BDP)、Cyanine 7.5 (Cy7.5) (美国Lumiprobe公司); RPMI 1640培养基、0.25%胰蛋白酶、谷氨酰胺、青霉素链霉素混合双抗[中科迈晨(北京)科技有限公司]; 胎牛血清(德国PAN-Biotech公司); MTT (北京酷来搏科技有限公司); LysoTracker Red (美国Life Technologies公司); Hoechst 33342 (北京雷根生物技术有限公司)。
主要仪器 流式细胞仪(CytoFLEX S, 美国Beckman Coulter公司); 激光共聚焦显微镜(A1, 日本Nikon公司); 粒度仪(Zetasizer Nano ZSP, 美国Malvern公司); 小动物活体成像(VISQUETM In Vivo Elite, 韩国Vieworks公司); 凝胶渗透色谱(1515-2414, 美国Waters公司); 酶标仪(Multiskan FC, 美国Thermo Fisher公司); 荧光光谱仪(F-7000)、紫外分光光度仪(UH5300) (日本HITACHI公司); 场发射透射电镜(JEM-200CX, 日本JEOL公司); 核磁共振氢谱仪(AVANCE Ⅲ HD 400M, 瑞士Bruker公司); 细胞破碎仪(VCX-150, 美国Sonics公司); 冷冻干燥机(BenchTop Pro, 美国Virtis公司); 超纯水仪(Milli-Q Integral 10, 美国Merck Millipore公司)。
细胞 鼠乳腺癌细胞株4T1购自中国医学科学院基础医学研究所, 采用含有100 μg·mL-1青霉素、100 μg·mL-1链霉素和10%胎牛血清的RPMI 1640培养基培养; 用0.25%胰蛋白酶作为消化液进行消化传代。
动物 BALB/c小鼠(雌性, 体重18~20 g)购自北京大学医学部实验动物科学部, 许可证号: SCXK (京) 2016-0010, 于北京大学医学部实验动物科学部饲养。实验动物在恒温恒湿条件下饲养(温度为25 ℃、湿度为50%~60%, 自然光照明)。实验按照北京大学医学部实验动物伦理委员会的指导原则进行。
大分子引发剂PEG-Br的合成与表征 称取PEG5k-OH 20 g, 加入CH2Cl2 250 mL使其溶解。向反应液中加入5倍当量的三乙胺和DMAP。在0 ℃下滴加2-溴异丁酰溴2.5 mL, 室温反应24 h。反应完毕后, 分别用10% Na2CO3溶液、饱和NaCl溶液萃取提纯3次。保留有机相, 并用无水硫酸钠进行干燥。过滤除去硫酸钠。将有机相滴到冰乙醚中, 过滤收集沉淀, 干燥后即得大分子引发剂PEG5k-Br[15]。取产物10 mg, 溶解于500 μL CDCl3中, 进行核磁表征, δ: 4.34 (t, 2H)、3.66 (m, 450H)、3.40 (s, 3H)、1.96 (s, 6H)。
pH超敏感聚合物PEG-iPDPA 的合成与表征称取PEG5k-Br 500 mg (0.1 mmol)和AMA 16.7 mg (0.1 mmol), 加入iDPA-MA 428 mg (2 mmol)、PMDETA 21 μL (0.1 mmol)、异丙醇2 mL和DMF 2 mL。冻融循环3次, 在氮气气流下加入CuBr 14.4 mg (0.1 mmol)。40 ℃下反应12 h。反应完毕, 向反应瓶中加入四氢呋喃10 mL终止反应, 反应液用中性Al2O3柱进行纯化, 用100 mL四氢呋喃洗脱, 收集洗脱液, 旋转蒸发浓缩, 将剩余液体转移至透析袋中, 用超纯水进行透析, 24 h后冷冻干燥, 得到聚合物固体[16]。核磁表征, 计算聚合效率(n)。δ: 3.65 (m, 450H)、3.39 (s, 3H)、3.84 (m, 2nH)、3.00 (m, 2nH)、2.64 (m, 2nH)、1.75~2.25 (m, 2nH)、0.75~1.25 (m, 15nH)。将产物溶解在THF中(约10 mg·mL-1), 用凝胶渗透色谱(GPC)测定其分子质量和多分散性(PDI)。
pH滴定法测定聚合物的pKa 称取聚合物50 mg, 并用0.1 mol·L-1盐酸10 mL溶解, 在搅拌下滴加0.1 mol·L-1氢氧化钠溶液, 每次加入100 μL, 测定pH随氢氧化钠加入体积的变化, 并绘制图像[17]。
探针的连接 取PEG5k-iPDPA20聚合物50 mg, 按聚合物质量的1.5倍称取荧光探针(TMR、BDP或Cy7.5), 将二者共同溶解在1 mL DMF中, 反应24 h。反应完毕后通过制备凝胶渗透色谱进行分离, 得到连有探针的聚合物, 透析, 冷冻干燥后得到连有荧光探针的聚合物粉末PEG5k-iPDPA20-TMR1、PEG5k-iPDPA20-BDP1和PEG5k-iPDPA20-Cy7.51。并通过紫外-可见分光光度计对探针的连接率进行测定[18]。
胶束的制备 ①球形胶束的制备[19]:称取PEG5k-iPDPA20聚合物4 mg, 溶解在2 mL甲醇中, 在探头超声下, 加入至8 mL水中, 探头超声30 s, 用100 kDa超滤管超滤4次, 定容至1 mL, 即得到4 mg·mL-1球形胶束。②蠕虫形胶束的制备[20]:称取PEG5k-iPDPA20聚合物4 mg, 溶解在10 mL甲醇中, 旋转蒸发成膜, 用水4 mL水化, 探头超声20 s, 用100 kDa超滤管超滤2次, 定容至1 mL, 得到4 mg·mL-1蠕虫形胶束。
粒径 取上述两种形状胶束, 并用水稀释至约200 μg·mL-1, 用马尔文粒度仪分别测定两种形状胶束的粒径分布。
透射电镜 将制剂稀释至约300 μg·mL-1, 在铜网上滴加约10 μL左右, 吸附1 min, 随后用滤纸吸去多余的液体, 干燥后滴加磷钨酸溶液约10 μL, 干燥后, 用透射电镜(TEM)观察两种制剂的形态。
pH敏感性 称取连有探针的聚合物, 分别制备得到两种制剂, 定容至4 mg·mL-1。分别用不同pH的磷酸盐缓冲液(PBS)稀释至100 μg·mL-1, 用荧光光谱仪或小动物活体成像仪分别测定各pH组的荧光值, 绘制荧光强度随pH变化的曲线, 计算胶束的荧光ON/OFF倍数。并按如下公式计算相对荧光强度(normalized fluorescence intensity, NFI):
| $ {\rm{NFI}} = \frac{{F - {F_{\min }}}}{{{F_{\max }} - {F_{\min }}}} $ | (1) |
其中, F为任一pH下的荧光强度, Fmax、Fmin分别为制剂在ON、OFF状态下, 荧光的最大值与最小值。绘制NFI-pH曲线, 并以此计算制剂的pH转变点(pHt)、pH响应锐度(ΔpH10%-90%)。
细胞毒性 将4T1细胞以2 000个/孔接种到96孔板中, 培养过夜, 分别用不同浓度(2.5 μg·mL-1~1 mg·mL-1, n = 6)的制剂于37 ℃下孵育4 h。随后, 弃去制剂, 每孔加入MTT工作液100 μL, 孵育4 h。之后, 弃去MTT, 每孔加入DMSO 200 μL, 振摇30 min后, 用酶标仪测定各孔吸光度。
细胞摄取 ①细胞对制剂摄取的浓度依赖性:将4T1细胞以1.6×104个/孔接种到12孔板上, 培养过夜。分别用含有50、100和200 μg·mL-1制剂的无血清培养基于37 ℃下孵育2 h。随后, 胰酶消化并收集细胞, 分别用流式细胞仪、活体成像仪测定细胞摄取不同浓度的两种形状胶束的荧光值。②细胞摄取制剂的时间依赖性:方法同前, 分别用100 μg·mL-1的两种制剂孵育细胞0.25、0.5、1、2和4 h。随后, 胰酶消化并收集细胞, 分别用流式细胞仪和活体成像仪测定细胞摄取两种形状制剂不同时间后的荧光值。③摄取机制:方法同前, 每孔加入500 μL用无血清、无酚红培养基稀释的抑制剂, 包括:氯丙嗪(chlorpromazine, CPZ)、制菌霉素(nystatin)、乙基异丙基氨氯吡咪(ethylisopropylamiloride, EIPA)和金雀异黄素(genistein)等, 于37 ℃孵育15 min。分别用含有抑制剂和100 μg·mL-1制剂的无血清培养基于37 ℃下孵育2 h。随后, 胰酶消化并收集细胞, 用流式细胞仪检测经不同抑制剂处理的细胞摄取制剂的荧光值。
激光共聚焦成像实验 将4T1细胞以2 500个/孔接种到共聚焦小皿中, 37 ℃培养过夜, 用100 μg·mL-1制剂孵育1.5 h后, 弃去制剂, 加入细胞核荧光染料Hoechst 33342工作液, 15 min后弃去液体, 加入溶酶体荧光染料LysoTracker Red工作液孵育15 min, 在激光共聚焦显微镜下观察制剂的细胞器分布情况。
药物动力学 取荷4T1肿瘤的BALB/c小鼠12只, 随机分为2组, 每组6只。分别按20 mg·kg-1体重尾静脉注射两种制剂, 于2、15、30 min、1、3、6、12、24 h, 从小鼠眼眶取血1滴(50 μL), 2 000 r·min-1离心10 min, 取血清20 μL, 加入提取液200 μL, 10 000 r·min-1离心10 min, 取上清, 用荧光光谱仪测定荧光值, 绘制药物动力学曲线。
活体成像实验 取荷4T1肿瘤的BALB/c小鼠8只, 随机分为2组, 每组4只。分别按20 mg·kg-1体重尾静脉注射两种制剂, 于不同时间点进行活体成像。成像完毕后, 灌流并剖出脏器, 对脏器进行成像。
苏木精-伊红(H & E)染色切片 将上述成像后的各种脏器用4%多聚甲醛固定, 切片并进行H & E染色, 通过显微镜对H & E染色切片进行成像分析。
数据分析 采用GraphPad Prism 7软件进行统计学分析, P<0.05为具有显著性差异, P<0.01为具有极显著性差异。
结果 1 聚合物的合成及处方筛选首先, 通过一步反应, 合成了大分子引发剂PEG5k-Br, 并进行纯化。核磁共振氢谱(1H NMR)显示, 产物均有95%以上的溴末端。随后, 利用原子转移自由基聚合(ATRP)方法, 合成了PEG5k-iPDPA20, 见合成路线1所示。

|
Scheme1 Synthesis of PEG5k-Br macroinitiator (A); synthesis of poly(ethylene glycol)-b-poly(2-(diisopropyl amino)ethyl methacrylate) block copolymer (PEG5k-iPDPA20) (B) |
通过核磁共振氢谱(图 1A), 计算出该聚合物的单体连接个数约为21.3个, 相对分子质量约为9 540。通过凝胶渗透色谱(GPC)对PEG5k-iPDPA20进行分析, 结果显示, 聚合物呈单峰分布, 凝胶渗透色谱测定的分子质量与核磁共振氢谱计算的结果相吻合。通过pH滴定法测定出这种聚合物的pKa为6.70左右(图 1B)。

|
Figure 1 1H NMR of PEG5k-iPDPA20 (A); pH-titration curves of PEG5k-iPDPA20 polymer and its corresponding monomer 2-(diisopropyl amino)ethyl methacrylate (iDPA-MA) (B); particle size and polydispersity (PDI) analysis of wormlike micelles (WMs) with different ultrasound time (C); particle size and PDI of WMs with different polymer concentrations (D). n = 3, x ± s |
采用薄膜分散法成功地将这种聚合物制备成了蠕虫形胶束, 并对其制备条件进行了筛选。研究发现, 随着超声时间的延长, 制剂的粒径及分布(PDI)均明显降低(图 1C); 随着超声时制剂浓度的增加, 制剂的粒径和PDI均有不同程度的变化(图 1D)。综合考虑, 确定蠕虫形胶束的制备条件为:将1 mg·mL-1聚合物探头超声20 s。采用溶剂去除法将聚合物制备为球形胶束, 超声时间和浓度的改变对其粒径分布影响不大。
此外, 还对其他一系列不同亲水-疏水链长的聚合物进行了制剂制备的考察, 研究发现, 仅有PEG5k-iPDPA20这种聚合物能通过薄膜分散法制备为稳定的纳米混悬液, 因此, 在后续研究中, 选用PEG5k-iPDPA20作为模型聚合物, 研究不同形状制剂的生物学性质差异。
2 不同形状荧光纳米粒的制备与表征蠕虫形胶束与球形胶束的体外性质差异如图 2所示。使用场发射透射电镜观察了两种形状制剂的形态, 球形胶束、蠕虫形胶束的透射电镜图片分别如图 2A, B所示, 球形胶束呈球形, 粒径为25~30 nm左右; 蠕虫形胶束呈条形或蠕虫形, 直径约25~30 nm, 长度不一, 在100~500 nm均有分布。

|
Figure 2 Preparation and characterization of fluorescent nanoparticles with different shapes. A and B: Transmission electron microscope (TEM) images of spherical micelles (SMs, A) and wormlike micelles (WMs, B) prepared with PEG5k-iPDPA20 block copolymer. Scale bars, 200 nm; C and D: pH-dependent fluorescence spectra of SMs-TMR (C) and WMs-TMR (D). Each sample was excited at 545 nm, and emission spectrum was collected from 560 nm to 660 nm; E and F: pH-dependent fluorescence spectra of SMs-BDP (E) and WMs-BDP (F). Each sample was excited at 488 nm, and emission spectrum was collected from 500 nm to 600 nm; G and H: Normalized fluorescence intensity (NFI) of SMs (G) and WMs (H); I and J: pH-dependent fluorescence images of SMs (I) and WMs (J); K: Stability of SMs-BDP and WMs-BDP in the presence of fresh mouse plasma. FI: Fluorescence intensity; TMR: Tetramethyl rhodamine; BDP: BODIPY-FL; SMs-TMR: SMs conjugated with TMR; WMs-TMR: WMs conjugated with TMR; SMs-BDP: SMs conjugated with BDP; WMs-BDP: WMs conjugated with BDP |
PEG5k-iPDPA20为pH敏感材料, 在中性和碱性条件下, 其疏水链段的2-二异丙基氨基基团呈电中性和疏水性, 聚合物整体呈亲水-疏水两亲性, 此时形成的制剂会很稳定; 而在酸性条件下, 2-二异丙基氨基基团发生质子化, 使其带有正电荷, 呈正电性和亲水性, iPDPA嵌段亲水性增强, 并且聚合物分子之间的正电荷会相互排斥, 使胶束解散。
采用荧光技术来考察这两种形状制剂的pH响应性。将PEG5k-iPDPA20聚合物化学连接上TMR探针或BDP探针, 得到PEG5k-iPDPA20-TMR1及PEG5k-iPDPA20-BDP1, 并用紫外分光光度计测定探针的连接个数。经测定, 平均每个聚合物分子上连有0.7个探针分子。随后将连有荧光探针的聚合物制备成两种形状的制剂, 并用不同pH的PBS稀释, 利用荧光光谱仪测定制剂在不同pH下的荧光强度(图 2C~F)。在中、碱性条件下, 制剂为完整状态, 探针分子之间的距离很近, 小于10 nm, 因此, 存在homo-FRET现象[16], 使探针的荧光自淬灭, 导致制剂整体的荧光值很低, 为荧光OFF状态; 在酸性条件下, 制剂解散, 探针分子之间的距离增大, 荧光值恢复, 为荧光ON状态。因此, 可用制剂荧光的ON/OFF来评价体系的pH响应性。结果显示:连接BDP探针后, 两种形状的制剂均能达到100倍以上的荧光ON/OFF倍数, 而连接TMR探针后, 两种制剂的荧光ON/OFF倍数为50倍左右。
按公式(1)对两种形状制剂的荧光强度进行处理分析, 并绘制NFI-pH曲线(图 2G, H)。结果显示, 连接TMR探针后, 两种制剂ΔpH10%-90%会更小, 约为0.3左右, 与此相比, 连接BDP探针后, ΔpH10%-90%更大, 为0.6左右, 这可能与BDP探针的性质有关, BDP探针在不同pH下的荧光强度有差异, 在酸性条件下, 其荧光强度增强, 导致其pH转变范围更大, ON/OFF倍数更高。对于连接相同探针的制剂, 蠕虫形胶束的ON/OFF倍数稍高, pHt更低, ΔpH10%-90%也更小。
利用活体成像仪测定了两种形状制剂在不同pH的荧光值(图 2I, J), 成像结果与荧光光谱仪测定的结果吻合。
图 2K为两种形状制剂的血浆稳定性的结果, 从图中可以看出制剂在pH 7.4和pH 5.4下的荧光值均比较稳定, 在37 ℃下孵育24 h后, 蠕虫形胶束还有61.2倍的ON/OFF倍数, 而球形胶束则有33.6倍的ON/OFF倍数。且制剂在血浆中的荧光值也始终保持稳定, 与pH 7.4组的结果差异不大, 说明制剂在血浆中不会解散。以上结果表明制剂的稳定性良好, 可用于后续细胞、动物水平的评价。
3 细胞摄取及机制研究用流式细胞仪检测了4T1细胞摄取不同浓度制剂或摄取制剂不同时间后的荧光值。结果显示, 由PEG5k-iPDPA20-BDP1制备得到的两种形状的制剂在细胞内摄取量都随着制剂浓度(图 3A)和摄取时间(图 3D)的增加而增加, 呈浓度依赖性和时间依赖性。在相同的制剂浓度和摄取时间的情况下, 4T1细胞摄取球形胶束的量约为蠕虫形胶束的4~5倍(图 3B, E)。用活体成像仪测定细胞摄取制剂后的荧光值, 如图 3C, F所示, 其趋势与流式细胞术的结果吻合, 这说明球形胶束在细胞摄取上更具有优势。

|
Figure 3 In vitro cell uptake of different shaped micelles. A and B: Cellular uptake of SMs and WMs (A) and cellular uptake ratio of SMs to WMs (S/W ratio) (B) at different concentrations for 2 h, measured by flow cytometry; C: Cellular uptake of SMs and WMs at different concentrations for 2 h, measured by in vivo imaging system; D and E: Cellular uptake of SMs and WMs (D) and cellular uptake ratio of SMs to WMs (S/W ratio) (E) for different incubation time at the micelles concentration of 100 μg·mL-1, measured by flow cytometry; F: Cellular uptake of SMs and WMs for different incubation time at the micelles concentration of 100 μg·mL-1, measured by in vivo imaging system in 4T1 cells; G: Effect of inhibitors on the cellular uptake of SMs and WMs in 4T1 cells. The polymer concentration was 100 μg·mL-1, measured by flow cytometry; H: Lysosome colocalization with SMs and WMs in 4T1 cells, measured by confocal laser scanning microscopy. Green color represents the nanoprobe signals and red color represents the lysosome. Yellow color is an indication for colocalization of micelles with lysosomes. CPZ: Chlorpromazine; EIPA: Ethylisopropylamiloride. n = 3, x ± s. *P < 0.05, **P < 0.01 vs each WMs |
为了验证细胞摄取两种形状制剂的机制是否存在差异, 进行了细胞摄取抑制剂的实验。用流式细胞术检测经不同抑制剂处理的细胞摄取制剂的荧光强度, 结果如图 3G所示。经过不同抑制剂处理后, 细胞对两种制剂的摄取量均有相应程度的下降。结果显示, 两种制剂进入细胞都主要通过小窝蛋白或网格蛋白介导的内吞作用进入细胞。两种形状制剂之间进行比较, 球形胶束更多地通过小窝蛋白介导的内吞进入细胞, 而蠕虫形胶束则更依赖网格蛋白介导的内吞作用进入细胞。
进一步观察了细胞摄取制剂后两种制剂在细胞内的分布情况, 激光共聚焦显微镜成像(图 3H)显示, 红色通道为LysoTracker Red标记的溶酶体, 绿色通道为连接有BDP探针的胶束的位置, 蓝色为Hoechst 33342标记的细胞核。黄色为绿色与红色的叠加, 代表了制剂与溶酶体的共定位。从图 3H可以看出, 摄取2 h后两种制剂均与溶酶体有明显的共定位, 这也证明了两种制剂都是通过内吞作用进入细胞, 与抑制剂的实验结果相吻合。
4 体内靶向及成像研究蠕虫形和球形胶束在BALB/c小鼠体内的药物动力学曲线如图 4A所示, 两种形状制剂的体内循环时间都比较长, 球形和蠕虫形制剂的消除相半衰期分别为19.8 ± 5.7 h和14.6 ± 4.3 h。球形制剂的体内循环时间稍长于蠕虫形制剂, 统计学分析结果显示, 二者无显著性差异。
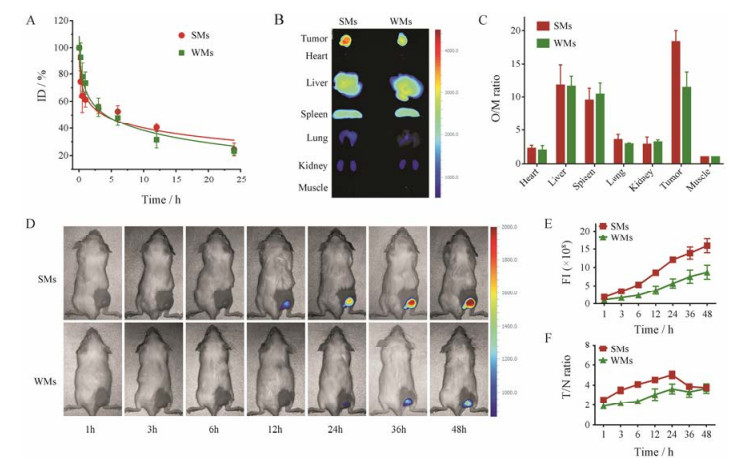
|
Figure 4 In vivo pharmacokinetics and fluorescence imaging analysis of different shaped micelles. A: Normalized concentration (ID %) of micelles in plasma after i.v. injection of SMs-BDP or WMs-BDP into 4T1-bearing mice at a dose of 20 mg·kg-1. n = 5, x ± s; B and C: Ex vivo fluorescent images (B) and organ to muscle ratios (O/M ratio) (C) at 48 h post-injection of SMs-Cy7.5 or WMs-Cy7.5. BALB/c mice were treated with micelles at a dose of 20 mg·kg-1; D: In vivo fluorescence images of 4T1-bearing mice treated with SMs-Cy7.5 or WMs-Cy7.5 at predetermined time points at a dose of 20 mg·kg-1; E and F: FI (E) and tumor to normal tissue ratio (T/N ratio) (F) as functions of time after injection of SMs-Cy7.5 or WMs-Cy7.5 at a dose of 20 mg·kg-1. Cy7.5: Cyanine 7.5; SMs-Cy7.5: SMs conjugated with Cy7.5; WMs-Cy7.5: WMs conjugated with Cy7.5. n = 2, x ± s |
采用活体成像的方法研究了两种形状制剂在荷瘤BALB/c小鼠体内的组织分布, 结果如图 4B所示。小鼠尾静脉给药24 h后, 两种制剂均在肿瘤、肝、脾有明显的蓄积, 在肌肉、心、肺、肾的蓄积较少。在肿瘤组织中, 球形胶束组的信号强度明显高于蠕虫形胶束组。以肌肉组织的荧光强度为基准, 将两组制剂的各组织荧光强度进行归一化处理, 组织-肌肉荧光比值(O/M ratio)的结果如图 4C所示, 其中, 球形胶束在肿瘤内的O/M ratio为18.3 ± 1.7, 蠕虫形的O/M ratio为11.4 ± 2.3, 说明球形胶束的瘤内蓄积量高于蠕虫形胶束的瘤内蓄积量。荷瘤BALB/c小鼠注射了两种制剂后的实时活体荧光成像的结果如图 4D所示, 随着时间的延长, 两种制剂在肿瘤内的荧光信号强度均明显增强, 两种制剂相比较, 球形胶束具有更高的荧光值(图 4E)。球形胶束在24 h时具有最高的肿瘤-正常组织信号对比度(T/N ratio), 其在肿瘤区域的T/N ratio为5.0 ± 0.4倍, 说明这个体系具有更优的成像灵敏度和对比度, 能够用于肿瘤的成像与检测, 而蠕虫形胶束T/N ratio最高能达到3.7 ± 0.5倍, 成像效果不如球形胶束(图 4F)。
5 安全性评价采用MTT法研究了两种制剂的细胞毒性, 不同浓度的两种制剂对4T1细胞的细胞毒性如图 5A所示, 结果显示:从2.5 μg·mL-1~1 mg·mL-1, 二者均未观察到明显的细胞毒性。
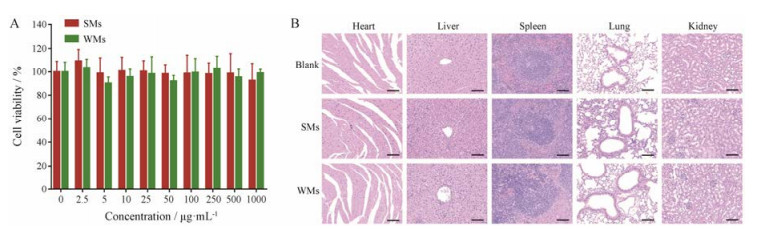
|
Figure 5 Cytotoxicity of SMs and WMs under the concentration gradients of 2.5 μg·mL-1 - 1 mg·mL-1 against 4T1 cells for 4 h (A); H & E staining of heart, liver, spleen, lung and kidney excised from 4T1 tumor-bearing mice treated with SMs, WMs or normal saline (B). Scale bars, 100 μm |
给药24 h后, BALB/c小鼠各脏器的H & E染色切片结果如图 5B所示。结果显示:实验组小鼠的染色结果与对照组相比, 没有明显的差异, 未引起心、肝、脾、肺和肾的急性病理损伤, 初步说明这两种形状的制剂无明显的急性毒性。
讨论本文采用ATRP法合成了pH超敏感两亲性聚合物PEG5k-iPDPA20, 且将其成功地制备成了蠕虫形以及球形胶束, 并对两种形状制剂的制备条件进行了筛选, 确定了最优制备条件。随后, 在体外考察了两种制剂的pH响应性以及血浆稳定性, 两种制剂均有非常好的pH响应性, 都能实现100倍的荧光ON/OFF, 灵敏度非常高。细胞摄取两种制剂均呈浓度、时间依赖性, 且细胞摄取球形制剂的量远多于蠕虫形胶束, 这可能与蠕虫形制剂的粒径大小有关, 蠕虫形胶束能达到500 nm甚至更长的长度, 其长度很难控制, 此时, 粒径大小对制剂的摄取会有影响, 因此导致蠕虫形胶束摄取的量更少。两种制剂的pHt在6.70~6.80左右, 都能够对肿瘤细胞内的酸性环境敏感, 实现肿瘤的特异性成像。两种制剂相比, 球形胶束具有更好的成像效果以及更高的瘤内蓄积量。综上所述, 本研究证明了球形胶束在细胞摄取、肿瘤成像和瘤内分布等方面具有更优的生物学效应。上述研究为设计与优化不同形状的纳米制剂, 提高其生物学效应, 最大程度发挥材料的生物学功能提供了一定的参考。
| [1] | Zheng RS, Zeng HM, Zhang SW, et al. National estimates of cancer prevalence in China, 2011[J]. Cancer Lett, 2016, 370: 33–38. DOI:10.1016/j.canlet.2015.10.003 |
| [2] | Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI:10.3322/caac.21338 |
| [3] | Scheinberg DA, Villa CH, Escorcia FE, et al. Conscripts of the infinite armada:systemic cancer therapy using nanomaterials[J]. Nat Rev Clin Oncol, 2010, 7: 266–276. DOI:10.1038/nrclinonc.2010.38 |
| [4] | Shi J, Kantoff PW, Wooster R, et al. Cancer nanomedicine:progress, challenges and opportunities[J]. Nat Rev Cancer, 2017, 17: 20–37. DOI:10.1038/nrc.2016.108 |
| [5] | Liu RW, Li XC, Xiao WW, et al. Tumor-targeting peptides from combinatorial libraries[J]. Adv Drug Deliv Rev, 2017, 110-111: 13–37. DOI:10.1016/j.addr.2016.05.009 |
| [6] | Chen DY, Yan L, Qiao MX, et al. Preparation of docetaxelloaded pH-sensitive block copolymer micelles[J]. Acta Pharm Sin (药学学报), 2008, 43: 1066–1070. |
| [7] | Zhang MM, Yang YT, Yu QW, et al. Preliminary study on immune mechanisms of pH-sensitive transmembrane peptide modified liposome loaded with α-galactosylceramides[J]. Acta Pharm Sin (药学学报), 2017, 52: 634–640. |
| [8] | Ma YY, Li L, Huang HF, et al. Advances of tumor targeting peptides drug delivery system with pH-sensitive activities[J]. Acta Pharm Sin (药学学报), 2016, 51: 717–724. |
| [9] | Hu XL, Hu JM, Tian J, et al. Polyprodrug amphiphiles:hierarchical assemblies for shape-regulated cellular internalization, trafficking, and drug delivery[J]. J Am Chem Soc, 2013, 135: 17617–17629. DOI:10.1021/ja409686x |
| [10] | Cabral H, Matsumoto Y, Mizuno K, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size[J]. Nat Nanotechnol, 2011, 6: 815–823. DOI:10.1038/nnano.2011.166 |
| [11] | Yamamoto Y, Nagasaki Y, Kato Y, et al. Long-circulating poly(ethylene glycol)-poly(D, L-lactide) block copolymer micelles with modulated surface charge[J]. J Control Release, 2001, 77: 27–38. DOI:10.1016/S0168-3659(01)00451-5 |
| [12] | Fox ME, Szoka FC, Frechet JM. Soluble polymer carriers for the treatment of cancer:the importance of molecular architecture[J]. ACC Chem Res, 2009, 42: 1141–1151. DOI:10.1021/ar900035f |
| [13] | Petros RA, De Simone JM. Strategies in the design of nanoparticles for therapeutic applications[J]. Nat Rev Drug Discov, 2010, 9: 615–627. DOI:10.1038/nrd2591 |
| [14] | Duan XP, Li YP. Physicochemical characteristics of nanoparticles affect circulation, biodistribution, cellular internalizetion, and trafficking[J]. Small, 2013, 9: 1521–1532. DOI:10.1002/smll.201201390 |
| [15] | Bronstein LM, Sidorov SN, Zhirov V, et al. Metalated diblock and triblock poly(ethylene oxide)-block-poly(4-vinylpyridine) copolymers:understanding of micelle and bulk structure[J]. J Phys Chem B, 2005, 109: 18786–18798. DOI:10.1021/jp053333x |
| [16] | Zhou KJ, Wang YG, Huang XN, et al. Tunable, ultrasensitive pH-responsive nanoparticles targeting specific endocytic organelles in living cells[J]. Angew Chem Int Ed, 2011, 50: 6109–6114. DOI:10.1002/anie.v50.27 |
| [17] | Wang CS, Wang YG, Li Y, et al. A nanobuffer reporter library for fine-scale imaging and perturbation of endocytic organelles[J]. Nat Commun, 2015, 6: 8524. DOI:10.1038/ncomms9524 |
| [18] | Ma XP, Wang YG, Zhao T, et al. Ultra-pH-sensitive nanoprobe library with broad pH tunability and fluorescence emissions[J]. J Am Chem Soc, 2014, 136: 11085–11092. DOI:10.1021/ja5053158 |
| [19] | Wang YG, Zhou KJ, Huang G, et al. A nanoparticle-based strategy for the imaging of a broad range of tumours by nonlinear amplification of microenvironment signals[J]. Nat Mater, 2014, 13: 204–212. DOI:10.1038/nmat3819 |
| [20] | Zeng LJ, Zou LL, Yu HJ, et al. Treatment of malignant brain tumor by tumor-triggered programmed wormlike micelles with precise targeting and deep penetration[J]. Adv Funct Mater, 2016, 26: 4201–4212. DOI:10.1002/adfm.v26.23 |
 2018, Vol. 53
2018, Vol. 53


