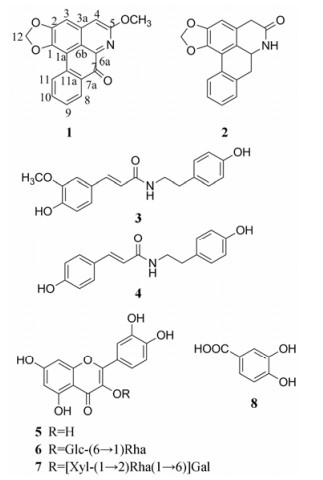
毛萼清风藤是清风藤科(Sabiaceae)清风藤属(Sabia Colebr)植物毛萼清风藤[Sabia limoniacea var. ardisioides (Hook.et Am.) L.Chen]的藤茎, 是传统瑶药“十八钻”中的黑钻[1], 别名黑风藤。瑶医认为“钻”类药物性能攒透强劲、透利关节、通达经络, 多为行气止痛、消肿散瘀药。毛萼清风藤产于广西巴马、那坡、武鸣、宁明、防城、桂平、岑溪、贺州、昭平、蒙山、平乐、金秀、融水等县市及福建、广东、云南等省, 具有祛风除湿、止痛散瘀的功效, 用于产后腹痛、风湿痹痛。前期本课题组已对毛萼清风藤的总三萜酸的提取工艺进行了优化研究[2], 采用GC-MS对其脂溶性成分进行分析[3], 并建立了药材薄层检测方法[4]。但是目前对毛萼清风藤的物质基础和作用机制研究尚不够深入, 为了进一步阐明该药的有效成分, 本课题组对毛萼清风藤的化学成分进行了深入研究, 从中分离得到8个化合物, 分别鉴定为5-甲氧基-1, 2-亚甲二氧基氧化阿朴菲碱(1)、5-氧阿朴菲碱(2)、N-p-阿魏酰酪胺(3)、N-反式香豆酰酪胺(4)、槲皮素(5)、芦丁(6)、mutabiloside (7)和原儿茶酸(8)。化合物1~8结构见图 1。其中, 化合物1为新化合物, 化合物2~8均为首次从毛萼清风藤中分离得到。
|
Figure 1 Structures of compounds 1-8 |
化合物1 黄色粉末, 易溶于氯仿, 254 nm紫外灯显示橙黄色荧光, 与改良碘化铋钾反应呈阳性, 推测为生物碱类化合物。紫外光谱在240和445 nm处有最大吸收, 提示分子中有长共轭系统。红外光谱显示化合物结构中含羰基(1 651 cm-1)、苯环(1 609、1 581 cm-1)。由HR-EI-MS (m/z): 305.069 5 [M]+ (计算值305.068 8, C18H11NO4)给出分子式为C18H11NO4, 不饱和度为14。
1H NMR (800 MHz, CDCl3)谱中(表 1)显示δ 6.23~8.60低场处有6个芳香质子信号, 其中δH 8.60 (1H, d, J = 8.0 Hz)、δH 7.68 (1H, t, J = 8.0 Hz)、δH 7.51 (1H, t, J = 8.0 Hz)和δH 8.50 (1H, d, J = 8.0 Hz)处为典型的苯环AA'BB'系统取代的芳氢信号; δH 7.19 (1H, s)和δH 7.00 (1H, s)为2个芳香单峰质子信号, δH 6.23 (2H, s)为亚甲二氧基的信号, δH 4.21 (3H, s)为甲氧基的信号。13C NMR (200 MHz, CDCl3)提示有18个碳信号, 由DEPT谱归属为1个甲基、1个亚甲基、6个次甲基和10个季碳信号, δC 182.1为羰基信号, δC 161.7上连接有氧原子, δC 102.3为亚甲二氧基的特征信号, δC 54.1为1个甲氧基信号。以上数据提示该化合物1为氧化阿朴菲碱类化合物。将其NMR数据与文献报道[5]对照, 发现化合物与鹅掌楸碱相似, 提示两者有相同的骨架结构。进一步比较两者的NMR数据, 发现化合物1结构中多一个甲氧基(δH 4.21, δC 54.1)。
| Table 1 1H NMR (800 MHz, CDCl3) and 13C NMR (200 MHz, CDCl3) spectral data of compound 1 |
在HSQC谱中显示:甲氧基(δH 4.21)与δC 54.1相关、H-12 (δH 6.23)与δC 102.3相关、H-3 (δH 7.00)与δC 102.1相关、H-4 (δH 7.19)与δC 110.5相关、H-9 (δH 7.51)与δC 128.4相关、H-10 (δH 7.68)与δC 133.5相关、H-8 (δH 8.50)与δC 128.6相关、H-11 (δH 8.60)与δC 127.3相关。在HMBC谱中显示(图 2): H-3 (δH 7.00)与C-1 (δC 147.0)、C-4 (δC 110.5)、C-6b (δC 120.3)相关; H-4 (δH 7.19)与C-5 (δC 161.7)相关; H-8 (δH 8.50)与C-7 (δC 182.1)相关; H-9 (δH 7.51)与C-7a (δC 131.4)、C-11 (δC 127.3)相关; H-10 (δH 7.68)与C-8 (δC 128.6)、C-11a (δC 132.7)相关; H-11 (δH 8.60)与C-1a (δC 107.6)和C-9 (δC 128.4)相关; H-12 (δH 6.23)与C-1 (δC 147.0)、C-2 (δC 151.9)相关, 说明亚甲二氧基连接在C-1和C-2上; 甲氧基(δH 4.21)与C-5 (δC 161.7)相关, 说明甲氧基连接在C-5上。综上所述, 最终确定化合物结构为5-甲氧基-1, 2-亚甲二氧基氧化阿朴菲碱(5-methoxy-1, 2-methylenedioxyl oxoaporphine)。该化合物的结构与文献[6]报道的oxostephanine相似, 只是甲氧基的连接位置不一样, oxostephanine结构中甲氧基是连接在C-8位上, 而化合物1结构中甲氧基是连接在C-5位上, 经检索, 确定化合物1为新化合物, 命名为5-甲氧基-1, 2-亚甲二氧基氧化阿朴菲碱(5-methoxy-1, 2-methylenedioxyl oxoaporphine)。

|
Figure 2 Key HMBC of compound 1 |
日本岛津UV2550紫外-可见分光光度计; TENSOR27红外光谱仪(KBr压片法); Autospec Premier P776高分辨磁质谱气质联用仪; Agilent 5973N气相色谱/四级杆质谱联用仪; Finnigan Trace DSQ四级杆质谱仪; Bruker 800 MHz核磁共振仪, Bruker 600 MHz核磁共振仪和Bruker 500 MHz核磁共振仪(TMS做内标); Waters制备型高效液相色谱仪; 柱色谱硅胶为青岛海洋化工厂生产, Sephadex LH-20凝胶为Pharmacia公司生产, Diaion HP20大孔树脂为日本三菱株式会社生产。检测用薄层色谱硅胶(青岛海洋化工有限公司)。常规试剂均为分析纯。
毛萼清风藤干燥根茎, 采集于广西金秀县, 经广西中医药研究院中药研究所赖茂祥研究员鉴定为毛萼清风藤[Sabia limoniacea var. ardisioides (Hook.et Am.) L.Chen]的根茎。
1 提取分离毛萼清风藤根茎9.6 kg, 粉碎后用95%乙醇回流提取3次, 每次提取2 h, 过滤, 合并提取液, 回收溶剂, 得乙醇提取物。将乙醇提取物用水悬浮后, 依次用石油醚(60~90 ℃)、乙酸乙酯、正丁醇萃取, 回收溶剂, 得石油醚部位36 g、乙酸乙酯部位80.5 g、正丁醇部位147 g。
取石油醚部位36 g经硅胶柱色谱(100~200目)分离, 以石油醚-乙酸乙酯不同体积比例梯度洗脱(100:0、95:5、90:10、85:15、80:20、70:30、50:50), 将所得洗脱液薄层点板合并后得到Fr.1~Fr.7共7个组分。Fr.2组分(石油醚-乙酸乙酯95:5)洗脱得到544个流分, 其中流分509~544析出黄色粉末, 经硅胶H柱色谱分离, 洗脱剂为氯仿-丙酮-石油醚(6:2:3), 得到黄色粉末1 (30.2 mg)。
将乙酸乙酯部位80.5 g经硅胶柱色谱(100~200目)分离, 以二氯甲烷-甲醇不同体积比例的梯度洗脱(98:2、90:10、80:20、70:30、60:40、50:50), 将所得洗脱液薄层点板合并后得到E1~E7共6个组分。E3组分(CH2Cl2-CH3OH, 80:20)经硅胶H柱色谱和Sephadex LH-20凝胶柱色谱分离, 得到化合物2 (8.3 mg); E4组分(CH2Cl2-CH3OH, 70:30)经硅胶H柱色谱和制备型HPLC (流动相甲醇-水=85:15, 流速为5 mL·min-1)分离纯化, 得到化合物3 (7.2 mg)和4 (8.1 mg); E5组分(CH2Cl2-CH3OH, 60:40)经硅胶H柱色谱和制备型HPLC (流动相甲醇-水=80:20, 流速为5 mL·min-1)分离纯化, 得到化合物5 (10.6 mg)和8 (12.5 mg)。
正丁醇部位147 g经D101大孔树脂分离, 以乙醇-水(0:100、30:70、60:40、90:10)不同体积比例进行梯度洗脱, 得到B1~B4共4个组分。B2组分经Sephadex LH-20凝胶色谱和制备型HPLC (流动相甲醇-水=70:30, 流速为5 mL·min-1)分离纯化, 得到化合物6 (20.9 mg)和7 (14.7 mg)。
2 结构鉴定化合物1 黄色粉末。UV (MeOH) λmax: 240、445 nm。IR (KBr) νmax: 1 651、1 609、1 581 cm-1。HR-EI-MS: m/z 305.069 5 [M]+ (计算值C18H11NO4, 305.068 8)。1H NMR (800 MHz, CDCl3)和13C NMR (200 MHz, CDCl3)数据见表 1。
化合物2 黄色针状结晶。EI-MS: m/z 279 [M]+, C17H13NO3。1H NMR (500 MHz, DMSO-d6) δ 2.68 (1H, t, J = 14.2 Hz, H-7), 3.12 (1H, dd, J = 14.6, 5.2 Hz, H-7), 3.29 (1H, m, H-4), 4.54 (1H, d, J = 13.8 Hz, H-6a), 6.04、6.18 (2H, each s, OCH2O), 6.76 (1H, s, H-3), 7.26~7.36 (3H, m, H-8, 9, 10), 8.00 (1H, d, J = 7.7 Hz, H-11), 8.27 (1H, s, NH)。13C NMR (125 MHz, DMSO-d6) δ 142.6 (C-1), l47.4 (C-2), 106.6 (C-3), 124.6 (C-3a), 36.2 (C-4), 168.8 (C-5), 49.9 (C-6a), 35.6 (C-7), 133.8 (C-7a), 128.5 (C-8), 128.0 (C-9), 127.3 (C-10), 126.4 (C-11), 130.3 (C-11a), 114.8 (C-11b), 124.0 (C-11c), 101.1 (OCH2O)。以上数据与文献[7]波谱数据完全一致, 故鉴定化合物2为5-氧阿朴啡碱。
化合物3 白色粉末。EI-MS: m/z 283 [M]+, C17H17NO3。1H NMR (500 MHz, MeOD) δ 2.75 (2H, t, J = 7.4 Hz, H-7'), 3.46 (2H, t, J = 7.4 Hz, H-8'), 3.88 (3H, s, 3-OMe), 6.40 (1H, d, J = 15.6 Hz, H-8), 6.71 (2H, d, J = 8.2 Hz, H-3', 5'), 6.79 (1H, d, J = 8.2 Hz, H-5), 7.02 (2H, dd, J = 1.8, 8.2 Hz, H-6), 7.05 (2H, d, J = 8.2 Hz, H-2', 6'), 7.16 (1H, d, J = 1.8 Hz, H-2), 7.43 (1H, d, J = 15.6 Hz, H-7)。13C NMR (125 MHz, MeOD) δ 128.2 (C-1), l11.4 (C-2), 149.3 (C-3), 149.8 (C-4), 116.4 (C-5), 123.2 (C-6), 142.0 (C-7), 118.7 (C-8), 169.2 (C-9), 131.3 (C-1'), 130.7 (C-2', 6'), 116.2 (C-3', 5'), 156.9 (C-4'), 35.8 (C-7'), 42.6 (C-8'), 56.3 (OCH3)。以上数据与文献[8]波谱数据完全一致, 故鉴定化合物3为N-p-阿魏酰酪胺。
化合物4 白色粉末。EI-MS: m/z 313 [M]+, C18H19NO4。1H NMR (500 MHz, MeOD) δ 2.74 (2H, t, J = 7.4 Hz, H-7'), 3.46 (2H, t, J = 7.4 Hz, H-8'), 6.38 (1H, d, J = 15.7 Hz, H-8), 6.71 (2H, d, J = 8.2 Hz, H-3', 5'), 6.78 (2H, d, J = 8.3 Hz, H-3, 5), 7.04 (2H, d, J = 8.2 Hz, H-2', 6'), 7.39 (2H, d, J = 8.3 Hz, H-2, 6), 7.43 (1H, d, J = 15.7 Hz, H-7)。13C NMR (125 MHz, MeOD) δ 127.7 (C-1), l30.7 (C-2), 116.7 (C-3), 156.9 (C-4), 116.7 (C-5), 130.7 (C-6), 147.8 (C-7), 118.4 (C-8), 169.2 (C-9), 131.3 (C-1'), 130.7 (C-2', 6'), 116.2 (C-3', 5'), 160.5 (C-4'), 35.8 (C-7'), 42.6 (C-8')。以上数据与文献[9]波谱数据完全一致, 故鉴定化合物4为N-反式香豆酰酪胺。
化合物5 黄色粉末。盐酸-镁粉反应呈阳性, 表明该化合物为黄酮类化合物。TLC检测与槲皮素对照品Rf值相同, 且二者混合熔点不下降。EI-MS: m/z 302 [M]+, C15H10O7。其1H NMR、13C NMR核磁数据与文献[10]报道一致, 故化合物5为槲皮素。
化合物6 淡黄色粉末。盐酸-镁粉呈阳性, Molish反应呈阳性。TLC检测与芦丁对照品Rf值相同, 且二者混合熔点不下降。ESI-MS: m/z 633 [M+Na]+, C27H30O16。其1H NMR、13C NMR核磁数据与文献[11]报道一致, 故化合物6为芦丁。
化合物7 棕褐色固体; 盐酸-镁粉呈阳性, Molish反应呈阳性。ESI-MS: m/z 765 [M+Na]+, C32H39O20。1H NMR (600 MHz, MeOD) δ 4.51 (1H, d, J = 1.2 Hz, H-1''''), 4.76 (1H, d, J = 7.0 Hz, H-1'''), 5.30 (1H, d, J = 7.2 Hz, H-1''), 6.18 (1H, d, J = 2.0 Hz, H-6), 6.38 (1H, d, J = 2.0 Hz, H-8), 6.88 (1H, d, J = 8.4 Hz, H-5'), 7.63 (1H, dd, J = 2.4, 8.4 Hz, H-6'), 7.73 (1H, d, J = 2.4 Hz, H-2')。13C NMR (150 MHz, MeOD) δ l58.6 (C-2), 135.6 (C-3), 179.4 (C-4), 163.0 (C-5), 100.0 (C-6), 166.1 (C-7), 94.9 (C-8), 159.3 (C-9), 104.7 (C-10), 123.1 (C-1'), 117.7 (C-2'), 145.8 (C-3'), 149.8 (C-4'), 116.1 (C-5'), 123.6 (C-6'), 102.4 (C-1''), 80.2 (C-2''), 75.3 (C-3''), 70.2 (C-4''), 75.6 (C-5''), 67.0 (C-6''), 105.6 (C-1'''), 74.5 (C-2'''), 77.0 (C-3'''), 69.8 (C-4'''), 66.8 (C-5'''), 102.0 (C-1''''), 71.9 (C-2''''), 72.3 (C-3''''), 74.2 (C-3''''), 69.6 (C-4''''), 17.9 (C-2''')。以上数据与文献[12]波谱数据完全一致, 故鉴定化合物7为mutabiloside。
化合物8 无色结晶(甲醇); 三氯化铁反应呈阳性。EI-MS: m/z 154 [M]+, C7H6O4。1H NMR (600 MHz, MeOD) δ 6.79 (1H, d, J = 8.4 Hz, H-5), 7.36 (1H, dd, J = 1.2, 8.4 Hz, H-6), 7.42 (1H, d, J = 1.2 Hz, H-2)。13C NMR (150 MHz, MeOD) δ 123.1 (C-1), l17.7(C-2), 146.1 (C-3), 151.5 (C-4), 115.7 (C-5), 122.9 (C-6), 170.2 (C=O)。以上数据与文献[13]波谱数据完全一致, 故鉴定化合物8为原儿茶酸。
| [1] | Dai B, Li ZD, Qiu CE, et al. Research on the traditional yao yao medicine of "tiger cattle drill"[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药杂志), 1998, 7: 28–34, 46. |
| [2] | Huang Y, Zhang CL, Liu BM, et al. Optimization of extraction technology and determination of total triterpenoidic acid from Sabia limoniacea Wall.[J]. J Guangxi Acad Sci (广西科学院学报), 2015, 31: 121–125. |
| [3] | Zhang CL, Huang Y, Liu Y, et al. GC-MS analysis of liposoluble components in Sabia limoniacea var. ardisioides[J]. J Guangxi Univ Chin Med (广西中医药大学学报), 2014, 17: 69–70. |
| [4] | Liu Y, Wen ZY, Song ZZ, et al. Study on the detection method of black diamond by thin layer chromatography[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药杂志), 2013, 22: 3. |
| [5] | Ye YS, Liu JW, Liu XQ, et al. Antibacterial constituents from roots of Zanthoxylum nitidum[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 1546–1551. |
| [6] | Li XB, Chen GY, Shao TM, et al. Alkaloids from the roots of Polyalthia laui[J]. J Chin Med Mater (中药材), 2017, 40: 2069–2072. |
| [7] | Deng Y, Chen J, Chen B, et al. Alkaloids from Sabia parviflora[J]. Nat Prod Res Dev (天然产物研究与开发), 2003, 15: 322–323. |
| [8] | Ren Y, Shen L, Dai SJ. Studies on flavonoids and amides from herbs of Solanum lyratum[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 721–723. |
| [9] | Li Y, Wang CL, Wang FF, et al. Phenolic components and flavanones from Dendrobium candidum[J]. Chin Pharm J (中国药学杂志), 2010, 45: 975–979. |
| [10] | Ni FY, Chen Z, Xu QM, et al. Chemical constituents from Rhodiola sachalinensis[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 798–802. |
| [11] | Peng LF, Lu LH, Yang LG, et al. A new biflavone from Dysosma versipellis[J]. Acta Pharm Sin (药学学报), 2016, 51: 1281–1284. |
| [12] | Iwaoka E, Oku H, Takahashi Y, et al. Allergy-preventive effects of hibiscus mutabilis 'versicolor' and a novel allergypreventive flavonoid glycoside[J]. Biol Pharm Bull, 2009, 32: 509–512. DOI:10.1248/bpb.32.509 |
| [13] | Zhao QL, Wu ZB, Zheng ZH, et al. Phenolic acid derivatives from Bauhinia glauca subsp. Pernervosa[J]. Acta Pharm Sin (药学学报), 2011, 46: 946–950. |
 2018, Vol. 53
2018, Vol. 53


