川陈皮素又称川皮亭、蜜橘黄素, 是一种多甲氧基黄酮, 富含于柑橘属植物的果皮中, 具有抗炎、抗氧化和抗血栓形成等药理作用[1, 2]。川陈皮素与人类生活密切相关, 在饮食或药物配伍中经常使用, 这将增加药物-食物或药物-药物相互作用(DDI)发生的可能性, 从而改变药物的疗效和安全性。黄酮类化合物通过调控药物代谢酶介导的DDI已有文献报道, 如高血压患者服用二氢吡啶类钙拮抗剂同服葡萄柚汁后, 通过抑制细胞色素P450 3A4 (CYP3A4)的酶活性, 引起血药浓度显著升高, 可能导致低血压等不良反应[3], 而通过调控药物转运体介导DDI的研究相对较少, 但近年来也已引起人们极大关注。
P-糖蛋白(P-glycoprotein, P-gp)是人体主要的外排蛋白, 属于ABC转运蛋白超家族, 主要表达于小肠、肝脏、肾脏和血脑屏障的毛细血管内皮细胞上, 并在肿瘤细胞中高表达[4]。P-gp的主要功能是将细胞内的有毒物质和外源物如药物等通过胃肠道、胆汁或尿液排出体外, 发挥抵抗外来物质侵袭的作用。由于P-gp的外排作用可影响药物的血药浓度、生物利用度、组织分布和肝肾外排率等[5]。因此, 在联合用药过程中, 某些药物可作为P-gp的底物或抑制剂/诱导剂, 引起合用药物血药浓度的改变从而产生DDI。如利托那韦通过抑制P-gp, 使地高辛的药时曲线下面积(AUC)上升86%, 分布容积上升77%, 肾及肾外清除率分别下降48%及35%, 增加地高辛中毒的危险[6]。
以往研究报道, 川陈皮素的转运主要以浓度差为势能的被动扩散作用为主, P-gp蛋白外排作用参与很少[7], Nabekura等[8]研究发现, 在KB-C2细胞中川陈皮素可通过抑制P-gp的活性增加柔红霉素的胞内积聚, 但川陈皮素通过调控P-gp的活性在体内外的生物学效应并未阐明。本研究应用自建人源化P-gp高表达MDR1-MDCKⅡ细胞模型, 通过细胞双向转运实验研究发现川陈皮素具有较强的P-gp抑制作用, 并从细胞和整体动物水平探讨川陈皮素对P-gp调控的生物学效应, 应用分子对接模型进一步阐明抑制作用的分子机制, 为预测临床潜在的药物相互作用提供科学的实验依据。
材料与方法试剂与动物 地高辛、洋地黄毒苷、普萘洛尔、阿替洛尔、PSC833均购自Sigma公司。川陈皮素购自四川成都曼斯特生物科技有限公司。百草枯购自百灵威公司产品。维拉帕米购自中国食品药品检定研究院。MTT购自Amresco公司。DMEM高糖培养基、胎牛血清、0.25%胰蛋白酶-EDTA、青霉素、链霉素购自Invitrogen公司。细胞培养板、0.4 μm孔径聚碳酸酯膜细胞培养小室购自Millipore公司。甲醇和乙腈为色谱纯, 购自德国Merck公司, 其他试剂均为分析纯。主要仪器有Bio-Tek μQuant酶标仪, Termo Finigan LC-MS/MS液质联用分析仪。
清洁级Sprague-Dawley (SD)大鼠, 雄性, 200~220 g, 购自北京维通利华实验动物技术有限公司[合格证号: SCXK (京) 2016-0006], 于SPF级标准饲养, 自由饮水, 室温20~25 ℃, 湿度50%~60%, 光照12 h明暗交替, 换气次数为10~20次/小时, 鼠盒每周换洗2次, 所有换洗的笼具清洗后均采用高压灭菌。
细胞培养 MDR1-MDCKⅡ细胞为本实验室自建细胞模型, 培养于DMEM高糖培养基中(含10%胎牛血清、100 g·L-1青霉素和100 g·L-1链霉素), 37 ℃、5% CO2孵箱培养, 细胞生长对数期进行传代备用。
川陈皮素对P-gp转运活性的影响 MDR1-MDCKⅡ细胞以每平方厘米2×105个接种于孔径0.4 µm、直径12 mm的Transwell TM多聚碳酸酯膜上, 置37 ℃、5% CO2孵箱培养。用EVOM检测跨细胞电阻(transepithelial electric resistance, TEER)以监测细胞生长状态。待培养6~7天, 细胞TEER ≥ 120 Ω·cm2时, 方可用于细胞转运实验。所有转运实验均在37 ℃的摇床中进行(50 r·min-1)。实验前用37 ℃的HBSS溶液清洗细胞2次, 清除细胞表面的干扰物质, 并在37 ℃用含不同浓度川陈皮素(0.2、1、5、10、15、20和50 μmol·L-1)的HBSS预温孵30 min。实验时在供给室加入含不同浓度川陈皮素的地高辛(5 μmol·L-1)溶液孵育, 每隔30 min从接收室取样50 μL检测, 并用含不同浓度的川陈皮素的HBSS补足原体积, 孵育2 h。实验中同时设定高渗(10 μmol·L-1普萘洛尔)、低渗(50 μmol·L-1阿替洛尔)和阳性抑制剂(5 μmol·L-1 PSC833)组, 监测细胞膜的完整性、通透性和实验结果的可靠性。
化合物从A到B和从B到A的表观渗透系数(Papp)值计算公式为: Papp = (ΔQ/Δt)/ (A*C0), 其中, Q为累积转运量, 与转运时间t满足线性方程Q = at + b, 其斜率a = ΔQ/Δt, A为聚碳酯膜的面积, C0为初始浓度。
P-gp抑制率计算公式[9]: inhibition (%) = [1-(BAi-ABi)/ (BA-AB)] × 100, 其中, BA和AB分别是地高辛Papp(BL-AP)和Papp(AP-BL), BAi和ABi分别是在抑制剂条件下地高辛Papp(BL-AP)和Papp(AP-BL)。
川陈皮素对百草枯细胞毒性的影响 取对数生长期的MDR1-MDCKⅡ细胞, 0.25%胰蛋白酶消化并计数后, 以每平方厘米2×105个接种于96孔板, 细胞贴壁后, 弃去DMEM培养基, 设置空白对照组(不含血清的培养基)、百草枯组和百草枯+川陈皮素组, 其中百草枯浓度为10、50、100、500、750和1 000 μmol·L-1, 川陈皮素浓度根据大鼠体内血药浓度选择为10 μmol·L-1[10]。37 ℃、5% CO2孵箱培养24 h, 加入MTT溶液, 4 h后加入DMSO, 490 nm测定吸光度值。细胞存活率=吸光度值含药培养基/吸光度值空白培养基× 100%。
川陈皮素对地高辛大鼠体内药代动力学影响 雄性SD大鼠15只, 平均分为3组, 每组5只。实验前禁食12 h, 自由饮水。实验动物分别口服给予25 mg·kg-1川陈皮素[11] (0.5%羧甲基纤维素钠), 25 mg·kg-1维拉帕米[12] (生理盐水)或者同等体积的0.5%羧甲基纤维素钠。30 min后, 口服给予各组动物0.25 mg·kg-1地高辛。给药后5、15、30 min、1、2、3、4、6、8、12 h各时间点于眼眶静脉丛连续取血, 肝素抗凝离心后, 分离血浆备用。
川陈皮素与P-gp的分子对接 分子对接应用Discovery Studio 2016中的CDOCKER模式, P-gp结构数据来源于Protein Data Bank (PDB编号3G60[13, 14])。对接前对蛋白晶体结构进行预处理, 选择自带配体周围5 Å 之内的所有氨基酸作为P-gp活性位点。分别将地高辛、川陈皮素和维拉帕米作为配体分子, 赋予CHARMm立场后进行对接。对接时, 设置Top Hit为10, 在Pose Cluster Radius参数内输入值0.5, 其余参数为默认值, 与CDOCKER最低能量值对应的构象视为化合物和受体结合的最可能作用模式。
LC/MS-MS测定
标准曲线制备 取空白HBSS或空白血浆50 μL, 分别加入不同浓度地高辛(1、5、10、50、100、500和1 000 nmol·L-1)标准品各50 μL, 再加入内标洋地黄毒苷(100 ng·mL-1)的乙腈50 μL, 振荡混匀, 高速离心(14 000 r·min-1, 5 min)两次, 取上清5 μL进行LC/MS-MS分析。
样品处理 取细胞或血浆样品50 μL, 分别加入含内标洋地黄毒苷(50 ng·mL-1)的乙腈100 μL, 振荡混匀, 高速离心(14 000 r·min-1, 5 min)两次, 取上清5 μL进行LC/MS-MS分析。
色谱柱为Eclipse Plus C18 (3.5 μm, 2.1 mm × 50 mm, 美国Agilent公司), 流动相为甲醇/水(0.1%甲酸), 梯度洗脱; 流速为0.3 mL·min-1; 地高辛: m/z 825.3→779.4 CE: 26 eV); 洋地黄毒苷: m/z 809.4→ 763.4 (CE: 25 eV)。
结果 1 川陈皮素对P-gp转运活性的影响在MDR1-MDCKⅡ细胞地高辛双向转运实验中, 阳性药PSC833的抑制率为98%, 高渗、低渗对照药及阳性底物地高辛的结果与文献报道[15]基本一致, 提示细胞模型可靠。不同浓度的川陈皮素通过地高辛双向转运实验, 0.2 μmol·L-1时抑制率为11%, 随浓度逐渐增大, 抑制率升高, 50 μmol·L-1时抑制率为97%, 经Prism软件做图分析, IC50 = 2.21 μmol·L-1。川陈皮素对P-gp的剂量依赖性抑制作用结果如表 1。
| Table 1 Inhibition effects of nobiletin on P-gp in MDR1-MDCKⅡ |
百草枯是典型的P-gp转运体底物, 具有很强的细胞毒性, 因此P-gp活性的改变会影响百草枯对MDR1-MDCKⅡ的细胞毒性。与百草枯组相比, 同时给予川陈皮素后, 细胞存活率降低, 在百草枯500、750和1 000 μmol·L-1时最为显著, 分别从71%、37%和26%降低至57% (P < 0.05)、27%和13% (P < 0.01)。实验结果表明, 川陈皮素通过抑制MDR1-MDCKⅡ细胞表面的P-gp活性, 减少了细胞毒药物百草枯的外排, 从而使细胞毒性增大, 存活率降低(图 1)。
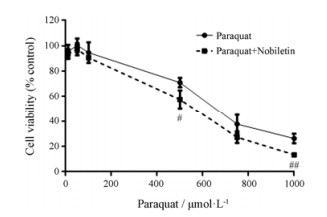
|
Figure 1 Paraquat concentration-response (cell viability) curves in the absence (paraquat) or in the presence of 10 μmol·L-1 nobiletin (paraquat + nobiletin). n = 3, x±s. #P < 0.05, ##P < 0.01 vs paraquat group |
大鼠体内地高辛血药浓度-时间曲线和药代动力学参数见图 2和表 2所示, 大鼠提前给予川陈皮素后, 地高辛的AUC0-t和Cmax与空白对照组相比, 分别增加2.02倍和3.29倍, Vd/F和CL/F分别减小43.1%和50%, t1/2无明显变化, 与阳性抑制剂维拉帕米结果相近, 以上结果提示, 川陈皮素和地高辛合用时, 可增加地高辛中毒的风险。
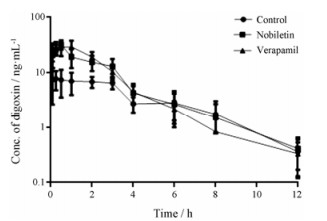
|
Figure 2 Plasma concentration-time curves in semilog scale of digoxin in control and herbal inhibitor-pretreated male SD rats. n = 3, x±s |
| Table 2 Pharmacokinetic parameters of digoxin in control and nobiletin-pretreated male SD rats. n = 5, x±s. *P < 0.05, **P < 0.01 vs control |
抑制剂川陈皮素和维拉帕米与P-gp对接后的空间构象与底物地高辛不同, 且结合的氨基酸种类和数量以及相互作用力存在差异, 地高辛与Tyr303、Ala981和Tyr110形成3个氢键, 与Phe974形成1个Pi-Sigma键。阳性抑制剂维拉帕米与Phe974和Phe728形成2个Pi-Pi键。川陈皮素与维拉帕米相似, 除了可与Phe974形成2个Pi-Pi键之外, 还可与Phe332形成2个Pi-Pi键。与地高辛相比, 维拉帕米和川陈皮素均无氢键形成。对接结果提示, P-gp的Phe974与小分子化合物形成较强的Pi-Pi键可能是产生抑制作用的重要因素。地高辛、川陈皮素、维拉帕米与P-gp的分子对接结果如图 3所示。

|
Figure 3 The three-dimensional diagrams (A) showed the binding conformation of digoxin (yellow), verapamil (blue) and nobiletin (red). Molecular docking (CDOCKER) of digoxin (B), verapamil (C) and nobiletin (D) to P-gp. The residue colors represent the types of interactions as follows: green (Van der Waals); purple (Pi interaction); green arrows (hydrogen bond) |
黄酮类化合物是植物经光合作用产生的一类低分子质量的化合物, 具有二苯基色元酮的基本结构, 在蔬菜、水果和中草药中均有分布, 具有广泛的药理活性, 如抗氧化、降血脂、调节心脑血管系统和清除自由基等[16]。近年来, 随着现代医学的发展, 黄酮类化合物由于广泛的药理活性引起了药物研究者的广泛关注, 它们与药物合用的现象越来越普遍, 这就大大增加了药物相互作用的可能性。
P-gp作为人体主要的外排转运体, 在参与药物吸收、转运和排泄的同时也有可能被中药某些有效成分抑制或诱导, 当与P-gp底物药物合用时存在DDI的可能性。以往研究报道黄酮类化合物如金丝桃素、山柰酚和槲皮素等可调节P-gp活性, 提高利托那韦和红霉素在Caco-2细胞中的摄取[17]。部分多甲氧基黄酮类化合物在Caco-2细胞中可降低他林洛尔的外排作用[18], 增加食物-药物相互作用发生的几率。黄酮类化合物对P-gp的调控不仅可影响到合用药物的吸收、转运和排泄的药代动力学特征, 在肿瘤治疗过程中还可影响到P-gp介导的肿瘤细胞的多药耐药。Ma等[19]研究发现在A2780/T和A549/T细胞中, 川陈皮素可通过抑制P-gp的活性提高化疗药物多柔比星、多西他赛等的敏感性; Wang等[20]研究发现川陈皮素与临床常用化疗药物紫杉醇、丝裂霉素等具有协同作用, 可有效抑制实验性肿瘤转移。
本研究首先在MDR1-MDCKⅡ细胞中鉴定出川陈皮素是P-gp的抑制剂(IC50为2.21 μmol·L-1), 然后从细胞和整体动物水平评价川陈皮素对P-gp调控的生物学效应, 研究结果表明川陈皮素可增加百草枯的细胞毒性, 使大鼠体内地高辛的血药浓度显著升高, 同时结合分子对接技术阐明川陈皮素与P-gp结构-抑制关系的分子机制, 以上研究结果将为川陈皮素的临床合理应用及预测临床潜在的药物相互作用提供科学的实验依据。
| [1] | Xiong Y, Chen D, Yu C, et al. Citrus nobiletin ameliorates experimental colitis by reducing inflammation and restoring impaired intestinal barrier function[J]. Mol Nutr Food Res, 2015, 59: 829–842. DOI:10.1002/mnfr.v59.5 |
| [2] | Yang S, Yu B, Zhang YF, et al. The activation effect of nobiletin on cystic fibrosis transmembrane conductance regulator chloride channel[J]. Acta Pharm Sin (药学学报), 2013, 48: 848–854. |
| [3] | Kimura Y, Ito H, Ohnishi R, et al. Inhibitory effects of polyphenols on human cytochrome P4503A4 and 2C9 activity[J]. Food Chem Toxicol, 2010, 48: 429–435. DOI:10.1016/j.fct.2009.10.041 |
| [4] | Thiebaut F, Tsuruo T, Hamada H, et al. Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues[J]. Proc Natl Acad Sci U S A, 1987, 84: 7735–7738. DOI:10.1073/pnas.84.21.7735 |
| [5] | Herfindal L, Myhren L, Kleppe R, et al. NostocyclopeptideM1:a potent, nontoxic inhibitor of the hepatocyte drug transporters OATP1B3 and 1B1[J]. Mol Pharm, 2011, 8: 360–367. DOI:10.1021/mp1002224 |
| [6] | Ding R, Tayrouz Y, Riedel KD, et al. Substantial pharmacokinetic interaction between digoxin and ritonavir in healthy volunteers[J]. Clin Pharmacol Ther, 2004, 76: 73–84. DOI:10.1016/j.clpt.2004.02.008 |
| [7] | Niu JL, Li L, Yuan CG, et al. The transport mechanism research of nobiletin in Caco-2 cells across membrane[J]. Chin Tradit Patent Med (中成药), 2011, 33: 1336–1339. |
| [8] | Nabekura T, Yamaki T, Kitagawa S. Effects of chemopreventive citrus phytochemicals on human P-glycoprotein and multidrug resistance protein 1[J]. Eur J Pharmacol, 2008, 600: 45–49. DOI:10.1016/j.ejphar.2008.10.025 |
| [9] | Balimane PV, Marino A, Chong S. P-gp inhibition potential in cell-based models:which "calculation" method is the most accurate?[J]. AAPS J, 2008, 10: 577–586. DOI:10.1208/s12248-008-9068-x |
| [10] | Yuan HQ. Pharmacokinetic Studies on the Nobiletin and Tangeretin of Citrus Reticulate 'Chachi' Peel Extracts (茶枝柑皮提取物中川陈皮素和桔皮素的药代动力学及肠吸收研究)[D]. Guangzhou: Guangdong Pharmaceutical University, 2014. http://cdmd.cnki.com.cn/article/cdmd-10573-1015007557.htm |
| [11] | Zhang L, Zhang XJ, Zhang C, et al. Nobiletin promotes antioxidant and anti-inflammatory responses and elicits protection against ischemic stroke in vivo[J]. Brain Res, 2016, 1636: 130–141. DOI:10.1016/j.brainres.2016.02.013 |
| [12] | Vavricka SR, Van Montfoort J, Ha HR, et al. Interactions of rifamycin SV and rifampicin with organic anion uptake systems of human liver[J]. Hepatology, 2002, 36: 164–172. |
| [13] | Hirano M, Maeda K, Shitara Y, et al. Drug-drug interaction between pitavastatin and various drugs via OATP1B1[J]. Drug Metab Dispos, 2006, 34: 1229–1236. DOI:10.1124/dmd.106.009290 |
| [14] | Seithel A, Eberl S, Singer K, et al. The influence of macrolide antibiotics on the uptake of organic nions and drugs mediated by OATP1B1 and OATP1B3[J]. Drug Metab Dispos, 2007, 35: 779–786. DOI:10.1124/dmd.106.014407 |
| [15] | Li X, Hu JP, Wang BL, et al. Inhibitory effects of herbal constituents on P-glycoprotein in vitro and in vivo:herb-drug interactions mediated via P-gp[J]. Toxicol Appl Pharmacol, 2014, 275: 163–175. DOI:10.1016/j.taap.2013.12.015 |
| [16] | Zhou X, Li HJ. Bioactivities and clinical applications of flavonoids[J]. Chin J New Drug (中国新药杂志), 2007, 16: 350–355. |
| [17] | Pal D, Mitra AK. MDR-and CYP3A4-mediated drug-herbal interactions[J]. Life Sci, 2006, 78: 2131–2145. DOI:10.1016/j.lfs.2005.12.010 |
| [18] | Mertens-Talcott SU, De Castro WV, Manthey JA, et al. Polymethoxylated flavones and other phenolic derivates from citrus in their inhibitory effects on P-glycoprotein-mediated transport of talinolol in Caco-2 cells[J]. J Agric Food Chem, 2007, 55: 2563–2568. DOI:10.1021/jf063138v |
| [19] | Ma WZ, Feng SL, Yao XJ, et al. Nobiletin enhances the efficacy of chemotherapeutic agents in ABCB1 overexpression cancer cells[J]. Sci Rep, 2015, 5: 18789–18804. |
| [20] | Wang GF, Wang XC, Xiao L, et al. Anti-tumor effects of citrus flavonoid nobiletin[J]. Chin Tradit Herbal Drugs (中草药), 2007, 38: 1694–1697. |
 2018, Vol. 53
2018, Vol. 53


