2. 哈尔滨商业大学, 生命科学与环境科学研究中心, 黑龙江 哈尔滨 150028
2. Center of Research and Development on Life Sciences and Environment Sciences, Harbin University of Commerce, Harbin 150028, China
信号转导与转录活化因子STAT3 (signal trans ducers and activators of transcription 3)是细胞内重要的信号转导分子, 在细胞存活、增殖及免疫细胞激活中起重要调节作用。在细胞内, STAT3可被多种激酶磷酸化后, 形成同源或与STAT家族其他成员形成异源二聚体, 进而从细胞质转入细胞核, 启动下游基因的转录。磷酸化STAT3的激酶包括JAK (janus kinase)激酶、Src (proto-oncogene tyrosine-protein kinase)激酶等[1]。STAT3可被多种细胞因子(如IL-6)和生长因子(如EGF)等活化。其中, IL-6/JAK/STAT3信号通路是最主要的信号通路, 该通路的异常活化不仅与多种肿瘤的发生发展密切相关, 也与自身免疫性疾病有关[2-5]。针对IL-6及其受体、JAK的抑制剂已获得上市批准用于自身免疫性疾病的治疗[6-11]。而已有研究表明, STAT3是潜在的药物治疗靶点[12, 13], 目前已有一些候选化合物进入临床研究[14-17]。因此, 开发靶向IL-6/JAK/STAT3信号通路的抑制剂, 对研发新型抗肿瘤药物和抗自身免疫性炎症药物具有重要的意义。
为了筛选新型的IL-6/JAK/STAT3信号通路抑制剂, 本研究利用了Invivogen公司的HEK-Blue IL-6细胞。HEK-Blue IL-6细胞不仅稳定表达IL-6受体, 而且还具有分泌型胚胎碱性磷酸酶(secrected embryonic alkaline phosphatase, SEAP)的报告基因, 该报告基因含有可与STAT3结合的位点。在IL-6的刺激下, 细胞质内磷酸化的STAT3形成二聚体转位进入细胞核, 结合到SEAP报告基因上启动转录, 最终产生可分泌到细胞外的SEAP, 其SEAP含量可通过与QUANTI-Blue反应在波长655 nm下检测。本研究利用HEK-Blue IL-6细胞, 优化了用于筛选IL-6/JAK/STAT3信号通路抑制剂的最佳条件, 并对14个天然产物进行了STAT3信号通路活性的筛选。
材料与方法细胞 HEK-Blue IL-6 Cells购自法国Invivogen公司。
试剂与药物 人IL-6重组蛋白、人IL-17A重组蛋白、人IL-6中和单抗(anti-hIL-6-IgG)、QUANTI-Blue和HEK-Blue Selection购自法国Invivogen公司; 人IL-17F和TNF-α重组蛋白购自美国PeproTech公司。和厚朴酚、槲皮素、木犀草苷、菊苣素、迷迭香酸、金丝桃苷、松果菊苷、木犀草素、洋蓟素、姜黄素、隐丹参酮、槲皮素苷和咖啡酸均购自上海阿拉丁生化科技股份有限公司。牛蒡子苷元由鲁南制药提供。
仪器 Biotek全波长酶标仪(美国)。
细胞培养 参照HEK-Blue IL-6细胞培养说明书, 细胞在含1×HEK-Blue Selection抗生素和10% FBS (56 ℃灭活30 min, 除去血清中的碱性磷酸酶)的DMEM培养基中贴壁生长, 待细胞密度达到70%~80%时进行传代。
细胞检测 待细胞密度达到80%时, 将贴壁生长的细胞轻轻拍下(勿用胰酶消化或将细胞吹打)后, 1 200 r·min-1离心5 min, 用37 ℃预热的完全培养基重悬并进行计数。采用无菌96孔细胞培养板, 每孔加入完全培养基或不同浓度的细胞因子20 μL, 之后加入细胞悬液(每孔最终细胞数为2.5×104或5×104个) 180 μL, 在37 ℃细胞培养箱孵育不同时间。从该96孔板中每孔吸取20 μL溶液平行转移至另一块96孔板, 加入37 ℃预热的QUANTI-Blue显色液180 μL, 在37 ℃孵育不同时间后, 于655 nm波长下进行检测。
化合物筛选 参照上述方法, 每孔加入IL-6细胞因子(终质量浓度1 ng·mL-1) 20 μL、不同浓度的IL-6中和性抗体或天然产物(0.1、0.25、0.5、1、2.5、5和10 μmol·L-1) 20 μL及细胞悬液(每孔最终细胞数为5×104个) 160 μL, 共200 μL体系。阴性对照组为40 μL完全培养基和160 μL细胞悬液; 阳性对照组为IL-6细胞因子(终质量浓度1 ng·mL-1) 20 μL、完全培养基20 μL和细胞悬液160 μL。在37 ℃细胞培养箱孵育20 h。从96孔板中每孔吸取20 μL溶液转移至另一块96孔板中, 加入37 ℃预热的QUANTI-Blue显色液180 μL, 在37 ℃孵育1 h后, 于655 nm波长下进行检测。
数据处理 所有实验均至少重复3次, 数据以平均值±标准差(x±s)表示, 由Excel进行数据处理, 并使用Graphpad Prism计算IC50和作图。抑制率(%) = [1-(ODtest-ODNC)/(ODPC-ODNC)]×100%。其中, test为待测化合物, NC为阴性对照组, PC为阳性对照组。
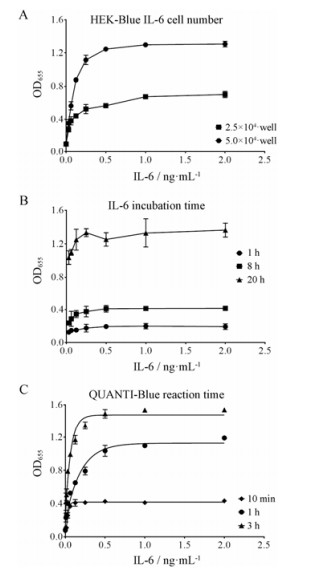
结果 1 模型的验证为了验证细胞的反应性和特异性, 首先检测了HEK-Blue IL-6细胞对人IL-6、TNF-α、IL-17A和IL-17F四种细胞因子的反应性。在这4种细胞因子处理细胞20 h后进行检测, 由图 1可见, IL-6可通过激活STAT3促使STAT3结合的SEAP报告基因转录, 产生SEAP, 而TNF-α、IL-17A和IL-17F在这株细胞上对STAT3的激活无明显影响。在此基础上, 从HEK-Blue IL-6细胞数量、IL-6作用时间及QUANTI-Blue反应时间3个方面进一步摸索了这株细胞的最佳反应条件。在96孔板每孔2.5×104和5×104个细胞的条件下, 使用IL-6作用细胞20 h, 随着IL-6浓度的增加, 5×104个细胞/孔的反应值明显优于2.5×104个细胞/孔的反应值, 且达到了理想检测范围(图 2A)。在固定细胞数为5×104个/孔的前提下, 给予IL-6作用细胞不同时间, 由图 2B可见, 随着IL-6作用时间的延长, 反应值不断增加, IL-6作用20 h的反应值明显优于1和8 h, 并且IL-6在1 ng·mL-1浓度下即可达到最大反应值。最后, 在固定细胞数为5×104个/孔和IL-6作用20 h的前提下, 又检测了显色液QUANTI-Blue的反应时间, 随着时间增加, 细胞的反应值也不断增加, 且QUANTI-Blue反应1 h后, 即可达到理想的检测范围(图 2C)。因此, 最终选择每孔5×104个细胞、1 ng·mL-1 IL-6处理20 h和QUANTI-Blue反应1 h作为该细胞模型的最佳反应条件。

|
Figure 1 The response of HEK-Blue IL-6 cells to different cytokines. 5×104 cells/well, cytokine incubation for 20 h, reaction time of QUANTI-Blue for 1 h |
|
Figure 2 Optimization of test conditions for HEK-Blue IL-6 cells. A: Cell number (IL-6 incubation for 20 h, reaction time of QUANTI-Blue for 1 h); B: IL-6 incubation time (5×104 cells/well, reaction time of QUANTI-Blue for 1 h); C: QUANTI-Blue reaction time (5×104 cells/well, IL-6 incubation for 20 h) |
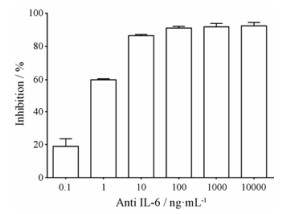
在确定细胞最佳反应条件的基础上, 为了验证该细胞是否可以用于筛选IL-6/JAK/STAT3信号通路的抑制剂, 本研究使用了IL-6的中和性抗体处理该细胞, 并在IL-6存在的前提下检测了STAT3的激活作用。由图 3可见, IL-6抗体可呈浓度依赖性地抑制STAT3的激活, IC50为0.91 ng·mL-1。以上结果表明, HEK-Blue IL-6细胞可用于IL-6/JAK/STAT3信号通路抑制剂的筛选。
|
Figure 3 Inhibitory activity of IL-6 antibody on STAT3 transcriptional activation |
在验证细胞模型后, 本研究对14个天然产物进行了筛选。由表 1可见, 牛蒡子苷元、姜黄素和隐丹参酮对STAT3的激活均有不同程度的抑制作用, IC50值分别为1.28 ± 0.28、2.96 ± 0.84和6.61 ± 0.59 μmol·L-1, 而在最高浓度为10 μmol·L-1时, 细胞未见明显的增殖抑制作用。结果表明, 牛蒡子苷元、姜黄素和隐丹参酮可抑制IL6/JAK/STAT3信号通路。
| Table 1 The inhibitory activity of nature products on STAT3 transcriptional activation |
IL-6/JAK/STAT3是细胞内调节细胞生长、存活和分化的重要信号通路, 这条信号通路也控制着T淋巴细胞的分化和激活。IL-6/JAK/STAT3信号通路的异常与自身免疫性疾病和肿瘤密切相关。在自身免疫性疾病中, 这条通路的激活导致其下游调控的细胞因子的大量释放, 而在许多实体肿瘤中, STAT3处于持续激活的状态, 导致了肿瘤细胞的不断增殖、侵袭转移, 甚至免疫逃逸[1-5]。阻断IL-6/JAK/STAT3信号通路也就成为治疗自身免疫性疾病和肿瘤的一个新策略。其中, IL-6及其受体IL-6R单抗药物已被批准用于类风湿性关节炎、葡萄膜炎的治疗[6, 10, 11], JAK的小分子抑制剂也已获得上市批准, 适应症包括类风湿性关节炎和骨髓纤维化等[8, 9]。作为这条信号通路中下游最重要的转录因子STAT3, 随着研究的不断深入和药物研发技术的提高, 也已被认为是一个潜在的药物治疗靶点。因此, 建立针对IL-6/JAK/STAT3信号通路的高通量筛选方法, 有助于发现结构新颖的小分子抑制剂。
本研究利用Invivogen公司的HEK-Blue IL-6细胞, 验证了该细胞模型可用于IL-6/JAK/STAT3信号通路抑制剂的筛选。目前, 在细胞水平针对这条信号通路筛选抑制剂最常用的方法是基于化学发光的STAT3报告基因方法[18]。相比于传统的化学发光报告基因方法, 该方法成本更低, 操作更简单。然而这类方法主要集中于针对阻断IL-6/JAK/STAT3整条信号通路的抑制剂, 尚不能定位到通路中的特定蛋白分子。因此, 为了进一步配合药物开发, 在该方法的基础上可结合针对JAK激酶筛选、IL-6及其受体IL-6R的配体受体结合实验、STAT3荧光偏振等方法[19], 确定化合物作用靶点。
利用该细胞筛选模型, 本研究初步筛选了14个天然产物单体, 其中牛蒡子苷元、隐丹参酮和姜黄素在10 μmol·L-1浓度下具有明显的抑制活性, 与文献报告的这些天然产物可抑制IL-6/JAK/STAT3信号通路是一致的[20-24]。已有文献报道和厚朴酚、斛皮素和木樨草素在肿瘤细胞上对STAT3磷酸化水平具有一定的抑制作用, 但有效抑制浓度大于40 μmol·L-1[25-27], 在HEK-Blue IL-6细胞模型中这些化合物在10 μmol·L-1浓度下未见明显抑制作用, 这可能与化合物浓度有关。此外, 未见文献报道木犀草苷、菊苣素、迷迭香酸、金丝桃苷、松果菊苷、洋蓟素、槲皮素苷和咖啡酸等化合物对IL-6/JAK/STAT3信号通路有抑制作用。由于牛蒡子苷元、隐丹参酮和姜黄素这些小分子化合物与IL-6抗体不同, 无法与IL-6蛋白直接结合, 因此仍需要结合JAK激酶筛选、IL-6及其受体IL-6R的配体受体结合实验、STAT3荧光偏振等方法寻找这些化合物在IL-6/JAK/STAT3信号通路中的直接作用蛋白分子。本课题组将应用该模型进一步筛选天然产物化合物库, 并结合其他检测方法, 寻找结构新颖的IL-6/JAK/STAT3信号通路抑制剂, 针对其抗肿瘤作用进行深入研究。
| [1] | Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity:a leading role for STAT3[J]. Nat Rev Cancer, 2009, 9: 798–809. DOI:10.1038/nrc2734 |
| [2] | Yu H, Kortylewski M, Pardoll D. Crosstalk between cancer and immune cells:role of STAT3 in the tumour microenvironment[J]. Nat Rev Immunol, 2007, 7: 41–51. DOI:10.1038/nri1995 |
| [3] | Neurath MF, Finotto S. IL-6 signaling in autoimmunity, chronic inflammation and inflammation-associated cancer[J]. Cytokine Growth Factor Rev, 2011, 22: 83–89. DOI:10.1016/j.cytogfr.2011.02.003 |
| [4] | Ataie-Kachoie P, Pourgholami MH, Morris DL. Inhibition of the IL-6 signaling pathway:a strategy to combat chronic inflammatory diseases and cancer[J]. Cytokine Growth Factor Rev, 2013, 24: 163–173. DOI:10.1016/j.cytogfr.2012.09.001 |
| [5] | Chen Y, Ji M, Chen XG. Research progress of relationship between STAT3 and tumor[J]. Acta Pharm Sin (药学学报), 2017, 52: 1351–1358. |
| [6] | Thompson CA. FDA approves tocilizumab to treat rheumatoid arthritis[J]. Am J Health Syst Pharm, 2010, 67: 254. |
| [7] | Mascarenhas J, Hoffman R. Ruxolitinib:the first FDA approved therapy for the treatment of myelofibrosis[J]. Clin Cancer Res, 2012, 18: 3008–3014. DOI:10.1158/1078-0432.CCR-11-3145 |
| [8] | Traynor K. FDA approves tofacitinib for rheumatoid arthritis[J]. Am J Health Syst Pharm, 2012, 69: 2120. |
| [9] | Raedler LA. Jakafi (Ruxolitinib):first FDA-approved medication for the treatment of patients with polycythemia vera[J]. Am Health Drug Benefits, 2015, 8: 75–79. |
| [10] | Pelechas E, Voulgari PV, Drosos AA. Sirukumab:a promising therapy for rheumatoid arthritis[J]. Expert Opin Biol Ther, 2017, 17: 755–763. DOI:10.1080/14712598.2017.1315099 |
| [11] | Scott LJ. Sarilumab:first global approval[J]. Drugs, 2017, 77: 705–712. DOI:10.1007/s40265-017-0724-2 |
| [12] | Kortylewski M, Yu H. STAT3 as a potential target for cancer immunotherapy[J]. J Immunother, 2007, 30: 131–139. DOI:10.1097/01.cji.0000211327.76266.65 |
| [13] | Klosek SK, Nakashiro K, Hara S, et al. STAT3 as a molecular target in RNA interference-based treatment of oral squamous cell carcinoma[J]. Oncol Rep, 2008, 20: 873–878. |
| [14] | Ogura M, Uchida T, Terui Y, et al. Phase Ⅰ study of OPB-51602, an oral inhibitor of signal transducer and activator of transcription 3, in patients with relapsed/refractory hematological malignancies[J]. Cancer Sci, 2015, 106: 896–901. DOI:10.1111/cas.2015.106.issue-7 |
| [15] | Wong AL, Soo RA, Tan DS, et al. Phase Ⅰ and biomarker study of OPB-51602, a novel signal transducer and activator of transcription (STAT) 3 inhibitor, in patients with refractory solid malignancies[J]. Ann Oncol, 2015, 26: 998–1005. DOI:10.1093/annonc/mdv026 |
| [16] | Hubbard JM, Grothey A. Napabucasin:an update on the first-in-class cancer stemness inhibitor[J]. Drugs, 2017, 77: 1091–1103. DOI:10.1007/s40265-017-0759-4 |
| [17] | Cafferkey C, Chau I. Novel STAT 3 inhibitors for treating gastric cancer[J]. Expert Opin Investig Drugs, 2016, 25: 1023–1031. DOI:10.1080/13543784.2016.1195807 |
| [18] | Page BD, Croucher DC, Li ZH, et al. Inhibiting aberrant signal transducer and activator of transcription protein activetion with tetrapodal, small molecule Src homology 2 domain binders:promising agents against multiple myeloma[J]. J Med Chem, 2013, 56: 7190–7200. DOI:10.1021/jm3017255 |
| [19] | Schust J, Berg T. A high-throughput fluorescence polarization assay for signal transducer and activator of transcription 3[J]. Anal Biochem, 2004, 330: 114–118. DOI:10.1016/j.ab.2004.03.024 |
| [20] | Bharti AC, Donato N, Aggarwal BB. Curcumin (diferuloylmethane) inhibits constitutive and IL-6-inducible STAT3 phosphorylation in human multiple myeloma cells[J]. J Immunol, 2003, 171: 3863–3871. DOI:10.4049/jimmunol.171.7.3863 |
| [21] | Yang JY, Zhong X, Yum HW, et al. Curcumin inhibits STAT3 signaling in the colon of dextran sulfate sodium-treated mice[J]. J Cancer Prev, 2013, 18: 186–191. DOI:10.15430/JCP.2013.18.2.186 |
| [22] | Li W, Saud SM, Young MR, et al. Cryptotanshinone, a STAT3 inhibitor, suppresses colorectal cancer proliferation and growth in vitro[J]. Mol Cell Biochem, 2015, 406: 63–73. DOI:10.1007/s11010-015-2424-0 |
| [23] | Chen Z, Zhu R, Zheng J, et al. Cryptotanshinone inhibits proliferation yet induces apoptosis by suppressing STAT3 signals in renal cell carcinoma[J]. Oncotarget, 2017, 8: 50023–50033. |
| [24] | Feng T, Cao W, Shen W, et al. Arctigenin inhibits STAT3 and exhibits anticancer potential in human triple-negative breast cancer therapy[J]. Oncotarget, 2017, 8: 329–344. |
| [25] | Michaud-Levesque J, Bousquet-Gagnon N, Beliveau R. Quercetin abrogates IL-6/STAT3 signaling and inhibits glioblastoma cell line growth and migration[J]. Exp Cell Res, 2012, 318: 925–935. DOI:10.1016/j.yexcr.2012.02.017 |
| [26] | Bi L, Yu Z, Wu J, et al. Honokiol inhibits constitutive and inducible STAT3 signaling via PU.1-induced SHP1 expression in acute myeloid leukemia cells[J]. Tohoku J Exp Med, 2015, 237: 163–172. DOI:10.1620/tjem.237.163 |
| [27] | Huang X, Dai S, Dai J, et al. Luteolin decreases invasiveness, deactivates STAT3 signaling, and reverses interleukin-6 induced epithelial-mesenchymal transition and matrix metalloproteinase secretion of pancreatic cancer cells[J]. Onco Targets Ther, 2015, 8: 2989–3001. |
 2018, Vol. 53
2018, Vol. 53


