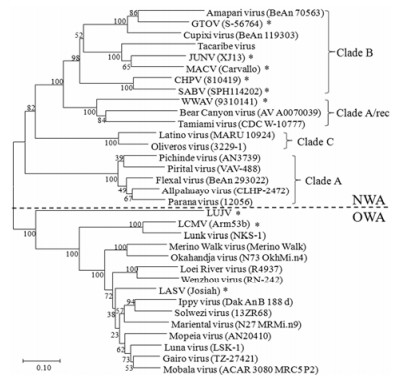
病毒性出血热是一类严重危害公共安全和人类健康的传染性疾病, 沙粒病毒科(Arenaviridae)哺乳类沙粒病毒属(Mammarenavirus)中有多种病毒可致人出血热。病毒学家根据沙粒病毒的地理分布和病毒血清学将其分为旧世界沙粒病毒(old world arenavirus, OWA)和新世界沙粒病毒(new world arenavirus, NWA) (图 1)。目前已知属于旧世界型的拉沙病毒(Lassa virus, LASV)和卢约病毒(Lujo virus, LUJV), 及新世界型的胡宁病毒(Junín virus, JUNV)、马丘波病毒(Machupo virus, MACV)、沙比亚病毒(Sabiá virus, SABV)、瓜纳瑞托病毒(Guanarito virus, GTOV)、查帕雷病毒(Chaparé virus, CHPV)和白水阿罗约病毒(Whitewater Arroyo virus, WWAV)可致人出血热[1-6], 他们被列为管制病原[7]。这类活病毒实验需要在生物安全四级(BSL-4)实验室进行。沙粒病毒感染后潜伏期一般为6~21天, 患者在感染早期多出现流感样症状, 在感染晚期会出现休克及多器官系统功能衰竭, 部分患者(10%~20%)可伴随神经系统病变。拉沙病毒是流行程度最广、危害性最大的沙粒病毒, 主要流行于西非, 每年感染者达10万~30万人, 死亡约5 000人[2]。新世界型病毒中致出血热的几种沙粒病毒主要流行于美洲, 死亡率约15%~30%[1]。
|
Figure 1 Phylogeny of mammarenavirus based on amino acid sequences of glycoprotein complex. The phylogenetic tree was constructed by neighbor-joining method with 1 000 bootstrap replications using MEGA 7.0 software; the bootstrap values are indicated at the nodes, and the scale bar indicates substitutions per site. Asteroids (*) denote lethal hemorrhagic fever viruses and lymphocytic choriomeningitis virus (LCMV). Virus strains and their Genebank accession numbers are: Allpahuayo virus (CLHP-2472, YP_001649221.1); Amapari virus (BeAn 70563, YP_001649208.1); Bear Canyon virus (AV A0070039, AAX99345.1); CHPV (810419, YP_001816782.1); Cupixi virus (BeAn 119303, YP_001649222.1); Flexal virus (BeAn 293022, YP_001936019.1); Gairo virus (TZ-27421, YP_009116790.1); GTOV (S-56764, AAT72103.1); Ippy virus (Dak An B 188 d, YP_516230.1); JUNV (XJ13, ACO52428.1); LASV (Josiah, NP_694870.1); Latino virus (MARU 10924, YP_001936021.1); LCMV (Arm53b, AAX49341.1); LUJV (ACR56359.1); Luna virus (LSK-1, YP_004933730.1); Lunk virus (NKS-1, YP_006858706.1); MACV-GP (Carvallo, NP_899212.1); Mariental virus (N27 MRMi.n9, YP_009141003.1); Merino Walk virus (Merino Walk, YP_009019200.1); Mobala virus (ACAR 3080 MRC5 P2, YP_ 516226.1); Mopeia virus (AN20410, YP_170709.1); Okahandja virus (N73 OkhMi.n4, YP_009141005.1); Oliveros virus (3229-1, YP_001649210.1); Parana virus (12056, YP_001936017.17; Pichinde virus (AN3739, YP_138543.1); Pirital virus (VAV-488, YP_025080.1); SABV (SPH114202, YP_089665.1); Solwezi virus (13ZR68, BAU22152.1); Tacaribe virus (NP_694849.1); Tamiami virus (CDC W-10777, YP_001911115.1); Wenzhou virus (RN-242, YP_009113206.1); WWAV (9310141, AAN09950.1) |
沙粒病毒出血热属被忽视的热带病, 目前仅有针对胡宁病毒的减毒活疫苗Candid#1, 注射该疫苗可显著降低胡宁出血热的发病率[8, 9]。虽然也有关于抗沙粒病毒药物研发的报道, 如融合抑制剂ST-294[10]、ST-193[11]、16G8、17C8[12], 以宿主蛋白酶SKI-1/S1P为靶点的小分子PF-429242[13], 及作用于病毒复制环节或作用于Z蛋白的小分子[14]等, 但这些小分子均在药物研发早期阶段。目前临床无抗沙粒病毒的特效治疗药物, 针对患者主要给予利巴韦林(ribavirin)[15]及对症治疗控制病情的发展。
由于活沙粒病毒毒株不易获得, 且实验需要在BSL-4实验室进行, 这些因素限制了抗沙粒病毒药物的研发。因此, 建立安全并可在普通实验室操作的体外病毒感染模型将有助于抗沙粒病毒药物的研发。
沙粒病毒基因组为双义编码RNA, 包括S和L两条链, L编码基质蛋白Z和病毒RNA聚合酶L; S编码包膜糖蛋白GP和核蛋白NP, 其中包膜糖蛋白GP是唯一负责病毒进入宿主的病毒蛋白[5]。沙粒病毒进入宿主是病毒感染的第一步, 阻断病毒的进入可有效抑制病毒感染。
本研究即用9种沙粒病毒的包膜蛋白GP包裹HIV核心构建重组病毒(arenavirus-GP/HIV-luc), 然后用所构建的9种重组病毒感染细胞, 建立高安全性的沙粒病毒体外感染模型, 并用工具药确认了所建立的模型可用于沙粒病毒进入抑制剂的活性评价。
材料与方法质粒 9个沙粒病毒GP基因(LASV-Josiah GP, Genbank NC_004296.1, 1 476 bp; LCMV-Arm53b GP, Genbank AY847350.1, 1 497 bp; LUJV GP, Genbank FJ952384.1, 1 365 bp; MACV-Carvallo GP, Genbank NC_005078.1, 1 491 bp; GTOV-S-56764 GP, Genbank AY572554.1, 1 440 bp; JUNV-XJ13 GP, Genbank FJ805378.1, 1 458 bp; SABV-SPH114202 GP, Genbank NC_006317.1, 1 467 bp; WWAV-9310141 GP, Genbank AF485264.1, 1 443 bp; CHPV-810419 GP, Genbank NC_010562.1, 1 455 bp)经密码子优化后委托北京义翘神州生物技术有限公司合成, 所合成的基因克隆至pCMV3载体; 携带荧光素酶报告基因的HIV-1质粒(pNL4-3.Luc.R-E-)从美国NIH获得。
细胞 人胚胎肾上皮细胞HEK293T、人肝癌细胞HepG2、人肺腺癌上皮细胞A549、人肺支气管癌细胞NCI-H1650、人神经母细胞瘤细胞SH-SY5Y、人脐静脉融合细胞Ea.hy926、人急性T淋巴细胞白血病细胞Jurkat、人组织细胞淋巴瘤细胞U937、非洲绿猴肾细胞VeroE6、叙利亚仓鼠肾细胞BHK-21、中国仓鼠卵巢细胞CHO、小鼠单核巨噬细胞白血病细胞RAW264.7、小鼠胚胎成纤维细胞MEF、小鼠结缔组织L细胞株929克隆L929、小鼠胚胎成纤维细胞NIH3T3、人小肠癌细胞HIC和蝙蝠肺细胞Tb 1 Lu购自国家实验细胞资源共享平台(China Infrastructure of Cell Line Resource), 所有细胞按照说明书进行培养和传代。
试剂 荧光素酶检测试剂盒购自Promega公司; jetPRIME®转染试剂购自Polyplus transfection公司; 兔抗HIV-1 p24多克隆抗体及HIV-1 p24 ELISA试剂盒购自北京义翘神州生物技术有限公司; 小鼠抗His-tag单克隆抗体、小鼠抗β-actin单克隆抗体、辣根酶标记山羊抗小鼠IgG和辣根酶标记山羊抗兔IgG购自北京中杉金桥生物技术公司; 蛋白预染分子量标准购自NEB公司; 依法韦仑(efavirenz)购自Sigma-Aldrich公司; ST-193购自MCE公司; 化合物F3406-2010及地昔帕明(desipramine)购自上海陶素生化科技有限公司。
重组病毒制备和病毒定量 转染前24 h, 将HEK293T细胞以4×106细胞数接种于10 cm培养皿中, 按照jetPRIME®转染试剂说明书将HIV-luc核心质粒(pNL4-3.Luc.R-E-)分别与各沙粒病毒GP质粒或模型对照VSV-G质粒共转染, 转染后48 h的上清液中含有重组病毒, 收集上清并经0.45 μm滤膜过滤, 获得9种重组沙粒病毒(LASV-GP/HIV-luc、LCMV- GP/HIV-luc、LUJV-GP/HIV-luc、MACV-GP/HIV-luc、GTOV-GP/HIV-luc、JUNV-GP/HIV-luc、SABV-GP/HIV-luc、WWAV-GP/HIV-luc、CHPV-GP/HIV-luc)和VSV- G/HIV-luc, 所获得的重组病毒用HIV-1 p24 ELISA试剂盒定量。
LASV-GP的检测 转染前24 h, 将HEK293T细胞以4×106细胞数接种于10 cm培养皿中, 按照jetPRIME®转染试剂说明书将HIV-luc核心质粒、VSV-G质粒和羧基端含6×His标签的LASV-GP质粒分别转染至293T细胞, 转染后48 h, 弃去上清, 消化收集细胞, 裂解细胞, 制备蛋白样品用于聚丙烯酰胺凝胶电泳。采用蛋白免疫印迹法检测HEK293T细胞中LASV-GP的表达(一抗:鼠抗His-tag单克隆抗体; 二抗:辣根酶标记山羊抗鼠IgG)。
重组病毒感染细胞 将被感染细胞按每孔2×104细胞数接种在48孔板中, 继续培养24 h后, 加入重组病毒液, 感染48 h后, 弃去上清, 裂解细胞, 用荧光素酶检测试剂盒测定细胞裂解液中的相对荧光素酶活性(relative luciferase units, RLUs), 即病毒感染程度。
阳性药物验证 将HEK293T细胞按每孔2×104个接种在48孔板中, 并继续培养24 h。感染前10 min将阳性药(ST-193、F3406-2010、地昔帕明、依法韦仑)加至细胞, 以等量DMSO作为溶剂对照, 再加入病毒(每孔0.2 ng HIV-1 p24)。48 h后, 弃去上清, 裂解细胞, 测定细胞裂解液中的相对荧光素酶活性, 以DMSO溶剂孔RLUs值为100%, 计算加药孔的感染率。
计算Z'因子 按照Z' = 1-[(3σc++3σc-)/|μc+-μc-|]公式[16]进行计算, 其中μc-和σc-分别表示阴性对照组(即DMSO溶剂组) RLUs的平均值和标准差; μc+和σc+分别表示阳性药对照组(即100 nmol·L-1 ST-193组) RLUs的平均值和标准差。
数据分析及统计方法 用GraphPad Prism软件分析实验数据, 以浓度-感染率作散点图并用非线性拟合得到相关线、相关系数及半数有效浓度(EC50)。
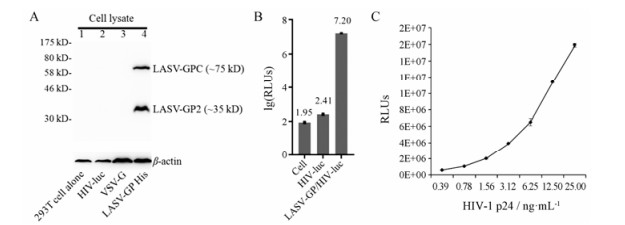
结果 1 重组拉沙病毒LASV-GP/HIV-luc感染模型的构建LASV-GP/HIV-luc是用LASV表面糖蛋白GP包裹HIV核心的重组病毒。LASV-GP是病毒负责进入宿主细胞的唯一元件, 以三聚体的形式镶嵌于病毒表面。LASV-GP首先以糖蛋白前体复合物(glycoprotein precursor complex, GPC)形式被合成, 然后由蛋白酶SKI-1/S1P (subtilisin kexin isozyme-1/site-1 protease)剪切为GP1和GP2亚基, 2个亚基以非共价键连接, 其中GP1负责识别并结合宿主细胞表面受体, GP2的主要功能是介导病毒与宿主溶酶体膜的融合过程。本研究检测了羧基端带6×His标签的LASV- GP质粒在真核细胞的表达, 结果显示GPC (分子质量75 kD)和GP2 (分子质量37 kD)正确表达(图 2A)。将LASV-GP与HIV核心质粒共转染, 收集含有LASV-GP/HIV-luc病毒颗粒的上清并感染细胞, 被感染细胞表达荧光素酶。结果显示, 被LASV-Josiah GP/ HIV-luc感染48 h后的HEK293T细胞中相对荧光素酶活性(RLUs)达到1×107, 信号值超过HIV-luc空白对照组10 000倍(图 2B), 且具有病毒量-信号值剂量依赖关系(图 2C)。
|
Figure 2 Establishment of LASV-GP/HIV-luc pseudovirions. A: Identification of LASV-GP expression. Lane 1: Blank, cell lysates of HEK293T cells alone; Lane 2, 3: Mock, cell lysates of HEK293T transfected with HIV-luc or VSV-G plasmid; Lane 4: Cell lysates of HEK293T transfected with LASV-GP-His plasmid. The plasmid, HIV-luc, VSV-G or LASV-GP-His, was transfected to HEK293T cells individually, 48 h post-transfection, cell lysates were collected and detected by Western blot. LASV-GP was detected by mouse anti-His monoclonal antibody, and the cellular β-actin expression was detected by mouse anti-β-actin monoclonal antibody. Bands indicate LASV-GPC (~75 kDa), LASV-GP2 (~37 kDa) and β-actin (43 kDa). B: Infectivity of LASV-GP/HIV-luc pseudovirions against HEK293T cells. The virions (15 ng p24/well) were incubated with HEK293T cells for 48 h, then the infected cells were lysed and tested for luciferase activity. C: The dose-signal curve of LASV-GP/HIV-luc infection. HEK293T cells were infected by indicated amount of LASV-GP/HIV-luc for 48 h, then the infected cells were lysed and tested for luciferase activity |
本研究针对所有8种致人出血热的沙粒病毒和致人病毒性脑膜炎的淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus, LCMV), 构建了9种重组病毒, 其中旧世界沙粒病毒3种: LCMV、LASV和LUJV; 新世界沙粒病毒6种: MACV、GTOV、JUNV、SABV、WWAV和CHPV。用所构建的重组沙粒病毒感染HEK293T细胞, 结果显示, 旧世界沙粒病毒LASV和LCMV的感染信号值高于对照组(HIV-luc) 10 000倍, 旧世界病毒LUJV和新世界病毒MACV、GTOV、JUNV、SABV、WWAV的感染信号值高于对照组1 000倍, 新世界病毒CHPV信号值高于对照组100倍(图 3)。本结果提示所构建的重组沙粒病毒可感染HEK293T细胞, 其中旧世界沙粒病毒LASV和LCMV的感染力强于LUJV及新世界病毒10~100倍。
|
Figure 3 Infectivities of arenavirus pseudovirions on HEK293T cells. HEK293T cells were infected with arenavirus-GP/ HIV-luc (12.5 ng HIV-1 p24/well). Cells were lysed and tested for luciferase activity 48 h post-infection |
囊膜病毒的外壳糖蛋白是介导病毒进入宿主细胞的唯一因子, 也是影响细胞对病毒易感性的重要因素。为了比较重组沙粒病毒的种属选择性和感染趋向性, 本课题研究了人、猴、鼠及蝙蝠的不同组织来源共17株细胞对9种重组沙粒病毒的易感性。结果显示, 17种细胞均可被模型对照VSV-G/HIV-luc感染, lg(RLUs) > 4.00, 说明17种细胞均支持病毒HIV核心的复制与表达; 本底对照(HIV-luc)在17种细胞中的信号值lg(RLUs) < 3.00, 说明缺失外壳糖蛋白的重组病毒无法进入宿主细胞启动HIV核心的复制与表达; 因此, 被感染细胞的相对荧光素酶活性(RLUs)可反映细胞对重组病毒的易感程度。本研究将细胞对沙粒病毒的易感程度以相对荧光素酶活性值进行分类: lg(RLUs)≥6.00为易感; 4.00≤lg(RLUs) < 6.00为可感; 3.00≤lg(RLUs) < 4.00为不易感, 据此绘制热度图(图 4)。

|
Figure 4 A heat map of arenavirus-GP/HIV-luc infectivity on 17 cell lines. Cells were infected with arenavirus-GP/HIV-luc, and cells were lysed and tested for luciferase activity 48 h post-infection |
通过分析结果发现: ①大多数人源细胞对旧世界沙粒病毒LASV和LCMV易感; 肺细胞(A549)对大多数新世界沙粒病毒易感; 人淋巴细胞(U937和Jurkat)对大多数沙粒病毒不易感。②仓鼠肾细胞(BHK-21)和小鼠胚胎成纤维细胞(MEF)对旧世界沙粒病毒LASV和LCMV易感, 其他啮齿动物细胞对LASV和LCMV不易感; 6种啮齿动物来源细胞对大多数新世界沙粒病毒均不易感。③蝙蝠是多种病毒的天然宿主, 本研究首次全面评价了蝙蝠肺细胞(Tb 1 Lu)对沙粒病毒的易感性, 结果显示, 蝙蝠细胞可被除JUNV和CHPV外的7种重组沙粒病毒感染, 提示蝙蝠有作为沙粒病毒宿主的可能性。
4 沙粒病毒进入抑制剂药效学评价模型的确认以囊膜病毒外壳糖蛋白包裹慢病毒核心的重组病毒可用于病毒进入抑制剂的发现, 该技术已应用于多种病毒[17-20]。本研究将所构建的重组病毒应用于沙粒病毒进入抑制剂活性评价, 评价模型用已知工具药进行验证。
4.1 LASV-GP/HIV-luc体外感染模型可用于化合物抗拉沙病毒活性筛选本研究以LASV-GP/HIV-luc为模型进行化合物筛选时, 以VSV-G/HIV-luc作为特异性对照, 当化合物仅抑制LASV-GP/HIV-luc, 而对VSV-G/HIV-luc无抑制作用时, 可认为化合物为特异性LASV进入抑制剂。
以LASV进入抑制剂ST-193为阳性对照药验证模型, 结果显示ST-193可抑制LASV-GP/HIV-luc感染, EC50为2.16 nmol·L-1, 与文献[11]报道一致, 而对VSV-G/HIV-luc的感染无抑制作用(图 5A)。而HIV逆转录酶抑制剂依法韦仑[21]对LASV-GP/HIV-luc和VSV-G/HIV-luc均可抑制, EC50为0.61和0.79 nmol·L-1 (图 5B)。

|
Figure 5 LASV-GP/HIV-luc pseudovirus infection model can be used for LASV entry inhibitors screening. Effect of ST-193 (A) or efavirenz (B) on LASV-GP/HIV-luc and VSV-G/HIV-luc infection. Compounds were added to 293T cells at indicated concentrations 10 min prior to infection. Cells were lysed 48 h post-infection, and the luciferase activity was measured. DMSO was used as a solution control and its infectivity was defined as 100%. C: Z' values calculated from the RLUs of ST-193 (100 nmol·L-1) and DMSO on LASV-GP/HIV-luc infection. Data represents the Z' values from 25 independent experiments |
Z'因子是评估药物筛选模型质量的重要参数, 其理想值为1。当Z'值大于0.5时, 通常认为该模型可用于高通量筛选。以ST-193 (终浓度100 nmol·L-1)为阳性对照组, 以等量DMSO为阴性对照组, 重复25次实验, 计算得到Z'因子为0.75 ± 0.11 (图 5C)。上述结果表明本研究所建立的LASV-GP/HIV-luc感染细胞模型精确度及稳定性好, 可用于LASV进入抑制剂的高通量筛选。
4.2 应用阳性药物验证8种重组沙粒病毒模型文献报道ST-193除可抑制LASV的进入外, 还对新世界沙粒病毒中的MACV、GTOV、JUNV、SABV有抑制活性[11]。本研究使用ST-193对所构建的新世界重组沙粒病毒模型进行验证(图 6A), 结果显示, ST-193对新世界沙粒病毒的进入有抑制作用, EC50 (MACV: 1.12 nmol·L-1, GTOV: 0.36 nmol·L-1, JUNV: 0.87 nmol·L-1, SABV: 9.81 nmol·L-1)与文献[11]报道一致, 此外本研究发现ST-193对新世界沙粒病毒WWAV和CHPV也有抑制活性, EC50分别为4.27和6.58 nmol·L-1。
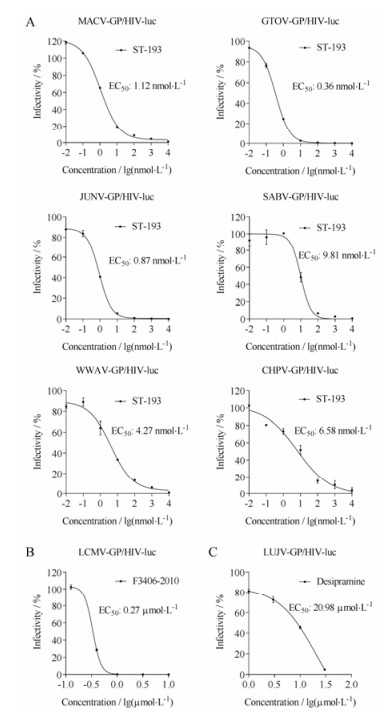
|
Figure 6 The arenavirus-GP/HIV-luc infection models were confirmed by tool compounds. A: Effect of ST-193 on six NW arenavirus-GP/HIV-luc infections. B: Effect of compound F3406-2010 on LCMV-GP/HIV-luc infection. C: Effect of desipramine on LUJV-GP/HIV-luc infection. Compounds were added to 293T cells at indicated concentrations 10 min prior to infection. Cells were lysed 48 h post-infection, and the luciferase activity was measured. DMSO was used as a solution control and its infectivity was defined as 100% |
使用LCMV特异性抑制剂F3406-2010对LCMV重组病毒模型进行验证, 其EC50 (0.27 μmol·L-1, 图 6B)与文献[22]报道一致; 使用已报道的LUJV抑制剂地昔帕明(desipramine)对LUJV病毒模型进行验证, 其EC50 (20.98 μmol·L-1, 图 6C)与文献[23]报道一致。
上述结果表明, 本研究所构建的所有9种重组沙粒病毒模型均可应用于沙粒病毒进入抑制剂的活性评价。
讨论啮齿类动物是沙粒病毒的天然宿主, 可携带并散播病毒, 但自身通常无病理表现。人接触携带病毒的鼠或其排泄物可被感染。沙粒病毒出血热患者早期临床症状包括发烧、不适、头痛、结膜炎、恶心、呕吐和腹泻等流感样症状; 感染晚期患者除发烧外, 还会有出血, 多器官功能衰竭和神经系统症状[1]。用致死量LASV感染恒河猴, 在猴血清、肝、肺、肾、胰腺、淋巴和脑脊液中均可检测到病毒[5]。沙粒病毒进入宿主细胞是病毒感染的第一步, 阻断此过程可有效抑制沙粒病毒感染, 寻找沙粒病毒进入抑制剂是抗沙粒病毒药物研发的重要途径。本研究应用重组病毒技术, 以沙粒病毒GP包裹HIV-luc核心组装获得重组病毒, 该病毒仅可单次感染宿主细胞, 特异性好、安全性高。应用重组病毒, 本研究针对人、猴、鼠及蝙蝠的不同组织来源细胞对沙粒病毒的易感性结果表明, 相较于天然宿主啮齿类动物细胞, 沙粒病毒对灵长类动物及人源细胞的感染性更强, 且组织趋向性更广, 这可能是沙粒病毒可致人疾病的原因之一。
蝙蝠是翼手目哺乳动物, 是多种病毒的天然宿主, 如SARS[24]、Ebola[25]等。而哺乳动物沙粒病毒属中大部分病毒是从啮齿类动物中分离得到的, 目前所报道的沙粒病毒中只有塔卡里伯病毒(Tacaribe virus, TCRV)是从蝙蝠中分离得到[1]。研究蝙蝠对沙粒病毒的易感性可有助于对沙粒病毒宿主趋向性和感染性的理解和预测。本研究首次报道了蝙蝠细胞对9种可致人疾病的沙粒病毒的易感性, 此结果不仅有助于对沙粒病毒致病性的理解, 而且对沙粒病毒的宿主选择性也提供了线索。
基于慢病毒的假病毒技术是研究囊膜病毒进入过程的经典方法[17-20], 除研究病毒趋向性和宿主选择性外, 国际大型制药公司已将此项技术用于囊膜病毒进入抑制剂的筛选[26]。虽然此技术也应用于拉沙病毒进入抑制剂的评价[11], 但是, 针对除拉沙病毒外的其他致病沙粒病毒假病毒感染模型研究较少, 而本研究构建了所有9种人致病沙粒病毒假病毒感染模型, 并明确了此假病毒体系可用于沙粒病毒进入抑制剂的评价, 本研究结果在国内属首次报道。基于慢病毒的沙粒病毒感染细胞模型具有高安全性和特异性, 在BSL-2实验室即可进行实验, 将此模型应用于沙粒病毒进入抑制剂的筛选, 将有助于沙粒病毒进入的广谱抑制剂的研发, 为抗沙粒病毒药物的研发提供技术平台。
| [1] | Sarute N, Ross SR. New world arenavirus biology[J]. Annu Rev Virol, 2017, 4: 141–158. DOI:10.1146/annurev-virology-101416-042001 |
| [2] | Coyle AL. Lassa fever[J]. Nursing, 2016, 46: 69–70. |
| [3] | Paweska JT, Sewlall NH, Ksiazek TG, et al. Nosocomial outbreak of novel arenavirus infection, southern Africa[J]. Emerg Infect Dis, 2009, 15: 1598–1602. DOI:10.3201/eid1510.090211 |
| [4] | Delgado S, Erickson BR, Agudo R, et al. Chapare virus, a newly discovered arenavirus isolated from a fatal hemorrhagic fever case in Bolivia[J]. PLoS Pathog, 2008, 4: e1000047. DOI:10.1371/journal.ppat.1000047 |
| [5] | Gunther S, Lenz O. Lassa virus[J]. Crit Rev Clin Lab Sci, 2004, 41: 339–390. DOI:10.1080/10408360490497456 |
| [6] | Centers for Disease C, Prevention. Fatal illnesses associated with a new world arenavirus-California, 1999-2000[J]. MMWR Morb Mortal Wkly Rep, 2000, 49: 709–711. |
| [7] | Dept, U.S. Health. Biosafety in Microbiological and Biomedical Laboratories[M]. 5th ed. USA: Centers for Disease Control and Prevention, National Institutes of Health, 2010: 246-265. |
| [8] | Enria DA, Briggiler AM, Sanchez Z. Treatment of Argentine hemorrhagic fever[J]. Antiviral Res, 2008, 78: 132–139. DOI:10.1016/j.antiviral.2007.10.010 |
| [9] | Aguilar PV, Camargo W, Vargas J, et al. Reemergence of Bolivian hemorrhagic fever, 2007-2008[J]. Emerg Infect Dis, 2009, 15: 1526–1528. DOI:10.3201/eid1509.090017 |
| [10] | Bolken TC, Laquerre S, Zhang Y, et al. Identification and characterization of potent small molecule inhibitor of hemorrhagic fever New World arenaviruses[J]. Antiviral Res, 2006, 69: 86–97. DOI:10.1016/j.antiviral.2005.10.008 |
| [11] | Larson RA, Dai D, Hosack VT, et al. Identification of a broad-spectrum arenavirus entry inhibitor[J]. J Virol, 2008, 82: 10768–10775. DOI:10.1128/JVI.00941-08 |
| [12] | Lee AM, Rojek JM, Spiropoulou CF, et al. Unique small molecule entry inhibitors of hemorrhagic fever arenaviruses[J]. J Biol Chem, 2008, 283: 18734–18742. DOI:10.1074/jbc.M802089200 |
| [13] | Hay BA, Abrams B, Zumbrunn AY, et al. Aminopyrrolidineamide inhibitors of site-1 protease[J]. Bioorg Med Chem Lett, 2007, 17: 4411–4414. DOI:10.1016/j.bmcl.2007.06.031 |
| [14] | Radoshitzky SR, Kuhn JH, de Kok-Mercado F, et al. Drug discovery technologies and strategies for Machupo virus and other New World arenaviruses[J]. Expert Opin Drug Discov, 2012, 7: 613–632. DOI:10.1517/17460441.2012.687719 |
| [15] | Charrel RN, Coutard B, Baronti C, et al. Arenaviruses and hantaviruses:from epidemiology and genomics to antivirals[J]. Antiviral Res, 2011, 90: 102–114. DOI:10.1016/j.antiviral.2011.02.009 |
| [16] | Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays[J]. J Biomol Screen, 1999, 4: 67–73. DOI:10.1177/108705719900400206 |
| [17] | Guo Y, Rumschlag-Booms E, Wang J, et al. Analysis of hemagglutinin-mediated entry tropism of H5N1 avian influenza[J]. Virol J, 2009, 6: 39. |
| [18] | Cao YL, Guo Y. Screening of HIV-1 replication inhibitors by using pseudotyped virus system[J]. Acta Pharm Sin (药学学报), 2008, 43: 253–258. |
| [19] | Zhang C, Cao YL, Zhong W, et al. Establishment of a cellbased 2009 H1N1 influenza neuraminidase inhibitors evaluation system[J]. Acta Pharm Sin (药学学报), 2010, 45: 383–387. |
| [20] | Chen Q, Tang K, Zhang X, et al. Establishment of pseudovirus infection mouse models for in vivo pharmacodynamics evaluation of filovirus entry inhibitors[J]. Acta Pharm Sin B, 2018, 8: 200–208. DOI:10.1016/j.apsb.2017.08.003 |
| [21] | Ford N, Mofenson L, Kranzer K, et al. Safety of efavirenz in first-trimester of pregnancy:a systematic review and metaanalysis of outcomes from observational cohorts[J]. AIDS, 2010, 24: 1461–1470. DOI:10.1097/QAD.0b013e32833a2a14 |
| [22] | Ngo N, Henthorn KS, Cisneros MI, et al. Identification and mechanism of action of a novel small-molecule inhibitor of arenavirus multiplication[J]. J Virol, 2015, 89: 10924–10933. DOI:10.1128/JVI.01587-15 |
| [23] | Tani H, Iha K, Shimojima M, et al. Analysis of Lujo virus cell entry using pseudotype vesicular stomatitis virus[J]. J Virol, 2014, 88: 7317–7330. DOI:10.1128/JVI.00512-14 |
| [24] | Li W, Shi Z, Yu M, et al. Bats are natural reservoirs of SARS-like coronaviruses[J]. Science, 2005, 310: 676–679. DOI:10.1126/science.1118391 |
| [25] | Leroy EM, Kumulungui B, Pourrut X, et al. Fruit bats as reservoirs of Ebola virus[J]. Nature, 2005, 438: 575–576. DOI:10.1038/438575a |
| [26] | Basu A, Li B, Mills DM, et al. Identification of a smallmolecule entry inhibitor for filoviruses[J]. J Virol, 2011, 85: 3106–3119. DOI:10.1128/JVI.01456-10 |
 2018, Vol. 53
2018, Vol. 53


