小檗碱(berberine), 又叫黄连素, 是从毛茛科植物黄连(Coptis chinensis French.)等的干燥根茎中提取分离的一种异喹啉生物碱, 几十年来, 一直作为非处方药物(OTC)在临床上治疗细菌引起的腹泻。2004年, 作者课题组首先发现小檗碱是一种不同于他汀的新机制降脂药[1]。之后, 国内外多个独立临床组的研究证实, 口服小檗碱可以治疗高脂血症[1]、2型糖尿病[2]和脂肪肝[3]等, 并且显示了非常可靠的安全性。之后, 多个研究证实小檗碱是一个通过多靶点机制治疗能量代谢紊乱性疾病的药物[4]。随之而产生的疑惑主要来自小檗碱的药代数据。
小檗碱的化学结构呈平面状, 是一种具有共轭双键的季铵生物碱, 刚性强。小檗碱的溶解性不好, 同时, 小檗碱是外排转运体P-gp的底物, 这些因素都可能导致小檗碱口服后很难被吸收, 在动物和人体内均显示了一个很低的生物利用度(远低于5%), 这种药代特性很难解释小檗碱在体内的显著疗效。相关研究指出, 小檗碱的I相代谢产物依然保持一定的生物学活性, 如增加了胰岛素受体(insulin receptor, InsR)和低密度脂蛋白受体(low-density-lipoprotein receptor, LDLR) mRNA的表达, 激活了一磷酸腺苷活化的蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK), 只是活性比小檗碱降低了30%~70%[5], 部分解释了小檗碱体内的药效, 但远没有达到令人满意的程度。考虑到绝大部分没有被吸收的小檗碱留在肠道与肠道菌相互作用, 这种作用产生哪些生物学效应, 成为研究兴趣的焦点。
实际上, 天然药物源自于结构类型多样的天然产物(如生物碱、黄酮、皂苷、多糖等), 普遍存在疗效确切而口服生物利用度低的特性。因此, 阐明其在体内的药效物质基础及分子机制是天然药物研究的关键科学问题之一。为此, 本文围绕小檗碱药代的特点, 尤其从肠道菌与小檗碱相互作用的新视角, 介绍小檗碱最近的研究进展, 可能为其本身和其他天然药物的深入研究提供参考。
1 口服小檗碱主要分布于肝脏而血药浓度低多年来, 学者们以不同种属动物模型及临床试验为基础, 从多种途径了解小檗碱的体内过程。结果表明, 无论大鼠[6-8]、Beagle犬[9, 10]、还是人类健康志愿者[11], 小檗碱经口服(或灌胃)后体内药代动力学特征基本相同, 即口服后约1~2 h达峰, 半衰期约为10~14 h, 口服生物利用度约为1%[7, 8]。血药浓度很低, Cmax在不同种属体内约为0.3~40 ng·mL-1[6-11], 没有明显蓄积。排泄动力学[12]的结果显示, 在大鼠的胆汁、尿、粪便中, 共检测出16个代谢产物(包括10个Ⅰ相和6个Ⅱ相代谢产物) (图 1), 粪便是小檗碱排泄的主要途径。临床试验的结果也显示健康志愿者口服小檗碱后的血药浓度很低, 吸收少[11]。Liu等[7]以4种不同的给药方式(灌胃, 十二指肠、门静脉和静脉注射)给予大鼠小檗碱, 用来研究其在小肠和肝脏的首过消除。结果显示, 采用灌胃方式给予大鼠小檗碱后, 大约有一半的小檗碱从胃肠道排除, 而另一半被小肠处置; 同时, 小檗碱在肝脏的分布量是其血中暴露量的70倍。这个工作表明, 肠道的首过消除和肝脏的趋向性分布, 可能是小檗碱在血中暴露量低的原因之一。有文献[13]表明, 肝脏中的有机阴离子转运体(OATP)和有机阳离子转运体(OCT)能共同转运小檗碱的肝脏摄取, 而且OATP影响小檗碱在肝脏中的分布。这可能是小檗碱肝脏暴露明显高于血浆的主要原因之一。作者课题组[8]也深入研究了小檗碱在SD大鼠的器官分布, 结果显示, 小檗碱(200 mg·kg-1, 口服)可以很快分布在主要器官, 如肝、肾、肌肉、肺、脑、心、胰脏和脂肪等, 在4 h时, 其在主要器官中的浓度远高于血中小檗碱的浓度。在肝和肾中被检测出活性代谢产物唐松草分定、小檗红碱、药根碱; 其中, 小檗红碱的含量占代谢产物总量的65.1%, 肝脏是小檗碱分布的主要器官, 按AUC计算, 肝中小檗碱或代谢产物分布的量分别是血中暴露量的10~30倍。因此, 器官趋向性分布的结果可能部分解释了小檗碱良好的临床疗效, 因为肝脏是能量代谢的主要器官, 所以, 小檗碱在肝脏的高分布特性对其发挥作用是有益的。

|
Figure 1 The structures of berberine and its major metabolites identified in vivo |
肠道菌群是人体最庞大而复杂的微生物群落, 其中寄生着多种多样、数目庞大的菌群。主要的4种菌群包括:革兰阴性拟杆菌门(Gram-negative Bacteroidetes)、变形菌门(Proteobacteria)、革兰阳性放线菌门(Gram-positive Actinobacteria)和厚壁菌门(Firmicutes)。在人体内, 肠道微生物由至少1×1014细菌(bacteria)和古生菌(archaea)组成, 由大约1 100个种属组成(而每个人大约有其中的100个种属, 因人而异), 包括97%厌氧菌和3%需氧菌[14]。近年来, 肠道菌群作为人体的“隐形器官”被广泛关注。最新研究报道, 肠道菌与某些疾病的发生密切相关, 如肥胖、糖尿病、心脏病等[15-18]。对口服化学药物的代谢或转化来说, 肠道菌仍然是一个未知领域, 其中生化酶的种类和数量可能多于人体其他器官, 由此代谢后产生的产物或降解碎片, 可能与肝脏等人体器官不同, 因此, 研究肠道微生物对化学药物的代谢或转化具有重要意义。
近年来, 作者课题组把药代的研究重点转移至肠道菌群与小檗碱的相互作用上。研究表明, 肠道菌的生物转化作用调控着小檗碱在体内的吸收[19], 小檗碱口服后主要在肠道与肠道菌群发生相互作用。研究首先发现肠道菌中的硝基还原酶(nitroreductase, NR)是正向调控小檗碱肠道吸收的重要生物因素[19]。细菌中NR是催化含氮化合物发生还原反应的一类生化酶[20], 对于细菌来说这是一种脱毒的生化过程, 目的是保护细菌少受外来化学物质伤害。本课题组研究发现, NR可将肠道的小檗碱转化成容易吸收的形式——二氢小檗碱, 二氢小檗碱在肠道的吸收是小檗碱的5~10倍。小檗碱转化成二氢小檗碱是由NR催化的还原反应, 这与文献[20]报道的肠道菌产生还原和水解反应相一致。二氢小檗碱是首次在大鼠或人体内发现的小檗碱代谢产物, 也是由肠道菌转化产生的特征性代谢产物。在口服小檗碱(200 mg·kg-1)的大鼠粪便中检测到18.21%的二氢小檗碱, 而连续口服抗生素后的伪无菌大鼠口服小檗碱, 其粪便中仅检测到6.09%二氢小檗碱, 进一步证明了二氢小檗碱是小檗碱经过肠道菌转化的代谢产物。当二氢小檗碱被小肠上皮细胞吸收进入肠壁后, 在肠壁组织大量氧化因子(如单胺氧化酶、超氧阴离子、金属离子等)作用下发生非酶促反应, 使二氢小檗碱很快氧化转化回小檗碱, 并进入血液发挥药效。因此, 肠道菌转化的代谢产物二氢小檗碱可能是小檗碱在肠道吸收的主要分子结构形式[19], 也是小檗碱药代研究的重要进展。
3 肠道菌NR酶介导了小檗碱对高脂血症患者的个性化治疗如上所述, 肠道菌的NR酶可以将小檗碱转化为二氢小檗碱, 而二氢小檗碱的化学性质不稳定, 当二氢小檗碱通过小肠壁时被快速氧化而转化为小檗碱原型结构进入血液发挥作用[19]。所以, 理论上说不同人群肠道内NR酶表达水平的不同就可能会影响小檗碱对高脂血症的个性化治疗。
作者课题组首先经过KK-Ay糖尿病小鼠的实验获得了验证。当口服小檗碱的KK-Ay小鼠与预先口服抗生素的KK-Ay小鼠相比, 后者肠道菌的数量减少了接近80%, 所以抗生素组小鼠再口服小檗碱时, 小檗碱向二氢小檗碱的转化减少, 血中小檗碱的浓度显著降低; 相应地, 小檗碱调节血脂和降低血糖的疗效也被削弱, 具体的说, 降血糖的疗效由于口服抗生素而被降低了42%, 降甘油三酯和总胆固醇的疗效也分别降低了53%和44%[19]。
Alolga等[21]在比较非洲和中国志愿者的肠道菌和小檗碱的代谢时, 发现了小檗碱在非洲人体内Cmax和AUC分别是中国人的2.67倍和2.0倍, 血药浓度呈现显著差异。通过比较肠道菌的组成, 发现中国人肠道菌中Prevotella、Bacteroides和Megamonas三个菌属比非洲人高, 他们推测, 小檗碱在非洲人和中国人体内代谢的显著差异, 可能与两者肠道菌的组成有联系, 推测与服用食物种类的差别有关。作者课题组的研究结果似有助于解释Alolgo的发现, 即非洲人与中国人肠道菌中NR活性表达水平的不同, 可能是造成小檗碱在不同人群体内生物利用度差异的原因之一。
为了深入探索肠道菌与小檗碱吸收代谢的因素, 作者课题组采用高脂饮食(HFD)喂养金黄地鼠, 诱导其体内血脂升高, 结果发现肠道的NR同时也被上调, 并通过研究证明高脂金黄地鼠肠道菌中NR的上调是由于菌群中NR产生菌丰度的增加及细菌中NR表达的升高所造成的。灌胃给予小檗碱后发现, 高脂金黄地鼠对小檗碱的生物利用度比正常金黄地鼠显著增高, 从而使血脂明显下降; 与之相比, 小檗碱几乎没有引起正常金黄地鼠血脂的改变。为了进一步确证这个结果, 作者课题组开展了临床试验, 结果证明, 高脂血症患者粪便中NR活性显著高于健康人, 其血中小檗碱浓度也显著高于健康人的浓度, 而小檗碱血药浓度与其粪菌中NR活性呈现正相关。因此, 粪便中NR的活性可能是一个生物标志物, 用于小檗碱对于高脂血症患者的个性化治疗[22] (图 2)。以上的研究首次揭示肠道菌NR调控了小檗碱在肠道的吸收机制。NRs在高脂患者肠道菌中表达上调, 部分解释了为什么小檗碱不会对健康人的血糖和血脂产生明显下调作用、而仅对高脂血症患者产生显著疗效的现象。这个研究的结果可以为用小檗碱对临床高脂血症患者进行个性化治疗提供依据。
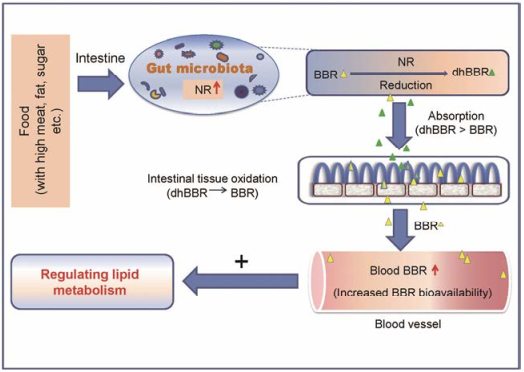
|
Figure 2 Gut microbiota-mediated personalized treatment of hyperlipidemia using berberine |
药物疗效和不良反应的轻重可能受到药物靶点变异的影响, 如丙肝感染[23]、癌症[24, 25]、血液凝结[26-28]等; 也可能与药物代谢酶有关, CYP450亚型在不同人种与个体上的差异可能导致药物降解率的不同, 成为药物个性化治疗的一个因素[29, 30]。作者课题组对小檗碱进行了研究, 并首次报道了肠道菌中的酶可作为预测药物生物利用度和疗效的生物标志物, 为临床开展口服药物的精准治疗提供了参考。
4 小檗碱诱导肠道菌合成短链脂肪酸(SCFA)是其降脂降糖的新机制由于小檗碱口服后大部分留在肠道内, 其对肠道菌的生物学刺激可能影响了不同类型次生代谢产物的生物合成。这些内源性物质水平的增加或减少, 也可能是小檗碱具有的多种生物学效应的物质基础。所以, 研究小檗碱对肠道菌代谢产物的影响、药效作用及机制成为作者关注的研究内容。
多项研究已经证明, 小檗碱在临床上是通过多靶点作用机制调节血脂和降低血糖的[31-38]。Han等[39]在2011年就首先提出, 肠道菌可能是小檗碱治疗糖尿病的机制之一的假说。
根据文献资料, 作者推测小檗碱的调节血脂和降低血糖的机制可能与肠道菌产生的短链脂肪酸(如丁酸)有关。短链脂肪酸是人体内由肠道菌与纤维食物通过发酵而合成的小分子化合物, 能够快速地被肠道吸收进入血液并分布于组织和器官[40, 41]。通常, 短链脂肪酸一般是由1~6个碳组成, 以直链或支链形式存在[42]。短链脂肪酸对机体的活性报道很多, 包括增加能量代谢、抗炎、免疫调节等[14, 43, 44], 主要的短链脂肪酸包括乙酸、丙酸、丁酸。作者的研究结果显示, 大鼠口服小檗碱后可以促进肠道菌产生短链脂肪酸(如丁酸), 被吸收入血后发挥降低血脂和血糖的作用。体外单一肠道细菌与小檗碱共温孵后, 也增加该菌丁酸的产生。实际上, OB/OB肥胖鼠直接口服丁酸(丁酸钠)就降低了血脂和血糖, 但是通过不同的作用机制。OB/OB鼠腹腔注射给予小檗碱的结果表明, 这种给药方式没有引起OB/OB鼠体内丁酸水平的增加, 但降低了血脂和血糖, 可见小檗碱经口服给药后在体内可能有两种作用机制, 即小檗碱进入血液循环后的直接作用, 以及小檗碱通过刺激肠道菌产生丁酸等的间接作用。预先口服抗生素的OB/OB鼠采用口服小檗碱治疗, 其降血脂和降血糖的疗效被削弱, 再次说明肠道菌对小檗碱药效的重要性。机制的研究结果表明, 口服小檗碱可以通过增加丁酸产生菌的丰度而改善了肠道菌群的组成。此外, 小檗碱也降低肠道菌ATP的产生和NADH水平, 并引起丁酰辅酶A表达的升高, 最终通过上调肠道菌中磷酸丁酰化酶转移酶/丁酸激酶(phosphotransbu tyrylase, PTB; butyrate kinase, BK)及丁酰辅酶A:乙酰辅酶A转移酶(butyryl-CoA: acetate-CoA transferase, BUT)而产生丁酸。因此, 促进肠道菌中短链脂肪酸(如丁酸)的产生可能是小檗碱调节能量代谢的重要机制之一[45]。
此外, 二甲双胍和小檗碱都是临床上治疗2型糖尿病的有效药物, 效果相当, 机制上有多个类似的地方, 如均可激活AMPK, 均为mTOR的抑制剂等。赵立平课题组[46, 47]比较了小檗碱和二甲双胍对肠道菌的影响, 发现其机制可能都与优化肠道菌组成有关。实际上, 这两个药物改变HFD喂养的大鼠肠道菌结构的结果很相似。如, 134 OUTs中有60个OUTs经二甲双胍或小檗碱治疗后, 数量都减少, 而属于SCFA产生者的菌, 如Allobaculum、Bacteroides、Blautia、Butyricoccus和Phascolarctobacterium, 经小檗碱或二甲双胍治疗后都显著增多; 但是, 小檗碱增多这些菌的程度似比二甲双胍更大一些, 即小檗碱增加益生菌的效应比二甲双胍更明显。总之, 他们的研究提示小檗碱和二甲双胍都可以通过相似的模式调节肠道菌的结构, 包括增加SCFA-产生菌的丰度和优化肠道菌的组成, 从而发挥对宿主的药物疗效。
5 肠道胆酸的作用Gu等[48]利用代谢组学和药代动力学方法, 研究了小檗碱口服后的降血脂作用和机制。他们对口服小檗碱后的血浆和肠道内容物进行了研究。结果显示小檗碱可以明显地调控参与脂质代谢的分子并促进高脂血症大鼠胆酸的产生。宏基因组分析揭示了口服小檗碱可以调控肠道菌群, 并可显著抑制胆酸的7α-脱羟基作用, 减少其向脱氧胆酸的转化, 减缓肠道胆酸的消除。结果提示, 口服小檗碱后降低胆固醇的机制可能包括了调节胆酸的逆转和farnesoid X受体(FXR)的信号通路。最近, Sun等[49]的研究进一步证明了口服小檗碱是通过改变肠道菌的胆汁酸代谢和肠道FXR信号通路而调节肝脏脂质代谢。此外, 口服不同剂量小檗碱也影响了小鼠体内胆汁酸代谢和肠道菌群[50], 以及高脂血症大鼠肠道菌的分布[51], 进一步确认肠道菌与小檗碱的药效密切相关。
最近还有报道显示, 小檗碱治疗糖尿病也可能是通过调控肠道菌减少其产生的内毒素并提高肠道多肽的水平来实现的[52]; 也可通过调控肠道菌, 改善高脂饮食诱导的非酒精性脂肪肝[53]。总之, 使肠道菌群正常化可能是小檗碱治疗代谢性疾病的基础之一。
6 思考与展望药物在体内的代谢研究一直是药学领域及新药开发中的重要环节, 而药物口服后吸收好、生物利用度高, 是目前评价药物成药性的国际通行的指标。但小檗碱肠道吸收很少, 对其药代的特点的研究结果引发了对现有的药代动力学理论和实际意义新的思考。
首先, 按照常规药物评价方法, 小檗碱口服后如此低的血药浓度, 将可能被视为“先天不足”而止步于研发。事实上, 自2004年首次发现小檗碱是具有与他汀不同机制的降血脂新药后, 国内外数十家临床机构纷纷独立地开展临床试验, 积累的大量临床结果证实小檗碱疗效肯定、安全性好。由此, 小檗碱口服用药后药效好而血药浓度低的特性引发了对现有的药物生物利用度的概念的重新探究:以药物分子本身作为生物利用度判断的唯一指标是否完整。实际上, 小檗碱在肠道吸收难的特性, 有益于刺激肠道菌产生活性代谢产物, 如SCFA等。这些“体内的”内源性代谢产物大多数不仅生物活性温和, 而且安全性好, 被人体吸收入血后成为小檗碱间接发挥药效的物质基础。这项研究的发现为目前单纯评价原形药物的生物利用度理论提供了一个重要的补充。对于像小檗碱这一类型的天然药物来说, 其PK-PD的研究, 应基于药物与肠道菌的相互作用, 将血中暴露的原形药物以及药物刺激细菌产生的内源性代谢产物(如丁酸等)作为一个整体, 来考虑完整的药物在体内的代谢动力学以及药效作用机制。更值得注意的是, 这类机制的药物由于原形药物入血量低, 对内脏(如心肝肾)的不良反应也会大大减少, 可能是未来治疗慢病药物的发展方向。
此外, 人体不同状态时(如肥胖与健康), 或日常食物不同, 肠道菌NR酶的量具有显著差异; 因此, 肠道菌NR酶对小檗碱转化吸收过程控制作用的研究结果, 第一次能够在肠道菌生化酶的基础上观察到多靶点的化学药物实现个性化治疗的分子机制, 也在临床上解释了(至少部分地)为什么小檗碱主要对高血脂患者有效, 而对血脂正常的人无明显降脂作用。这是肠道菌及相关生化酶以参与药物化学结构转化的方式介入个性化治疗的首个证例, 为其他类似的研究提供了重要参考。同时, 用正常人群来研究口服药物肠吸收, 得出该药物的生物利用度时, 应该考虑来自这种人群的数据可能具有的局限性。
口服化学药物与肠道菌相互作用及药理学意义的研究还刚刚起步。小檗碱的研究显示, 这种看似矛盾的药代-药效特性隐含着重要的科学意义, 有待去发掘并发现真理。实际上, 我国多个天然药物可能具有药效明显但口服血药浓度低(ng·mL-1级)的特点, 比如人参皂苷、甘草酸、糖类等[54-59]。这些天然药物的口服生物利用度均很低, 难以解释其临床的药效。所以, 如何建立完善的药代理论和技术体系去评价这类药物的药代和药效, 并阐明口服后其在体内的药效物质基础及分子机制, 是一个具有中国特色的药学问题, 值得更加关注。由小檗碱的药代研究引发的思考和实践, 已经先行进入了基于肠道菌的药学新领域, 可能对一些天然药物的研究产生重要影响。
| [1] | Kong W, Wei J, Abidi P, et al. Berberine is a novel cholesterollowering drug working through a unique mechanism distinct from statins[J]. Nat Med, 2004, 10: 1344–1351. DOI:10.1038/nm1135 |
| [2] | Ko BS, Choi SB, Park SK, et al. Insulin sensitizing and insulinotropic action of berberine from Cortidis Rhizoma[J]. Biol Pharm Bull, 2005, 28: 1431–1437. DOI:10.1248/bpb.28.1431 |
| [3] | Yan HM, Xia MF, Wang Y, et al. Efficacy of berberine in patients with non-alcoholic fatty liver disease[J]. PLoS One, 2015, 10: e0134172.. DOI:10.1371/journal.pone.0134172 |
| [4] | Yao J, Kong W, Jiang J. Learning from berberine:treating chronic diseases through multiple targets[J]. Sci China Life Sci, 2015, 58: 854–859. DOI:10.1007/s11427-013-4568-z |
| [5] | Li Y, Ren G, Wang YX, et al. Bioactivities of berberine metabolites after transformation through CYP450 isoenzymes[J]. J Transl Med, 2011, 9: 62. DOI:10.1186/1479-5876-9-62 |
| [6] | Zuo F, Nakamura N, Akao T, et al. Pharmacokinetics of berberine and its main metabolites in conventional and pseudo germfree rats determined by liquid chromatography/ion trap mass spectrometry[J]. Drug Metab Dispos, 2006, 34: 2064–2072. DOI:10.1124/dmd.106.011361 |
| [7] | Liu YT, Hao HP, Xie HG, et al. Extensive intestinal first-pass elimination and predominant hepatic distribution of berberine explain its low plasma levels in rats[J]. Drug Metab Dispos, 2010, 38: 1779–1784. DOI:10.1124/dmd.110.033936 |
| [8] | Tan XS, Ma JY, Feng R, et al. Tissue distribution of berberine and its metabolites after oral administration in rats[J]. PLoS One, 2013, 8: e77969. DOI:10.1371/journal.pone.0077969 |
| [9] | Chen W, Meng LK, Fan DJ, et al. Pharmacokinetics of berberine chloride after a single and multiple oral dose in Beagle dogs[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2011, 28: 512–516. |
| [10] | Feng R, Ma SR, Zhao ZX, et al. Gut microbiota-regulated pharmacokinetics of berberine and active metabolites in Beagle dogs after oral administration[J]. Front Pharmacol, 2018, 9: 214. DOI:10.3389/fphar.2018.00214 |
| [11] | Hua W, Ding L, Chen Y, et al. Determination of berberine in human plasma by liquid chromatography-electrospray ionization-mass spectrometry[J]. J Pharm Biomed Anal, 2007, 44: 931–937. DOI:10.1016/j.jpba.2007.03.022 |
| [12] | Ma JY, Feng R, Tan XS, et al. Excretion of berberine and its metabolites in oral administration in rats[J]. J Pharm Sci, 2013, 102: 4181–4192. |
| [13] | Chen C. The Mechanism Research of Organic AnionTransporting Polypeptides in the Hepatic Uptake of Berberine (有机阴离子转运多肽(OATP)在小檗碱肝脏摄取中的机制研究)[D]. Zhenjiang: Jiangsu University, 2015. |
| [14] | Tilg H, Kaser A. Gut microbiome, obesity, and metabolic dysfunction[J]. J Clin Investig, 2011, 121: 2126–2132. DOI:10.1172/JCI58109 |
| [15] | Zhang C, Li S, Yang L, et al. Structural modulation of gut microbiota in life-long calorie-restricted mice[J]. Nat Commun, 2013, 4: 2163. DOI:10.1038/ncomms3163 |
| [16] | Vadder FD, Petia KD, Goncalves D, et al. Microbiotagenerated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell, 2014, 156: 84–96. DOI:10.1016/j.cell.2013.12.016 |
| [17] | Schulz MD, Atay CD, Heringer J, et al. High-fat-diet-mediated dysbiosis promotes intestinal carcinogenesis independently of obesity[J]. Nature, 2014, 514: 508–512. DOI:10.1038/nature13398 |
| [18] | Tang WH, Wang Z, Levison BS, et al. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk[J]. N Engl J Med, 2013, 368: 1575–1584. DOI:10.1056/NEJMoa1109400 |
| [19] | Feng R, Shou JW, Zhao ZX, et al. Transforming berberine into its intestine-absorbable form by the gut microbiota[J]. Sci Rep, 2015, 5: 12155. DOI:10.1038/srep12155 |
| [20] | Roldán MD, Pérez-Reinado E, Castillo F, et al. Reduction of polynitroaromatic compounds:the bacterial nitroreductases[J]. FEMS Microbiol Rev, 2008, 32: 474–500. DOI:10.1111/j.1574-6976.2008.00107.x |
| [21] | Alolga RN, Fan Y, Chen Z, et al. Significant pharmacokinetic differences of berberine are attributable to variations in gut microbiota between Africans and Chinese[J]. Sci Rep, 2016, 6: 27671. DOI:10.1038/srep27671 |
| [22] | Wang Y, Tong Q, Shou JW, et al. Gut microbiota-mediated personalized treatment of hyperlipidemia using berberine[J]. Theranostics, 2017, 7: 2443–2451. DOI:10.7150/thno.18290 |
| [23] | Eslam M, George J. Genome-wide association studies and hepatitis C:harvesting the benefits of the genomic revolution[J]. Semin Liver Dis, 2015, 35: 402–420. DOI:10.1055/s-00000069 |
| [24] | Swanton C, Govindan R. Clinical implications of genomic discoveries in lung cancer[J]. N Engl J Med, 2016, 374: 1864–1873. DOI:10.1056/NEJMra1504688 |
| [25] | Wijesinghe P, Bollig-Fischer A. Lung cancer genomics in the era of accelerated targeted drug development[J]. Adv Exp Med Biol, 2016, 890: 1–23. DOI:10.1007/978-3-319-24932-2 |
| [26] | Johnson JA, Cavallari LH. Pharmacogenetics and cardiovascular disease-implications for personalized medicine[J]. Pharmacol Rev, 2016, 65: 987–1009. |
| [27] | Chatalic KL, Heskamp S, Konijnenberg M, et al. Towards personalized treatment of prostate cancer:PSMA I & T, a promising prostate-specific membrane antigen-targeted theranostic agent[J]. Theranostics, 2016, 6: 849–861. DOI:10.7150/thno.14744 |
| [28] | Jo SD, Ku SH, Won YY, et al. Targeted nanotheranostics for future personalized medicine:recent progress in cancer therapy[J]. Theranostics, 2016, 6: 1362–1377. DOI:10.7150/thno.15335 |
| [29] | Dubovsky SL. The usefulness of genotyping cytochrome P450 enzymes in the treatment of depression[J]. Expert Opin Drug Metab Toxicol, 2015, 11: 369–379. DOI:10.1517/17425255.2015.998996 |
| [30] | Murray M, Petrovic N. Cytochromes P450:decision-making tools for personalized therapeutics[J]. Curr Opin Mol Ther, 2006, 8: 480–486. |
| [31] | Zhang H, Wei J, Xue R, et al. Berberine lowers blood glucose in type 2 diabetes mellitus patients through increasing insulin receptor expression[J]. Metabolism, 2010, 59: 285–292. DOI:10.1016/j.metabol.2009.07.029 |
| [32] | Derosa G, D'Angelo A, Bonaventura A, et al. Effects of berberine on lipid profile in subjects with low cardiovascular risk[J]. Expert Opin Biol Ther, 2013, 13: 475–482. DOI:10.1517/14712598.2013.776037 |
| [33] | Lee YS, Kim WS, Kim KH, et al. Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J]. Diabetes, 2006, 55: 2256–2264. DOI:10.2337/db06-0006 |
| [34] | Kong WJ, Zhang H, Song DQ, et al. Berberine reduces insulin resistance through protein kinase C-dependent up-regulation of insulin receptor expression[J]. Metabolism, 2009, 58: 109–119. DOI:10.1016/j.metabol.2008.08.013 |
| [35] | Li H, Dong B, Park SW, et al. Hepatocyte nuclear factor 1α plays a critical role in PCSK9 gene transcription and regulation by the natural hypocholesterolemic compound berberine[J]. J Biol Chem, 2009, 284: 28885–28895. DOI:10.1074/jbc.M109.052407 |
| [36] | Chen CH, Zhang YB, Huang C. Berberine inhibits PTP1B activity and mimics insulin action[J]. Biochem Biophys Res Commun, 2010, 397: 543–547. DOI:10.1016/j.bbrc.2010.05.153 |
| [37] | Yin J, Gao Z, Liu D, et al. Berberine improves glucose metabolism through induction of glycolysis[J]. Am J Physiol Endocrinol Meta, 2008, 294: E148–E156. DOI:10.1152/ajpendo.00211.2007 |
| [38] | Chen W, Miao YQ, Fan DJ, et al. Bioavailability study of berberine and the enhancing effects of TPGS on intestinal absorption in rats[J]. AAPS Pharm Sci Tech, 2011, 12: 705–711. DOI:10.1208/s12249-011-9632-z |
| [39] | Han J, Lin H, Huang W. Modulating gut microbiota as an anti-diabetic mechanism of berberine[J]. Med Sci Monit, 2011, 17: RA164–7. |
| [40] | Topping DL, Clifton PM. Short-chain fatty acids and human colonic function:roles of resistant starch and nonstarch polysaccharides[J]. Physiol Rev, 2001, 81: 1031–1064. DOI:10.1152/physrev.2001.81.3.1031 |
| [41] | Tan J, McKenzie C, Potamitis M, et al. The role of shortchain fatty acids in health and disease[J]. Adv Immunol, 2014, 121: 91–119. DOI:10.1016/B978-0-12-800100-4.00003-9 |
| [42] | Miller TL, Wolin MJ. Fermentations by saccharolytic intestinal bacteria[J]. Am J Clin Nutr, 1979, 32: 164–172. DOI:10.1093/ajcn/32.1.164 |
| [43] | Machiels K, Joossens M, Sabino J, et al. A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis[J]. Gut, 2014, 63: 1275–1283. DOI:10.1136/gutjnl-2013-304833 |
| [44] | Atarashi K, Tanoue T, Shima T, et al. Induction of colonic regulatory T cells by indigenous Clostridium species[J]. Science, 2011, 331: 337–341. DOI:10.1126/science.1198469 |
| [45] | Wang Y, Shou JW, Li XY, et al. Berberine-induced bioactive metabolites of the gut microbiota improve energy metabolism[J]. Metabolism, 2017, 70: 72–84. DOI:10.1016/j.metabol.2017.02.003 |
| [46] | Zhang X, Zhao Y, Xu J, et al. Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats[J]. Sci Rep, 2015, 5: 14405. DOI:10.1038/srep14405 |
| [47] | Zhang X, Zhao Y, Zhang M, et al. Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats[J]. PLoS One, 2012, 7: e42529. DOI:10.1371/journal.pone.0042529 |
| [48] | Gu S, Cao B, Sun R, et al. A metabolomic and pharmacokinetic study on the mechanism underlying the lipid-lowering effect of orally administered berberine[J]. Mol Biosyst, 2015, 11: 463–474. DOI:10.1039/C4MB00500G |
| [49] | Sun R, Yang N, Kong B, et al. Orally administered berberine modulates hepatic lipid metabolism by altering microbial bile acid metabolism and the intestinal FXR signaling pathway[J]. Mol Pharmacol, 2017, 91: 110–122. DOI:10.1124/mol.116.106617 |
| [50] | Guo Y, Zhang Y, Huang W, et al. Dose-response effect of berberine on bile acid profile and gut microbiota in mice[J]. BMC Complement Altern Med, 2016, 16: 394. DOI:10.1186/s12906-016-1367-7 |
| [51] | Li M, Shu X, Xu H, et al. Integrative analysis of metabolome and gut microbiota in diet-induced hyperlipidemic rats treated with berberine compounds[J]. J Transl Med, 2016, 14: 237. DOI:10.1186/s12967-016-0987-5 |
| [52] | Xu JH, Liu XZ, Pan W, et al. Berberine protects against dietinduced obesity through regulating metabolic endotoxemia and gut hormone levels[J]. Mol Med Rep, 2017, 15: 2765–2787. DOI:10.3892/mmr.2017.6321 |
| [53] | Cao Y, Pan Q, Cai W, et al. Modulation of gut microbiota by berberine improves steatohepatitis in high-fat diet-fed BALB/C mice[J]. Arch Iran Med, 2016, 19: 197–203. |
| [54] | Lee J, Lee E, Kim D, et al. Studies on absorption, distribution and metabolism of ginseng in humans after oral administration[J]. J Ethnopharmacol, 2009, 122: 143–148. DOI:10.1016/j.jep.2008.12.012 |
| [55] | He CY, Feng R, Sun YP, et al. Simultaneous quantification of ginsenoside Rg1 and its metabolites by HPLC-MS/MS:Rg1 excretion in rat bile, urine and feces[J]. Acta Pharm Sin B, 2016, 6: 593–599. DOI:10.1016/j.apsb.2016.05.001 |
| [56] | Odani T, Tanizawa H, Takino Y. Studies on the absorption, distribution, excretion and metabolism of ginseng saponins. Ⅳ. Decomposition of ginsenoside-Rg1 and-Rb1 in the digestive tract of rats[J]. Chem Pharm Bull (Tokyo), 1983, 31: 3691–3697. DOI:10.1248/cpb.31.3691 |
| [57] | Xu QF, Fang XL, Chen DF. Pharmacokinetics and bioavailability of ginsenoside Rb1 and Rg1 from Panax notoginseng in rats[J]. J Ethnopharmacol, 2003, 84: 187–192. DOI:10.1016/S0378-8741(02)00317-3 |
| [58] | Takeda S, Ishthara K, Wakui Y, et al. Bioavailability study of glycyrrhetic acid after oral administration of glycyrrhizin in rats; relevance to the intestinal bacterial hydrolysis[J]. J Pharm Pharmacol, 1996, 48: 902–905. DOI:10.1111/jphp.1996.48.issue-9 |
| [59] | Sasaki K, Yonebayashi S, Yoshida M, et al. Improvement in the bioavailability of poorly absorbed glycyrrhizin via various non-vascular administration routes in rats[J]. Int J Pharm, 2003, 265: 95–102. DOI:10.1016/S0378-5173(03)00407-1 |
 2018, Vol. 53
2018, Vol. 53


