2. 北京市药品检验所中药成分分析与生物评价北京市重点实验室, 北京 102206
2. Beijing Institute for Drug Control, Beijing Key Laboratory of Analysis and Evaluation on Chinese Medicine, Beijing 102206, China
甘草是我国最常用的大宗药材之一, 始载于《神农本草经》, 被列为上品[1], 享有“十方九草”之美誉, 具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效。大量现代药理研究表明, 甘草及其提取物具有抗炎[2]、抗癌[3]、抗菌[4]、抗抑郁[5]、保肝护肝[6]等多种功效, 用途极为广泛。然而, 由于过度采挖, 我国野生甘草资源蕴藏量已不足50万吨[7]。自2000年起, 国务院已禁止采挖野生甘草(国发[2000] 13号), 栽培甘草成为中药材市场上的主流商品, 在宁夏、甘肃、新疆、内蒙古等省市自治区进行大面积种植。《中华人民共和国药典》(2015版)[8]规定甘草药材包括3种基原植物:乌拉尔甘草 Glycyrrhiza uralensis Fisch.、胀果甘草 Glycyrriza inflate Bat.及光果甘草 Glycyrrhiza glabra L., 且其质量标准为甘草酸(glycyrrhizic acid)含量不低于2.0%, 甘草苷(liquiritin)含量不低于0.5%。然而本课题组前期对全国4个主要中药材集散中心及主要栽培基地的甘草药材进行了深入的调查研究, 发现市售甘草药材质量良莠不齐, 存在大量甘草酸或甘草苷含量未达标的样品[9, 10]。这将严重影响甘草药材的质量及药效发挥。
植物在长期进化的过程中, 由于自然突变的作用, 遗传基因会发生不同程度的变异, 形成基因多态性, 其中功能基因的多态性对于调控产物的合成具有显著的影响。就药材而言, 药用成分的含量高低是评价其质量的决定性因素。本课题组前期对甘草中甘草酸生物合成途径上的3个功能基因[11-15]进行研究表明, 功能基因存在单核苷酸多态性(single nuleotide polymorphisms, SNPs)、插入/缺失长度多态性(inser tion/deletion length polymorphism, InDel)、选择性剪接多态性(alternative splicing, AS)以及拷贝数多态性(copy number variations, CNVs), 而这些多态性会明确影响到次生代谢产物甘草酸的含量。因此推测, 甘草苷的生物合成途径也势必受关键酶及其编码基因的影响及调控。
查尔酮合酶(chalcone synthase, CHS, EC2.3.1.74)是甘草苷生物合成途径中的第1个关键限速酶[16]。它催化3分子丙二酰辅酶A (malonyl-CoA)和1分子4-香豆酰辅酶A (4-coumaroyl-CoA)缩合, 生成第1个以C6-C3-C6为基本骨架的黄酮类化合物—柚皮素查尔酮, 该产物再进一步衍化生成多种黄酮类化合物。CHS基因在植物中广泛存在, Reimold等[17]于1983年首次报道了欧芹 Petroselinum crispum CHS基因序列, 截止目前, GenBank数据库中已经注册了9 000多条植物CHS的核苷酸序列。此前, 已报道对三基原甘草中CHS基因的克隆研究[18, 19], 但样本量较小。有关CHS基因多态性与甘草苷含量的相关性研究则尚未见诸报道。
本文收集了来自于新疆、黑龙江及内蒙古3个省区7个不同居群的栽培及野生甘草种子, 在北京中医药大学建立了甘草种质资源圃。利用课题组前期已建立的HPLC方法, 对其中60份甘草样品(20份/基原)中的4种主要黄酮类化合物进行了含量测定。进而, 选取含量最高的5株乌拉尔甘草及含量最低的5株胀果甘草分为黄酮高、低含量组, 进行CHS基因的克隆, 并对其多态性进行分析, 筛选出黄酮高、低含量组特异CHS基因型及氨基酸序列类型。本文的研究结果将为阐明CHS基因多态性影响甘草苷生物合成的分子机制, 指导栽培甘草的分子育种奠定基础。
材料与方法甘草植物材料 从全国3省份7个居群分别收集甘草种子, 统一栽培于北京中医药大学药草园, 生长两年, 由北京中医药大学刘颖副教授对其进行分子鉴定以确定基原。材料详细信息见表 1。
| Table 1 The contents of four main flavonoids in 60 samples |
实验仪器 Agilent 1100高效液相色谱仪(Agilent); CAPCELL PAK C18 MGII色谱柱(4.6 mm × 250 mm, 5 μm, 日本资生堂株式会社); 十万分之一电子天平CPA225D (德国赛多利斯科学仪器有限公司); 超声清洗仪KQ-250E (中国昆山市超声仪器有限公司); 1-13000型离心机(SIGMA); TC-3000 PCR扩增仪(Techne); DYY-6C型电泳仪(北京六一仪器厂); BG-gdsAUTO510型凝胶成像系统(上海培清科技有限公司); 酶标仪(Bio-Tek)等。
实验试剂 甘草苷对照品(纯度98.5%, 批号MUST-16032801)、异甘草苷对照品(纯度99.99%, 批号MUST-15031204)、甘草素对照品(纯度99.07%, 批号MUST-15021104), 均购于成都曼思特公司; 异甘草素对照品(纯度98%, 批号16061501), 购于成都普菲德公司。乙腈(色谱纯)、甲醇(色谱纯)为Merck公司产品, 磷酸(分析纯)为北京化工厂产品, 实验用水为屈臣氏蒸馏水。ESPY spin植物RNA快速提取试剂盒、琼脂糖凝胶纯化回收试剂盒、DL2000核酸分子质量标准、M-MLV (Rnase H-)、pMD19-T载体、大肠杆菌DH5α感受态细胞、氨苄青霉素(ampicillin, Amp)、琼脂糖等购于北京博迈德生物技术有限公司; LA Taq DNA聚合酶、Oligo dT等购于TaKaRa公司; 引物合成由生工生物工程(上海)股份有限公司完成。
HPLC法分析甘草药材中4种黄酮含量 利用本课题组前期已建立的HPLC法[10]对甘草样品中甘草苷、异甘草苷(isoliquiritin)、甘草素(liquiritigenin)、异甘草素(isoliquiritigenin) 4种主要黄酮类化合物的含量进行测定。运用统计软件SAS 8.0及SPSS 19.0对甘草中4种黄酮类化合物的含量及其相关性进行统计学分析。
甘草RNA提取及逆转录 取冻存于-80 ℃冰箱中的甘草主根, 液氮中充分研磨后, 依据ESPY spin植物快速提取试剂盒说明书提取总RNA; 利用琼脂糖凝胶电泳检测RNA完整性; 利用酶标仪测定RNA浓度; 按M-MLV (Rnase H-)反转录试剂盒说明书, 以Oligo dT为引物, 对所提总RNA进行逆转录。
甘草CHS扩增及测序 根据GenBank上已注册的胀果甘草CHS基因序列(EU706287), 利用Primer Premier 5.0软件设计引物如下:上游引物GF: 5'-CAATGGTGAGCGTAGCTGAAATTC-3', 下游引物GR: 5'-CAATCATATAGCCACACTGTGCAG-3'。25 μL PCR扩增体系: 2.5 μL模板cDNA、0.25 μL上游引物GF (10 μmol·L-1)、0.25 μL下游引物GR (10 μmol·L-1)、0.25 μL LA TaqDNA聚合酶、2.5 μL 10×Buffer、2.0 μL dNTP (2.5 mmol∙L-1)、17.25 μL RNase-free Water。PCR扩增程序: 94 ℃ 5 min; 94 ℃ 15 s, 56 ℃ 30 s, 72 ℃ 90 s (30个循环); 72 ℃ 5 min, 4 ℃保存。1.0%琼脂糖凝胶电泳检测PCR扩增结果, 利用胶回收试剂盒对PCR产物进行胶回收纯化。将胶回收产物与pMD19-T载体连接后转化至大肠杆菌DH5α感受态细胞中, 涂于含有50 mg·L-1 Amp的LB培养基平板上, 于37℃倒置培养12 h。随机挑取单克隆, 接种于含有50 mg·L-1 Amp的LB液体培养基中, 于37 ℃、200 r·min-1条件下培养12 h。对菌液进行PCR验证, 将阳性克隆送生工生物工程(上海)股份有限公司测序, 测至饱和。
生物信息学分析 应用软件DNAMAN对全部cDNA序列进行比对分析; 应用软件Editseq将全部cDNA序列翻译成氨基酸序列; 对甘草黄酮高/低含量组中高频出现的序列进行以下生物信息学分析:运用SOPMA进行二级结构预测; 运用PROSITE进行蛋白活性位点预测; 运用Swiss Model进行三级结构同源模建; 运用SAVES服务器对同源模建蛋白结果进行评价; 运用Discovery Studio 2.5对三维结构进行功能预测; 运用MEGA 5.0进行同源比对并构建系统进化树。
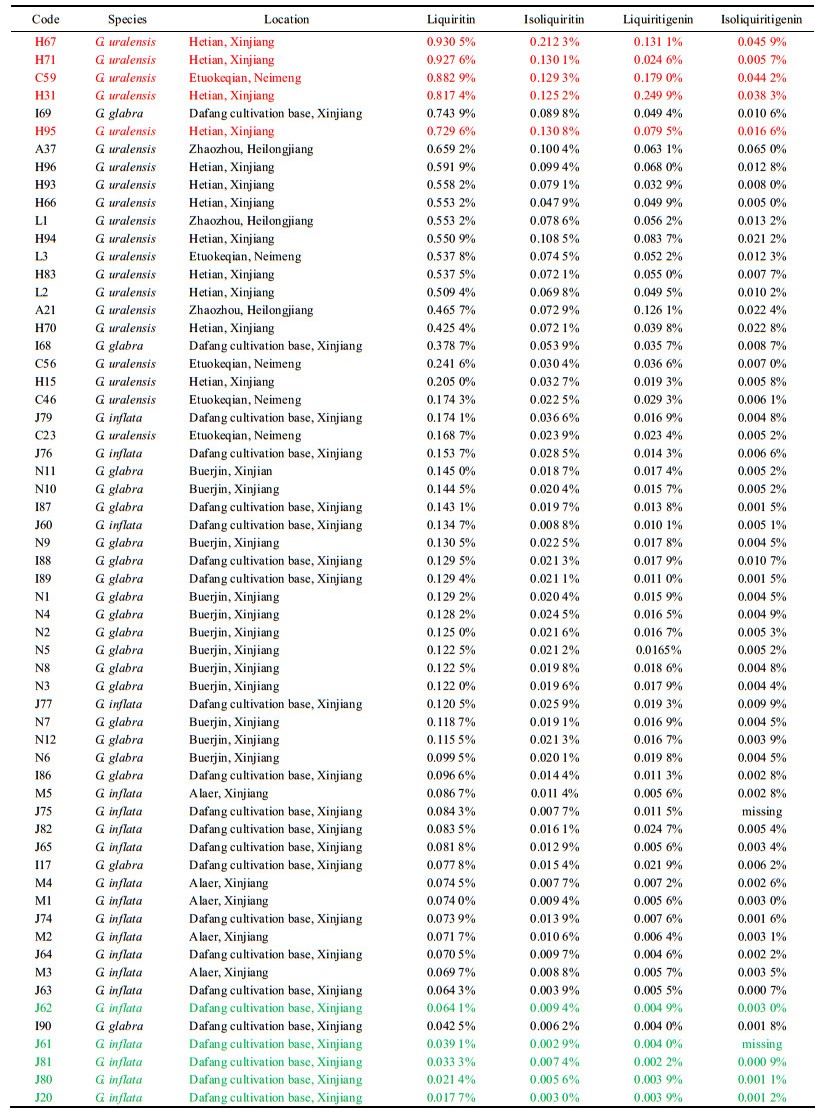
结果 1 三基原甘草样品中4种黄酮类化合物的含量分析HPLC色谱图如图 1所示, 曲线A为4种黄酮类化合物混合对照品的色谱图, 曲线B、C、D分别为乌拉尔甘草、光果甘草、胀果甘草样品的色谱图, 由图可知甘草苷、异甘草苷、甘草素、异甘草素的保留时间分别为9.052、19.393、24.035、35.236 min。甘草苷的标准曲线为: Y = 5.644 7 × 10-4 X + 2.204 5 × 10-4 (R2 = 0.999 9);异甘草苷的标准曲线为: Y = 2.479 8 × 10-4 X + 2.214 4 × 10-4 (R2 = 0.999 9);甘草素的标准曲线为: Y = 3.179 6 × 10-4 X -3.222 0 × 10-5 (R2 = 0.999 9);异甘草素的标准曲线为: Y = 1.423 8 × 10-4 X -6.781 0 × 10-5 (R2 = 0.999 9)。60份甘草样品中4种黄酮化合物的百分含量列于表 1中, 三基原甘草中4种黄酮类化合物含量列于表 2中。
|
Figure 1 HPLC chromatograms of reference substance and samples. Compound 1-4: liquiritin, isoliquiritin, liquiritigenin, isoliquiritigenin; A: HPLC chromatograms of reference substance; B, C, D: HPLC chromatograms of G. uralensis, G. glabra, and G. inflate |
| Table 2 The contents of four main flavonoids in G. uralensis Fisch., G. inflata Bat. and G. glabra L. |
利用SPSS 19.0及SAS 8.0对三基原甘草样品中甘草苷、异甘草苷、甘草素及异甘草素含量进行相关性分析, 结果列于表 3, 差异分析结果列于表 4。Spearman相关性分析表明甘草苷与异甘草苷、甘草素与异甘草素的含量均具有显著相关关系。χ2检验显示甘草苷、异甘草苷、甘草素和异甘草素的含量在三基原甘草之间的差异均具有统计学意义, 且通过比较秩均数发现, 这4种主要黄酮类成分的含量在三基原甘草中均满足:乌拉尔甘草 > 光果甘草 > 胀果甘草。
| Table 3 The Spearman correlation test results. **Correlation is significant at the 0.01 level (2-tailed) |
| Table 4 The χ2 test results |
由于黄酮类化合物的含量在三基原甘草间均存在显著性差异, 其中乌拉尔甘草含量最高, 而胀果甘草含量最低, 因此在上述60份甘草样品中, 选取黄酮含量最高的5株乌拉尔甘草(表 1中红色标出)及黄酮含量最低的5株胀果甘草(表 1中绿色标出)进行多态性分析, 按甘草苷含量由高至低的顺序重新编号为H1~H5, L1~L5。10株甘草样品共克隆得到336条长度为1175 bp的CHS基因cDNA序列。DNAMAN比对分析显示336条序列中存在249个变异位点, 其中错义突变位点141个, 可分为137种单倍型(单倍型1~137), 序列一致性为99.98%。变异位点统计于表 5中。
| Table 5 Variable sites in the 137 CHS haplotypes. Underline: Missense mutation |
上述长度为1 175 bp的CHS序列包含1个完整的开放阅读框(open reading frame, ORF), 编码1条包含389个氨基酸残基的多肽序列。336条CHS氨基酸序列中共存在130个变异位点, 可分为102种氨基酸序列类型(AA-1~AA-102), 序列一致性为99.33%。变异位点统计于表 6中。其中, 单倍型3~23为同义突变序列, 编码氨基酸序列类型AA-3;单倍型25~27为同义突变序列, 编码AA-5;单倍型28、29为同义突变序列, 编码AA-6;单倍型32~34为同义突变序列, 编码AA-9;单倍型60~62为同义突变序列, 编码AA-35;单倍型63~68为同义突变序列, 编码AA-36;单倍型92~95为同义突变序列, 编码AA-60。
| Table 6 Variable sites in the 102 CHS amino acid sequence types |
将全部氨基酸序列注册号、单倍型来源及不同单倍型、不同氨基酸序列类型出现频次统计于表 7中。137种CHS单倍型中, 黄酮高含量组甘草样品中存在71种CHS单倍型, 特有单倍型64种; 黄酮低含量组甘草样品中存在73种CHS单倍型, 特有单倍型66种; 高、低含量组共有CHS单倍型7种, 即单倍型1、6、25、28、35、51和单倍型92。黄酮高含量组样品中共克隆获得了178条CHS基因cDNA序列, 出现频率最高的单倍型为单倍型1、10及60 (数目: 8条, 占比: 4.49%), 其中单倍型10及60为黄酮高含量组甘草样品特有CHS单倍型。黄酮低含量组样品中共克隆获得158条CHS基因cDNA序列, 出现频率最高的单倍型为单倍型92 (数目: 6条, 占比:3.80%), 其次为单倍型1、6、28、41 (数目: 4条, 占比: 2.53%), 其中单倍型41为黄酮低含量组甘草样品特有单倍型。
| Table 7 Haplotypes-quantity-source-AA sequence types-GenBank accession No. information of 137 haplotypes |
根据表 7中的统计数据, 102种氨基酸序列类型中, 黄酮高含量组甘草样品存在53种氨基酸序列类型, 特有氨基酸序列类型为45种; 黄酮低含量组甘草样品中存在57种氨基酸序列类型, 特有氨基酸序列类型为49种; 高、低含量组共有的氨基酸序列类型有8种, 即AA-1、AA-3、AA-5、AA-6、AA-9、AA-10、AA-26和AA-60。黄酮高含量组甘草样品中共计得到178条CHS氨基酸序列, 出现频率最高的为AA-3 (数目: 36条, 占比20.22%), 其次为AA-35、AA-60 (数目: 12条, 占比6.74%), 其中AA-35为黄酮高含量组甘草样品特有CHS氨基酸序列类型。黄酮低含量组甘草样品中共计得到158条CHS氨基酸序列, 出现频率最高的也是AA-3 (数目: 22条, 占比: 13.92%), 其次为AA-36 (数目: 12条, 占比7.59%), 为黄酮低含量组甘草样品的特异CHS氨基酸序列类型。综上, 由于AA-35是黄酮高含量组甘草样品中占比最高的特有氨基酸序列类型, 而AA-36是黄酮低含量组甘草样品中占比最高的特有氨基酸序列类型, 因此将进一步对这两条序列进行二级结构、三级结构等生物信息学分析, 从分子水平上寻找其影响甘草黄酮类化合物生物合成的原因。
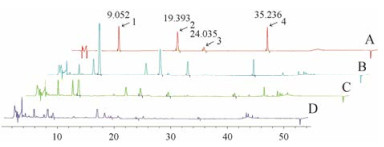
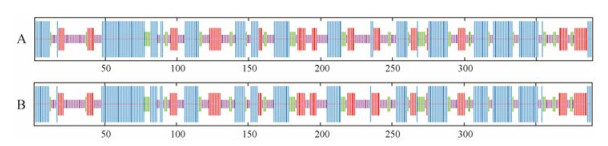
7 黄酮高、低含量组特有CHS氨基酸序列类型AA-35与AA-36的二级结构比对分析对AA-35与AA-36进行比对分析, 发现其在193位与229位处存在I/V、V/T突变。应用SOPMA对AA-35及AA-36进行二级结构预测, 结果如图 2所示: AA-35序列中含α-螺旋41.13%、无规卷曲30.08%、延长链17.99%及β-折叠10.80%。AA-36序列中含α-螺旋40.87%、无规卷曲29.56%、延长链18.77%及β-折叠10.80%。且AA-35序列与AA-36序列的二级结构仅在193位点处存在无规卷曲/延长链、225位点处存在无规卷曲/延长链及237位点处存在α-螺旋/延长链的差异, 这与氨基酸序列差异较一致。应用PROSITE对AA-35及AA-36进行活性位点预测, 结果如图 3所示: AA-35与AA-36的活性位点均为164位点, 活性区域处于156位点至172位点间。
|
Figure 2 The secondary structure prediction results of AA-35 and AA-36. A: The secondary structure prediction results of AA-35; B: The secondary structure prediction results of AA-36; Blue: Alpha helix; Purple: Random coil; Red: Extended strand; Green: Beta sheet |
|
Figure 3 The active site prediction results of AA-35 and AA-36 |
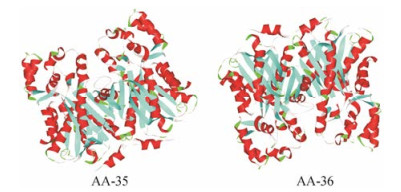
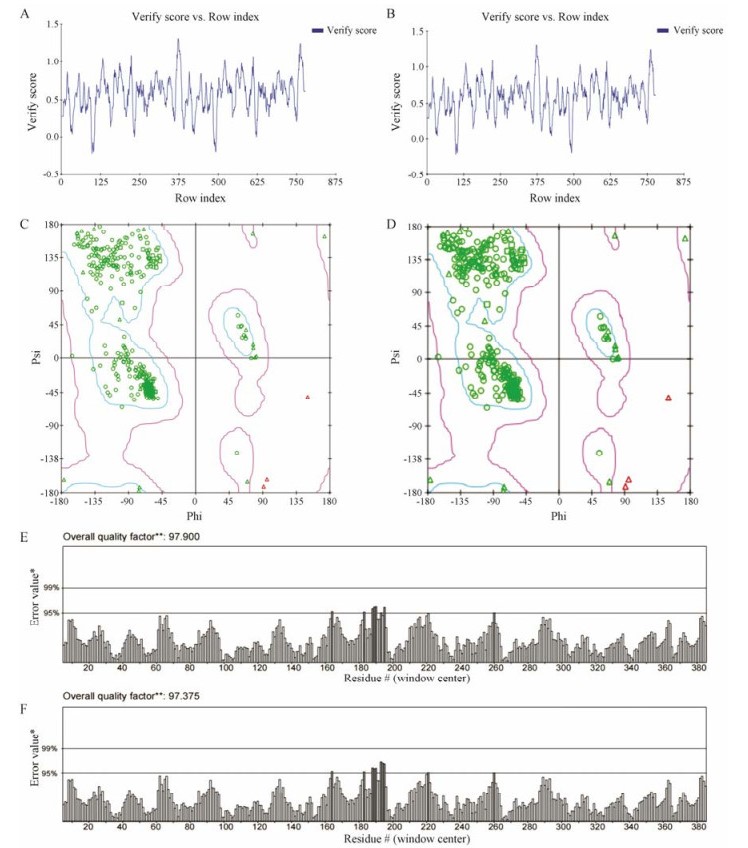
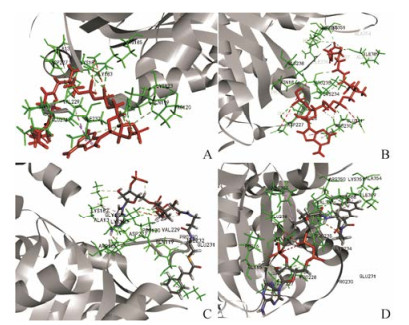
应用在线软件Swiss-model同源模建的AA-35与AA-36的三级结构如图 4所示。SAVES对AA-35、AA-36同源模建结果的分析如图 5所示。AA-35三维模型的拉氏图的最适残基量为91.52%, ERRAT值为97.900; AA-36三维模型的拉氏图的最适残基量为92.54%, ERRAT值为97.375, 均显示建模结构具有良好立体化学参数和空间结构, 可用于后续分析。Discovery Studio 2.5结合位点预测结果如图 6所示。结果显示仅AA-35的229位缬氨酸位于结合位点区域, 能够与丙二酰辅酶A的结合, 而AA-35的193位异亮氨酸、AA-36的193位缬氨酸、229位苏氨酸均与底物结合无关, 这也可以解释为什么AA-35对应样品的黄酮水平较高。
|
Figure 4 The homology modeling results of AA-35 and AA-36 |
|
Figure 5 The verify score, Ramachandran plot and ERRAT of AA-35 and AA-36. A: The verify score of AA-35; B: The verify score of AA-36; C: The Ramachandram plot of AA-35; D: The Ramachandram plot of AA-36; E: The ERRAT of AA-35; F: The ERRAT of AA-36 |
|
Figure 6 The binding sites prediction results between malonyl-CoA, 4-coumaroyl-CoA and the tertiary structure of AA-35, AA-36. A, B: The binding sites prediction results between malonyl-CoA and the tertiary structure of AA-35, AA-36; C, D: The binding sites prediction results between 4-coumaroyl-CoA and the tertiary structure of AA-35, AA-36 |
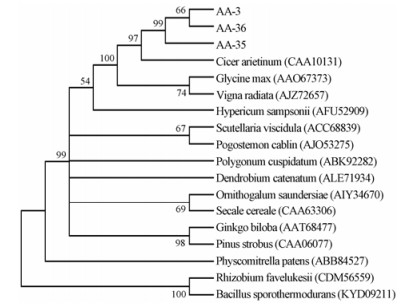
利用MEGA 5.0将主流CHS氨基酸序列类型AA-3、黄酮高含量组样品特有氨基酸序列类型AA-35、黄酮低含量组样品特有氨基酸序列类型AA-36与NCBI数据库中其他物种的CHS氨基酸序列进行聚类分析。18条氨基酸序列聚类结果如图 7所示。所有序列分为两大支, 植物聚为一大支, 微生物根瘤菌 Rhizobium favelukesii与芽孢杆菌 Bacuillus sporothermodurans单独聚为一支。在植物中, 苔藓类植物小立碗藓 Physcomitrella patens单独聚为一支, 与甘草进化距离最远。豆科植物鹰嘴豆 Cicer arietinum、大豆 Glycine max、绿豆 Vigna radiata与甘草聚为一支, 且鹰嘴豆与甘草进化关系最近。其余植物依亲缘关系远近, 分别聚为不同小支。甘草的主流CHS氨基酸序列类型AA-3与黄酮低含量组特有氨基酸序列类型AA-36先聚为一支, 再与黄酮高含量组特有氨基酸序列类型AA-35聚为一支, 这从进化关系层面上也可推测导致黄酮高含量组样品黄酮大量累积的原因。
|
Figure 7 NJ tree based on CHS amino acid sequences from G. uralensis Fisch., G. glabra L., G. inflate Bat. and 15 registered CHS amino acid sequences in Gen Bank. Boostrap repeated 1 000 times and branch values lower than 50% were hided |
2015版《中国药典》明确规定栽培甘草的质量标准为甘草酸≥2.0%、甘草苷≥0.5%, 即:三萜类化合物甘草酸不再作为评价甘草质量的唯一标准, 而黄酮类化合物甘草苷作为评价甘草的指标之一, 同样具有重要的地位。目前, 甘草中发现的黄酮类化合物有300多种, 结构类型几乎包括了除花青素外的所有黄酮小类[20]。其中最具代表性的结构是包括甘草素、甘草苷在内的二氢黄酮类及包括异甘草苷、异甘草素在内的查尔酮类。对质量控制成分甘草苷的研究多集中于药理活性[2, 3]方面, 而对其生物合成途径则关注较少。因此, 本文从甘草苷生物合成途径中的第一个关键功能基因CHS入手展开研究。
CHS为超基因家族成员之一, 在不同植物间, 功能及拷贝数均存在差异[21]。其主要功能与植物花色素积累[22, 23]、植物的育性[24]及防御相关[25, 26]。Courtney-Gutterson等[27]利用根癌农杆菌介导法, 向花色为粉红色的菊花 Chrysanthemum morifolium中, 分别以正义和反义方向转入CHS基因, 获得了开浅红色和白色花的转基因植株。Pollak等[28]研究发现, 缺乏CHS的矮牵牛突变植株体内无黄酮类物质积累, 且属于雄性不育, 可通过补充黄酮醇类物质, 使花粉管恢复正常生长。Qi等[29]对水稻中与白叶枯病菌互作中的防卫基因CHS的转录进行研究, 发现病菌均不诱导或只是微弱诱导水稻CHS基因的转录。
在药用植物中, CHS基因的研究多集中于克隆及表达载体构建[30-32], 红花 Carthamus tinctorius L.[33]、黄芩 Scutellaria baicalensis Georgi[34]、铁皮石斛 Dendrobium officinale[35]等药用植物的CHS基因已被成功克隆。Liu等[33]发现将红花中CHS基因在拟南芥 Arabidpsis thaliana L.中进行过表达, 可以导致拟南芥中黄酮含量的提高。Liu等[34]成功克隆黄芩CHS基因, 并将其导入根癌农杆菌, 获得黄芩CHS基因高效表达载体, 促进了黄芩苷的合成。Meng等[35]对1~3年生铁皮石斛的根、茎、叶中CHS基因表达量进行分析, 发现CHS基因在1年生铁皮石斛叶片中的表达量最高, 且随着植株年龄的增长, 叶片中CHS基因的表达量降低、茎中的表达量升高。因此在药用植物中CHS基因的功能与药效成分的累积具有明确的相关性。就甘草而言, 其CHS基因的报道仅限于基因克隆及乌拉尔甘草的基因组测序[36], 这些研究为甘草基因表达谱的建立、基因库的完善、功能基因的挖掘及功能注释奠定了基础, 但目前甘草中功能基因与有效成分之间的关联分析尚缺乏系统的研究。
本文利用HPLC法对60份甘草样品中甘草苷、异甘草苷、甘草素、异甘草素进行含量分析, 结果表明乌拉尔甘草黄酮类化合物含量最高, 光果甘草次之, 胀果甘草最低, 这与课题组前期的研究结果一致[9]。不仅提示在临床用药中, 乌拉尔甘草有利于发挥黄酮类化合物独特的药理活性, 如:抗氧化[37]、抗抑郁症[5]、细胞保护作用[38]等, 更表明乌拉尔甘草中黄酮类化合物生物合成的高效性, 而导致此高效性的分子机制则有可能与功能基因的多态性、表达量、拷贝数、转录因子调控、外界环境因子刺激等多种因素相关, 本文试图从功能基因的多态性方面寻找原因, 而其他方面的调控则亟待进一步研究。
本文的研究结果表明甘草CHS基因具有丰富的基因多态性, 筛选出黄酮高/低含量甘草样品的特异CHS基因型及氨基酸序列类型, 并从生物信息学角度对其产生原因进行了分析。发现黄酮高含量组特有主流氨基酸类型AA-35的229位缬氨酸位于结合位点区域, 能够与丙二酰辅酶A结合, 而黄酮低含量组特有的主流氨基酸类型AA-36的229位苏氨酸则与底物结合无关, 因此推测这一位点的突变有可能与黄酮的高水平积累相关, 但尚需进一步实验对其进行评价。本文可为甘草中其他功能基因的多态性研究提供参考, 为揭示功能基因与次生代谢之间的相关性奠定基础, 并为甘草中优良基因筛选及分子育种提供理论支持。
| [1] | Sen L. Shennong's Herbal (神农本草经)[M]. Shanghai: Shanghai Technology and Health Press, 1959: 35. |
| [2] | Cui Y, Ao M, Li W, et al. Anti-inflammatory activity of licochalcone A isolated from Glycyhhiza inflate[J]. Z Natur-forsch B, 2008, 63: 361–365. |
| [3] | Zhou Y, Ho WS. Combination of liquiritin, isoliquiritin and isoliquirigenin induce apoptotic cell death through upregulating p53 and p21 in the A549 non-small cell lung cancer cells[J]. Oncol Rep, 2014, 31: 298–304. DOI:10.3892/or.2013.2849 |
| [4] | Ai-Turki AI, Ei-Ziney MG, Abdel-Salam AM. Chemical and anti-bacterial characterization of aqueous extracts of oregano, marjoram, sage and licorice and their application in milk and labneh[J]. Int J Food Agric Environ, 2008, 6: 39–44. |
| [5] | Zhao Z, Wang W, Guo H, et al. Antidepressant-like effect of liquiritin from Glycyrrhiza uralensis in chronic variable stress induced depression model rats[J]. Behav Brain Res, 2008, 194: 108–113. DOI:10.1016/j.bbr.2008.06.030 |
| [6] | Abe K, Ikeda T, Wake K, et al. Glycyrrhizin prevents of lipopolysaccharide/D-galactosamine-induced liver injury through down-regulation of matrix metalloproteinase in mice[J]. J Pharm Pharmacol, 2008, 60: 91–97. DOI:10.1211/jpp.60.1.0012 |
| [7] | Huang MJ, Wang WQ, Wei SL, et al. Investigation on medicinal plant resources of Glycyrrhiza uralensis in China and chemical assessment of its underground part[J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 947–951. |
| [8] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Part 1(中华人民共和国药典一部)[S]. Beijing: China Medical Science Press, 2015: 87. |
| [9] | Yang R, Li WD, Ma YS, et al. The molecular identification of licorice species and the quality evaluation of licorice slices[J]. Acta Pharm Sin (药学学报), 2017, 52: 318–326. |
| [10] | Yang R, Yuan BC, Ma YS, et al. Simultaneous determination of liquiritin, isoliquiritin, liquiritigenin and liquiritigenin in Glycyrrhiza uralensis Fisch., Glycyrrhiza glabra L., and Glycyrrhiza inflata Bat. by HPLC[J]. Chin J Pharm Anal (药物分析杂志), 2016, 36: 1729–1736. |
| [11] | Liu Y, Zhan XJ, Li WD, et al. Copy number variations of functional genes influence contents of glycyrrhizic acid in Glycyrrhiza uralensis[J]. Acta Physiol Plant, 2014, 36: 1433–1440. DOI:10.1007/s11738-014-1521-0 |
| [12] | Liu Y, Liu DJ, Liu CS, et al. Mechanism of genuineness of liquorice Glycyrrhiza uralensis based on CNVs of HMGR, SQS1 and β-AS gene[J]. Acta Pharm Sin (药学学报), 2012, 47: 250–255. |
| [13] | Liu Y, Xu QX, Wang XY, et al. Analysis on correlation between 3-hydroxy-3-methylglutary-coenzyme A reductase gene polymorphism of Glycyrrhiza uralensis ans content of glycyr-rhizic acid[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3789–3792. |
| [14] | Liu Y, Zhang N, Wang XY, et al. Researches on influence of squalene synthase gene polymorphism on catalytic efficiency of its encode enzyme in Glycyrrhiza uralensis[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3777–3783. |
| [15] | Liu Y, Zhu XQ, Li WD, et al. Enhancing production of ergosterol in Pichia pastoris GS115 by over-expression of 3-hydroxy-3-methylglutaryl CoA reductase from Glycyrrhiza uralensis[J]. Acta Pharm Sin B, 2014, 4: 161–166. DOI:10.1016/j.apsb.2014.02.007 |
| [16] | Koes RE, Francesca Q, Joseph NM. The flavonoid biosynthetic pathway in plants:function and evolution[J]. Bioessays, 1994, 16: 123–132. DOI:10.1002/(ISSN)1521-1878 |
| [17] | Reimold U, Kr ger M, Kreuzaler F, et al. Coding and 3' non-coding nucleotide sequence of chalcone synthase mRNA and assignment of amino acid sequence of the enzyme[J]. Embo J, 1983, 2: 1801–1805. |
| [18] | Xu HF. Cell Culture And Cloning of Chalcone Synthase Gene from Glycyrrhiza inflata Bat. (胀果甘草细胞培养及查尔酮合成酶基因的cDNA克隆)[D]. Baoding: Hebei University, 2011. |
| [19] | Zhou S, Ma YS, Hu T, et al. Cloning and sequence analysis of chalcone synthase gene from Glycyrrhiza uralensis Fisch.[J]. Lett in Biotech (生物技术通讯), 2017, 28: 812–817. |
| [20] | Wang X, Zhang H, Chen L, et al. Liquorice, a unique "guide drug" of traditional Chinese medicine:a review of its role in drug interactions[J]. J Ethnopharmacol, 2013, 150: 781–790. DOI:10.1016/j.jep.2013.09.055 |
| [21] | Durbin ML, Mccaig B, Clegg MT. Molecular evolution of the chalcone synthase multigene family in the morning glory genome[J]. Plant Mol Biol, 2000, 42: 79–92. DOI:10.1023/A:1006375904820 |
| [22] | Kamiishi Y, Otani M, Takagi H, et al. Flower color alteration in the liliaceous ornamental Tricyrtis sp. by RNA interference-mediated suppression of the chalcone synthase gene[J]. Mol Breeding, 2012, 30: 671–680. DOI:10.1007/s11032-011-9653-z |
| [23] | Blokland RV, Geest NVD, Mol JNM, et al. Transgene-mediated suppression of chalcone synthase expression in Petunia hybrida, results from an increase in RNA turnover[J]. Plant J, 2010, 6: 861–877. |
| [24] | Taylor LP, Jorgensen R. Conditional male fertility in chalcone synthase-deficient Petunia[J]. J Hered, 1991, 83: 11–17. |
| [25] | Dao TTH, Linthorst HJM, Verpoorte R. Chalcone synthase and its functions in plant resistance[J]. Phytochem Rev, 2011, 10: 397–412. DOI:10.1007/s11101-011-9211-7 |
| [26] | Cushnie TP, Lamb AJ. Antimicrobial activity of flavonoids[J]. Int J Antimicrob Agents, 2005, 26: 243–356. |
| [27] | Courtney-Gutterson N, Napoli C, Lemieux C, et al. Modifi-cation of flower color in florist's chrysanthemum:production of a white-flowering variety through molecular genetics[J]. Biotechnology (NY), 1994, 12: 268–271. DOI:10.1038/nbt0394-268 |
| [28] | Pollak PE, Vogt T, Mo Y, et al. Chalcone synthase and flavonol accumulation in stigmas and anthers of Petunia hybrida[J]. Plant Physiol, 1993, 102: 925–932. DOI:10.1104/pp.102.3.925 |
| [29] | Qi FJ, Gao XW, Wang JS, et al. Accumulation of pal and chs gene transcripts of rice carrying different bacterial blight resistance genes interacted with Xanthomonas oryzae pv. Oryzae[J]. J Agric Biotechnol (农业生物技术学报), 2000, 8: 337–340. |
| [30] | Rao C, Lei W, Li P, et al. Cloning of Scutellaria viscidula CHS gene and consteuction of its sense and antisense plant expression vectors[J]. J Chin Med Mater (中药材), 2009, 32: 1661–1664. |
| [31] | Shang J, Chen AL, Pan WZ. Cloning and bioinformation analysis of chalcone synthase gene from Lycium barbarum in Ningxia[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 2898–2903. |
| [32] | Fu M, Wei L, Yu J, et al. cDNA cloning and protein sequence analysis of chalcone synthase gene in leaves of Ampelopsis grossdentata[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 85–89. |
| [33] | Liu XM, Lu WH, Li J, et al. Over-expression of chalcone synthase of safflower increases flavonoid content in Arabidopsis thaliana[J]. Chin J Cell Biol (中国细胞生物学学报), 2017, 39: 182–190. |
| [34] | Liu GM, Lei W, Shui XR. Molecular clone, sequence analysis and expression vector construction with high efficiency of CHS gene from Scutellaria baicalensis Georgi[J]. Genomics Appl Biol (基因组学与应用生物学), 2016, 35: 2814–2818. |
| [35] | Meng HL, Zhang W, Liu BY, et al. Cloning and expression of chalcone synthase gene from Dendrobium officiale[J]. J South Agric (南方农业学报), 2016, 47: 2015–2019. |
| [36] | Mochida K, Sakurai K, Seki H, et al. Draft genome assembly and annotation of Glycyrrhiza uralensis, a medical legume[J]. Plant J, 2017, 89: 181–195. DOI:10.1111/tpj.2017.89.issue-2 |
| [37] | Cheel J, Antwerpen PV, Tumoval L, et al. Free radical-scavenging, antioxidant and immunostimulating effects of a licorice infusion (Glycyrrhiza glabra L.)[J]. Food Chem, 2010, 122: 508–517. DOI:10.1016/j.foodchem.2010.02.060 |
| [38] | Yang Y, Bian GX, Lv QJ. Neuroprotection and neurontrophism effects of liquiritin on primary cultured hippocampal cells[J]. China J Chin Mater Med (中国中药杂志), 2008, 33: 931–935. |
 2018, Vol. 53
2018, Vol. 53