方剂是中医临床用药的主要形式, 方剂配伍与辩证立法一致, 对配伍的理解和发展直接决定方药的有效性与组方设计的合理性, 更有助于提高临床疗效及中药创新药物水平[1]。方剂在防治疾病过程中发挥了重要作用, 而其复杂体系制约了方剂科学内涵的揭示。药对是中医临床遣药组方常用且相对固定的两味中药配伍形式, 是方剂组成的基本结构, 体现了方剂配伍的精髓[2, 3]。因此, 药对的现代研究有助于解析方剂的遣药组方规律, 揭示方剂的科学内涵, 提高临床用药的有效性和安全性, 对于发展中医药配伍理论和创制现代中药都具有十分重要的理论意义与实践价值。
黄芩-黄连配伍是临床上常用的清热解毒药对, 具有清热燥湿、泻火解毒的功效。二者配伍出自《伤寒论》“葛根芩连汤”, 常“相须”为用, 协同增效, 许多经典名方如黄连解毒汤、泻心汤、三黄丸等均含有该药对[4]。现代研究表明, 黄芩-黄连药对的单体成分(黄芩苷、小檗碱等)、单味药及相关复方如葛根芩连汤等均可以显著改善胰岛素抵抗, 具有降血糖、调血脂的功效, 且可拮抗胰岛β细胞的损伤, 促进β细胞再生及功能恢复, 促进胰岛素的分泌, 该药对已成为现代中医临床用于糖尿病及其并发症治疗的遣药组方常选药味组合[5-9]。
本研究采用辐射设计法用于响应曲面研究所需要的样本例数, 即将二维坐标平均分成8等分, x轴表示黄芩单味药, y轴表示黄连单味药, 得到9个黄芩-黄连药对配比: 1:0、3:1、2:1、3:2、1:1、2:3、1:2、1:3和0:1。黄芩、黄连单味药设置6个临床等效量的不同倍数: 1、3、6、9、12和15倍。另外, 7个黄芩-黄连不同配比(3:1、2:1、3:2、1:1、2:3、1:2、1:3)设置高、低两个不同剂量。应用响应曲面法分析黄芩-黄连的配伍对2型糖尿病大鼠糖脂代谢各指标的影响, 以期阐明黄芩-黄连配伍的合理性及可行性, 为中医临床治疗糖尿病及其并发症提供科学依据。
材料与方法实验动物 SPF级雄性SD大鼠266只, 体重200 ± 20 g, 由浙江省实验动物中心提供, 许可证号: SCXK (浙) 2014-0001。
药材 黄芩(批号 为170301)购自亳州市永刚饮片有限公司; 黄连(批号为 17010)购自安徽慧隆中药饮片有限公司。
试剂与仪器 链脲佐菌素(streptozotocin, STZ, 上海源叶生物科技有限公司); 甘油三脂(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白(high-density lipoprotein, HDL-C)和低密度脂蛋白(low-density lipoprotein, LDL-C)试剂盒(南京迈博生物科技有限公司); 胰岛素(insulin, INS)和游离脂肪酸(free fatty acid, FFA)放射免疫分析测定盒(南京建成生物工程研究所); 稳择易血糖仪、血糖试纸(强生公司)。
药材提取 按一定比例(1:0、3:1、2:1、3:2、1:1、2:3、1:2、1:3、0:1)称取黄芩、黄连共9份混合物, 每份均为1 kg, 用8倍量水进行热回流提取2 h, 自然冷却后, 倾出水溶液, 药渣再用6倍量水进行热回流提取1.5 h, 自然冷却后, 倾出水溶液, 过滤药渣, 合并水提液, 进行真空减压浓缩至1.0 g·mL-1, 冷藏备用。
2型糖尿病大鼠模型的建立 将大鼠随机分为正常组和造模组, 正常组采用普通饲料喂养, 造模组采用高糖高脂饲料(基础饲料67.5%、蛋黄2.5%、蔗糖20%、猪油10%)喂养1个月后, 腹腔注射STZ (30 mg·kg-1), 72 h后测定空腹血糖(fasting blood glucose, FBG) ≥ 11.1 mmol·L-1, 即造模成功。
动物分组及给药 将造模成功的大鼠随机分为模型组、黄芩组(6个剂量)、黄连组(6个剂量)和黄芩-黄连药对组(7个不同配比, 每个配比设高、低剂量), 每组6只大鼠。黄芩组大鼠分别灌胃给予黄芩提取物临床等效量(根据中国药典中黄芩用量3~10 g, 取生药量5 g为临床1倍量)的1、3、6、9、12和15倍量, 剂量分别为0.50、1.57、3.15、4.72、6.30和7.87 g (生药)·kg-1·d-1, 各组编号为HQ (1)、HQ (3)、HQ (6)、HQ (9)、HQ (12)和HQ (15);黄连组大鼠分别灌胃给予黄连提取物临床等效量(根据中国药典中黄连用量2~5 g, 取生药量5 g为临床1倍量)的1、3、6、9、12和15倍量, 剂量分别为0.50、1.57、3.15、4.72、6.30和7.87 g (生药)·kg-1·d-1, 各组编号为HL (1)、HL (3)、HL (6)、HL (9)、HL (12)和HL (15);黄芩-黄连药对组分别灌胃给予不同配比黄芩-黄连药对提取物临床等效量的高、低浓度(黄芩、黄连的临床用量各为5 g, 本实验以此为基准, 设定各不同比例的黄芩-黄连药对临床1倍量总量为10 g)共14个样品, 黄芩-黄连3:1 (8倍、4倍)、2:1 (9倍、3倍)、3:2 (10倍、5倍)、1:1 (12倍、6倍)、2:3 (10倍、5倍)、1:2 (9倍、3倍)、1:3 (8倍、4倍), 剂量分别为8.40、4.20、9.45、3.15、10.50、5.25、12.60、6.30、10.50、5.25、9.45、3.15、8.40和4.20 g (生药)·kg-1·d-1, 各组编号分别为QL 3:1 (8)、QL 3:1 (4)、QL 2:1 (9)、QL 2:1 (3)、QL 3:2 (10)、QL 3:2 (5)、QL 1:1 (12)、QL 1:1 (6)、QL 2:3 (10)、QL 2:3 (5)、QL 1:2 (9)、QL 1:2 (3)、QL 1:3 (8)、QL 1:3 (4)。
检测指标 连续给药30天, 腹腔注射10%水合氯醛, 腹主动脉取血。大鼠血清中TG (mmol·L-1)、TC (mmol·L-1)、HDL-C (mmol·L-1)和LDL-C (mmol·L-1)水平采用相应的试剂盒测定; FINS (mU·L-1)和FFA (nmol·L-1)水平采用放射免疫分析测定盒测定。
统计学分析 实验数据采用SPSS19.0进行统计分析, 结果以x± s表示, 各给药组与模型组比较, 采用单因素方差分析中的Dunnett法进行检验, P < 0.05表示有显著性差异。
根据多指标综合指数法, 对FBG、TG、TC、HDL-C、LDL-C、FINS和FFA进行归一化处理, 计算各给药组的总改善糖脂代谢值。首先对各指标数值(V)进行标化处理, V标化=(V给药-V模型)/(V对照-V模型), 标化指标的权重采用专家评分法, 即同行业专家依据各指标在糖脂代谢综合评价的影响程度, 分别得到各指标的权重系数。本研究咨询了相关糖尿病专家并结合相关文献[10], 将FBG、FINS、TC、TG、HDL-C、LDL-C和FFA的权重系数分别设为0.6、0.4、0.2、0.5、0.05、0.1和0.01。
结果 1 外观特征正常组大鼠动作敏捷, 毛发光滑。模型组大鼠神情倦怠、毛发脱落、拱背, 饮水量明显增加, 尿量也增加, 并伴有烂尾现象。不同给药组经灌胃给药后, 大鼠状况较模型组得到明显改善, 尤其饮水量较模型组明显减少。
2 不同配比剂量黄芩-黄连药对对2型糖尿病大鼠糖脂代谢的影响与正常组相比, 模型组FBG、FINS、TC、TG、FFA和LDL-C水平显著提高(P < 0.01), HDL-C水平显著下降(P < 0.001), 这表明2型糖尿病大鼠造模成功。
不同HQ剂量组与模型组比较结果可见: HQ (1)显著降低FFA水平(P < 0.01), 而对其他指标没有明显的改善作用; 在3~15倍临床等效剂量范围内, 均显著降低TG、FFA和LDL-C水平(P < 0.05), 显著提高HDL-C水平(P < 0.01)。此外, 在6~12倍临床等效剂量范围内, 均显著降低FBG、FINS和TC水平(P < 0.05), 说明HQ (9)对2型糖尿病大鼠糖脂代谢紊乱的改善效果最佳。不同HL剂量组与模型组比较结果可见:在1~15倍临床等效剂量范围内, 均显著降低FINS和FFA水平(P < 0.05), 显著提高HDL-C水平(P < 0.05);在3~15倍临床等效剂量范围内, 均显著降低FBG水平(P < 0.05)。此外, HL (6)还显著降低TG水平(P < 0.05);在9~15倍临床等效范围内, 均显著降低TC、TG和LDL-C水平(P < 0.01), 说明HL (12)对2型糖尿病大鼠糖脂代谢紊乱的改善效果最佳。
与模型组比较, 黄芩-黄连配伍组在设定的比例、剂量范围内均显著降低TG、FFA和LDL-C水平(P < 0.05), 显著提高HDL-C水平(P < 0.05), 尤其是QL 1:1 (12)组显著降低TG水平(P < 0.001), QL 1:2 (9)组显著降低FFA、LDL-C水平(P < 0.001), 显著提升HDL-C水平(P < 0.001);除QL 2:1 (3)组外, 其余各组均显著降低FBG水平(P < 0.05), 尤其QL 1:3 (8)组(P < 0.001);除QL 3:1 (4)组外, 其余各组均显著降低FINS水平(P < 0.05), 尤其QL 1:3 (8)组(P < 0.01);除QL 3:1 (4)组、QL 3:2 (5)组、QL 1:2 (3)组和QL 1:3 (4)组外, 其余各组均显著降低TC水平(P < 0.05), 尤其QL 1:1 (12)组(P < 0.01) (表 1)。
| Table 1 Effect of Scutellaria (HQ) -Coptis (HL) with different proportions, doses on index of glucolipid metabolism of type 2 diabetes mellitus (T2DM) rats. n = 6, x± s. △△P < 0.01, △△△P < 0.001 vs normal group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group. FBG: Fasting blood glucose; FINS: Fasting insulin; TC: Total cholesterol; TG: Triglyceride; FFA: Free fatty acid; HDL-C: High-density lipoprotein; LDL-C: Low-density lipoprotein; QL: Scutellaria-Coptis herb pair |
综上可知, 各给药组对于FBG、FINS、TC、TG、FFA、LDL-C和HDL-C等指标的灵敏度较强, 提示黄芩、黄连及黄芩-黄连提取物可能通过调控以上指标发挥其改善糖脂代谢紊乱的作用, 单味药中HQ (9)和HL (12)改善糖脂代谢紊乱的效果最好, 药对中QL (12)改善糖脂代谢紊乱的效果最好, 且优于HQ (9)和HL (12), 说明二者配伍后发挥了协同增效的效应。
3 各效应观察指标的标化值与整合效应采用多指标综合指数法, 对各指标进行标化与效应整合。黄芩和黄连单味药对糖尿病大鼠的糖脂代谢改善作用在一定范围内随剂量的增大而增大, 之后随着剂量的继续增大改善作用呈现下降趋势。其中黄芩单用剂量为4.72 g·kg-1·d-1时, 效果最好; 黄连单用剂量为6.30 g·kg-1·d-1时, 效果最好。此外, 不同比例黄芩-黄连的糖脂代谢改善效果都是高剂量优于低剂量, 且1:1高剂量组的改善效果最好, 3:1低剂量组改善糖脂代谢紊乱的效果最差(表 2)。
| Table 2 Total effect (TE) values of HQ and HL combination |
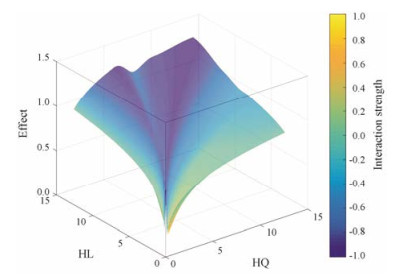
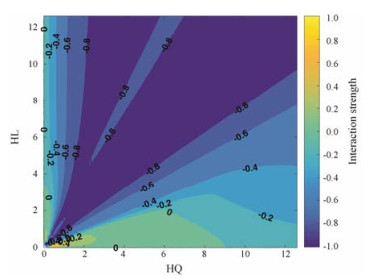
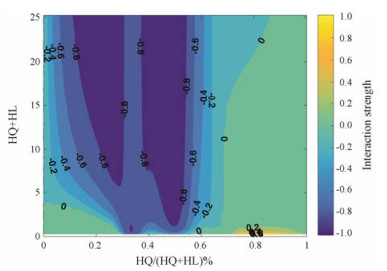
由图 1, 2可知, 在响应曲面模型中, 横坐标代表大鼠灌胃黄芩的剂量, 纵坐标代表大鼠灌胃黄连的剂量, 颜色深浅代表两味药相互作用强度的大小。依照综合指数法, 指数接近0时, 代表两味药为相加作用, 颜色为绿色; 指数接近1时, 代表两味药为拮抗作用, 颜色为黄色; 指数接近-1时, 代表两味药为协同作用, 颜色为蓝色。由图 3可知, 横坐标为黄芩在药对中的比例, 纵坐标为大鼠灌胃黄芩-黄连药对的剂量, 蓝色区域代表两味药为协同作用(相互作用值: -0.2~-0.8)。黄芩-黄连配比在3:1~1:3之间表现为协同作用(相互作用值: -0.4~-0.8), 在图中表现为蓝色, 且各比例高剂量的协同作用大于低剂量的协同作用, 尤其是1:1 (12)的协同作用最强(相互作用值: -0.8)。经过响应曲面处理后, 发现黄芩-黄连配比在7:3~1:0内, 剂量在0~10 g表现出一定的拮抗作用, 但拮抗效果不明显(相互作用值: 0.2), 在图中表现为黄色。
|
Figure 1 Three dimensional response surface digram of HQ-HL combination |
|
Figure 2 Sectional response surface digram of HQ-HL combination |
|
Figure 3 Sectional response surface digram of different proportions, doses of HQ-HL combination |
糖尿病是由于胰岛素抵抗和/或胰岛素分泌不足而引起的以慢性高血糖为主要特征的糖脂代谢紊乱疾病, 现代临床研究发现, 糖尿病患者90%以上为2型糖尿病[11]。近年来, 糖尿病及其并发症的患者人数逐年增加, 且其发病机制尚未明确, 因此构建合适、合理的动物模型对于研究2型糖尿病的发生发展具有重要意义。目前常见的糖尿病模型主要包括基因敲除、单纯化学药物诱导的糖尿病模型等[12], 而这些模型均忽略了饮食因素的影响, 因此不符合人类2型糖尿病的发病特点。本文采用高糖高脂饲料喂养并注射低剂量STZ, 诱发大鼠胰岛素抵抗[13], 结果发现, FBG、FINS、TC、TG、FFA、LDL-C水平显著提高, HDL-C水平显著降低, 表明成功建立了2型糖尿病模型, 此模型更符合人类2型糖尿病的特点。
在中药量效关系研究中, 单一指标很难反映效应的变化规律, 通过采用多指标的效应评价方法, 建立适宜的数学模型, 应用响应曲面法能较好地反映药对间的相互作用。如Huang等[14]采用响应曲面法对当归川芎药对活血效应进行整合分析, 结果发现当归-川芎配比2:1~1.3:1具有显著的协同作用。Jin等[15]采用响应曲面法阐明当归-红花配比在0.8:1~1.1:1显示较强的协同作用。为了综合反映药效, 对糖脂代谢各指标进行标化, 赋予不同指标不同的权重系数, 并采用响应曲面法定量分析黄芩和黄连的相互作用。结果表明, 黄芩-黄连配伍比例在3:2~1:3具有显著的协同作用, 且二者1:1高剂量组的协同作用较强。实验也证实了黄芩和黄连在中医临床应用的常用比例为1:1。中国药典2015版规定黄芩的临床用量为3~10 g, 黄连的临床用量为2~5 g, 在此区间内呈现一定的协同作用。如黄连解毒汤中黄芩、黄连用量各为9 g, 呈现较强的协同作用(协同值: -0.8)。黄芩-黄连配比在7:3~1:0内, 剂量在0~10 g内表现出一定的拮抗作用, 但拮抗效果并不明显。本研究为黄芩-黄连配伍应用于糖尿病及其并发症的临床治疗提供了科学依据。
| [1] | Wang XJ. Methodology for systematic analysis of in vivo efficacy material base of traditional Chinese medicine Chinmedomics[J]. Chin J Chin Mater Med (中国中药杂志), 2015, 40: 13–17. |
| [2] | Wang J, Guo LL, Yang G, et al. Methodology and prospects of study on theory of compatibility of prescriptions in traditional Chinese medicine[J]. World Sci Technol (世界科学与技术), 2006, 8: 1–5. |
| [3] | Li WX, Tang YP, Shi XQ, et al. Research on Chinese medicine pairs (IV)-their compatibility effects[J]. Chin J Chin Mater Med (中国中药杂志), 2013, 38: 4203–4207. |
| [4] | Zhang XL, Zhou MM, Jia W, et al. Survey of modern research on Coptis root Scutellaria root and their drugs in a prescription[J]. Jilin J Tradit Chin Med (吉林中医药), 2010, 30: 163–166. DOI:10.1016/S0254-6272(10)60034-9 |
| [5] | Pirillo A, Catapano AL. Berberine, a plant alkaloid with lipid-and glucose-lowering properties:from in vitro evidence to clinical studies[J]. Atherosclerosis, 2015, 243: 449–461. DOI:10.1016/j.atherosclerosis.2015.09.032 |
| [6] | Zhao L, Cang Z, Sun H, et al. Berberine improves gluco-genesis and lipid metabolism in nonalcoholic fatty liver dis-ease[J]. BMC Endocr Disord, 2017, 17: 13. DOI:10.1186/s12902-017-0165-7 |
| [7] | Zhang Z, Zhang H, Li B, et al. Berberine activates thermogenesis in white and brown adipose tissue[J]. Nat Commun, 2014, 5: 5493. DOI:10.1038/ncomms6493 |
| [8] | Song KH, Lee SH, Kim BY, et al. Extracts of Scutellaria baicalensis reduced body weight and blood triglyceride in db/db mice[J]. Phytother Res, 2013, 27: 244–250. DOI:10.1002/ptr.v27.2 |
| [9] | Zhang CH, Xu GL, Liu YH, et al. Anti-diabetic activities of Gegen Qinlian Decoction in high-fat diet combined with streptozotocin-induced diabetic rats and in 3T3-L1 adipocytes[J]. Phytomedicine, 2013, 20: 221–229. DOI:10.1016/j.phymed.2012.11.002 |
| [10] | Quan L, Lu YJ, Wan QP, et al. Study on evaluation index system and weight of management effect of diabetes mellitus[J]. Chin J Health Stati (中国卫生统计), 2014, 31: 663–666. |
| [11] | American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2014, 37: S81–S90. DOI:10.2337/dc14-S081 |
| [12] | Zhu C, Zhu YY. Animal models of type Ⅱ diabetes:an overview[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2013, 21: 84–88. |
| [13] | Yu T, Sungelo MJ, Goldberg IJ, et al. Streptozoto-cin-treated high fat fed mice:a new type 2 diabetes model used to study canagliflozin-induced alterations in lipids and lipoproteins[J]. Horm Metab Res, 2017, 49: 400–406. DOI:10.1055/s-0042-110934 |
| [14] | Huang MY, Tang YP, Shang EX, et al. Study on interaction of activating blood effects of the herb pair constituted by danggui and chuanxiong by response surface method[J]. Chin Pharmacol Bull (中国药理学通报), 2012, 28: 1407–1413. |
| [15] | Jin Y, Pu ZJ, Tang YP, et al. Effect of promoting blood circulation of herb pair containing Angelicae Sinensis Radix and Carthami Flos[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 2087–2092. |
 2018, Vol. 53
2018, Vol. 53


