2. 山西振东安特生物制药有限公司, 山西 晋中 030600;
3. 山西大学化学化工学院, 山西 太原 030006
2. Shanxi Zhendong Ante Biological Pharmaceutical Co., Ltd., Jinzhong 030600, China;
3. College of Chemistry and Chemical Engineering of Shanxi University, Taiyuan 030006, China
脑震宁颗粒是由当归、地黄、牡丹皮、川芎、地龙、丹参、茯苓、陈皮、炒酸枣仁、竹茹和柏子仁共11味中药经科学提取加工制成的一种中药复方制剂。临床常用于治疗颅脑损伤后遗症、血管神经性头痛[1], 具有凉血活血、化瘀通络、补血安神、宁心定智、除烦止呕之功效[2], 是一种改善中轻型颅脑外伤症状, 促进功能恢复, 纠正植物神经功能紊乱的有效药物[1]。目前关于脑震宁颗粒的研究多是药理药效[3]以及基于阿魏酸[4]、橙皮苷[4, 5]、丹酚酸B[5]等指标成分的含量测定。由于脑震宁颗粒组方中含有11味中药材, 导致其化学成分非常复杂。然而其化学成分和物质基础研究目前未见报道, 明确其化学成分对于进一步阐明脑震宁颗粒药效物质基础以及作用机制是非常必要的。
液质联用技术具有高分离能力、高灵敏度和专属性强的特点, 在天然产物的定性鉴别中发挥着重要的作用。UHPLC-Q Exactive轨道高分辨质谱将四级杆母离子选择性与高分辨率和准确质量数(HRAM) Orbitrap检测相结合, 具有高灵敏度, 在一次扫描中同时检测痕量级和高丰度化合物, 可用于中药复杂体系的快速分析和成分识别, 如金钗石斛[6]、酸枣仁[7]、酸枣叶[8]、中华苦荬菜与苣荬菜[9]、黄芪建中汤[10]等。本研究拟采用UHPLC-Q Exactive轨道肼高分辨质谱对脑震宁颗粒的化学成分进行分析鉴定, 得到所含成分的准分子离子峰及蕴含丰富结构信息的碎片离子峰, 从而对其结构进行准确、快速的鉴定, 为脑震宁颗粒质量控制和药效物质基础研究奠定依据。
材料与方法仪器与试剂 Thermo fisher U3000超高效液相色谱仪, 配置在线脱气机、四元梯度泵、柱温箱、自动进样器(美国Thermo Fisher Scientific公司), Thermo ScientificTMQ ExactiveTM组合型四极杆Orbitrap质谱仪; 十万分之一天平(梅特勒−托利多仪器有限公司); 数据分析采用Xcalibur 3.2软件, Compound Discover 2.0软件。超纯水由Milli-Q Integral Water Purification System (美国Millipore公司)制备, 甲酸、乙腈为色谱纯(美国Thermo公司), 甲醇(分析纯)购于天津市大茂化学试剂厂。
对照品与药材 对照品斯皮诺素(批号: 131217, 质量分数≥98%)、酸枣仁皂苷A (批号: A0274, 质量分数≥98%)、酸枣仁皂苷B (批号: A0275, 质量分数≥98%)、梓醇(批号: 0808-9803, 质量分数≥98%)、柚皮苷(批号: 110722-200309, 质量分数≥98%)、丹皮酚(批号: 110708-200506, 质量分数≥98%)、芍药苷(批号: 110736-201640, 质量分数≥98%)购自中国食品药品检定研究院; 当药黄素(批号: 140516, 质量分数≥98%)购自四川省维克奇生物科技有限公司; 咖啡酸(批号: YJ-141119, 质量分数≥98%)、绿原酸(批号: YJ-141004, 质量分数≥98%)、新绿原酸(批号: YJ-140925, 质量分数≥98%)、隐绿原酸(批号: YJ-141020, 质量分数≥98%)、橙皮苷(批号: YJ-141108, 质量分数≥98%)购自江苏永健医药有限公司; 没食子酸(批号: 20130729, 质量分数≥98%)购自上海源叶生物科技有限公司; 亚正丁基苯酞内酯, (E)+(Z) (批号: 10153545, 质量分数≥95%), 购自阿法埃莎(中国)化学有限公司。脑震宁颗粒(批号: 20151202, 20160501, 20160609)以及当归、地黄、牡丹皮、川芎、地龙、丹参、茯苓、陈皮、炒酸枣仁、竹茹和柏子仁药材由山西振东安特生物制药有限公司提供, 药材均经山西大学秦雪梅教授鉴定, 当归为伞形科植物当归[Angelica sinensis (Oliv.) Diels]的干燥根, 地黄为玄参科植物地黄(Rehmannia glutinosa Libosch.)干燥块根, 牡丹皮为毛茛科植物牡丹[Paeonia suffruticosa Andr.]的干燥根皮, 川芎为伞形科植物川芎[Ligus ticum chuanxiong Hort.]的干燥根茎, 地龙为钜蚓科环毛属参环毛蚓[Pheretima aspergillum (E. Perrier)]的干燥虫体, 丹参为唇形科植物丹参[Salvia miltiorrhiza Bge.]的干燥根及根茎, 茯苓为多孔菌科真菌茯苓[Poria cocos (Schw.) Wolf]的干燥菌核, 陈皮为芸香科柑橘属植物橘[Citrus reticulata Blanco]及其栽培变种的干燥成熟果皮, 酸枣仁为鼠李科植物酸枣[Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H.F.Chou]的干燥成熟种子, 竹茹为禾本科植物淡竹[Phyllostachys nigra (Lodd.) Munro var. henonis (Mitf.) Stapf ex Rendle]的茎秆的干燥中间层, 柏子仁为柏科植物侧柏[Platycladus orientalis (L.) Franco]的干燥成熟种仁。
供试品溶液的制备 取三批脑震宁颗粒混匀, 称取1 g, 研细, 置于具塞锥形瓶中, 加入50 mL 50%甲醇溶液, 超声提取30 min, 放至室温, 用定性滤纸过滤, 取上清液经0.22 µm微孔滤膜滤过, 置4 ℃冰箱备用。
单味药材样品溶液的制备 分别称取各单味药当归、地黄、牡丹皮、川芎、地龙、丹参、茯苓、陈皮、炒酸枣仁、竹茹和柏子仁各10 g, 分别加水100 mL煎煮1.5 h, 滤过, 浓缩后分别置于50 mL锥形瓶, 加50%甲醇溶液50 mL, 超声提取30 min, 用定性滤纸过滤, 取上清液经0.22 µm微孔滤膜滤过, 置4 ℃冰箱备用。
对照品溶液的配制 分别取各对照品适量, 精密称定, 用甲醇制备斯皮诺素(1.220 mg·mL−1)、酸枣仁皂苷A (1.240 mg·mL−1)、酸枣仁皂苷B (1.260 mg·mL−1)、当药黄素(1.130 mg·mL−1)、梓醇(1.230 mg·mL−1)、柚皮苷(1.250 mg·mL−1)、丹皮酚(1.240 mg·mL−1)、橙皮苷(1.210 mg·mL−1)、绿原酸(1.350 mg·mL−1)、新绿原酸(1.510 mg·mL−1)、隐绿原酸(1.420 mg·mL−1)、阿魏酸(1.020 mg·mL−1)、没食子酸(1.550 mg·mL−1)、咖啡酸(1.270 mg·mL−1)、芍药苷(1.250 mg·mL−1)、亚正丁基苯酞内酯(1.550 mg·mL−1)对照品储备液, 各取200 µL到5 mL量瓶, 用50%甲醇溶液定容, 制备成混合对照品溶液。
超高效液相色谱条件 色谱柱为Waters Acquity UPLC BEH C18液相色谱柱(2.1 mm × 100 mm, 1.7 µm), 流动相为A: 0.1%甲酸水溶液; B:乙腈。梯度洗脱, 0~15 min, 5%~20% B; 15~20 min, 20%~35% B; 20~30 min, 35%~55% B。检测波长为290 nm, 柱温为45 ℃, 流速为0.2 mL·min−1, 进样量为1 μL。
质谱条件 Full MS/DD MS2 (TOPN); 离子源:电喷雾离子源(HESI); 扫描方式:正负离子同时扫描; 毛细管温度: 320 ℃; 鞘气体积流量为35 psi (1 psi ≈ 6.9 kPa), 辅助气体积流量为10 psi; 喷雾电压:正离子模式为3.5 kV, 负离子模式为2.5 kV, 透镜电压55 kPa; 探头加温器温度: 300 ℃; 最大喷雾电流: 100 V; NEC: 10, 30, 50;质量扫描范围均为m/z 100~1 500, 质量分辨率70 000。
数据处理分析 将采集到的原始质谱数据运用Xcalibur 3.2数据软件进行峰提取、峰匹配分析处理。将采集到的原始质谱数据导入Compound Discover 2.0软件, 与数据库进行计算匹配, 导出样品名称、保留时间、分子式、质荷比、以及对应的离子强度组成的数据集, 主要参数设置如下:保留时间范围0~25 min; 质荷比范围为100~1 500 Da; 偏差为5 ppm; 信噪比为3;保留时间漂移值为0.1 min。
结果采用UHPLC-Q Exactive轨道肼高分辨质谱对脑震宁颗粒进行分析, 同时获得正负离子模式下多级质谱数据, 然后运用Xcalibur 3.2数据软件进行分析处理。正、负总离子流分别如图 1所示。

|
Figure 1 Total ion chromatogram (TIC) of Naozhenning granule in negative mode (A), TIC of Naozhenning granule in positive mode (B). The peak numbers in A and B were in accordance with table 1 and 2, respectively |
| Table 1 Chemical constituents identified in Naozhenning granule by UHPLC-MS in negative mode. D: Rehmanniae Radix; G: Radix Angelicae Sinensis; C: Citrus reticulata; S: Radix Salviae Miltiorrhizae; L: Pheretimaaspergillum; M: Cortex Moutan; Z: Ziziphi Spinosae Semen; X: Chuanxiong Rhizoma; R: Bamboo bark; B: Seed of oriental arborvitae; F: Poriacocos. a: Identified by comparing with the standards; b: Identified by comparing with the MS data from reference; c: Identified by Compound Discover 2.0; d: Identified by pseudo molecular ion peaks. HA: p-Hydoxyphenylactic acid; DHA: DL-4-Hydroxyphenyllactic acid; HOG: Hespe-retin-7-O-glucoside; CMGC: Cortex Moutan glycosides C; RI: Rehmannioside/Iso-rehmannioside; BOHD: 4H-1-Benzopyran-4-one, 5-hydroxy-2-(3-hydroxy-4, 5-dime-thoxyphenyl)-7, 8-dimethoxy; ATTPLI: Cyclo (L-alanyl-L-threonylglycyl-L-threonyl-L-phenylalanyl-L-leucyl-L-isoleucyl); GSPLLPT: Cyclo (glycyl-L-seryl-prolyl-L-leucyl-L-leucyl-L-prolyl-L-tyrosyl) |
| Table 2 Chemical constituents identified in Naozhenning granule by UHPLC-MS in positive mode. a: Identified by comparing with the standards; b: Identified by comparing with the MS data from reference; c: Identified by Compound Discover 2.0; d: Identified by pseudo molecular ion peaks. DF: N-(2, 4-Dimethylphenyl) formamide; ANDA: 9-Amino-1, 3, 9-nonanedicarboxylicacid; GHIA: 3S-N-glc-3-hydroxy-indoleaceticacid; AEOA: (S)-2-{[(benzyloxy)carbonyl]amino}-5-ethoxy-5-oxopentanoic acid; GHIA: 3R-N-glc-3-hydroxy-indoleacetic acid; ODDA: 9-Oxo-10(E), 12(E)-octadecadienoic acid |
脑震宁颗粒中的环烯醚萜苷类化合物来源于地黄, 其中梓醇是代表性成分。在负离子模式下化合物11得到准分子离子峰m/z 361.112 9 [M–H]–, 然后失去一分子葡萄糖(Glu)得到m/z 199.060 5 [M–H–Glu]–, 进一步失去一分子–CH2O得到m/z 169.050 0 [M–H–Glu–CH2O]–; 此外, 准分子离子峰还可失去一分子–CH2O得到m/z 331.066 9 [M– H–CH2O]–。进一步通过与梓醇对照品的质谱行为进行比对后确定化合物11为梓醇。
负离子模式下化合物18的准分子离子峰m/z 345.118 0 [M–H]–, 一方面失去一分子Glu得到m/z 183.066 1 [M–H–Glu]–, 随后再失去一分子H2O得到m/z 165.055 2 [M–H–Glu–H2O]–。另一方面准分子离子峰失去一分子H2O得到m/z 327.128 0 [M–H–H2O]–, 再失去一分子H2O得到m/z 309.108 9 [M–H–2H2O]–, 与文献中桃叶珊瑚苷的质谱碎片一致[11]。脑震宁颗粒中鉴定的环烯醚萜苷类化合物还包括地黄苷A[11]、地黄苷D[11]、单密力特苷[11]、京尼平苷[11], 该类成分均为负离子模式下鉴定。环烯醚萜苷类化合物裂解途径有一定的共性规律, 大多会失去H2O、–CH2O等中性碎片, 或是失去糖得到苷元后再失去H2O、–CH2O等。
1.2 丁基苯酞类当归和川芎均含有丁基苯酞类化合物。在正离子模式下, 化合物58、65具有相同的准分子离子峰m/z 189.091 1 [M+H]+, 保留时间分别为16.26和17.98 min。在正离子二级质谱图中, 化合物58准分子离子峰失去一分子H2O得到m/z 171.080 4 [M+H–H2O]+, 再失去一分子H2O, 得到m/z 153.069 5 [M+H–2H2O]+, 准分子离子峰还可同时失去H2O和CO得到m/z 143.085 6 [M+H–H2O–CO]+, 另外还观察到m/z 105.033 8 [M+H–C5H8O]–的碎片峰; 化合物65产生的碎片离子包括m/z 153.069 9 [M+H–2H2O]+、m/z 143.085 6 [M+H–H2O–CO]+、m/z 105.033 8 [M+H– C5H8O]–。通过和对照品的保留时间和质谱碎片相比对, 结合文献[12, 13]报道确认化合物58、65分别为E-丁烯基苯酞和Z-丁烯基苯酞。
在正离子模式下, 化合物66的保留时间为18.12 min, 准分子离子峰为m/z 191.106 8 [M+H]+, 在二级质谱中失去一分子H2O得到m/z 173.096 1 [M+ H–H2O]+, 失去一分子CO得到m/z 163.111 5 [M+H– CO]+; 化合物78的保留时间为20.25 min, 准分子离子峰为m/z 191.106 7 [M+H]+, 在二级质谱中失去一分子H2O得到m/z 173.096 1 [M+H–H2O]+, 失去一分子CO得到m/z 163.111 7 [M+H–CO]+; 结合文献[12, 13]报道, 推测保留时间较小的化合物66为E-蒿本内酯, 化合物78为Z-蒿本内酯。此外, 脑震宁颗粒中鉴定的丁基苯酞类化合物还包括senkyunolide H/I[12, 13]、butylphthalide[12, 13]、senkyunolide A[12, 13], 该类成分均为正离子模式下鉴定。丁基苯酞类化合物在正离子模式下一般会失去一分子CO形成四元环, 进一步电子转移再失去一分子H2O; 或内酯环电子转移失去一分子H2O, 进一步电子转移再失去一分子H2O。
1.3 黄酮氧苷类在正离子模式下, 化合物44的准分子离子峰为m/z 581.186 8 [M+H]+, 并通过m/z 603.168 6 [M+Na]+进一步确认其为准分子离子峰。在二级质谱中, 准分子离子峰失去鼠李糖(rhamnose, Rha)得到m/z 435.128 1 [M+H–Rha]+, 进一步失去一分子Glu则得到二氢黄酮苷元, 其m/z 273.075 6 [M+ H–Rha–Glu]+。该苷元可发生裂解得到m/z 147.044 1, 并进一步失去CO得到m/z 119.049 3。在正离子模式下化合物48产生m/z 611.197 7 [M+H]+的准分子离子峰和m/z 633.179 6 [M+Na]+, 准分子离子峰失去3分子H2O产生m/z 557.158 6, 同时裂解产生m/z 465.139 1 [M+H–Rha]+, 进一步失去一分子Glu得到m/z 303.086 3 [M+H–Rha–Glu]+, 柚皮苷和橙皮苷的质谱行为均与对照品一致。
在正离子模式下, 化合物56的准分子离子峰为m/z 595.202 1 [M+H]+, 并找到m/z 617.183 8 [M+Na]+, 准分子离子峰失去Rha得到m/z 449.144 2 [M+H– Rha]+, 进一步失去O得到m/z 433.148 9 [M+H–Rha–O]+, 继续失去H2O得到m/z 415.138 1 [M+H–Rha–O–H2O]+、m/z 397.128 3 [M+H–Rha–O–2H2O]+; 准分子离子峰失去一分子Rha、一分子Glu得到m/z 287.091 2 [M+ H–Rha–Glu]+, 与文献[14]报道的枸橘苷质谱裂解碎片一致。脑震宁中鉴定的黄酮氧苷类化合物还包括陈皮中的芸香柚皮苷[14], 炒酸枣仁中的当药黄素[15]。该类成分均为正离子模式下鉴定, 质谱碎片主要是氧苷键断裂和脱水产生。
1.4 黄酮碳苷类酸枣仁中含有斯皮诺素等黄酮碳苷类化合物。在负离子模式下化合物52产生m/z 607.166 8 [M–H]–准分子离子峰, 失去一分子Glu得到m/z 445.114 6 [M–H–Glu]–, 继续失去一分子H2O得到m/z 427.103 2 [M–H–Glu–H2O]–, 失去C4H8O4则产生m/z 325.071 8 [M–H–Glu–C4H8O4]–。其质谱行为与斯皮诺素对照品一致。
在负离子模式下化合物41产生m/z 593.151 2 [M–H]–的准分子离子峰, 失去一分子H2O得到m/z 445.114 6 [M–H–H2O]–, 失去C4H8O4产生m/z 473.108 8 [M–H–C4H8O4]–, 失去两个C4H8O4产生m/z 353.066 6 [M–H–2C4H8O4]–, 再失去一分子CO得到m/z 325.071 3 [M–H–2C4H8O4–CO]–, 与黄酮碳苷的裂解途径相一致, 参考文献[16]报道的裂解规律, 可以推测化合物41为vicenin Ⅱ。在负离子模式下该类化合物的碳苷键难以断裂, 首先出现丢失C4H8O4的碎片。
1.5 单萜苷类牡丹皮中含有以芍药苷为代表的单萜苷类化合物。在负离子模式下化合物47产生准分子离子峰m/z 479.155 6 [M–H]–、m/z 525.161 1 [M+ HCOO–]–。准分子离子峰失去CH2O得到m/z 449.145 4 [M–H–CH2O]–, 酯键断裂再脱水得到m/z 327.108 9 [M–H–CH2O–C7H6O2]–, 进一步脱去C6H10O5得到m/z 165.054 9 [M–H–CH2O–C7H6O2–C6H10O5]–。通过和对照品质谱数据比较, 可以确定化合物47为芍药苷。
在负离子模式下化合物31产生准分子离子峰m/z 495.150 6 [M–H]–, 准分子离子峰失去CH2O得到m/z 465.150 6 [M–H–CH2O]–, 苯甲酰酯键断裂同时脱掉1分子H2O得到m/z 327.107 0 [M–H–CH2O– C7H6O3]–, 最后再脱去C6H10O5得到m/z 165.055 0 [M–H–CH2O–C7H6O3–C6H10O5]–, 另外还有酯键断裂产生的m/z 137.023 6。通过与文献报道的裂解碎片[17]比较推测化合物31为氧化芍药苷(图 2)。通过分析该类化合物的质谱裂解规律, 从脑震宁中鉴定的该类成分还包括没食子酰芍药苷[17]、没食子酰芍氧化药苷[17]、苯甲酰芍药苷[17]、苯甲酰氧化芍药苷[17]、牡丹皮苷C[17], 该类成分均为负离子模式下鉴定。单萜苷类化合物在负离子模式下裂解途径相近, 通常是丢失–CH2O后酯键或糖苷键断裂, 最后都会得到m/z 165的碎片峰。
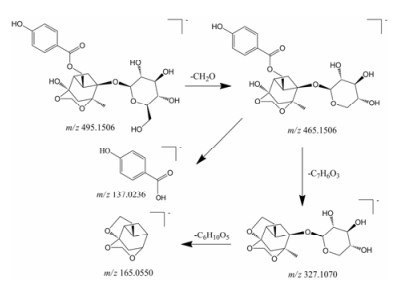
|
Figure 2 Fragmentation process of oxypaeoniflorin |
新绿原酸、绿原酸、隐绿原酸互为同分异构体, 其分子式均为C16H18O9。在负离子模式下均产生准分子离子峰m/z 353.087 7 [M– H]–, 保留时间分别为4.41、7.05、7.52 min (化合物25、30、32)。进一步分析二级质谱数据, 化合物25酯键断裂, 准分子离子峰失去C9H7O3, 得到m/z 191.055 6 [M–C9H7O3]–, 进一步失去一分子H2O, 得到m/z 173.045 0 [M–C9H7O3–H2O]–, 另外还有脱掉奎尼酸产生的m/z 179.034 3 [M–C7H11O5]–碎片峰, 而化合物30、32也产生相同的碎片峰, 与对照品和文献[18, 19]中报道的碎片峰相一致。通过与对照品保留时间对照, 可以确定化合物25、30、32分别为新绿原酸、绿原酸、隐绿原酸。
1.7 丹酚酸类丹酚酸类化合物是丹参的特征成分。在负离子模式下化合物68得到准分子离子峰m/z 717.146 3 [M–H]–, 分子离子峰进行电子转移, 失去C9H10O5得到m/z 519.092 8 [M–H–C9H10O5]–, 然后进一步裂解得到m/z 339.050 5 [M–H–C18H18O9]–、m/z 321.040 0 [M–H–C18H20O10]–、m/z 295.060 5 [M–H– C19H18O11]–, 与文献[20]报道质谱碎片裂解途径相一致, 所以推测化合物68为丹酚酸B (图 3)。
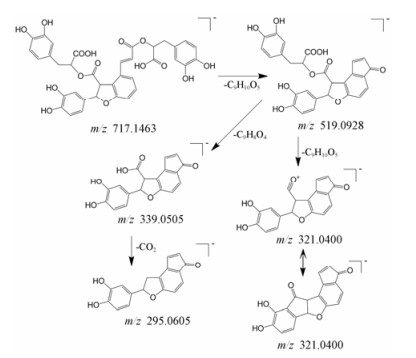
|
Figure 3 Fragmentation process of salvianolic acid B |
在负离子模式下化合物65下产生m/z 493.113 9 [M–H]–准分子离子峰, 可进一步裂解得到m/z 313.071 5 [M–H–C9H8O4]–, 或酯键断裂失去C9H10O5得到m/z 295.061 1 [M–H–C9H10O5]–, 然后再失去一分子H2O得到m/z 277.050 4 [M–H–C9H10O5–H2O]–, 参考文献[21]报道的裂解特征推测化合物65为丹酚酸A。通过分析该类化合物的共性裂解特征, 从脑震宁颗粒中鉴定的丹酚酸类化合物还包括丹酚酸C[21]、丹酚酸D[21]、丹酚酸E[21]、丹酚酸F[21]、丹酚酸H/I[21], 该类成分均为负离子模式下鉴定。
1.8 生物碱类在正离子模式下, 化合物32产生m/z 286.143 6 [M+H]+准分子离子峰, 二级质谱中产生碎片m/z 269.117 0 [M+H–NH3]+、m/z 254.096 1 [M+ H–NH3–CH3]+、m/z 237.090 8 [M+H–CH3O–H2O]+, 参照文献报道的质谱碎片推测其为乌药碱[15]。化合物37在正离子模式下产生m/z 342.170 1 [M+H]+准分子离子峰, 二级质谱产生m/z 311.127 0 [M+H–CH3O]+和311.127 0 [M+H–C2H6N]+, 推测其为木兰花碱[19]。脑震宁中鉴定的生物碱类化合物还包括酸李碱[15]、N-glc-indoleaceticacid[15]、juzirine[15]、lotusine[15], 这些成分均来源于酸枣仁, 且均在正离子模式下鉴定。
1.9 其他类化合物通过与对照品比对保留时间和精确分子量还鉴定了酸枣仁皂苷A、B, 由于酸枣仁皂苷类成分分子量大, 难以电离, 仅提取到酸枣仁皂苷A、B的准分子离子峰, 未检测到其碎片峰及其同类成分。
此外, 脑震宁中还含有氨基酸、小分子有机酸等化合物, 这些化合物的鉴定主要通过裂解碎片分析并结合文献对照完成。在负离子模式下化合物50产生准分子离子峰m/z 193.050 1 [M–H]–, 裂解失去CH3得到m/z 178.026 5 [M–H–CH3]–, 或失去一分子CO2得到m/z 149.060 0 [M–H–CO2]–, 与对照品质谱行为相一致。脑震宁中鉴定的小分子有机酸类化合物还包括柠檬酸[11]、琥珀酸[22]、没食子酸[17]、香草酸[18]、原儿茶酸[21]、对香豆酸[18, 23]、对羟基苯乙酸[23]、原儿茶酸[21]和咖啡酸[21], 这些成分均在负离子模式下鉴定。
在正离子模式下, 化合物13产生准分子离子峰m/z 182.081 2 [M+H]+, 二级质谱中产生碎片m/z 165.054 6 [M+H–NH3]+、m/z 136.061 8 [M–COOH]+、m/z 119.049 3 [M+H–NH3–COOH]+和m/z 107.049 7 [M+H–NH3–COOH–NH]+, 通过参照文献报道的质谱碎片推测其为酪氨酸[22]。脑震宁中鉴定的氨基酸类化合物还包括亮氨酸[22]、苯丙氨酸[22]、色氨酸[22]、赖氨酸[22]、精氨酸[22]和谷氨酸[22], 均在正离子模式下鉴定。
2 Compound Discover 2.0指认将样品和空白溶剂的谱图导入Compound Discover 2.0中, 设置预测化合物的分子组成为C、H、O、N, 并将化合物碎片匹配值设置在50%以上, 通过CD数据库进行自动结构指认, 鉴定出93个可能的结构, 手动去除非天然产物、未提取到准分子离子峰的化合物、匹配度低于70%且未在二级质谱图中找到碎片的化合物后, 共指认53个化合物, 其中包括上述手动鉴定的化合物12个, 新鉴定化合物41个, 主要包括隐丹参酮、柠檬苦素、neodiosmin、prunin等次级代谢物, 以及葡萄糖醛酸、甘露糖、棉子糖等初级代谢物。
3 药材中特征化合物的鉴定通过TCMSP数据库(http://ibts.hkbu.edu.hk/LSP/tcmsp.php )进一步查询单味药材中含有的特征成分, 并从中筛选出上述裂解规律分析和CD自动鉴定过程中均未得到鉴定的成分, 分别列出分子式, 在Xcalibur 3.2软件中提取这些化合物可能产生的准分子离子峰, 共有14个成分检测到准分子离子峰, 但无二级碎片或仅有少量裂解途径未知的碎片, 包括水苏糖、二氢梓醇、槲皮素等。
综上, 采用上述指认策略从脑震宁颗粒中共指认出161个化合物, 其中负离子模式下鉴定成分81个(表 1[7, 1, 12, 15−19, 21−25]), 正离子模式下鉴定成分80个(表 2[12−15, 17, 19, 22, 26])。按照结构鉴定的可靠性, 将定性分析结果由高到低分为4个不同层次。a为与对照品比对鉴定, 包括16个化合物; b为分析精确分子质量、裂解碎片结合文献数据对照鉴定, 包括106个化合物; c为Compound Discover 2.0自动鉴定, 包括54个化合物, 见表 3; d为仅检测到准分子离子峰的药材特征性成分, 包括14个化合物。
| Table 3 The mz Cloud best matches of chemical constituents identified by Compound Discover 2.0 |
通过比较脑震宁颗粒与单味药总离子流图保留时间初步判断峰来源, 然后通过保留时间下的质谱图比对进一步确定峰的归属。脑震宁中鉴定的161个成分中, 有42个来源于地黄, 54个来源于当归, 58个来源于川芎, 62个来源于陈皮, 50个来源于丹参, 49个来源于牡丹皮, 64个来源于酸枣仁, 36个来源于竹茹, 37个来源于柏子仁, 32个来源于地龙, 28个来源于茯苓。上述鉴定和归属的化合物中包括部分共有成分, 如氨基酸类, 糖类, 以及柠檬酸、琥珀酸、原儿茶酸、阿魏酸、咖啡酸、对香豆酸等小分子有机酸类, 在多种药材中均有发现。
讨论通过分析裂解碎片信息、结合文献及对照品MS数据对照, 并借助Compound Discover 2.0自动指认, 共鉴定出脑震宁颗粒中161个化合物, 包括环烯醚萜苷类、丁基苯酞类、黄酮苷类、酚酸类、单萜苷类等, 所构建的脑震宁化学成分物质组为其质量控制和药效物质基础研究奠定了基础。
柏子仁主要成分是脂肪油[26], 茯苓主要成分是三萜类化合物[27], 竹茹的主要化学成分是木脂素类[28]和三萜类[29], 这些极性较低的化学成分在本研究中检出较少, 原因可能在于脑震宁颗粒的生产工艺中这些药材均为水煎煮提取。脑震宁颗粒化学成分复杂, 对于在液质联用中难以电离或存在离子抑制的成分, 还需要进一步采用核磁共振等非选择性技术进行分析。此外, 脑震宁颗粒生产过程中包括当归、牡丹皮、陈皮、川芎的挥发油成分提取, 因此该中成药还含有丰富的挥发性成分, 下一步还将采用气质联用对其挥发性成分进行系统分析。
| [1] | Xiao S, Wu FP, Zheng WM, et al. Analysis of 98 cases of craniocerebral trauma treated by Naozhenning granule[J]. J Mod Med Health (现代医药卫生), 2005, 21: 1711. |
| [2] | Shi DF, Zhang C. 66 Cases of headache after brain traumatreated by Naozhenning granule[J]. Hebei J Tradit Chin Med (河北中医), 2006, 28: 358. |
| [3] | Zhang MS, Sun DC, Gao SJ, et al. Experimental study on the pharmacodynamics of the Naozhenning granule[J]. Chin Tradit Pat Med (中成药), 1997, 19: 33–34. |
| [4] | Li J, Li XY. Determination of ferulic acid and hesperidin in Naozhenning granule by HPLC[J]. Pharm J Chin People's Lib Army (解放军药学学报), 2009, 25: 264–265. |
| [5] | Li XY, Hao SJ, Wang XD, et al. Determination of salvianolic acid B and hesperidin in the Naozhenning granule by high performance liquid chromatography[J]. China J Hosp Pharm (中国医院药学杂志), 2010, 30: 1508–1510. |
| [6] | He YQ, Lu YL, Li LS, et al. Analysis of alkaloids from dendrobiumnobile stem by UPLC-ESI-orbitrap-MS[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 30–35. |
| [7] | Yan Y, Li Q, Qin XM, et al. Investigation of the potentially effective components of Semen Ziziphi Spinosae based on "in vitro to in vivo" translation approach[J]. Acta Pharm Sin (药学学报), 2017, 52: 283–290. |
| [8] | Yan Y, Du CH, Qin XM, et al. Integrated strategy of UHPLC-Q exactive orbitrap-HRMS and HPLC-CL to study with constituents in Ziziphi Spinosae Folium[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 3109–3114. |
| [9] | Liu HX. Comparative Study on Major Chemical Constituents and Anti-inflammatory and Hepatoprotective Activities of Ixeris chinensis (Thunb. ) Nakai and Sonchus brachyotus DC (中华苦荬菜与苣荬菜主要化学成分及保肝抗炎药理作用的比较研究)[D]. Taiyuan: Shanxi University of Chinese Medicine, 2016. |
| [10] | Hu YH, Qin XM, Liu YT, et al. Rapid identification of chemical constituents in Huangqi Jianzhong Tangby UHPLC coupled with hybrid quadrupole-orbitrap MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 964–970. |
| [11] | Zhang BY, Jiang ZZ, Wang YF, et al. Analysis of chemical constituents in fresh dried and prepared Rehmanniae Radix by UPLC/ESI-Q-TOF MS[J]. Chin Tradit Pat Med (中成药), 2016, 38: 1104–1108. |
| [12] | Qian YY, Wang YL, Sa RN, et al. Metabolic fingerprinting of Angelica sinensis during growth using UPLC-TOF MS and chemometrics data analysis[J]. Chem Cent J, 2013, 7: 42. DOI:10.1186/1752-153X-7-42 |
| [13] | Zuo AH, Cheng MC, Wang L, et al. Analysis of constituents absorbed into the brain in chuanxiong by UPLC-Q-TOF MS[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3647–3650. |
| [14] | Zhang L, Zhou J, Zhu W, et al. Comparative study on chemical constituents in Pericarpium Citri Reticulatae, citrus peels and fermented Citrus peels by HPLC-DAD-ESI-MSn and GC-MS[J]. Food Ferment Ind (食品与发酵工业), 2013, 39: 192–199. |
| [15] | Zhang FX, Li M, Qiao LR, et al. Rapid characterization of Ziziphi Spinosae Semen by UPLC/Qt of MS with novel informatics platform and its application in evaluation of two seeds from Ziziphus species[J]. J Pharm Biomed Anal, 2016, 122: 59–80. DOI:10.1016/j.jpba.2016.01.047 |
| [16] | Wang WJ, Luo JG, Kong LY. Analysis of the chemical constituentsin Ziziphi Spinosae Semen by HPLC-ESI-MSn[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 2769–2773. |
| [17] | Hu YF, Pei YM, Wu H, et al. Difference analysis of chemical compositions in Moutan Cortex from different origins by UPLC-Q-TOF-MS[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2984–2991. |
| [18] | Su SL, Cui WX, Zhou W, et al. Chemical fingerprinting and quantitative constituent analysis of Siwu decoction categorized formulae by UPLC-QTOF/MS/MS and HPLC-DAD[J]. Chin Med, 2013, 8: 5. DOI:10.1186/1749-8546-8-5 |
| [19] | Zhu YX, Chen LL, Gong JR, et al. Analysis of the chemical constituents in Suanzaoren Tang by LC-Q-TOF-MS and LC-IT-MS[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 457–465. |
| [20] | Wang H, Wang Q. ESI-MSn performance and LC-MSn fingerprint of salvianolic acid constituents from Radix et Salviae Miltiorrihizae[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2007, 25: 1387–1389. |
| [21] | Qi XX, Dong Y, Shan CX, et al. Analysis of the main components in herbal pair:Astragali Radix and Salviae Miltiorrhizae by UFLC-Q-TOF/MS[J]. J Univ Tradit Chin Med (南京中医药大学学报), 2017, 33: 93–96. |
| [22] | Zhang Y, Dong WT, Huo JH, et al. Analysis on chemical constituents of Pheretima aspergillum by UPLC-Q-TOF-MS[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 252–262. |
| [23] | Li R. Studies on the Quality Standard of Huang Qi Extract and the Chemical Constituents of CiZhuRu (中药黄芪提取物质量标准及慈竹茹的化学成分研究)[D]. Chengdu: Chengdu Institute of Biology, Chinese Academy of Sciences, 2015. |
| [24] | Xu WYJ, Lian HY, Liang QD, et al. Chemical comparison between decoctions of Angelicae Sinensis Radix and chuanxiong Rhizoma by UPLC-QTOF-MS[J]. Pharm J Chin People's Lib Army (解放军药学学报), 2015, 31: 4–9. |
| [25] | Ma L, Huang XF, Ou YH, et al. Identification of chemical composition in Pericarpium Citri Reticulatae by UHPLC/Q-TOF-MS/MS[J]. Asia-Pac Tradit Chin Med (亚太传统医药), 2015, 11: 33–37. |
| [26] | Sun LJ. Research on the chemical constituents of cypress kernels[J]. J Hebei Norm Univ (河北师范大学学报), 2001, 25: 217–218. |
| [27] | Kang A, Guo JR, Xie T, et al. Analysis of the triterpenes in Poria cocos by UPLC-LTQ-Orbitrap[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2014, 30: 561–565. |
| [28] | Zhu M, Xiong L, Wang YN, et al. Analysis of the lignans in Sinocalamus affinis[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 1968–1972. |
| [29] | Yao XB. Study on Triterpenoids from Bamboo Bark (竹茹中三萜类化合物的研究)[D]. Hangzhou: Zhejiang University, 2004. |
 2018, Vol. 53
2018, Vol. 53


