卡铂为第二代铂类抗癌药物, 由美国Bristol-Myers Squibb公司、英国癌症研究所和Johnson Matthey公司于20世纪80年代合作开发。卡铂上市产品有两种剂型:注射用卡铂和卡铂注射液。中国药典2010年版仅收载注射用卡铂, 中国药典2015年版不再收载注射用卡铂, 而收载了卡铂注射液[1, 2]。
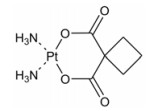
卡铂的CAS号为41575-94-4, 分子式为C6H12N2O4Pt, 相对分子质量为371.26, 化学名为顺式-1, 1-环丁烷二羧酸二氨铂, 结构式见图 1。
|
Figure 1 Structure of carboplatin |
卡铂一般以六氯铂酸钾为起始原料, 制得顺-二碘二氨铂, 然后与1, 1-环丁烷二羧酸盐反应制得[3]。卡铂原料及注射剂中含量的测定方法研究较多[4−7], 而杂质的研究较少[8]。在中国药典2015年版之前, 卡铂注射液的质量标准中尚未有控制1, 1-环丁烷二羧酸的量。
由于1, 1-环丁烷二羧酸为卡铂合成过程的重要起始物, 也是其已知降解产物, 本研究采用中国药典2015年版高效液相色谱法对某企业的不同规格卡铂注射剂进行了考察。该企业生产的小规格(10 mL:50 mg)卡铂注射液样品中的1, 1-环丁烷二羧酸含量都约为大规格(10 mL:100 mg)卡铂注射液样品的2倍, 而同一企业生产的注射用卡铂中1, 1-环丁烷二羧酸的量则远小于两种规格卡铂注射液样品中的1, 1-环丁烷二羧酸的量。结果表明该企业生产的卡铂注射液没有注射用卡铂稳定。因此, 有必要进一步通过考察卡铂注射液中其他有关物质的量及卡铂注射液的稳定性来评价处方工艺的合理性。
材料与方法仪器 1260型液相色谱仪(美国Agilent公司); ACQUITY 2D UPLC®−Xevo G2-XS QTOF (美国Waters公司); iCAP6300电感耦合等离子体发射光谱仪(美国Thermo公司); 8800 ICP-MS/MS (美国Agilent公司)。
对照品与试剂 卡铂对照品(含量98.7%, 批号 100322-201102)由中国食品药品检定研究院提供; 1, 1-环丁烷二羧酸对照品(含量99%, 批号J1420001)、依地酸二钠对照品(含量99.0%, 批号 F20071126)由阿拉丁试剂公司提供; 水中铂(1.000 g·L−1, 批号 15A021)由国家有色金属及电子材料分析测试中心提供。硫酸四丁基铵、磷酸、氢氧化钠为分析纯, 乙腈为色谱纯, 水为Millipore超纯水。
试药 样品均来源于2015年国家药品评价性抽验。卡铂注射液分别由企业A (16批次, 10 mL:100 mg和10 mL:50 mg)和企业B (3批次, 15 mL:150 mg)提供, 注射用卡铂由企业A提供(15批次, 规格均为100 mg), 均为2015年10月前生产, 均符合各自生产时现行有效的质量标准。
液相色谱条件 采用苯基己基硅烷键合硅胶色谱柱(250 mm × 4.6 mm, 5 µm), 以0.17%硫酸四丁基铵缓冲液(pH 7.5)为流动相A, 以0.17%硫酸四丁基铵缓冲液(pH 7.5) −乙腈(800:200)为流动相B, 进行梯度洗脱: 0~15 min 100% A; 15~30 min 100% A~100% B; 35~50 min 100% B。流速为0.5 mL·min−1, 柱温为27 ℃, 进样温度为4 ℃, 检测波长为220 nm[9], 进样量为20 μL。
二维液相色谱串联质谱条件 一维液相系统采用上述液相方法进行分离, 二维液相系统使用质谱兼容的流动相与QTOF相连, 将样品中待测杂质(保留时间约20~25 min)切入二维进质谱检测。色谱柱为HSS T3 (100 mm × 2.1 mm, 1.7 mm), 柱温50 ℃, 流速0.6 mL·min−1。流动相A: 0.1%甲酸水溶液, 流动相B:乙腈, 梯度:切峰后100% A相冲洗4 min, B相3 min比例由5%~80%。质谱条件: Xevo G2-XS QTOF, 离子化模式: ESI+, 毛细管电压: 2.5 kV, 源温度: 120 ℃, 雾化气温度: 500 ℃, 雾化气流速为900 L·h−1, 采集模式为MSE。软件: MassLynx 4.1/MassFragment。
电感耦合等离子体原子发射光谱条件 采用Thermo iCAP6300电感耦合等离子体发射光谱仪(ICP-AES), 反射功率1 150 W, 载气流速0.60 L·min−1, 在214.4 nm波长处测定铂的发射强度。
电感耦合等离子体质谱条件 采用Agilent 8800 ICP-MS/MS, 反射功率1 550 W、载气流速0.9 L·min−1、采样深度10 mm; 选取铂同位素195进行测定。
供试品溶液 分别精密量取卡铂注射液或转移注射用卡铂适量, 用水定量稀释或溶解后定量制成约含卡铂1 mg·mL−1的溶液, 摇匀, 作为液相和二维液相色谱串联质谱供试品溶液。
加速实验溶液 分别取企业A生产的3批卡铂注射液(规格均为10 mg·mL−1)与3批注射用卡铂(规格均为100 mg)于40 ℃温度、75%湿度的加速实验条件下放置1个月。分别参照企业A (含EDTA)与企业B (不含EDTA)的处方, 制成含卡铂均为10 mg·mL−1的溶液作为卡铂注射液的模拟样品, 于40 ℃温度、75%湿度的加速实验条件下放置半个月。取上述样品分别用水定量稀释或溶解后定量制成约含卡铂1 mg·mL−1的溶液, 摇匀, 作为加速实验溶液。
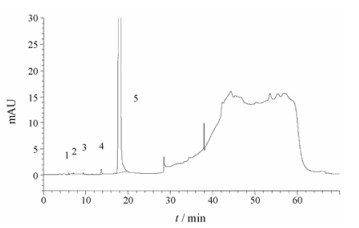
结果 1 有关物质检查按峰面积归一化法对卡铂注射液和注射用卡铂进行有关物质检查。企业A样品典型色谱图详见图 2和3。企业A的卡铂注射液未知有关物质测定结果见表 1。

|
Figure 2 Typical chromatogram of the related substances in carboplatin injection. 1: Carboplatin 2: Maximum unknown impurity |
|
Figure 3 Typical chromatogram of the related substances in carboplatin for injection. 1−4: Impurities; 5: Carboplatin |
| Table 1 Determination results of unknown impurities in carboplatin injection |
由图 2和表 1可知, 企业A的卡铂注射液中均有一个相对保留时间(RRT)为1.3的未知杂质超过0.5%, 且小规格(10 mL:50 mg)注射液样品中该杂质的量均大于大规格(10 mL:100 mg)注射液样品中该杂质的量, 约为2倍关系, 与1, 1-环丁烷二羧酸测得量趋势一致, 推测此两种杂质的含量具有一定的相关性。值得关注的是, 由图 3还可知, 注射用卡铂样品中未检出RRT为1.3的未知杂质。且注射用卡铂样品单个有关物质测得值均小于0.1%, 杂质总量均小于0.3%。
2 未知杂质结构分析采用上述二维液相色谱串联质谱条件, 对卡铂注射液中单个最大特定未知杂质进行鉴定。卡铂注射液一维色谱图, 与图 2结果一致。
2.1 推测的相对分子质量和分子式将样品中待测杂质(保留时间约20~25 min)切入二维进质谱检测。二维一级质谱给出的m/z为502.07, 二级质谱给出的m/z为485.05, 通过质量偏差和同位素分布, 软件推测m/z为502.07的可能分子式为C10H17N3O8Pt, m/z为485.05的可能分子式为C10H14N2O8Pt, C10H17N3O8Pt为C10H14N2O8Pt的加铵峰, 详见卡铂注射液未知杂质一级和二级质谱图(图 4)。

|
Figure 4 MS spectra (a) and MS/MS spectra (b) of the unknown impurity (tR = 25.3 min) |
由软件给出的可能结构中含乙二胺四醋酸结构, 与企业A的卡铂注射液处方中添加有依地酸二钠相吻合。但是, 软件给出的可能结构还缺乏合理性, 根据二级质谱给出的信息对结构进行了初步的推断, 详见图 5。后续还需从卡铂的处方工艺, 卡铂注射液中依地酸二钠与卡铂的相互作用来进一步确证。

|
Figure 5 Structure of edetate calcium disodium (a) and possible structure of the unknown impurity in carboplatin injection (b) |
对单个最大未知杂质(保留时间21.9 min)馏分收集液经稀释5倍后, 采用Thermo iCAP6300 ICP-AES在214.4 nm波长处测定铂的发射强度, 确定杂质中确实含有铂元素, 证明该杂质为卡铂的含铂有关物质。
2.4 未知有关物质与依地酸二钠相关性确认取企业B卡铂注射液(10 mg·mL−1, 不含依地酸二钠), 在注射液中加入依地酸二钠, 使其浓度为0.02% (同企业A处方中量)、0.04%与0.1%, 在40 ℃放置1、2、3、4天, 分别取样测定, 照上述液相色谱条件进样, 按峰面积归一化法计算, 结果详见表 2。
| Table 2 Study on the content of the unknown impurity at different ratio of EDTA-2Na (%, n = 2) |
从结果可以看出, 卡铂注射液中加入依地酸二钠后, 很快就产生了此未知杂质, 且随着依地酸二钠浓度的增大而增加; 连续4天稳定性考察测定结果也表明, 此未知杂质随着时间亦会逐渐增加。
2.5 加速实验实际样品与模拟样品的加速实验表明, 当处方中有依地酸二钠存在时, 依地酸二钠会加速主成分卡铂降解, 生成1, 1-环丁烷二羧酸, 同时生成上述与依地酸二钠相关的含铂的化合物。
3 电感耦合等离子体质谱法定量测定取企业A的3批卡铂注射液(5 mg·mL−1), 按上述液相色谱条件进行测定, 进样100 μL, 收集20.5~26.0 min的流出液, 用水定量稀释至25 mL, 采用8800 ICP-MS/MS测定铂的含量, 再乘以502/195计算未知杂质的准确含量, 结果详见表 3。
| Table 3 Comparison of the content of the unknown impurity using different method (%, n = 2) |
峰面积归一化法是基于杂质与主药吸收强度一致, 由于未知杂质和卡铂结构不同, 在220 nm波长的吸收不可能完全一致, 峰面积归一化测定结果与ICP-MS/MS测定结果相比, 结果偏小。结果说明, 该杂质实际含量比峰面积归一化法测得值大40%左右。
讨论比较处方工艺, 发现企业A卡铂注射液辅料含依地酸二钠, 而其注射用卡铂辅料为甘露醇, 含依地酸二钠的处方易产生含铂杂质, 而含甘露醇的处方中没有产生该含铂杂质。从企业A的1, 1-环丁烷二羧酸的测定结果, 可以推断1, 1-环丁烷二羧酸与处方工艺、辅料有一定关系。依地酸二钠的存在, 可能发生酸根替换会促进1, 1-环丁烷二羧酸的生成。
由于企业A两种规格卡铂注射液中都添加了相同量的依地酸二钠(0.2 mg·mL−1), 通过常规铜离子络合法和高效液相色谱法对注射液中依地酸二钠进行测定, 测得含量仅为处方量的26%~30%左右, 而通过离子色谱法测定钠离子间接测定依地酸二钠则均为处方量的100%左右。说明企业按照处方量投入了准确量的依地酸二钠, 但是依地酸二钠与卡铂注射液中的游离铂发生了络合反应或者依地酸二钠与主成分卡铂发生了置换反应, 使得测得的游离依地酸二钠减少, 而起始原料1, 1-环丁烷二羧酸的量则增加。
实际样品与模拟样品的加速稳定性实验表明, 当处方中有依地酸二钠存在时, 依地酸二钠会加速主成分卡铂降解, 生成1, 1-环丁烷二羧酸, 同时生成与依地酸二钠相关的含铂杂质。由于处方中依地酸二钠的量小于处方中卡铂或铂的量, 因此依地酸二钠的量决定了该含铂杂质量的多少。
依地酸二钠在非金属药物注射液和滴眼液中通常用于螯合痕量或微量的重金属离子起到稳定剂作用, 但依地酸二钠在卡铂这类含金属药物中并未起到稳定剂作用, 反而会与其螯合对有关物质的增加产生影响。实验表明继续加大处方中依地酸二钠的量, 该杂质量继续增加。根据中国药典2015年版四部9102药品杂质分析指导原则, 对于表观含量在0.1%及其以上的杂质以及表观含量在0.1%以下的具强烈生物作用的杂质或毒性杂质予以定性或者确定其结构。
该杂质在原料、注射用卡铂和原研卡铂注射液中均未出现, 为本次研究首次发现的含铂杂质。由于研究时所采集的样品当时执行的质量标准中还未控制1, 1-环丁烷二羧酸和单个未知杂质, 建议相关企业进一步研究卡铂注射液处方中添加依地酸二钠的合理性, 保证药品质量安全可靠。
致谢: Waters公司王志英工程师对结构推断给予帮助和技术支持。| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2010 ed. Vol 2. Beijing: China Medical Science Press, 2010: 134-135. |
| [2] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Vol 2. Beijing: China Medical Science Press, 2015: 191-192. |
| [3] | Qin YN. Synthesis of carboplatin[J]. Chin J Pharm (中国医药工业杂志), 1991, 22: 9–16. |
| [4] | Xu FH, Ou-Yan L, Liu YQ. ICP-AES determination of carboplatin in poly (1 actic-cooycolic acid) microspheres by ICP-MS[J]. Chin J Pharm Anal (药物分析杂志), 2006, 26: 790–792. |
| [5] | Du CS, Chen C, Song XK, et al. Content determination and stability study of carboplatin injection[J]. J China Pharm (中国药房), 2011, 22: 442–444. |
| [6] | Yang SY, Xie XT, Ye QS, et al. Research progress of the HPLC method for anticancer platinum complexes[J]. Precious Metals (贵金属), 2011, 32: 89–97. |
| [7] | Mittal A, Chitkara D, Kumar N. HPLC method for the determination of carboplatin and paclitaxel with cremophor EL in an amphiphilic polymer matrix[J]. J Chromatogr B, 2007, 855: 211–219. DOI:10.1016/j.jchromb.2007.05.005 |
| [8] | Liu WP, Que ZH, Yang YK, et al. The photolytical products of aqueous carboplatin solutions[J]. Acta Pharm Sin (药学学报), 1996, 31: 72–74. |
| [9] | Committee on Japanese Pharmacopoeia. The Japanese Phar-macopoeia (English Edition)[S]. Supplement I, XVI ed. Tokyo: Yakuji Nippo Ltd, 2012: 2378-2379. |
 2018, Vol. 53
2018, Vol. 53


