2. 广西壮族自治区食品药品检验所, 广西 南宁 530021
2. Guangxi Institute for Food and Drug Control, Nanning 530021, China
冬虫夏草(Cordyceps sinensis)为我国传统名贵中药材, 具有补肾益肺、止血化痰的功效[1−3], 在我国有着悠久的药用历史, 众多古籍中均记载冬虫夏草对肺、肾方面的疾病有治疗作用, 公元710年, 《月王药诊》首次记载冬虫夏草用于治疗肺部疾病。而现代研究中, 由于其含有的化学成分较多, 故相应的药理作用也很广泛, 如抗疲劳、强身延年、延缓衰老、增强耐缺氧能力、抗肾损伤、镇静、解毒、免疫调节、平喘及祛痰作用等[4], 但临床中仍主要用其治疗肺[5]、肾等方面的疾病[6]。冬虫夏草为麦角菌科真菌冬虫夏草菌Cordyceps sinensis (BerK.) Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体, 主要分布在我国青海、西藏、甘肃、云南和四川等高海拔地区, 野生冬虫夏草含水分、粗蛋白、粗脂肪、总糖、纤维素, 此外还含有多种氨基酸[7]、核苷类成分[8]、麦角甾醇及其氧化物、甘露醇、硬脂酸、挥发油以及多种矿物质元素, 活性成分主要是核苷类、色氨酸、虫草多糖、虫草酸、甾醇类[9]物质以及一些维生素类。冬虫夏草隶属古代九大仙草之一, 因其疗效确切, 样品生长环境恶劣、采集有难度等因素[10], 故冬虫夏草的价格一直居高不下。传统市场中销售时又将其按规格大小分为五大等级, 价格从高至低依次为王中王, 每公斤1 400~1 800条; 虫草王, 每公斤2 000~2 900条, 约每克2~3条; 一级虫草, 每公斤3 000~3 900条, 每克约3~4条; 二级虫草, 每公斤4 000~4 900条, 每克约4~5条; 而每公斤5 000条以上的都属于三级虫草, 有了所谓的分级, 则贩售价格也相应地水涨船高。冬虫夏草的优劣甄别一直缺少科学的方法, 国内至今也并未出台相应的中药材商品等级质量标准。为了避免中药材市场产生“柠檬市场效应” (柠檬市场效应是指在信息不对称的情况下, 往往好的商品遭受淘汰, 而劣等品会逐渐占领市场, 从而取代好的商品, 导致市场中都是劣等品), 本研究旨从冬虫夏草中核苷类成分入手, 对不同商品等级的冬虫夏草进行核苷类成分[11, 12]指纹图谱的研究, 以及比较其主要核苷的含量高低, 探索其究竟。结果表明, 产地相同而商品等级不同的冬虫夏草中所含核苷类成分无显著性差异, 而不同产地的相似度及主要核苷的含量差异较大, 此研究为进一步开展不同产地冬虫夏草的成分分析夯实了基础, 也为不同等级冬虫夏草的合理使用提供依据, 亦可作为制订冬虫夏草商品等级质量标准的参考。
材料与方法实验仪器 Aglient 1260型高效液相色谱仪, Agilent G1315二极管阵列检测器(DAD), QUINTIX313-1CN型万分之一电子天平, MSE125S型十万分之一电子天平, KQ-300DV型超声波清洗器, Milli-Q纯水仪。
试剂与药品 对照品尿苷(批号 110887-200202)、肌苷(批号 140669-201305)、鸟苷(批号 111977-201501)和腺苷(批号 110879-200202)由中国食品药品检定研究院提供, HPLC-DAD (面积归一化法)检测纯度均大于98.0%。甲醇和乙腈为色谱纯(Fisher公司), 实验用水为超纯水。
药材 冬虫夏草1~5分别依次采自于西藏自治区林芝地区、青海省玉树州、云南省德钦县、四川省甘孜州、甘肃省甘南州, 并按市面贩售等级区分, 见表 1。实验样品经中国食品药品检定研究院中药民族药检定所郑健研究员鉴定; 冬虫夏草鉴定为麦角菌科真菌冬虫夏草菌 Cordyceps sinensis (BerK.) Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体。
| Table 1 The information of samples |
HPLC-DAD色谱条件 Waters XSelect HSS T3 C18 (250 mm × 4.6 mm, 5 µm); 流动相A为水溶液, B为乙腈; 流速0.6 mL·min−1, 柱温30 ℃, 进样量5 μL, 采用梯度洗脱程序, 0~5 min, 0 B; 5~15 min, 0~10% B; 15~30 min, 10%~20% B; 30~33 min, 20%~50% B; 33~35 min, 50%~0 B; 35~40 min, 0 B); 检测波长为260 nm。
混合对照品溶液的制备 取尿苷、肌苷、鸟苷和腺苷对照品适量, 精密称定, 加水制成每毫升含尿苷、鸟苷、肌苷和腺苷分别为500.0、490.0、475.5和201.5 µg的对照品储备液。分别取对照品储备液适量, 加水制成每1 mL含尿苷、鸟苷、肌苷和腺苷分别为50.00、49.00、47.55和20.15 µg的混合对照品溶液, 即得。
供试品溶液的制备 取样品粉末约0.2 g, 精密称定, 置具塞锥形瓶中, 精密加入水10 mL, 超声处理(功率300 W, 频率40 kHz, 20 ℃以下) 30 min, 再称定重量, 用水补足减失的重量, 摇匀, 滤过, 取续滤液, 即得。
方法学考察专属性 分别吸取对照品溶液和供试品溶液适量, 按上述色谱条件分别进样分析, 比较对照品和供试品的色谱图。
线性关系考察 精密吸取各对照品储备液0.1、0.2、0.5、1.0和2.0 mL分别置于5个10 mL量瓶中, 加水定容至刻度, 摇匀各系列浓度的混合对照品溶液。分别精密吸取上述混合对照品溶液各5 μL, 注入液相色谱仪, 测定, 以各对照品质量浓度(μg·mL−1)为横坐标, 以峰面积为纵坐标, 绘制标准曲线。
精密度 精密吸取同一混合对照品溶液5 μL, 按上述色谱条件当日连续进样测定6次和连续进样3天, 每天2次, 记录各成分保留时间和色谱峰面积。分别计算RSD值, 即为日内精密度和日间精密度。
重复性 精密吸取CC1-L 6份, 约0.2 g, 精密称定, 按供试品溶液制备方法, 平行制备6份, 分别进样分析, 记录色谱图。
稳定性 精密吸取CC1-L供试品溶液, 分别于0、2、4、8、12、16和24 h进样分析, 记录色谱图包括各成分的保留时间和色谱峰面积, 计算RSD值。
加样回收率 取已知含量的CC1-L粉末6份, 每份约0.1 g, 置具塞锥形瓶中, 分别加入各对照品溶液(尿苷200.0 μg·mL−1、肌苷95.1 μg·mL−1、鸟苷147.0 μg·mL−1和腺苷60.5 μg·mL−1) 1.00 mL, 按照供试品溶液方法制备, 进样分析, 记录峰面积, 计算回收率。
指纹图谱的建立 取冬草夏草1~5号各3种等级样品的粉末, 精密称定, 按供试品溶液方法制备, 精密吸取5 μL, 分别进样测定, 记录40 min的HPLC色谱图, 转换成AIA格式, 导入《中药色谱指纹图谱相似度评价系统》(2012.130723版本, 下称“指纹图谱软件”)。
含量测定 分别取15份样品, 按供试品溶液方法制备, 进样分析, 用外标法计算样品中各成分的含量。
统计方法分析 应用Excel 2010版软件通过方差计算进行显著性差异分析。
结果 1 方法学考察 1.1 方法专属性供试品HPLC色谱图中指标成分与其他成分的色谱峰均分离良好, 且与对照品保留时间一致(尿苷、肌苷、鸟苷及腺苷对照品的保留时间分别为16.963、18.952、19.231和22.170 min), 表明该方法具有良好的专属性。HPLC色谱图见图 1。

|
Figure 1 HPLC chromatograms of mixed reference substances (A), first grade (B), second (C) and third (D) of Cordyceps sinensis. 4: Uridine; 6: Inosine; 7: Guanosine; 11: Adenosine |
结果如表 2所示, 各成分的r均大于0.99, 表明各成分在线性范围内线性良好。
| Table 2 Regression equations of reference substance |
结果显示尿苷、肌苷、鸟苷和腺苷峰面积日内精密度的的RSD分别为0.56%、0.44%、0.35%和0.58% (n = 6), 日间精密度的RSD分别为0.88%、1.01%、0.77%和0.95%。
1.4 重复性结果各特征峰的相对保留时间的RSD < 1%, 单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD < 2%, 采用指纹图谱软件进行评价, 相似度为0.99;各份供试品溶液的尿苷、肌苷、鸟苷和腺苷的测定结果RSD (n = 6)分别为0.91%、0.88%、0.97%和1.02%, RSD均 < 2%, 结果表明重复性良好。
1.5 稳定性在室温下自然放置24 h, 测得4个成分峰面积的RSD分别为1.13%、1.39%、0.89%和1.07% (n = 7), 各特征峰的相对保留时间的RSD < 1%, 单峰面积占总峰面积大于2%的特征峰的相对峰面积RSD < 2%, 采用指纹图谱软件进行评价, 相似度为0.99, 表明供试品溶液在24 h内稳定性良好。
1.6 加样回收率结果尿苷、肌苷、鸟苷和腺苷平均加样回收率(n = 6)分别为100.6%、101.5%、100.3%和101.6%, RSD分别为1.35%、1.58%、1.05%和1.78% (n = 6), 表明所建立的方法的准确度良好。
2 指纹图谱的建立及相似度分析根据5个产地3个等级共计15份样品的指纹图谱, 生成共同对照图谱, 并一共标定12个特征峰, 经过与对照品比对, 可知4号峰为尿苷、6号峰为肌苷、7号峰为鸟苷、11号峰为腺苷; 经文献分析[8, 12]及对照品定位得知: 1号峰为胞嘧啶、2号峰为次黄嘌呤、3号峰为黄嘌呤、5号峰为2'-去氧尿苷、8号峰为2'-脱氧肌苷、9号峰为2'-脱氧鸟苷、10号峰为胸苷、12号峰为2'-脱氧腺苷、13号峰为色氨酸, 见图 2; 并以此对照图谱为参照图谱计算该产地的相似度, 结果见表 3, 由相似度结果来看, 相同产地不同等级的冬虫夏草在核苷类成分上的表达均在0.991以上, 并无显著性差异, 但不同产地的相似度则从0.778~0.860不等, 差异显著, 可为进一步制订商品等级质量标准提供参考。
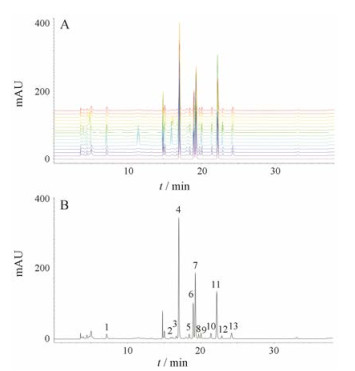
|
Figure 2 HPLC chromatograms of 15 samples (A) and reference specific chromatogram of Cordyceps sinensis (B). Peak 1: Uracil; 2: Hypoxanthine; 3: Xanthine; 4: Uridine; 5: 2'-Deoxyuridine; 6: Inosine; 7: Guanosine; 8: 2'-Deoxyinosine; 9: 2'-Deoxyguanosine; 10: Thymidine; 11: Adenosine; 12: 2'-Deoxyadenosine; 13: Tryptophan |
| Table 3 Similarity of specific chromatograms of Cordyceps sinensis |
15批次不同商品规格大小冬虫夏草含量测定结果见表 4。
| Table 4 Contents of four nucleosides of Cordyceps sinensis (n = 2) |
采用Excel 2010版软件处理15份冬虫夏草的4种主要核苷(尿苷、肌苷、鸟苷和腺苷)的含量, 通过方差进行显著性分析并制作折线图, 5批次样品三组样本之间分布均匀, P > 0.05, 结果显示同一产地不同商品等级之间4种主要核苷含量无显著性差异, 见图 3; 但不同产地冬虫夏草的含量差异明显, 结果见图 4, 可为进一步研究提供依据。
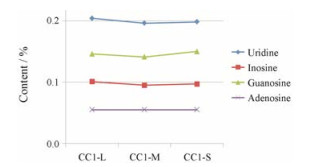
|
Figure 3 Variance analysis of four main nucleosides in Cordyceps sinensis with the different sizes from the same areas |
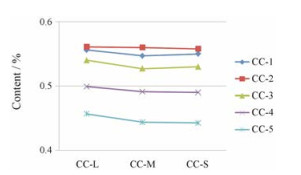
|
Figure 4 The contents of four main nucleosides in Cordyceps sinensis from the different areas |
冬虫夏草服用时多以水煮[13]或者清洗后直接嚼服, 入药时通常以粉末入药, 而核苷类成分极性大、易溶于水, 故本实验选择以纯水[14]为溶剂制备供试品溶液, 科学无毒环保。由于部分核苷类成分热稳定性[15, 16]差, 超声提取时加冰块控制超声温度小于35 ℃以避免核苷分解。
核苷类成分容易在亲水型极性柱[17]中分离, 现在市面上的极性柱分别有Waters XSelect HSS T3、Waters BHE、AQ-18、HILIC等, 经实验比较, Waters XSelect HSS T3[18]分离好, 柱效高, 保留时间适中, 故采取T3柱。流动相方面, 乙腈较甲醇的洗脱能力强, 且几乎不与样品发生化学反应, 吸收干扰低, 故有机相选取乙腈, 而水相部分考察过甲酸水溶液、磷酸水溶液以及纯水溶液, 相差不大, 而纯水安全无毒, 故最后流动相采用乙腈−水, 简便易得, 由于冬虫夏草中核苷类成分较多, 故且以纯水为实验梯度伊始, 流速为0.6 mL·min−1, 不仅节约资源并有利于核苷类成分的有效分离[19]。
本研究针对5个产地不同商品等级冬虫夏草进行相似度比较以及其主要核苷类含量的比较, 结果表明相同产地不同规格的冬虫夏草无显著性差异, 好比一颗树上的果子有的大有的小, 但营养成分基本一致; 但不同产地冬虫夏草的指纹图谱差异较大, 且主要核苷的含量也有差异, 犹如不同树上的果子吸收的养分不同, 成分有区别。说明不同产地的冬虫夏草作为商品贩售时可能有品质的差别, 与我国一直以来所遵循的“辩形识质”、“道地药材”等评价中药材质量的传统方法相符合, 目前并未有科学适用的商品等级质量标准[20]出台, 本研究为中药材商品等级质量标准的制订提供了科学依据及参考。
| [1] | Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Part 1. Beijing: China Medical Science Press, 2015: 115. |
| [2] | Lu D. Chinese caterpillar fungus contained in ancient Chinese literature research[J]. J Western (西部学刊), 2014(2): 71–75. |
| [3] | Qi ST, Zhang FH, Li Y, et al. Overview and prospect of Cordyceps sinensis[J]. Biotechnol World (生物医药), 2012, 15: 41–43. |
| [4] | Li RY, Song HP, Wei YX, et al. Research advances of phar-macological activities of Cordyceps[J]. Global Tradit Chin Med (环球中医药), 2016, 10: 1284–1287. |
| [5] | Zhang LQ, Yan M, Xie LY, et al. Research on the treatment of chronic obstructive pulmonary disease by cordyceps sinensis[J]. J Emergency Tradit Chin Med (中国中医急症), 2015, 24: 2157–2159. |
| [6] | Li RY, Song HP, Wei YX, et al. The utilization and analysis of present market situation for Cordyceps sinensis[J]. Res Pract Chin Med (现代中药研究与实践), 2016, 30: 83–86. |
| [7] | Hsu TH, Shiao LH, Hsieh C, et al. A comparison of the chemical composition and bioactive ingredients of the Chinese medicinal mushroom Dong chong xia cao, its counterfeit and mimic, and fermented mycelium of Cordyceps sinensis[J]. Food Chem, 2002, 78: 463–469. DOI:10.1016/S0308-8146(02)00158-9 |
| [8] | Fan H, Li SP, Xiang JJ, et al. Qualitative and quantitative determination of nucleoside, bases, and their analogues in natural and cultured Cordycpes by pressurized liquid extraction and high performance liquid chromatography-electrospray ionization tandem mass spectrometry (HPLC-ESI-MS/MS)[J]. Anal Chim Acta, 2006, 567: 218–228. DOI:10.1016/j.aca.2006.03.032 |
| [9] | Yuan JP, Wang JH, Liu X, et al. Simultaneous determination of free ergosterol and esters in Cordyceps sinensis by HPLC[J]. Food Chem, 2007, 105: 1755–1759. DOI:10.1016/j.foodchem.2007.04.070 |
| [10] | Li WJ, Dong CH, Liu XZ, et al. Progress in the research of Cordyceps sinensis[J]. Mycosystema (菌物学报), 2016, 35: 1–13. |
| [11] | Qian ZM, Li WQ, Sun MT, et al. Analysis of the chemical constituents of Cordyceps sinensis[J]. Mycosystema (菌物学报), 2016, 35: 476–490. |
| [12] | Ai Z, Qian ZM, Li WJ, et al. Recent advances in the analysis of nucleosides in Chinese Cordyceps[J]. Mycosystema (菌物学报), 2016, 35: 388–403. |
| [13] | Qian ZM, Liao N, Li WQ, et al. Application of modern instrumental analytical techniques in quality evaluation of Cordyceps sinensis[J]. Mod Chin Med (中国现代中药), 2016, 18: 708–714. |
| [14] | Zhao J, Xie J, Wang LY, et al. Advanced development in chemical analysis of Cordyceps[J]. J Pharm Biomed Anal, 2014, 87: 271–289. DOI:10.1016/j.jpba.2013.04.025 |
| [15] | Shi Y, Xiao XY, Cheng XL, et al. Study of ergosterol in cordyceps[J]. Mod Chin Med (中国现代中药), 2012, 14: 15–17. |
| [16] | Chen T, Liu Q, Mo ZK, et al. Determination of adenosine, cordycepin and ergosterol in Cordyceps sinensis by HPLC[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 161–163. |
| [17] | Qian ZM, Zhou MX, Sun MT, et al. Analysis of nucleosides in different parts of Cordyceps sinensis[J]. Mod of Tradit Chin Med Mater Med-World Sci Technol (世界科学技术:中医药现代化), 2014, 16: 2390–2394. |
| [18] | Zan K, Su R, Liu J, et al. Comparative study on content of adenosine between cultivated and wild Cordyceps Sinensis[J]. Chin Pham Affairs (中国药事), 2016, 30: 598–603. |
| [19] | Yang FQ, Li DQ, Feng K, et al. Determination of nucleotides, nucleosides and their transformation products in cordyceps by ion-pairing reversed-phase liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2010, 1217: 5501–5510. DOI:10.1016/j.chroma.2010.06.062 |
| [20] | Wang GL, Jin HY, Han XP, et al. The quality research and some problems in Cordyceps sinensis[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 115–118. |
 2018, Vol. 53
2018, Vol. 53


